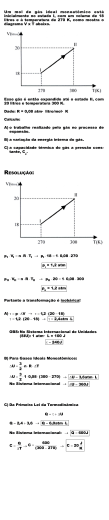
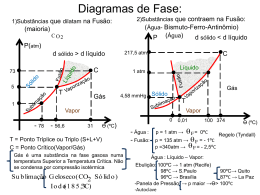
1 Liquefação de gases (condensação) Objetivos: • Compreender quais parâmetros interferem na liquefação dos gases; • Analisar graficamente condições de P e V onde ocorre a liquefação do gas; • Quais aspectos químicos-estruturais interferem na liquefação dos gases; • Quais expressões matemáticas estão associadas. 2 Quando um gás é liquefeito as moléculas reduzem seu movimento cinético e aproximam-se, aumentando sua densidade. Como reduzir o momento das moléculas? • Diminuindo a temperatura! Mas, quanto? • Aumentando a pressão! Mas, quanto? Gás Gás Líquido Líquido Líquido 3 Ao comprimirmos um gás ideal, por não se desconsiderar as forças intermoleculares, o gás ideal teoricamente não se liquefaz! Ao comprimirmos um gás real, em determinada condição, as moléculas estarão tão próximas que as forças intermoleculares se tornam relevantes e a liquefação ocorre. Analisemos uma ÚNICA isoterma T1: 4 Agora sobrepomos várias isotermas T1, T2, T3, T4......... 5 Entre as isotermas T3 e T4 existe apenas uma única pressão e Temperatura na qual o gás se liquefaz. Esta temperatura e pressão são chamados de Temperatura crítica e de Presão crítica. Acima das Temperatura críticas (Tc) o gás NÃO se liquefaz por compressão. A Temperatura, pressão e volume críticos são chamados de PONTO CRÍTICO. No Ponto Crítico não há distinção entre líquido e vapor. 6 Condições críticas para alguns solventes 7 Entendendo o que ocorre com as moléculas..... Quando o gás é aquecido acima da sua temperatura crítica, a energia cinética das moléculas é tão alta que não há pressão capaz de torná-la líquida. Quando a temperatura for abaixo da temperatura crítica, menores pressões são necessárias a levar o vapor ao estado vapor. 8 Relações simples.... Vc, molar = 3b Pc= a 27b2 Tc = 8a 27Rb Zc= PcVc RTc = 3/8 9 Mãos à obra....Exercícios 1) As coordenadas críticas do metano são Pc = 45,6 atm; Vc = 98,7 cm3/mol; Tc = 190,6 K. Calcule as constantes de Van der Waals do gás. 2) Considere as isotemas abaixo de um gás real e identifique o ponto crítico; a região onde o líquido e vapor co-existem; a região do gráfico onde as moléculas estão no estado vapor; a região do gráfico onde as moléculas estão no estado líquido. 10 3) É possível liquefazer dióxido de carbono a 80 atm de pressão e 31 oC? a = 3,610 atm L2 mol -2 e b = 4,29 x 10-2 L.mol-1. 4) Acima de qual temperatura e pressão que O2 pode ser liquefeito? a = 1,364 atm L2 mol -2 e b = 3,19 x 10-2 L.mol-1. 5) Acima de qual temperatura e pressão que N2 pode ser liquefeito? a = 1,352 atm L2 mol -2 e b = 3,84 x 10-2 L.mol-1. 6) Um gás a 350 K e 12 atm tem o volume molar 12% maior do que o calculado pela lei dos gases perfeitos. Calcule (a) o volume molar do gás (b) o fator de compressibilidade nestas condições. Que forças intermoleculares são dominantes no gás, as atrativas ou repulsivas?
Baixar