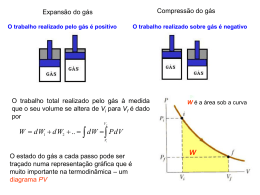
Física Experimental III Compressão isotérmica de um gás ideal Lei dos Gases Ideias Definimos um gás ideal como um gás para o qual a razão PV/nT é constante em todas as pressões. Portanto, essas variáveis estão relacionadas por: PV = nRT onde n – número de moles do gás, que é dado pela razão entre o número de moléculas do gás e o número de Avogadro NA n = N NA R – constante universal dos gases. R = 8,314 J/mol.K . Primeira Lei de Termodinâmica A primeira lei de termodinâmica é um enunciado sobre a conservação da energia e relaciona o trabalho realizado sobre o sistema, o calor trocado entre o sistema e o meio e a energia interna do sistema. Q = ΔU + W No caso de um gás ideal, a energia interna depende somente da temperatura do gás. Para um gás monoatômico, a energia interna é U = 3 nRT 2 Compressão Isotérmica de um Gás Ideal Considere um gás confinado num cilindro que dispõe de um pistão que pode ser mover sem atrito. Quando o pistão é deslocado, o gás é comprimido e trabalho é realizado sobre o sistema. Durante a compressão, calor é transferido para o meio, e a temperatura do gás permanece a mesma. Dizemos que o processo é isotérmico. O diagrama PV de um processo isotérmico é uma hipérbole. O trabalho realizado sobre (ou pelo) sistema é dado pela área subtendida pela curva P x V. W = PV = constante ∫ P dV
Baixar