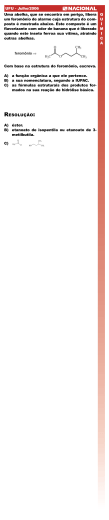UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA Compostos Fenólicos e Terpenos de Myrcia hiemalis e Myrcia myrtifolia (Myrtaceae) PAULO DANIEL SILVA Salvador 2012 UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA Compostos Fenólicos e Terpenos de Myrcia hiemalis e Myrcia myrtifolia (Myrtaceae) Paulo Daniel Silva Orientador: Dr. Frederico Guaré Cruz Tese apresentada ao Colegiado de Pósgraduação em Química, do Instituto de Química, da Universidade Federal da Bahia, para obtenção do grau de Doutor em Química, área de concentração em Química Orgânica. Salvador 2012 Sistema de Bibliotecas – IQ/UFBA Silva, Paulo Daniel. Compostos fenólicos e terpenos de Myrcia hiemalis e Myrcia myrtifolia (Myrtaceae) / Paulo Daniel Silva . - 2013. 203 f.. : il. Inclui anexos Orientador: Prof. Dr. Frederico Guaré Cruz. Tese (doutorado) - Universidade Federal da Bahia, Instituto de Química, Salvador, 2012. 1. Mirtacea. 2. Fitoquímicos. 3. Flavonoides. 4. Terpenos. I. Cruz, Frederico Guaré. II. Universidade Federal da Bahia. Instituto de Química. III. Título. CDD – 583.42 CDU – 547.9 Dedico este trabalho aos meus pais, Victor e Araci, minha esposa, Verena, meus irmãos, Márcio e Gisele, e avós, Etel e Eva, por todo carinho e apoio. iv AGRADECIMENTOS Ao Prof. Dr. Frederico Guaré Cruz, pela amizade, confiança e orientação. À Prof. Maria Lenise da Silva Guedes, pela identificação das espécies Myrcia hiemalis e Myrcia myrtifolia. À minha esposa, Verena, pelo apoio, amor e compreensão. À Elisângela, Isley, Edson e Miquéias pela amizade e contribuições a este trabalho. Aos colegas dos Laboratórios 104 e 119 pela amizade e valorosos ensinamentos. Aos colegas e amigos do Departamento de Química Orgânica da UFBA, pela excelente convivência e ensinamentos. Aos amigos e colegas do IFBA, especialmente a Edeilza, Rita Cerqueira, Humberto, Mônica e Walter, pelo apoio e ajuda. A todos meus amigos que acreditam e confiam em mim. À CNPq, FAPESB, FINEP e CAPES pelo indispensável auxílio financeiro. v SUMÁRIO LISTA DE TABELAS ...........................................................................................................viii LISTA DE ESQUEMAS .........................................................................................................ix LISTA DE FIGURAS .............................................................................................................ix LISTA DE ESPECTROS .......................................................................................................xi ABREVIATURAS E SÍMBOLOS ..........................................................................................xx RESUMO ............................................................................................................................xxii ABSTRACT .......................................................................................................................xxiii Capítulo 1 - INTRODUÇÃO ...................................................................................................1 1.1. A Família Myrtaceae ...........................................................................................4 1.1.1. O Gênero Myrcia .......................................................................................5 1.2. A Química da Família Myrtaceae ........................................................................6 1.2.1.A Química do Gênero Myrcia ...................................................................18 1.3. Objetivos ...........................................................................................................23 Capítulo 2 - PARTE EXPERIMENTAL ................................................................................24 2.1. Métodos Cromatográficos .................................................................................24 2.2. Reagentes Utilizados ........................................................................................24 2.3. Especificação dos Equipamentos .....................................................................25 2.4. Material Vegetal ................................................................................................25 2.5. Estudo Fitoquímico das Folhas de M. hiemalis e de M. myrtifolia ....................26 2.5.1. Obtenção dos Extratos e das Fases........................................................26 2.5.2. Fracionamento da Fase Diclorometânica das Folhas de M. hiemalis ...................................................................................................28 2.5.3. Fracionamento da Fase Hexânica das Folhas de M. hiemalis ...............34 2.5.4. Fracionamento da Fase Diclorometânica das Folhas de M. myrtifolia .................................................................................................36 Capítulo 3 - RESULTADOS E DISCUSSÃO .......................................................................43 3.1. Constituintes Químicos Isolados .......................................................................43 3.2. Identificação e Determinação Estrutural dos Constituintes Químicos Isolados das folhas de M. hiemalis ..........................................................47 3.2.1. Substância 1-h ........................................................................................47 3.2.2. Substância 2-h ........................................................................................50 3.2.3. Substância 3-h ........................................................................................52 3.2.4. Substância 4-h ........................................................................................55 vi 3.2.5. Substância 5-h ........................................................................................58 3.2.6. Substância 6-h ........................................................................................62 3.2.7. Substância 7-h ........................................................................................64 3.2.8. Substância 8-h ........................................................................................67 3.2.9. Substância 9-h ........................................................................................70 3.2.10. Substância 10-h ....................................................................................76 3.2.11. Substância 11-h ....................................................................................77 3.2.12. Substância 12-h ....................................................................................79 3.3. Identificação e Determinação Estrutural dos Constituintes Químicos Isolados das folhas de M. myrtifolia .........................................................82 3.3.1. Substância 13-m .....................................................................................82 3.3.2. Substância 14-m .....................................................................................84 3.3.3. Substância 15-m .....................................................................................86 3.3.4. Substância 16-m .....................................................................................89 3.3.5. Substância 17-m .....................................................................................90 3.3.6. Substância 18-m .....................................................................................91 3.3.7. Substância 19-m .....................................................................................92 3.3.8. Substância 20-m .....................................................................................95 3.3.9. Substância 21-m .....................................................................................96 3.3.10. Substância 22-m ...................................................................................98 3.4. Considerações Gerais ....................................................................................100 4. CONCLUSÃO ................................................................................................................102 5. REFERÊNCIAS .............................................................................................................103 ANEXOS ............................................................................................................................115 ANEXO A: Espectros de RMN dos Constituintes Químicos Isolados das folhas de M. hiemalis .............................................................................................115 A.1. Substância 1-h ..................................................................................................115 A.2. Substância 2-h ..................................................................................................120 A.3. Substância 3-h ..................................................................................................123 A.4. Substância 4-h ..................................................................................................126 A.5. Substância 5-h ..................................................................................................129 A.6. Substância 6-h ..................................................................................................136 A.7. Substância 7-h ..................................................................................................139 A.8. Substância 8-h ..................................................................................................142 A.9. Substância 9-h ..................................................................................................149 A.10. Substância 10-h ..............................................................................................161 vii A.11. Substância 11-h ..............................................................................................162 A.12. Substância 12-h ..............................................................................................166 ANEXO B: Espectros de RMN dos Constituintes Químicos Isolados das folhas de M. myrtifolia ............................................................................................171 B.1. Substância 13-m ...............................................................................................171 B.2. Substância 14-m ...............................................................................................173 B.3. Substância 15-m ...............................................................................................179 B.4. Substância 16-m ...............................................................................................184 B.5. Substância 17-m ...............................................................................................187 B.6. Substância 18-m ...............................................................................................190 B.7. Substância 19-m ...............................................................................................193 B.8. Substância 20-m ...............................................................................................196 B.9. Substância 21-m ...............................................................................................198 B.10. Substância 22-m .............................................................................................201 viii LISTA DE TABELAS Tabela 1: Alguns constituintes químicos fixos obtidos de plantas da família Myrtaceae .................................................................................................8 Tabela 2: Alguns constituintes químicos fixos relatados para o gênero Myrcia ...........................................................................................................18 Tabela 3: Constituintes químicos isolados das folhas de M. hiemalis e M. myrtifolia ...................................................................................................44 Tabela 4: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substância 1-h e dados da literatura [125 MHz (13C), CDCl3, (ppm)] ............49 Tabela 5: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substâncias 2-h e 3-h e dados da literatura .....................................................54 Tabela 6: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substância 4-h e dados da literatura [125 MHz (13C), CDCl3, (ppm)] ............57 Tabela 7: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substância 5-h e dados da literatura de substâncias similares ........................61 Tabela 8: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] das substâncias 6-h e 7-h e dados da literatura ...................................................66 Tabela 9: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substância 8-h e dados da literatura ................................................................69 Tabela 10: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substância 9-h e dados da literatura de substância similar [125 MHz (13C), Piridina-d5, (ppm)] ...................................................................................75 Tabela 11: Dados de RMN de 1H [300 MHz (1H), CDCl3, (ppm)] da substância 10-h e dados da literatura (RMN de 1H em DMSO-d6) ........................................................76 Tabela 12: Dados de RMN de 1H e 13C [300 MHz (1H) e 75 MHz (13C), CDCl3, (ppm)] das substâncias 11-h e 12-h e dados da literatura ...............................................81 Tabela 13: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), acetona-d6, (ppm)] da substância 13-m e dados da literatura [75 MHz (13C), DMSO-d6, (ppm)] .....................................................................................................83 Tabela 14: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] das substâncias 14-m e 15-m e dados da literatura .............................................88 Tabela 15: Dados de RMN de C [125 MHz ( C), CDCl3, (ppm)] das substâncias 13 13 16-m, 17-m, 18-m e 19-m e dados da literatura ................................................................................95 ix Tabela 16: Dados de RMN de 13C [125 MHz (13C), CDCl3, (ppm)] das substâncias 20-m, 21-m e 22-m e dados da literatura ........................................................99 LISTA DE ESQUEMAS Esquema 1: Obtenção dos extratos e das fases a partir das folhas de Myrcia hiemalis e de M. myrtifolia ............................................................................................27 Esquema 2: Fracionamento para isolamento das substâncias 1-h, 4-h e 7-h ...................30 Esquema 3: Fracionamento para isolamento das substâncias 2-h, 3-h e 6-h ...................31 Esquema 4: Fracionamento para isolamento das substâncias 5-h, 8-h e 9-h ...................32 Esquema 5: Fracionamento para isolamento da substância 10-h .....................................33 Esquema 6: Fracionamento para isolamento das substâncias 11-h e 12-h ......................35 Esquema 7: Fracionamento para isolamento da substância 13-m ....................................38 Esquema 8: Fracionamento para isolamento das substâncias 14-m e 15-m ....................39 Esquema 9: Fracionamento para isolamento das substâncias 18-m e 19-m ....................40 Esquema 10: Fracionamento para isolamento da substância 17-m e 22-m ......................41 Esquema 11: Fracionamento para isolamento das substâncias 16-m, 20-m e 21-m ........42 LISTA DE FIGURAS Figura 1: Distribuição dos Biomas brasileiros ......................................................................1 Figura 2: Rota biossintética da flavanona C-metilada (adaptado de SCHRÖDER et al., 1998) ......................................................................................................7 Figura 3: Partes aéreas de (a) Myrcia hiemalis e (b) M. myrtifolia ....................................25 Figura 4: Vista do local da coleta na Área de Proteção Ambiental da Lagoa do Abaeté – Salvador, BA ...................................................................................26 Figura 5: Correlações selecionadas do espectro de gHMBC da substância 1-h ...............48 Figura 6: Estrutura da 7-hidróxi-6,8-dimetil-5-metóxi-isoflavona (1-h) ...............................48 Figura 7: Correlações selecionadas do espectro de gHMBC da substância 2-h ...............51 Figura 8: Estrutura da 5-hidróxi-6,8-dimetil-7-metoxiflavanona (2-h) .................................51 Figura 9: Correlações selecionadas do espectro de gHMBC da substância 3-h ...............53 Figura 10: Estrutura da 6,8-dimetil-5,7-dimetoxiflavanona (3-h) ........................................53 Figura 11: Correlações selecionadas do espectro de gHMBC da substância 4-h .............56 Figura 12: Estrutura da 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona (4-h) ........................57 x Figura 13: Estrutura parcial da substância 5-h ...................................................................59 Figura 14: Correlações selecionadas do espectro de gHMBC da substância 5-h .............59 Figura 15: Estrutura da 2’,4’-di-hidróxi-3’,5’-dimetil-4,6’-dimetoxichalcona (5-h) ...............60 Figura 16: Substâncias encontradas na literatura com estrutura similar a 5-h ..................60 Figura 17: Correlações selecionadas do espectro de gHMBC da substância 6-h .............63 Figura 18: Estrutura da 2’-hidróxi-3’,5’-dimetil-4’,6’-dimetoxichalcona (6-h) ......................63 Figura 19: Correlações selecionadas do espectro de gHMBC da substância 7-h .............65 Figura 20: Comparação de alguns deslocamentos químicos observados para os isômeros .................................................................................................................65 Figura 21: Estruturas parciais A e B com correlações selecionadas do gHMBC ...............67 Figura 22: Correlações selecionadas do gHMBC para o sinal em 1,53 e correlações selecionadas do gCOSY para o sinal em 2,21 ............................................68 Figura 23: Estrutura do eudesm-4(15)-eno-7,11-diol (8-h) ..............................................68 Figura 24: Estrutura parcial A com correlações selecionadas do gHMBC .........................71 Figura 25: Estrutura parcial B com correlações selecionadas do gHMBC .........................72 Figura 26: Estrutura parcial B com correlações selecionadas do gCOSY .........................72 Figura 27: Estrutura em conformação de cadeira da substância 9-h .................................73 Figura 28: Estrutura do 2,321-tri- hidroxitaraxastan-28,20-olídeo (9-h) ....................74 Figura 29: Estrutura de substância similar a 9-h, o 2,3-di-hidroxitaraxastan-28,20-olídeo ............................................................................74 Figura 30: estrutura do ácido cinâmico (10-h) ....................................................................76 Figura 31: Correlações selecionadas do espectro de gHMBC para a estrutura parcial da substância 11-h ...................................................................................78 Figura 32: Estrutura do -tocoferol (11-h) ..........................................................................78 Figura 33: Correlações selecionadas em (a) e (b) do espectro de HMBC da substância 12-h ..............................................................................................................80 Figura 34: Estrutura do acetato de geranilgeranila (12-h) ..................................................80 Figura 35: Estrutura da quercetina (13-m) com correlações selecionadas do espectro de gHMBC ............................................................................................................83 Figura 36: Correlações selecionadas do espectro de gHMBC da substância 14-m ..........85 Figura 37: Estrutura da 2’-hidróxi-2,3’-dimetil-4’,6’-dimetoxipropiofenona (14-m) ..............85 Figura 38: Correlações selecionadas do espectro de gHMBC da substância 15-m ..........87 Figura 39: Estrutura da 2’-hidróxi-3’-metil-4’,6’-dimetoxibutirofenona (15-m) ....................87 Figura 40: Estrutura do ácido betulínico (16-m) .................................................................93 Figura 41: Estrutura do ácido betulônico (17-m) ................................................................93 Figura 42: Estrutura do betulinaldeído (18-m) ....................................................................93 Figura 43: Estrutura da betulona (19-m) ............................................................................93 xi Figura 44: Estrutura do ácido oleanólico (20-m) ................................................................95 Figura 45: Estrutura do ácido ursólico (21-m) ....................................................................97 Figura 46: Estrutura do estigmasterol (22-m) .....................................................................98 LISTA DE ESPECTROS E.1: Espectro de RMN de 1H da substância 1-h [500 MHz, CDCl3, (ppm)] ....................115 E.2: Ampliação de 2,1-3,9 do espectro de RMN de 1H da substância 1-h [500 MHz, CDCl3, (ppm)] ................................................................................................115 E.3: Ampliações do espectro de RMN de 1H da substância 1-h [500 MHz, CDCl3, (ppm)] ..................................................................................................................116 E.4: Espectro de RMN de 13C da substância 1-h [125 MHz, CDCl3, (ppm)] ..................116 E.5: Espectro de gHSQC-TOCSY da substância 1-h .......................................................116 E.6: Ampliação de 0,0-4,5 (1H) do espectro de gHSQC-TOCSY da substância 1-h ......117 E.7: Ampliação de 7,2-7,92 (1H) do espectro de gHSQC-TOCSY da substância 1-h ....117 E.8: Espectro de gHMBC da substância 1-h .....................................................................118 E.9: Ampliação de 100-180 (13C) do espectro de gHMBC da substância 1-h ................118 E.10: Ampliação de 145-166 (13C) do espectro de gHMBC da substância 1-h ..............119 E.11: Ampliação de 7,28-7,96 (1H) do espectro de gHMBC da substância 1-h .............119 E.12: Ampliação de 2,0-2,47 (1H) do espectro de gHMBC da substância 1-h ...............120 E.13: Espectro de RMN de 1H da substância 2-h [500 MHz, CDCl3, (ppm)] ..................120 E.14: Ampliações do espectro de RMN de 1H da substância 2-h [500 MHz, CDCl3, (ppm)] .............................................................................................................................121 E.15: Espectro de RMN de 13C da substância 2-h [125 MHz, CDCl3, (ppm)] ................121 E.16: Espectro de gHMQC da substância 2-h ..................................................................121 E.17: Espectro de gHMBC da substância 2-h ...................................................................122 E.18: Ampliação de 7,0-12,5 (1H) do espectro de gHMBC da substância 2-h ...............122 E.19: Ampliação de 1,78-2,44 (1H) do espectro de gHMBC da substância 2-h .............123 E.20: Espectro de RMN de 1H da substância 3-h [500 MHz, CDCl3, (ppm)] ..................123 E.21: Ampliações do espectro de RMN de 1H da substância 3-h [500 MHz, CDCl3, (ppm)] .............................................................................................................................124 E.22: Espectro de RMN de 13C da substância 3-h [125 MHz, CDCl3, (ppm)] ................124 E.23: Espectro de gHMQC da substância 3-h ..................................................................124 E.24: Ampliação de 1,7-3,9 (1H) do espectro de gHMBC da substância 3-h .................125 xii E.25: Ampliação de 2,0-3,8 (1H) do espectro de gHMBC da substância 3-h .................125 E.26: Espectro de RMN de 1H da substância 4-h [500 MHz, CDCl3, (ppm)] ..................126 E.27: Ampliação do espectro de RMN de 1H da substância 4-h [500 MHz, CDCl3, (ppm)] .............................................................................................................................126 E.28: Espectro de RMN de 13C da substância 4-h [125 MHz, CDCl3, (ppm)] ................127 E.29: Espectro de gHMQC da substância 4-h ..................................................................127 E.30: Ampliação de 1,75-2,35 (1H) do espectro de gHMBC da substância 4-h .............128 E.31: Espectro de gHMBC da substância 4-h ...................................................................128 E.32: Ampliação de 3,1-4,04 (1H) do espectro de gHMBC da substância 4-h ...............129 E.33: Espectro de RMN de 1H da substância 5-h [500 MHz, CDCl3, (ppm)] ..................129 E.34: Ampliação do espectro de RMN 1H da substância 4-h [500 MHz, CDCl3, (ppm)] .............................................................................................................................130 E.35: Ampliações de (a) 2,18-2,24 e (b) 7,82-7,92 do espectro de RMN 1H da Substância 5-h [500 MHz, CDCl3, (ppm)] .......................................................................130 E.36: Ampliação de 7,7-14,0 do espectro de RMN 1H da substância 5-h [500 MHz, CDCl3, (ppm)] ..................................................................................................................131 E.37: Ampliação de 6,88-8,0 do espectro de RMN 1H da substância 5-h [500 MHz, CDCl3, (ppm)] ..................................................................................................................131 E.38: Espectro de RMN de 13C da substância 5-h [125 MHz, CDCl3, (ppm)] ................131 E.39: Ampliação de 0-65 do espectro de RMN de 13C da substância 5-h [125 MHz, CDCl3, (ppm)] ..................................................................................................................132 E.40: Ampliação de 106-196 do espectro de RMN de 13C da substância 5-h [125 MHz, CDCl3, (ppm)] ................................................................................................132 E.41: Espectro de gHMQC da substância 5-h ..................................................................133 E.42: Espectro de gHMBC da substância 5-h ...................................................................133 E.43: Ampliação de 106-178 (13C) do espectro de gHMBC da substância 5-h ..............134 E.44: Ampliação de 2,0-4,0 (1H) do espectro de gHMBC da substância 5-h .................134 E.45: Ampliação de 6,86-7,72 (1H) do espectro de gHMBC da substância 5-h .............135 E.46: Ampliação de 2,0-7,7 (1H) do espectro de gHMBC da substância 5-h .................135 E.47: Espectro de RMN de 1H da substância 6-h [500 MHz, CDCl3, (ppm)] ..................136 E.48: Ampliação de 7,38-8,14 do espectro de RMN 1H da substância 6-h [500 MHz, CDCl3, (ppm)] ..................................................................................................................136 E.49: Ampliação de 2,18-3,9 do espectro de RMN de 1H da substância 6-h [500 MHz, CDCl3, (ppm)] ................................................................................................137 E.50: Espectro de RMN de 13C da substância 6-h [125 MHz, CDCl3, (ppm)] ................137 xiii E.51: Ampliação de 0,0-66 do espectro de 13C da substância 6-h [125 MHz, CDCl3, (ppm)] .............................................................................................................................137 E.52: Ampliação de 100-196 do espectro de 13C da substância 6-h [125 MHz, CDCl3, (ppm)] ..................................................................................................................138 E.53: Ampliação de 2,1-3,95 (1H) do espectro de gHMBC da substância 6-h ...............138 E.54: Ampliação de 1,95-2,5 (1H) do espectro de gHMBC da substância 6-h ...............139 E.55: Espectro de RMN de 1H da mistura contendo a substância 7-h [500 MHz, CDCl3, (ppm)] ..................................................................................................................139 E.56: Ampliação do espectro de RMN 1H da mistura contendo a substância 7-h [500 MHz, CDCl3, (ppm)] ................................................................................................140 E.57: Espectro de RMN de 13C da mistura contendo a substância 7-h [125 MHz, CDCl3, (ppm)] ..................................................................................................................140 E.58: Ampliação de 7,00-7,60 (1H) do espectro de gHMBC da mistura contendo a substância 7-h ..................................................................................................................141 E.59: Ampliação de 3,55-3,88 (1H) do espectro de gHMBC da mistura contendo a substância 7-h ...................................................................................................................141 E.60: Ampliação de 1,84-2,41 (1H) do espectro de gHMBC da mistura contendo a substância 7-h ...................................................................................................................142 E.61: Espectro de RMN de 1H da substância 8-h [500 MHz, CDCl3, (ppm)] ..................142 E.62: Ampliação de 0,68-1,31 do espectro de RMN de 1H da substância 8-h [500 MHz, CDCl3, (ppm)] ................................................................................................143 E.63: Ampliação de 1,31-1,71 do espectro de RMN de 1H da substância 8-h [500 MHz, CDCl3, (ppm)] ................................................................................................143 E.64: Ampliação de 2,0-2,39 do espectro de RMN de 1H da substância 8-h [500 MHz, CDCl3, (ppm)] ................................................................................................144 E.65: Ampliação de 2,78-5,44 do espectro de RMN de 1H da substância 8-h [500 MHz, CDCl3, (ppm)] ................................................................................................144 E.66: Espectro de RMN de 13C da substância 8-h [125 MHz, CDCl3, (ppm)] ................144 E.67: Ampliação do espectro de RMN de 13C da substância 8-h [125 MHz, CDCl3, (ppm)] .............................................................................................................................145 E.68: Espectro de RMN de DEPT 135º da substância 8-h [125 MHz, CDCl3, (ppm)] ....145 E.69: Espectro de gHMQC da substância 8-h ..................................................................146 E.70: Espectro de gHMBC da substância 8-h ...................................................................146 E.71: Ampliação de 4,48-7,52 (1H) do espectro de gHMBC da substância 8-h .............147 E.72: Ampliação de 0,4-1,68 (1H) do espectro de gHMBC da substância 8-h ...............147 xiv E.73: Espectro de gCOSY da substância 8-h ...................................................................148 E.74: Ampliação do espectro de gCOSY da substância 8-h .............................................148 E.75: Espectro de RMN de 1H da substância 9-h [500 MHz, CDCl3, (ppm)] ..................149 E.76: Ampliação do espectro de RMN de 1H da substância 9-h [500 MHz, CDCl3, (ppm)] .............................................................................................................................149 E.77: Ampliação de 1,68-2,44 do espectro de RMN de 1H da substância 9-h [500 MHz, CDCl3, (ppm)] ..............................................................................................150 E.78: Ampliação de 2,96-3,98 do espectro de RMN de 1H da substância 9-h [500 MHz, CDCl3, (ppm)] ................................................................................................150 E.79: Ampliação de 0,78-1,56 do espectro de RMN de 1H da substância 9-h [500 MHz, CDCl3, (ppm)] ................................................................................................151 E.80: Ampliação de 0,78-1,48 do espectro de RMN de 1H da substância 9-h [500 MHz, CDCl3, (ppm)] ................................................................................................151 E.81: Espectro de RMN de 13C da substância 9-h [125 MHz, CDCl3, (ppm)] ................152 E.82: Ampliação de 14-51 do espectro de RMN de 13C da substância 9-h [125 MHz, CDCl3, (ppm)] ..................................................................................................................152 E.83: Ampliação de 54-180 do espectro de RMN de 13C da substância 9-h [125 MHz, CDCl3, (ppm)] ..................................................................................................................152 E.84: Espectro de DEPT 135º da substância 9-h [125 MHz, CDCl3, (ppm)] ..................153 E.85: Espectro de gHMQC da substância 9-h ..................................................................153 E.86: Ampliação de 0,7-2,5 do espectro de gHMQC da substância 9-h ........................154 E.87: Ampliação de 0,78-2,3 do espectro de gHMQC da substância 9-h ......................154 E.88: Ampliações de 2,96-4,0 do espectro de gHMQC da substância 9-h ....................155 E.89: Ampliações de 1,68-2,44 do espectro de gHMQC da substância 9-h .................155 E.90: Ampliação de 1,5-2,4 do espectro de gHMQC da substância 9-h ........................156 E.91: Espectro de gHMBC da substância 9-h ...................................................................156 E.92: Ampliação de 0,7-2,48 do espectro de gHMBC da substância 9-h ......................157 E.93: Ampliação de 0,8-2,4 do espectro de gHMBC da substância 9-h ........................157 E.94: Ampliação de 0,7-3,1 do espectro de gHMBC da substância 9-h ........................158 E.95: Ampliações de 0,4-2,7 do espectro de gHMBC da substância 9-h.......................158 E.96: Ampliações de 0,7-3,8 do espectro de gHMBC da substância 9-h .....................159 E.97: Ampliações de 0,7-2,7 do espectro de gHMBC da substância 9-h ......................159 E.98: Ampliações de 1,0-2,44 do espectro de gHMBC da substância 9-h ...................160 E.99: Espectro de gCOSY da substância 9-h ...................................................................160 E.100: Espectro de RMN de 1H da substância 10-h [300 MHz, CDCl3 e Acetona-d6, xv (ppm)] .............................................................................................................................161 E.101: Ampliação do espectro de RMN de 1H da substância 10-h [300 MHz, CDCl3 e Acetona-d6, (ppm)] ..........................................................................................................161 E.102: Espectro de RMN de 1H da substância 11-h [300 MHz, CDCl3, (ppm)] ..............162 E.103: Ampliação do espectro de RMN de 1H da substância 11-h [300 MHz, CDCl3, (ppm)] .............................................................................................................................162 E.104: Espectro de RMN de 13C da substância 11-h [75 MHz, CDCl3, (ppm)] ..............163 E.105: Ampliação de 10,6-25,2 do espectro de RMN de 13C da substância 11-h [75 MHz, CDCl3, (ppm)] ..................................................................................................163 E.106: Ampliação de 27-40,4 do espectro de RMN de 13C da substância 11-h [75 MHz, CDCl3, (ppm)] ..................................................................................................163 E.107: Ampliação de 72-148 do espectro de RMN de 13C da substância 11-h [75 MHz, CDCl3, (ppm)] ..................................................................................................164 E.108: Espectro de RMN de DEPT 135º da substância 11-h [75 MHz, CDCl3, (ppm)] .............................................................................................................................164 E.109: Ampliação de 0,0-2,8 (1H) do espectro espectro de gHMQC da substância 11-h .................................................................................................................165 E.110: Espectro de gHMBC da substância 11-h ...............................................................165 E.111: Espectro de RMN de 1H da substância 12-h [300 MHz, CDCl3, (ppm)] ..............166 E.112: Ampliação de 10,6-25,2 do espectro de RMN de 13C da substância 12-h [75 MHz, CDCl3, (ppm)] ..................................................................................................166 E.113: Ampliação de 27-40,4 do espectro de RMN de 13C da substância 12-h [75 MHz, CDCl3, (ppm)] ..................................................................................................167 E.114: Espectro de RMN de 13C da substância 12-h [75 MHz, CDCl3, (ppm)] ..............167 E.115: Ampliação de 10-80 do espectro de RMN de 13C da substância 12-h [75 MHz, CDCl3, (ppm)] ..................................................................................................168 E.116: Ampliação de 110-175 do espectro de RMN de 13C da substância 12-h [75 MHz, CDCl3, (ppm)] ..................................................................................................168 E.117: Espectro de RMN de DEPT 135º da substância 12-h [75 MHz, CDCl3, (ppm)] .............................................................................................................................169 E.118: Espectro de RMN de DEPT 90º da substância 12-h [75 MHz, CDCl3, (ppm)] ....169 E.119: Espectro de gHMBC da substância 12-h ...............................................................170 E.120: Ampliação de 0,0-130 (13C) do espectro de gHMBC da substância 12-h ...........170 E.121: Espectro de RMN de 1H da substância 13-m [500 MHz, Acetona-d6, (ppm)] .....171 E.122: Ampliação do espectro de RMN de 1H da substância 13-m [500 MHz, xvi Acetona-d6, (ppm)] ..........................................................................................................171 E.123: Espectro de RMN de 13C da substância 13-m [125 MHz, Acetona-d6, (ppm)] .............................................................................................................................172 E.124: Ampliação do espectro de RMN de 13C da substância 13-m [125 MHz, Acetona-d6, (ppm)] ..........................................................................................................172 E.125: Espectro de gHSQC da substância 13-m .............................................................172 E.126: Espectro de gHMBC da substância 13-m ..............................................................173 E.127: Espectro de RMN de 1H da substância 14-m [500 MHz, CDCl3, (ppm)] .............173 E.128: Ampliação de 1,0-4,0 do espectro de RMN de 1H da substância 14-m [500 MHz, CDCl3, (ppm)] ................................................................................................174 E.129: Ampliação de 6,8-14 do espectro de RMN de 1H da substância 14-m [500 MHz, CDCl3, (ppm)] ...............................................................................................174 E.130: Espectro de RMN de 13C da substância 14-m [125 MHz, CDCl3, (ppm)] ...........175 E.131: Ampliação de 6-58 espectro de RMN de 13C da substância 14-m [125 MHz, CDCl3, (ppm)] ..................................................................................................................175 E.132: Ampliação de 87-211 (13C) espectro de RMN de 13C da substância 14-m [125 MHz, CDCl3, (ppm)] ................................................................................................176 E.133: Espectro de RMN de DEPT 135º da substância 14-m [125 MHz, CDCl3, (ppm)] .............................................................................................................................176 E.134: Espectro de gHMQC da substância 14-m ............................................................177 E.135: Ampliação de 0,0-45 (13C) do espectro de gHMBC da substância 14-m ............177 E.136: Ampliação de 50-118 (13C) do espectro de gHMBC da substância 14-m ...........178 E.137: Ampliação de 161-220 (13C) do espectro de gHMBC da substância 14-m .........178 E.138: Espectro de RMN de 1H da substância 15-m [500 MHz, CDCl3, (ppm)] .............179 E.139: Ampliação de 3,6-14,4 do espectro de RMN de 1H da substância 15-m [300 MHz, CDCl3, (ppm)] ..................................................................................................................179 E.140: Ampliação de 0,88-2,18 do espectro de RMN de 1H da substância 15-m [500 MHz, CDCl3, (ppm)] ................................................................................................180 E.141: Ampliações de 0,88-2,18 e 3,05-6,04 do espectro de RMN de 1H da substância 15-m [500 MHz, CDCl3, (ppm)] .....................................................................180 E.142: Espectro de RMN de 13C da substância 15-m [125 MHz, CDCl3, (ppm)] ...........181 E.143: Espectro de RMN de DEPT 135º da substância 15-m [75 MHz, CDCl3, (ppm)] .............................................................................................................................181 E.144: Espectro de gHMQC da substância 15-m .............................................................182 E.145: Espectro de gHMBC da substância 15-m ..............................................................182 xvii E.146: Ampliação de 1,9-6,0 (1H) do espectro de gHMBC da substância 15-m ............183 E.147: Ampliação de 1,9-6,0 (1H) do espectro de gHMBC da substância 15-m ............183 E.148: Ampliação de 0,96-2,06 (1H) do espectro de gHMBC da substância 15-m ........184 E.149: Espectro de RMN de 1H da substância 16-m [500 MHz, CDCl3, (ppm)] .............184 E.150: Ampliação de 0,6-1,36 do espectro de RMN de 1H da substância 16-m [500 MHz, CDCl3, (ppm)] ................................................................................................185 E.151: Ampliação de 2,9-5,2 do espectro de RMN de 1H da substância 16-m [500 MHz, CDCl3, (ppm)] ................................................................................................185 E.152: Espectro de RMN de 13C da substância 16-m [125 MHz, CDCl3, (ppm)] ...........186 E.153: Ampliação de 13-35 do espectro de RMN de 13C da substância 16-m [500 MHz, CDCl3, (ppm)] ................................................................................................186 E.154: Ampliação 35-58 do espectro de RMN de 13C da substância 16-m [500 MHz, CDCl3, (ppm)] ................................................................................................186 E.155: Espectro de RMN de DEPT 135º da substância 16-m [75 MHz, CDCl3, (ppm)] .............................................................................................................................187 E.156: Espectro de RMN de 1H da substância 17-m [500 MHz, CDCl3, (ppm)] .............187 E.157: Ampliação do espectro de RMN de 1H da substância 17-m [500 MHz, CDCl3, (ppm)] .............................................................................................................................188 E.158: Espectro de RMN de 13C da substância 17-m [125 MHz, CDCl3, (ppm)] ...........188 E.159: Ampliação de 14-57 do espectro de RMN de 13C da substância 17-m [500 MHz, CDCl3, (ppm)] ................................................................................................189 E.160: Ampliação de 109,8-220 do espectro de RMN de 13C da substância 17-m [500 MHz, CDCl3, (ppm)] ................................................................................................189 E.161: Espectro de DEPT 135º da substância 17-m [125 MHz, CDCl3, (ppm)] .............189 E.162: Espectro de RMN de 1H da substância 18-m [300 MHz, CDCl3, (ppm)] .............190 E.163: Ampliação de 0,1-2,4 do espectro de RMN de 1H da substância 18-m [300 MHz, CDCl3, (ppm)] ................................................................................................190 E.164: Ampliações de 14-59 do espectro de RMN de 1H da substância 18-m [300 MHz, CDCl3, (ppm)] ................................................................................................191 E.165: Espectro de RMN de 13C da substância 18-m [125 MHz, CDCl3, (ppm)] ...........191 E.166: Ampliação de 79-208 do espectro de RMN de 13C da substância 18-m [125 MHz, CDCl3, (ppm)] ................................................................................................191 E.167: Ampliação de 14-59 do espectro de RMN de 13C da substância 18-m [125 MHz, CDCl3, (ppm)] ................................................................................................192 E.168: Espectro de RMN de DEPT 135º da substância 18-m [125 MHz, CDCl3, xviii (ppm)] .............................................................................................................................192 E.169: Espectro de RMN de 1H da substância 19-m [500 MHz, CDCl3, (ppm)] .............193 E.170: Ampliação de 3,3-5,35 do espectro de RMN de 1H da substância 19-m [500 MHz, CDCl3, (ppm)] ................................................................................................193 E.171: Ampliação de 0,7-1,28 do espectro de RMN de 1H da substância 19-m [500 MHz, CDCl3, (ppm)] ................................................................................................194 E.172: Espectro de RMN de 13C da substância 19-m [125 MHz, CDCl3, (ppm)] ...........194 E.173: Ampliação de 12-62 do espectro de RMN de 13C da substância 19-m [125 MHz, CDCl3, (ppm)] ................................................................................................195 E.174: Espectro de RMN de DEPT 135º da substância 19-m [75 MHz, CDCl3, (ppm)] .............................................................................................................................195 E.175: Espectro de RMN de 1H da substância 20-m [300 MHz, CDCl3, (ppm)] .............196 E.176: Ampliação de 0,7-2,4 do espectro de RMN de 1H da substância 20-m [500 MHz, CDCl3, (ppm)] ................................................................................................196 E.177: Ampliação de 0,7-2,4 do espectro de RMN de 1H da substância 20-m [500 MHz, CDCl3, (ppm)] ................................................................................................197 E.178: Espectro de RMN de 13C da substância 20-m [75 MHz, CDCl3, (ppm)] .............197 E.179: Ampliação de 14-57 do espectro de RMN de 13C da substância 20-m [75 MHz, CDCl3, (ppm)] ..................................................................................................197 E.180: Ampliação de 72-200 do espectro de RMN de 13C da substância 20-m [75 MHz, CDCl3, (ppm)] ..................................................................................................198 E.181: Espectro de RMN de 1H da mistura das substâncias 20-m e 21-m [500 MHz, CDCl3, (ppm)] ..................................................................................................................198 E.182: Espectro de RMN de 13C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] ................................................................................................199 E.183: Ampliação de 120-186 do espectro de RMN de 13C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] ......................................................199 E.184: Ampliação de 14-43 do espectro de RMN de 13C da mistura das Substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] ......................................................200 E.185: Ampliação de -81 do espectro de RMN de 13C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] ......................................................200 E.186: Espectro de RMN de 1H da substância 22-m [500 MHz, CDCl3, (ppm)] .............201 E.187: Ampliação de 0,64-1,36 do espectro de RMN de 1H da substância 22-m [500 MHz, CDCl3, (ppm)] ................................................................................................201 E.188: Ampliação de 3,26-5,36 do espectro de RMN de 1H da substância 22-m xix [500 MHz, CDCl3, (ppm)] ................................................................................................202 E.189: Espectro de RMN de 13C da substância 22-m [125 MHz, CDCl3, (ppm)] ...........202 E.190: Espectro de RMN de DEPT 135º da substância 22-m [125 MHz, CDCl3, (ppm)] .............................................................................................................................203 xx ABREVIATURAS E SÍMBOLOS AcOEt – acetato de etila Acetona-d6 – acetona deuterada CC – cromatografia em coluna CCDC – cromatografia em camada delgada comparativa CCDP – cromatografia em camada delgada preparativa CDCl3 – clorofórmio deuterado CD3OD – metanol deuterado CIM – concentração inibitória mínima CoA – Coenzima A COSY – Correlation Spectroscopy (1H–1H) (correlação espectroscópica homonuclear 1H– 1 H) d – dubleto – deslocamento químico em partes por milhão DCM – diclorometano dd – duplo dubleto ddd – duplo duplo dubleto DEPT – Distortionless Enhancement by Polarization Transfer (intensificação do sinal sem distorção por transferência de polarização) DMSO – dimetilsulfóxido DMSO-d6 – dimetilsulfóxido deuterado dqd – duplo quarteto de dubletos dt – duplo tripleto gCOSY – Gradient Correlation Spectroscopy (1H–1H) (correlação espectroscópica homonuclear 1H–1H, com gradiente de campo) GESNAT – Grupo de Estudo de Substâncias Naturais Orgânicas (UFBA) gHMBC – Gradient Heteronuclear Multiple Bond Correlation (correlação heteronuclear de múltiplas ligações, com gradiente de campo) gHMQC – Gradient Heteronuclear Multiple Quantum Coherence (coerência heteronuclear múltiplo-quântica, com gradiente de campo) gHSQC – Gradient Heteronuclear Single Quantum Correlation (coerência heteronuclear de quantum-simples, com gradiente de campo) xxi gHSQCTOCSY – Gradient Heteronuclear Single Quantum Coherence – Total Correlation Spectroscopy (coerência heteronuclear de quantum-simples – espectroscopia total de correlação, com gradiente de campo) Hex – hexano HMBC – Heteronuclear Multiple Bond Correlation (correlação heteronuclear de múltiplas ligações) HMQC – Heteronuclear Multiple Quantum Coherence (Coerência heteronuclear múltiploquântica) Hz – Hertz IDH – índice de deficiência de hidrogênio J – constante de acoplamento (Hz) m – multipleto MeOH – metanol NOE – Nuclear Overhauser Effect (efeito Overhauser nuclear) NOESY – Nuclear Overhauser Effect Spectroscopy (espectroscopia de efeito Overhauser nuclear) Piridina-d5 – piridina deuterada ppt – precipitado ppm – partes por milhão q – quarteto qui – quinteto RMN – ressonância magnética nuclear s – singleto sl – singleto largo sxt – sexteto sep - septeto t - tripleto xxii RESUMO Neste trabalho é descrita a investigação dos constituintes químicos não-voláteis das fases hexânica e diclorometânica obtidas das folhas de Myrcia hiemalis e da fase diclorometânica obtida das folhas de Myrcia myrtifolia. O fracionamento da fase diclorometânica de M. hiemalis resultou no isolamento de dez compostos: 7-hidróxi-6,8dimetil-5-metóxi-isoflavona (1-h), 5-hidróxi-6,8-dimetil-7-metoxiflavanona (2-h), 6,8-dimetil5,7-dimetoxiflavanona (3-h), 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona (4-h), 2’,4’-dihidróxi-3’,5’-dimetil-4,6’-dimetoxichalcona (5-h), 2’-hidróxi-3’,5’-dimetil-4’,6’- dimetoxichalcona (6-h), 2’,6’-di-hidróxi-3’,5’-dimetil-4’-metoxichalcona (7-h), eudesm-4(15)eno-7,11-diol (8-h), 2,3,21-tri-hidroxitaraxastan-28,20-olídeo (9-h) e ácido cinâmico (10-h). Da fase hexânica de M. hiemalis foram isoladas duas substâncias, -tocoferol (11h) e acetato de geranilgeranila (12-h), enquanto que da fase diclorometânica de M. myrtifolia foram isoladas dez substâncias, quercetina (13-m), 2’-hidróxi-2,3’-dimetil-4’,6’dimetoxipropiofenona (14-m), 2’-hidróxi-3’-metil-4’,6’-dimetoxibutirofenona (15-m), ácido betulínico (16-m), ácido betulônico (17-m), betulinaldeído (18-m), betulona (19-m), ácido oleanólico (20-m), ácido ursólico (21-m) e estigmasterol (22-m). Não foram encontrados relatos na literatura sobre o isolamento dos compostos 5-h, 7-h e 9-h. Os constituintes químicos das fases foram isolados e purificados por sucessivas colunas cromatográficas e cromatografia em camada delgada preparativa, bem como, foram utilizadas técnicas de filtração e recristalização. As estruturas das substâncias foram determinadas através das análises de diversas técnicas de RMN de 1H e 13C. Palavras-Chave: Myrcia flavonoides; terpenos. hiemalis; M. myrtifolia; Myrtaceae; estudo fitoquímico; xxiii ABSTRACT This work describes the investigation of non-volatile chemical constituents of dichloromethane and hexane phases obtained from leaves of Myrcia hiemalis and dichloromethane phase obtained from leaves of Myrcia myrtifolia. The fractionation of dichloromethane phase of Myrcia hiemalis resulted in the isolation of ten compounds: 7hydroxy-6,8-dimethyl-5-methoxyisoflavone (1-h), 5-hydroxy-6,8-dimethyl-7- methoxyflavanone (2-h), 6,8-dimethyl-5,7-dimethoxyflavanone (3-h), 2,7-dihydroxy-6,8dimethyl-5-methoxyflavanone (4-h), (5-h), 2’,4’-dihydroxy-3’,5’-dimethyl-4,6’-dimethoxychalcone 2’-hydroxy-3’,5’-dimethyl-4’,6’-dimethoxychalcone dimethyl-4’-methoxychalcone (7-h), (6-h), eudesm-4(15)-ene-7,11-diol 2’,6’-dihydroxy-3’,5’(8-h), 2,321- trihydroxytaraxastan-28,20-olide (9) and cinnamic acid (10). Hexane phase of M. hiemalis two substances were isolated, -tocoferol (11-h) and geranylgeranyl acetate (12-h), while the dichloromethane phase of M. myrtifolia ten substances were isolated, quercetin (13-m), 2’-hydroxy-2,3’-dimethyl-4’,6’-dimethoxypropiophenone (14-m), 2’-hydroxy-3’-methyl-4’,6’dimethoxybutyrophenone (15-m), betulinic acid (16-m), betulonic acid (17-m), betulinaldehyde (18-m), betulone (19-m), oleanolic acid (20-m), ursolic acid (21-m) and stigmasterol (22-m). There were no reports in the literature about the isolation of compounds 5-h, 7-h and 9-h. The chemical constituents of the phases were isolated and purified by successive column chromatography and preparative thin-layer chromatography, as well were used techniques filtration and recrystallization. The structures of the substances were determined by analyses of various techniques of 1H and 13C NMR. Keywords: Myrcia hiemalis; M. myrtifolia; Myrtaceae; phytochemical studies; terpenes; flavonoids. Capítulo 1 1. INTRODUÇÃO O Brasil possui seis biomas terrestres, a Amazônia, a Caatinga, o Cerrado, a Mata Atlântica, o Pampa e o Pantanal (Figura 1), abrigando diversos ecossistemas, com uma flora contendo milhares de espécies de plantas nativas, das quais muitas são endêmicas. Entretanto, segundo dados do Ministério do Meio Ambiente (MMA, 2011a,b; MMA, 2010a,b,c), a supressão acumulada da vegetação nativa até 2002 pela ação do homem, tendo como referência a área total original, foi de 75,62% na Mata Atlântica, 52,76% no Pampa, 43,7% na Caatinga, 43,6% no Cerrado e 12,35% no Pantanal e, apesar das políticas ambientais e as ações de conscientização que vem sendo instituídas, estes índices chegaram em 2008 a 75,88%, 53,96%, 45,4 %, 47,8% e 15,18%, respectivamente. A Amazônia Legal é o maior bioma brasileiro, abrangendo cerca da metade do território nacional e em 2003, o percentual de desmatamento, em relação ao seu tamanho original, foi de 16,3% e chegou em 2011 a 17,14% (INPE, 2011). Fonte: Portal Brasil (http://www.brasil.gov.br/sobre/geografia/biomas-e-vegetacao/biomas-brasileiros) Figura 1: Distribuição dos biomas brasileiros A redução dos biomas é um dos principais problemas ambientais e implica na diminuição da biodiversidade. Supõe-se que muitas espécies vegetais que nem foram descritas, catalogadas ou estudadas já não existem mais. Considerando que cada espécie é uma fonte de uma grande quantidade de metabólitos secundários, muitas Cap. 1 Introdução vezes alguns deles sendo produzidos por uma única espécie, conclui-se que com a extinção de muitas espécies, houve grandes perdas em termos de variedade molecular e na possibilidade de entender melhor a interação dos seres vivos com o meio. Contudo, mesmo com a grande redução dos biomas brasileiros, o país ainda abriga a maior diversidade genética vegetal do mundo, sendo que várias dessas espécies são endêmicas de uma região e ainda não foram investigadas do ponto de vista fitoquímico e/ou farmacológico (SIMÕES e MARIOT, 2003). Dentre os biomas brasileiros, a Caatinga é o menos conhecido cientificamente e vem sendo tratado com baixa prioridade, não obstante ser um dos mais ameaçados, devido ao uso inadequado e insustentável dos seus solos e recursos naturais. O Estado da Bahia é o que abrange a maior parte deste bioma (54% da área territorial do Estado), entretanto em 2009, restava apenas 53,4% dos 300927 km2 de sua cobertura vegetal original, e apenas 1% está sobre área de proteção ambiental e conservação integral. Nos Municípios baianos de Mucugê, Ruy Barbosa, Sátiro Dias, Tucano e Itaberaba foram onde ocorreram as maiores devastações do bioma Caatinga em 20082009, sendo que em Mucugê, em comparação aos Municípios brasileiros, foi onde houve o maior desmatamento deste bioma neste período (MMA, 2011a). GIULIETTI e colaboradores (2002) relacionaram para a Caatinga a existência de 18 gêneros e de 318 espécies vegetais endêmicas, pertencentes a 42 famílias. Das famílias vegetais mais encontradas neste bioma, destacam-se por apresentarem mais espécies, as Fabaceae, Cactaceae, Euphorbiaceae, Malvaceae, Rutaceae, Caesalpiniaceae, Mimosaceae, Papilionoideae, Poaceae, Bignoniaceae, Annonaceae, Myrtaceae, Sapotaceae, entre outras (GIULIETTI et al., 2004). No litoral brasileiro há um corredor de vegetação associada ao bioma Mata Atlântica, que é a restinga. A vegetação de restinga no litoral baiano, onde predominam as formações herbáceas e arbustivas, possui características relacionadas ao bioma da região (a Caatinga), que influencia na composição das espécies vegetais dessas restingas. A supressão vegetal crescente das restingas no Estado da Bahia, principalmente na região metropolitana e no norte do Estado, tem como principal motivo a especulação imobiliária, a ocupação indevida nas áreas de preservação, o turismo predatório e a deposição irregular de lixo (BRITTO et al., 1993; MMA, 2012; QUEIROZ, 2007; SILVA, 1999; VIANA et al., 2006). Diante da destruição desenfreada da vegetação do Estado da Bahia torna necessário que seja feito, o quanto antes, o estudo e a descrição das espécies e que as áreas de proteção ambiental sejam ampliadas, a fim de preservar a diversidade. 2 Cap. 1 Introdução Historicamente, as plantas terrestres, especialmente as superiores, têm sido utilizadas pela população no tratamento de diversas doenças e, desta forma, o conhecimento popular tem auxiliado muito no direcionamento dos estudos das espécies vegetais (CHIN et al., 2006). O estudo químico das plantas tem sido um aliado de extrema importância no desenvolvimento das áreas farmacêutica, química, agrícola, alimentícia, entre outras, bem como, possibilita entender a evolução das espécies e as relações estrutura-atividade. O desenvolvimento das áreas da saúde e agronômica se deve muito à descoberta de novas drogas e ao entendimento da sua ação biológica. Isto se deve ao fato de que a natureza, de um modo geral, é a responsável pela produção da maioria das substâncias orgânicas conhecidas, sendo o reino vegetal o responsável pela maior parcela da diversidade química conhecida e registrada na literatura (HARVEY, 2008; VIEGAS JR et al., 2006). Com a introdução de novas tecnologias na indústria farmacêutica, foi possível através de métodos computacionais modernos, ampliar a química medicinal. Numa visão moderna, a química medicinal focaliza na compreensão das razões moleculares da ação dos fármacos, da relação entre estrutura química e atividade farmacológica destes, considerando fatores farmacodinâmicos e farmacocinéticos que se traduzam em propriedades que tornem um composto um candidato efetivo a novo fármaco. A utilização da química computacional permite o estudo de modelagem e dinâmica molecular e permite avaliar virtualmente fatores farmacocinéticos e toxicofóricos das substâncias-protótipos como candidatas a novos fármacos inovadores (BARREIRO e FRAGA, 2001; VIEGAS JR et al., 2006). Entretanto, o planejamento virtual de novos candidatos a fármacos, através da química combinatória, não atingiu o objetivo de ser uma fonte primária expressiva de diversidade química, que asseguraria a descoberta de numerosas moléculas ativas capazes de representarem, efetivamente, novas drogas. A indústria farmacêutica investiu muitos recursos financeiros na pesquisa de novos candidatos a fármacos, através dessas novas tecnologias, e não obteve um aumento proporcional nas descobertas inovadoras (BRAZ-FILHO, 2010; VIEGAS JR et al., 2006). Diante disso, os produtos naturais continuam sendo a principal fonte de investigação para a obtenção de novos fármacos (HARVEY, 2008). Todavia, a indústria farmacêutica não espera obter novos compostos de uso terapêutico, a partir das substâncias isoladas diretamente dos extratos vegetais, pois estas raramente apresentam características ideais para serem comercializadas. Nos vegetais, os produtos naturais são sintetizados pelos organismos com finalidades específicas, que na maioria das vezes são desconhecidas, porém a probabilidade destes compostos apresentarem alguma atividade biológica é maior do que os compostos sintetizados, 3 Cap. 1 Introdução considerando apenas estudos farmacológicos por métodos computacionais (in silico). Aliado a isso, os avanços nas técnicas de isolamento e purificação dos metabólitos, bem como, o desenvolvimento das técnicas para determinação das estruturas desses compostos, fortaleceu o interesse de pesquisadores e da indústria farmacêutica na área de produtos naturais (BRAZ-FILHO, 2010; HARVEY, 2008; NEWMAN, 2008). Desta forma, a maioria dos metabólitos secundários que apresentam atividade biológica é utilizada como modelo para o desenvolvimento de novos fármacos. Estes metabólitos são pontos de partida para a utilização de técnicas computacionais que permitem o aperfeiçoamento das características apresentadas, através dos recursos de modelagem molecular. Neste contexto, a investigação dos constituintes químicos das plantas é de extrema importância em busca de substâncias com atividade biológica e que também possam servir de templates para a modelagem de moléculas com atividade biológica e características ideais (HARVEY, 2008; LEE, 2004; McCHESNEY et al., 2007; VIEGAS JR et al., 2006). Além disso, as atividades da fitoquímica e o conhecimento dos constituintes químicos das espécies vegetais contribuem para o desenvolvimento científico do país e da química, contribuem para a formação de recursos humanos qualificados e para o avanço de outras atividades científicas e tecnológicas (BRAZ-FILHO, 2010). Como exemplo, auxilia no entendimento das relações desses organismos com o meio, bem como, no mapeamento evolutivo. Os estudos químicos envolvendo espécies da família Myrtaceae, que é amplamente distribuída no Brasil, inclusive no Estado da Bahia, são em sua maioria concentrados no estudo dos óleos essenciais, já que as mirtáceas produzem uma grande variedade destes. Tratando-se do gênero Myrcia (Myrtaceae), existem poucos estudos da sua composição química, sendo a maioria relacionada aos óleos essenciais. 1.1. A Família Myrtaceae A família Myrtaceae, pertencente a subfamília Myrtoideae que está inserida na ordem Myrtales, compreende mais de 4500 espécies, distribuídas em aproximadamente 140 gêneros (BARROSO et al., 1991; MOHAMMED et al., 2009), sendo a segunda maior família da ordem, após a família Melastomataceae (SOUZA e LORENZI, 2008). Há dois grandes centros de dispersão das espécies da família Myrtaceae: nas Américas, especialmente na parte da América que possui clima tropical (BARROSO et al., 1991) e no sul da Austrália, onde predomina o clima temperado (CRONQUIST, 4 Cap. 1 Introdução 1981). Entretanto, apesar de menos freqüentes em regiões de clima temperado (BARROSO et al., 1991), com exceção de parte da Austrália com este clima, as mirtáceas ocorrem em praticamente todo o mundo (JOLY, 1966; WILSON et al., 2001). As mirtáceas são plantas lenhosas, arbustivas ou arbóreas, com folhas inteiras, de disposição alterna ou oposta e às vezes oposta cruzada, com estípulas muito pequenas. As folhas apresentam glândulas oleíferas. As flores são em geral brancas ou às vezes vermelhas. Produzem fruto baciforme ou capsular loculicida (JOLY, 1966). Alguns exemplos mais conhecidos no Brasil são a goiabeira e o araçazeiro (Psidium), a jabuticabeira (Myrciaria), a pitangueira, a grumixameira e a cerejeira-nacional (Eugenia) (JOLY, 1966). Dentre as mirtáceas cultivadas no Brasil, destacam-se as do gênero Eucalyptus, com muitas espécies produtoras de madeira, essências importantes, além de espécies ornamentais, e do gênero Syzygium, representado, entre outras, pelo cravo-da-índia, cujos botões florais são colhidos verdes para o preparo da inigualável especiaria. Outras cultivadas são o jameleiro (Syzygium), jambeiro (Jambosa), jambeiro-vermelho (Eugenia), pimenteira-da-jamaica (Pimenta) e com certa raridade espécies de Myrcia (JOLY, 1966). As mirtáceas brasileiras caracteristicamente possuem tronco de casca lisa, separando-se todo ano o ritidoma, que se renova com cada estação de crescimento. Florescem no início da primavera (JOLY, 1966). A família Myrtaceae apresenta muitas espécies que produzem frutos carnosos, muito apreciados pela população. Na medicina popular, espécies dessa família são utilizadas pela população brasileira no tratamento de diversas enfermidades, destacando-se antidiabéticas, anti-reumáticas, antidiarréicas, adstringentes, antiinflamatórias e no tratamento de úlceras crônicas, hemorragias, febre, cistite e uretrite. Entre as famílias da Classe Angiospermae, em número de espécies utilizadas, para fins medicinais no Brasil, a família Myrtaceae ocupa o terceiro lugar (CRUZ e KAPLAN, 2004). Diante disso, percebe-se que a família Myrtaceae possui importante papel sócio-econômico no cenário nacional (GRESSLER et al., 2006). 1.1.1. O Gênero Myrcia O gênero Myrcia é um dos maiores da família Myrtaceae sendo formado por mais de 300 espécies (CRONQUIST, 1981), com mais de 50 catalogadas nos herbários da Bahia. 5 Cap. 1 Introdução As espécies desse gênero apresentam panículas mircióides, constituídas de ramos opostos decussados (em forma de cruz) ou verticilados (inseridas em um só nó caulinar), sendo os inferiores geralmente mais longos, eretos ou patentes. Suas flores geralmente se dispõem em grupos de três em três, todas sésseis ou com pedicelo curto. Apresentam hispânico mais ou menos desenvolvido, formado pela parede do receptáculo floral que pode ser campanulado, afunilado, globoso, anguloso ou liso, prolongado ou não acima do ovário (BARROSO, 1991). Algumas espécies deste gênero (M. salicifolia, M. citrifolia, M. uniflora, M. multiflora e M. sphaerocarpa) são popularmente conhecidas como pedra-hume-caá (planta insulina ou insulina vegetal) e são utilizadas na medicina popular para o tratamento de diabetes. 1.2. A química da família Myrtaceae A família Myrtaceae é quimicamente muito diversa. As plantas pertencentes a esta família caracterizam-se pela produção de taninos, flavonoides, mono- e sesquiterpenos, triterpenóides, derivados do floroglucinol, cromenos, estilbenoides e outros (AMARAL et al., 2001; AMOR et al., 2007; DAO et al., 2010; FURUYA et al., 1987; HÄBERLEIN e TSCHIERSCH, 1998; GOTTLIEB et al., 1972; LEE, 1998; LEE et al., 1997; MAYER, 1990; MUSTAFA et al., 2003; MUSTAFA et al., 2005; RAO e RAO, 1991; SANTOS et al., 1997; SARKER et al., 2001; SIDDIQUI et al., 2000; SLOWING et al., 1994; SRIVASTAVA et al., 1995; TANAKA et al.,1996; VIEIRA et al., 2004; YANG et al., 2000; YE et al., 2004; YOSHIDA et al., 1996; WANG e FUGIMOTO, 1993; WESTON et al., 1999; WOLLENWEBER et al., 2000) (Tabela 1, p. 8). Considerando o grande número de espécies da família Myrtaceae, em torno de 4500, fica evidente que há muito ainda a ser estudado, principalmente em relação aos constituintes químicos fixos. Os relatos encontrados sobre o estudo químico de espécies de Myrtaceae revelaram duas características químicas importantes, relacionadas aos flavonoides isolados. Uma das características é que, apesar destes compostos serem amplamente distribuídos nas plantas, nesta família muitos desses compostos apresentaram o grupo fenílico, proveniente da via do chiquimato, não substituído (anel A para chalconas e dihidrochalconas e anel B para os demais), o que sugere que a rota biossintética destes compostos, seja a partir do cinamoil-CoA (Figura 2, p. 7). A maioria dos flavonoides encontrados na natureza apresentam oxigenação no anel proveniente da via do chiquimato, enquanto que não é comum este anel não possuir substituintes. 6 Cap. 1 Introdução A outra característica está relacionada a ocorrência de flavonoides C- metilados, no anel proveniente da via do acetato, para isso têm como precursor biossíntético o metilmalonil-CoA (DEWICK, 2001; SCHRÖDER et al., 1998) (Figura 2). Os C-metilados que apresentam um grupo metílico, a rota biossintética envolve a utilização de uma unidade de metilmalonil-CoA e duas de malonil-CoA, enquanto os que apresentam dois grupos metílicos, têm como precursor uma unidade de malonilCoA e duas de metilmalonil-CoA. Os flavonoides C-metilados são raros e, portanto, revelam uma característica da química da família Myrtaceae (MUSTAFA et al., 2005; SARKER et al., 2001; WOLLENWEBER, 2000). CoAS O cinamoil-CoA O COOH CoAS 1x malonil-CoA O COOH CoAS CH3 2x metilmalonil-CoA Alongamento da cadeia Via acetato, partindo de um grupo cinamoil-CoA CH3 O CH3 SCoA HO OH O Claisen H3C chalcona sintase O H3C OH O O chalcona ciclização (fechamento estereoespecífico) chalcona isomerase CH3 HO O H3C OH O flavanona Figura 2: Rota biossintética da flavanona C-metilada (adaptado de SCHRÖDER et al., 1998) 7 Cap. 1 Introdução Tabela 1: Alguns constituintes químicos fixos obtidos de plantas da família Myrtaceae. HO OH OH OH HO OH HO O HO O O O O CO 2H HO OH O O OH OH HO HO OH OH OH syzyginina B Espécie: Syzygium aromaticum Referência: TANAKA et al., 1996 OH OH HO HO O O O OH OH O O O HO O O HO OH O HO O O OH HO OH OH R O HO O O O O HO OH OH O O OH HO OH OH OH OH OH OH O O O O HO O O O HO HO OH HO syzyginina A Espécie: Syzygium aromaticum Referência: TANAKA et al., 1996 HO OH OH OH OH O OH O OH O O O O HO O O HO O O O O O HO OH O O OH O OH O telimagrandina O HO OH OH OH R= -O-glicose eugenioflogina D1 Espécie: Eugenia uniflora Referência: LEE et al., 1997 Espécie: Melaleuca leucadendron Referência: YOSHIDA et al., 1996 OH OH OH HO HO O O HO OH HO O O HO OH HO O O O O OH OH OH OH HO HO O O O O O O O H O O O HO O HO OH R O O O HO O O OH O O O OH OH OH O OH O HO OH OH O OH OH O OH HO OH O HO OH OH 1-O-galoil castalagina OH R= -O-glicose eugenioflogina D2 Espécie: Eugenia uniflora Referência: LEE et al., 1997 Espécie: Eugenia jambos Referência: YANG et al., 2000 Continua 8 Cap. 1 Introdução OH OH OH HO HO HO HO O O O O O OH OH O OH O H HO O O CH3 OH OH O OH O OH O O O O CH3 OH ácido siríngico OH HO OH OH casuarinina Espécie: Eugenia jambos Referência: YANG et al., 2000 Espécie: Leptospermum scoparium Referência: WESTON et al., 1999 O H3C CH3 HO O OH O CH3 ácido trans-cinâmico O O siringato de metila Espécie: Leptospermum scoparium Referência: WESTON et al., 1999 HO Espécie: Leptospermum scoparium Referência: WESTON et al., 1999 HO OH O OH ácido trans-cafeico Espécie: Leptospermum scoparium Referência: WESTON et al., 1999 OH O ácido 2-hidróxi-3-fenilpropanóico Espécie: Leptospermum scoparium Referência: WESTON et al., 1999 H3C H3C CH3 O OH O O CH3 H3C OH CH3 O O vomifoliol 2,6-dimetoxi-p-benzoquinona Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 O O O CH3 CH3 O CH3 O O CH3 H3C O O O H3C CH3 acetato de 3,4,5-trimetoxifenila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 O H3C acetato de 2,4,6-trimetoxifenila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 Continuação da Tabela 1 9 Cap. 1 Introdução OH OH CH3 O O O O H3C H3C H3C H3C sideroxilina Espécies: Callistemon coccineus; Eucalyptus saligna; Eucalyptus tereticornis Referências: WOLLENWEBER et al., 2000; SARKER et al., 2001; WANG e FUGIMOTO, 1993 O Espécies: Eucalyptus saligna; Eucalyptus tereticornis Referências: SARKER et al., 2001; WANG e FUGIMOTO, 1993 OH CH3 CH 3 O HO O H3C O H3C OH 8-desmetil-sideroxilina O CH3 HO O OH O OH O OH CH3 O 6,8-dimetilapigenina 5,7-di-hidróxi-6-metil-3,8,4’-trimetoxiflavona Espécie: Metrosideros robusta Referência: WOLLENWEBER et al., 2000 Espécies: Callistemon acuminatus; Callistemon juniperinus; Callistemon rigidus; Callistemon salignus; Syzygium alternifolia Referências: WOLLENWEBER et al., 2000; RAO e RAO, 1991 HO OH O HO O HO OH OH OH O galangina O OH quercetina Espécie: Heteropyxis canescens Referência: MOHAMMED et al., 2009 Espécie: Leptospermum scoparium Referências: WESTON et al., 1999 CH3 O HO O O OH O OH crisina Espécie: Leptospermum scoparium Referências: MAYER, 1990; WESTON et al., 1999 O O H3C 5,7-dimetoxiflavona Espécie: Leptospermum scoparium Referência: HÄBERLEIN e TSCHIERSCH, 1998 Continuação da Tabela 1 10 Cap. 1 Introdução CH3 CH3 O O H3C H3C O O OH H3C O 5-hidróxi-6-metil-7-metoxiflavona 6-metil-5,7-dimetoxiflavona Espécie: Leptospermum scoparium Referência: HÄBERLEIN e TSCHIERSCH, 1998 CH3 O O CH3 CH3 O O Espécies: Leptospermum scoparium; Leptospermum polygalifolium Referências: HÄBERLEIN e TSCHIERSCH, 1998; MUSTAFA et al., 2003 CH3 O O H3C OH O OH 5-hidróxi-6,8-dimetil-7-metoxiflavona Espécie: Leptospermum scoparium Referência: HÄBERLEIN e TSCHIERSCH, 1998 CH3 CH3 HO O 5-hidróxi-8-metil-7-metoxiflavona Espécie: Leptospermum polygalifolium Referência: MUSTAFA et al., 2003 HO O O H3C H3C O O O O H3C H3C 7-hidróxi-6,8-dimetil-5-metoxi-isoflavona 7-hidróxi-6,8-dimetil-5-metoxiflavona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 OH CH3 O O O HO H3C H3C OH OH O 5,4’-di-hidróxi-6,8-dimetil-7-metoxiflavanona (angoforol) Espécie: Callistemon coccineus Referência: WOLLENWEBER et al., 2000 O pinocembrina Espécie: Leptospermum scoparium Referências: WESTON et al., 1999 CH3 O HO O HO OH OH H3C OH O 3,5,7-tri-hidróxi-6,8-dimetilflavanona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 OH O pinobanksina Espécie: Leptospermum scoparium Referência: WESTON et al., 1999 Continuação da Tabela 1 11 Cap. 1 Introdução CH3 O O CH3 OH OH H3C E-2,3,5-tri-hidróxi-6-metil-7-metoxiflavanona Espécie: Leptospermum polygalifolium Referência: MUSTAFA et al., 2003 CH3 CH3 OH O O O OH CH3 CH3 OH H3C O OH Z-2,3,5-tri-hidróxi-6-metil-7-metoxiflavanona Espécie: Leptospermum polygalifolium Referência: MUSTAFA et al., 2003 OH O O O O OH OH OH Z-2,3,5-tri-hidróxi-8-metil-7-metoxiflavanona Espécie: Leptospermum polygalifolium Referência: MUSTAFA et al., 2003 CH3 Z-2,3,5-tri-hidróxi-8-metil-7-metoxiflavanona Espécie: Leptospermum polygalifolium Referência: MUSTAFA et al., 2003 CH3 OH HO O HO O OH O OH O H3C H3C O O OH H3C O 5,7-di-hidróxi-6,8-dimetilflavanona 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 Espécies: Metrosideros excelsa; Cleistocalyx operculatus Referências: MAYER, 1990; MUSTAFA et al., 2005 O H CH3 O O O H3C O H3C H H3C O OH OH O 6-formil-5-hidróxi-8-metil-7-metoxiflavanona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 CH3 HO CH3 O O O 8-formil-5-hidróxi-6-metil-7-metoxiflavanona Espécie: Cleistocalyx operculatus Referência: YE et al., 2004 O H3C 7-hidróxi-8-metil-5-metoxiflavanona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 HO O OH O 5,7-di-hidróxi-8-metilflavanona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 Continuação da Tabela 1 12 Cap. 1 Introdução CH3 CH3 CH3 O O O O H3C H3C OH O O Espécies: Leptospermum scoparium; Cleistocalyx operculatus Referências: MAYER, 1990; DAO et al., 2010 O H3C 5-hidróxi-6,8-dimetil-7-metoxiflavanona 6-metil-5,7-dimetoxiflavanona Espécie: Leptospermum scoparium Referências: MAYER, 1990 CH3 O O HO O H3C O O OH H3C 5,7-dimetoxiflavanona Espécie: Leptospermum scoparium Referências: MAYER, 1990 O O 5,7-di-hidróxi-6-metilflavanona Espécie: Leptospermum scoparium Referências: MAYER, 1990 OH H CH3 HO O H3C CH3 CH3 HO O H3C OH O 3’-formil-4’,6’-di-hidróxi-5’-metil-2’-metoxichalcona Espécie: Cleistocalyx operculatus Referência: YE et al., 2004 CH3 HO OH O 4,2’,4’-tri-hidróxi-3’,5’-dimetil-6’-metoxichalcona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 CH3 CH3 O O CH3 OH H3C OH O 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona Espécies: Syzygium samarangense; Metrosideros excelsa; Heteropyxis natalensis Referências: SRIVASTAVA et al., 1995; MUSTAFA et al., 2005; MOHAMMED et al., 2009 CH3 CH3 O O OH O 2’,6’-di-hidróxi-3’-metil-4’-metoxichalcona Espécie: Metrosideros excelsa Referência: MUSTAFA et al., 2005 CH3 HO O H3C H3C OH O 2’-hidróxi-3’-metil-4’,6’-dimetoxichalcona Espécie: Metrosideros excelsa Referência: MUSTAFA et al., 2005 Continuação da Tabela 1 OH O 2’,4’-di-hidróxi-3’-metil-6’-metoxichalcona Espécies: Metrosideros excelsa Cleistocalyx operculatus Referências: MUSTAFA et al., 2005; DAO et al., 2010 13 Cap. 1 Introdução CH3 CH3 CH3 CH3 O HO O O OH OH OH H3C OH O 2’-hidróxi-5’-metil-4’,6’-dimetoxichalcona Espécie: Syzygium samarangense Referência: AMOR et al., 2007 O 2,2’,4’-tri-hidróxi-3’,5’-dimetil-6’-metoxichalcona Espécie: Cleistocalyx operculatus Referência: DAO et al., 2010 CH3 CH3 HO CH3 CH3 HO O O H3C H3C OH OH O 2’,4’-di-hidróxi-3’-metil-6’-metoxi-di-hidrochalcona Espécie: Syzygium samarangense Referência: AMOR et al., 2007 O 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxi-dihidrochalcona Espécie: Syzygium samarangense Referência: AMOR et al., 2007 HO CH3 HO OH O O O H3C HO OH O O CH3 O H3C O H3C O OH 2-hidróxi-6,8-dimetil-5,7-dimetoxiflavan-3-ona Espécie: Leptospermum scoparium Referência: HÄBERLEIN e TSCHIERSCH, 1998 H3C noreugenina-7-O--D-glicosídeo Espécie: Eucalyptus camaldulensis Referência: WANG e FUGIMOTO, 1993 CH3 H3C CH3 CH3 CH3 CH3 CH3 CH3 OH CH3 CH3 HO HO H3C H3C CH3 CH3 -amirina Espécies: Eucalyptus globulus; Myrcia citrifolia Referências: SANTOS et al., 1997; GOTTLIEB et al., 1972 eritridiol Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 H3C CH3 H3C CH3 O CH3 CH3 CH3 OH O H3C O CH3 OH CH3 O CH3 HO H3C CH3 ácido 3-acetiloleanólico Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 Continuação da Tabela 1 H3C CH3 ácido oleanólico Espécies: Eucalyptus camaldulensis; Leptospermum polygalifolium Referências: SIDDIQUI et al., 2000; MUSTAFA et al., 2003 14 Cap. 1 Introdução CH3 H3C CH3 H3C O CH3 HO O CH3 CH3 OH CH3 OH O CH3 CH3 HO O H3C H3C CH3 H3C HO ácido arjunólico Espécies: Heteropyxis canescens; Melaleuca alternifolia Referências: VIEIRA et al., 2004; MOHAMMED et al., 2009 ácido 3-acetilursólico Espécie: Melaleuca alternifolia Referência: VIEIRA et al., 2004 CH3 CH3 H3C H3C O CH3 OH CH3 CH3 O O CH3 CH3 CH3 O H3C H3C CH3 HO CH3 CH3 H3C 3-acetil-12-ursen-28-oato de metila uvaol Espécies: Eucalyptus globulus; Leptospermum scoparium Referências: SANTOS et al., 1997; MAYER, 1990 Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 CH3 CH3 CH3 H3C H3C O O H3C O H3C O O H3C CH3 CH3 CH3 O O CH3 O CH3 H3C O CH3 H3C O 3-acetil-11-metóxi-12-ursen-28-oato de metila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 CH3 3-cis-p-metoxicinamoil-12-ursen-28-oato de metila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 CH3 CH3 H3C H3C O CH3 O CH3 O O CH3 CH3 CH3 O CH3 CH3 O H3C CH3 CH3 H3C CH3 O 3-trans-p-metoxicinamoil-12-ursen-28-oato de metila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 CH3 HO H3C CH3 3-hidróxi-12-ursen-28-oato de metila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 Continuação da Tabela 1 15 Cap. 1 Introdução CH3 CH3 H3C H3C O CH3 CH3 CH3 O O CH3 HO O H3C H3C CH3 CH3 3-hidroxiurs-11-en-28,13-olídeo O 3,23-diacetil-12-ursen-28-oato de metila Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 Espécies: Eucalyptus camaldulensis; Eucalyptus tereticornis Referências: SIDDIQUI et al., 2000; WANG e FUGIMOTO, 1993 CH3 H3C H3C H3C CH3 O O H3C O CH3 H3C CH3 HO OH OH CH3 CH3 OH HO HO H3C H3C CH3 ácido ursólico Espécies: Eucalyptus camaldulensis; Eucalyptus tereticornis Referências: SIDDIQUI et al., 2000; WANG e FUGIMOTO, 1993 CH3 ácido 2,3,7-tri-hidróxi-11-metoxiurs-12-en28-óico Espécie: Eucalyptus camaldulensis Referência: SIDDIQUI et al., 2000 CH2 H3C H3C H3C HO H3C H3C CH3 O O CH3 O OH HO CH3 CH3 CH3 H3C H3C CH3 2,3,7-tri-hidroxiurs-11-en-28,13-olídeo Espécie: Eucalyptus camaldulensis Referências: SIDDIQUI et al., 2000 CH3 lupenona Espécie: Heteropyxis natalensis Referência: MOHAMMED et al., 2009 CH2 CH2 H3C H3C H O O CH3 O O CH3 O H3C CH3 CH3 CH3 CH3 O CH3 OH CH3 HO CH3 CH3 HO H3C CH3 éster metílico do ácido betulínico Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 H3C CH3 ácido betulínico Espécies: Eucalyptus camaldulensis; Heteropyxis natalensis Referências: SIDDIQUI et al., MOHAMMED et al., 2009 Continuação da Tabela 1 16 2000; Cap. 1 Introdução CH2 CH2 H3C H3C H O CH3 O CH3 CH3 CH3 OH O O CH3 O H3C HO CH3 H3C CH3 CH3 CH3 H3C ácido 3-acetilbetulínico 3-epi-betulinato de metila Espécie: Syzygium samarangense Referência: SRIVASTAVA et al., 1995 Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 CH2 H3C CH2 H3C H H O CH3 CH3 O O O CH3 CH3 H3C O CH3 CH3 CH3 CH3 O O H3C CH3 CH3 H3C 3-epi-acetilbetulinato de metila Espécie: Syzygium samarangense Referência: SRIVASTAVA et al., 1995 3-oxobetulinato de metila Espécie: Syzygium samarangense Referência: SRIVASTAVA et al., 1995 CH3 CH2 H3C H3C H CH3 CH3 CH3 AcO CH3 CH3 CH3 OH AcO O CH3 O AcO HO H3C CH3 betulina Espécies: Syzygium samarangense Melaleuca alternifolia Referências: SRIVASTAVA et al., 1995; VIEIRA et al., 2004 OAc tetra-acetil daucosterol Espécie: Eucalyptus globulus Referência: SANTOS et al., 1997 Continuação da Tabela 1 17 Cap. 1 Introdução 1.2.1. A química do gênero Myrcia Apesar do gênero Myrcia estar representado por um grande número de espécies, verificou-se que existem poucos trabalhos publicados relativos ao estudo dos constituintes químicos fixos e de atividades biológicas de espécies deste gênero, sendo que todos são de espécies do Brasil (Tabela 2). A grande maioria dos estudos com plantas do gênero Myrcia está vinculada a óleos essenciais. Trabalhos encontrados na literatura, com Myrcia multiflora, relatam o isolamento de flavonoides e acetofenonas glicosiladas, que apresentaram atividade antidiabética (MATSUDA et al., 2002; YOSHIKAWA et al., 1998). O trabalho com Myrcia citrifolia, relata o isolamento de um flavonoide e um triterpeno (GOTTLIEB et al., 1972) e de M. uniflora foram isolados dois flavonóides (FERREIRA et al., 2006). Os estudos realizados com espécies de Myrcia pelo nosso Grupo de Pesquisa (GESNAT-UFBA) resultaram no isolamento, a partir de Myrcia guianensis, de dois flavonoides, uma hidroxicetona cíclica, um sesquiterpeno e um esteróide (FEHLBERG, 2006), enquanto que, a partir de Myrcia rotundifolia (Berg.) Legrand, foram isolados terpenos e esteroides (CERQUEIRA, 2002) e de M. hiemalis obteve-se um esteróide e seis flavonóides (SILVA, 2007). Tabela 2: Alguns constituintes químicos fixos relatados para o gênero Myrcia. HO O HO HO O O O HO HO H3C OH HO OH CH3 O O O OH HO O OH OH H3C OH myrciacitrina I Espécie: M. multiflora Referência: YOSHIKAWA et al., 1998 O OH OH myrciacitrina II Espécie: M. multiflora Referência: YOSHIKAWA et al., 1998 HO HO H3C O HO OH O O OH O H3C CH3 O OH O O O O HO H3C OH HO OH OH OH O OH OH myrciacitrina III Espécie: M. multiflora Referência: MATSUDA et al., 2002 myrciacitrina IV Espécie: M. multiflora Referência: MATSUDA et al., 2002 Continua 18 Cap. 1 Introdução HO HO CH3 HO O HO O OH O O O HO O OH OH H3C OH HO H3C myriacetina O OH OH myrciacitrina V Espécie: M. multiflora Referência: MATSUDA et al., 2002 Espécie: M. multiflora Referência: YOSHIKAWA et al., 1998 HO CH3 O OH CH3 O HO HO OH O HO OH O OH OH H3C O O O OH OH O O H3C metoximatteucina OH OH 1-desmantina Espécie: M. multiflora Referência: YOSHIKAWA et al., 1998 Espécie: M. multiflora Referência: YOSHIKAWA et al., 1998 HO HO OH OH O HO O HO OH OH O O O O OH OH O O HO HO HO OH HO CH3 OH miricitrina Espécie: M. multiflora; M. uniflora M. hiemalis Referência: YOSHIKAWA et al., FERREIRA et al., 2006; SILVA, 2007 guaijaverina Espécie: M. multiflora Referência: YOSHIKAWA et al., 1998 1998; HO HO OH O CH3 O HO O HO OH O O OH OH O O HO CH3 HO mearnsitrina Espécie: M. multiflora; M. uniflora Referência: YOSHIKAWA et FERREIRA et al., 2006 Continuação da Tabela 2 O O HO CH3 HO OH OH quercitrina Espécie: Myrcia multiflora al., 1998; Referência: YOSHIKAWA et al., 1998 19 Cap. 1 Introdução OH O HO OH O O 6 CH3 4 OH myrciafenona A Espécie: Myrcia multiflora Referência: YOSHIKAWA et al., 1998 CH3 O H3C CH3 O OH HO H H OH HO O myrciafenona B CH3 CH3 friedelina Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 Espécie: Myrcia multiflora Referência: YOSHIKAWA et al., 1998 H3C CH3 H3C H3C O H3C CH3 HO CH3 CH3 H HO HO CH3 -amirina OH H CH3 OH ácido arjunólico Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 CH2 H3C CH3 H3C CH3 H3C CH3 CH3 CH3 OH OH H3C CH3 OH O O OH HO Espécie: Myrcia multiflora Referência: YOSHIKAWA et al., 1998 O OH HO ácido ginkgóico HO CH3 O CH2 H3C H H O H3C H3C CH3 CH3 CH3 OH CH3 HO H3C CH3 ácido betulínico Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 CH3 HO H3C H CH3 lupeol Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 Continuação da Tabela 2 20 Cap. 1 Introdução CH3 CH2 H3C H3C H3C H CH3 CH3 CH3 H3C CH3 CH3 CH3 HO O sitosterol CH3 H3C lupenona Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 CH3 CH3 H3C CH3 H3C CH3 CH3 CH3 CH3 CH3 CH3 CH3 HO estigmasterol CH3 H3C esqualeno Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 Espécie: Myrcia rotundifolia Referência: CERQUEIRA, 2002 OH OH CH3 CH3 O O O H3C O O H3C CH3 H3C H3C OH O 5,4’-di-hidroxi-6,8- dimetil-7,3’dimetoxiflavona Espécie: Myrcia guianensis Referência: FEHLBERG, 2006 O OH Espécie: Myrcia guianensis Referência: FEHLBERG, 2006 CH3 H H3C HO CH3 4-hidroxi-4,7-dimetil-1-tetralona Espécie: Myrcia guianensis Referência: FEHLBERG, 2006 O sideroxilina H3C H O H CH3 CH3 bourbonenona Espécie: Myrcia guianensis Referência: FEHLBERG, 2006 Continuação da Tabela 2 21 Cap. 1 Introdução H3C H3C CH3 CH3 O H3C CH3 H3C H3C CH3 H3C H H H OH O CH3 OH HO O H3C CH3 HO OH ácido ursólico OH Espécie: Myrcia guianensis Referência: FEHLBERG, 2006 daucosterol Espécie: Myrcia hiemalis Referência: SILVA, 2007 CH3 CH3 CH3 O HO OH O H3C H3C O OH 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona Espécie: Myrcia hiemalis Referência: SILVA, 2007 CH3 CH3 O HO O OH 2’,6’-di-hidróxi-3’-metil-4’-metoxichalcona Espécie: Myrcia hiemalis Referência: SILVA, 2007 CH3 O HO H3C HO OH O 2’,3’,4’-tri-hidróxi-5’-metil-6’-metoxichalcona Espécie: Myrcia hiemalis Referência: SILVA, 2007 O O H3C 7-hidróxi-6,8-dimetil-5-metoxiflavanona Espécie: Myrcia hiemalis Referência: SILVA, 2007 CH3 O HO H3C OH O 5,7-di-hidróxi-6,8-dimetilflavanona Espécie: Myrcia hiemalis Referência: SILVA, 2007 Continuação da Tabela 2 Da revisão da literatura não foram encontrados relatos sobre o estudo dos constituintes químicos não voláteis das espécies Myrcia myrtifolia e Myrcia hiemalis (Myrtaceae), além da dissertação de mestrado sobre os constituintes químicos de M. hiemalis (SILVA, 2007), desenvolvido pelo nosso Grupo de Pesquisa (GESNAT – 22 Cap. 1 Introdução UFBA). Este estudo fitoquímico das folhas de M. hiemalis foi iniciado em 2005, como parte do projeto de mestrado, e resultou no isolamento de sete substâncias: miricitrina, daucosterol, 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona, 2’,4’-di-hidróxi-3’-metil-6’metoxichalcona, 2’,3’,4’-tri-hidróxi-5’-metil-6’-metoxichalcona, 7-hidróxi-6,8-dimetil-5metoxiflavanona e 5,7-di-hidróxi-6,8-dimetilflavanona. Os flavonoides isolados foram avaliados quanto às suas propriedades antibacterianas contra Staphylococcus aureus, Bacillus subtillis, Pseudomonas aeruginosa, Streptococcus mutans, Escherichia coli, Micrococcus luteus e Salmonella typhimurum, antifúngicas contra Aspergillus niger, Cândida albicans, Cladosporium cladosporioides e Moniliophtora perniciosa (antigamente denominado de Crinipellis perniciosa), e antiparasitárias contra epimastigotas de Trypanosoma cruzi e promastigotas de Leishmania amazonensis. Os testes antimicrobianos realizados revelaram atividade da chalcona 2’,4’-dihidróxi-3’,5’-dimetil-6’-metoxichalcona contra M.luteus (CIM de 12,5 g/mL) e da flavanona 5-hidróxi-6,8-dimetil-7-metoxiflavanona contra B. subtilis (CIM de 25 g/mL) e M. luteus (CIM de 25 g/mL). Os ensaios anti-T. cruzi e anti-Leishmania exibiram potente atividade da chalcona 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona, que apresentou IC50 de 13,12 M para T. cruzi e, num ensaio preliminar, 100% de inibição na concentração de 50 M para Leishmania amazonensis. A chalcona 2’,4’-di-hidróxi3’-metil-6’-metóxi-chalcona exibiu contra T. cruzi relevante atividade, com IC50 de 35,95 M. Estes resultados preliminares sugerem que os metabólitos presentes nas espécies do gênero Myrcia, apresentam-se como candidatos em potencial para a descoberta de novos agentes antimicrobianos e antiparasitários, cujo estudo deve ser aprofundado. Além disso, avaliou-se a citotoxicidade das chalconas isoladas para células GL-15 de glioblastoma humano e verificou-se que a chalcona 2’,4’-di-hidróxi3’,5’-dimetil-6’-metoxichalcona possui significante atividade. Este trabalho contém a continuação do estudo fitoquímico das folhas de M. hiemalis e o estudo das folhas de M. myrtifolia, com intuito de contribuir para o conhecimento químico do gênero Myrcia, além de contribuir na busca de metabólitos que apresentem atividade biológica. 1.3. Objetivos - Realizar o estudo fitoquímico das folhas das espécies Myrcia hiemalis e Myrcia myrtifolia (Myrtaceae); - Purificar e determinar as estruturas dos constituintes químicos não-voláteis. 23 Capítulo 2 2. PARTE EXPERIMENTAL 2.1. Métodos Cromatográficos Para a cromatografia em camada delgada comparativa (CCDC) foi utilizado como adsorvente sílica gel 60 GF254 e HF254+366 e para a cromatografia em camada delgada preparativa (CCDP) foi utilizado sílica gel PF254+366 e HF254+366, todas da marca Merck. As cromatoplacas foram preparadas espalhando-se manualmente a suspensão de sílica em água destilada em placas de vidro com o auxílio de um espalhador mecânico do tipo Heidelberg. Para CCDC utilizou-se placas de 2,5 x 7,0 cm e de 5,0 x 7,0 cm e obteve-se placas com espessuras de 0,5 mm, enquanto que, para CCDP, utilizou-se placas de 20 x 20 cm e obteve-se placas com 1,0 mm de espessura. Após preparadas, as cromatoplacas foram deixadas para secar ao ar livre e, em seguida, foram ativadas em estufa a 70 ºC por um período de aproximadamente uma hora. As revelações das substâncias nas cromatoplacas foram feitas expondo estas, em câmaras de ultravioleta (UV), a irradiação nos comprimentos de onda de 254 nm e 366 nm, e expondo em cubas de iodo, a vapores de iodo. Para as separações cromatográficas em coluna foram utilizadas sílica gel 60230 mesh (0,063-0,210 mm) e 230-400 mesh (0,040-0,063 mm), da marca Merck, e SEPHADEX LH-20, da marca Sigma-Aldrich. Os processos cromatográficos com sílica gel foram realizados com colunas de vidro de diversos tamanhos (altura) e com diâmetros de 1,0, 1,5, 2,0 e 3,0 cm e, para coluna filtrante, foi utilizado uma coluna de vidro de 8,0 cm de diâmetro e 70 cm de altura. Os processos cromatográficos com SEPHADEX foram realizados com uma coluna de vidro de 2,0 cm de diâmetro e 1,0 m de altura. 2.2. Reagentes Utilizados Os solventes utilizados durante as análises cromatográficas, de qualidade P.A das marcas Merck, Grupo Química e Quimex, foram os seguintes: hexano, éter de petróleo, acetato de etila, diclorometano, clorofórmio, acetona, metanol e etanol. Os solventes utilizados para dissolução das amostras para obtenção dos espectros de RMN foram clorofórmio deuterado (CDCl3), acetona deuterada (acetonad6) e metanol deuterado (CD3OD), todos da marca Sigma-Aldrich. Cap. 2 Experimental 2.3. Especificação dos Equipamentos - As folhas secas foram reduzidas a pó no Moinho Thomas Wiley Laboratory MillModel 4. - A eliminação dos solventes dos extratos e das frações obtidas foi realizada sob pressão reduzida no evaporador rotatório de marca BUCHI, modelo R-3000. - Os espectros de RMN de 1H e 13 C unidimensionais e bidimensionais foram obtidos nos espectrômetros Varian Gemini 300 e Varian Inova 500, operando com freqüências do hidrogênio a 300 MHz e 500 MHz, e do carbono a 75 MHz e 125 MHz, respectivamente. - A determinação da rotação óptica específica foi realizada em polarímetro digital Perkin Elmer – Pol 343 (Nº série 9753), com filtro de Na e cela de quartzo com 6 mm de caminho óptico. - Os pontos de fusão foram obtidos utilizando o aparelho digital de ponto de fusão MQAPF – 301 da marca Micro Química. 2.4. Material Vegetal As folhas de espécimes de Myrcia hiemalis (Figura 3) e Myrcia myrtifolia foram coletadas em agosto de 2005, na Área de Proteção Ambiental da Lagoa do Abaeté, no Município de Salvador, Estado da Bahia. O local é uma área com dunas e repleta de vegetação arbustiva (Figura 4, p.26). Os espécimes apresentavam-se como arbustos de aproximadamente 3 m de altura com casca lisa e folhas discolores abundantes. A identificação botânica das espécies foi realizada pela Profa. Maria Lenise S. Guedes e registrada no Herbário “Alexandre Leal Costa” do Instituto de Biologia da Universidade Federal da Bahia, sob o número ALCB-61532 para M. hiemalis e ALCB-52168 para M. myrtifolia. (a) (b) Figura 3: Partes aéreas de (a) Myrcia hiemalis e (b) M. myrtifolia 25 Cap. 2 Experimental Figura 4: Vista do local da coleta na Área de Proteção Ambiental da Lagoa do Abaeté – Salvador, BA. 2.5. Estudo Fitoquímico das Folhas de M. hiemalis e de M. myrtifolia 2.5.1. Obtenção dos Extratos e das Fases As folhas secas de M. hiemalis (2,77 kg) e de M. myrtifolia (1,38 kg), coletadas em agosto de 2005, após terem sido reduzidas a pó foram submetidas a três extrações sucessivas com etanol, por um período de 72 h cada, obtendo-se assim, após a eliminação do solvente em evaporador rotatório sob pressão reduzida a aproximadamente 35 ºC, 349,9 g e 255,2 g de extratos etanólicos de folhas de M. hiemalis e de M. myrtifolia, respectivamente. A seguir, cada extrato etanólico foi solubilizado em 1 litro de etanol e acrescentou-se 500 mL de água. Logo após, foram submetidos à partição (líquidolíquido) em funil de separação, por três vezes sucessivas com hexano, diclorometano, acetato de etila e n-butanol, nesta ordem. Após eliminação do solvente de cada fase, em evaporador rotatório sob pressão reduzida a aproximadamente 35 ºC, obteve-se das folhas de M. hiemalis 127,4 g de fase hexânica, 37,1 g de fase diclorometânica, 58,9 g de fase acetato de etila e 74,2 g de fase n-butanólica, enquanto que a partir das folhas de M. myrtifolia obteve-se 44,3 g de fase hexânica, 38,0 g de fase diclorometânica, 38,5 g de fase acetato de etila e 49,1 g de fase n-butanólica (Esquema 1, p. 27). Durante a eliminação dos solventes das fases hexânica, 26 Cap. 2 Experimental diclorometânica e acetato de etila, obtidas da partição do extrato etanólico das folhas de M. myrtifolia, ocorreu formação de uma grande quantidade de precipitado branco que foi filtrado e pesou 28,1 g, sendo reservado para análise por CCD e RMN. M. hiemalis (Mh) 2,77 kg M. myrtifolia (Mm) 1,38 kg FOLHAS SECAS E MOÍDAS Três extrações sucessivas com etanol (72 h) Filtração Evaporação do solvente à pressão reduzida TORTA EXTRATO ETANÓLICO (Mh = 349,9 g; Mm = 255,2 g) Dissolveu-se o extrato em 1 L de etanol e acrescentou-se 500 mL de água destilada PARTIÇÃO (líquido-líquido) Partição com hexano – 3x Evaporação do solvente à pressão reduzida Fase etanol/água FASE HEXÂNICA (Mh = 127,4 g; Mm = 44,3 g) Partição com diclorometano – 3x Evaporação do solvente à pressão reduzida Fase etanol/água FASE DICLOROMETÂNICA (Mh = 37,1 g; Mm = 38,0 g) Partição com acetato de etila – 3x Fase etanol/água FASE ACETATO DE ETILA (Mh = 38,9 g; Mm = 38,5 g) Partição com n-butanol – 3x Fase etanol/água Evaporação do solvente à pressão reduzida Evaporação do solvente à pressão reduzida FASE n-BUTANÓLICA (Mh = 34,2 g; Mm = 49,1 g) Esquema 1: Obtenção dos extratos e das fases a partir das folhas de Myrcia hiemalis e de M. myrtifolia. 27 Cap. 2 Experimental 2.5.2. Fracionamento da Fase Diclorometânica das Folhas de M. hiemalis O fracionamento da fase diclorometânica foi iniciado em 2005, no trabalho de mestrado, e resultou no isolamento de sete substâncias (ver p. 22 e 23). Neste estudo, como parte do projeto de doutorado, relatamos a continuação do estudo químico da fase diclorometânica. A fase diclorometânica das folhas (37,1 g) foi submetida, no trabalho de mestrado, a uma coluna cromatográfica (código MhDCM-A), empacotada a seco com sílica gel 60-230 mesh. Utilizou-se como eluentes inicialmente hexano puro e, em seguida, misturas de Hex:AcOEt em gradiente crescente de polaridade até chegar a AcOEt 100%. Obteve-se 26 frações de aproximadamente 200 mL cada, denominadas MhDCM-A1 a A26. Após a evaporação do solvente, todas as frações desta coluna foram submetidas à CCDC e, após análise dos resultados, algumas frações foram reunidas e submetidas a outros fracionamentos cromatográficos. A seguir, estão descritas apenas as etapas que fizeram parte deste estudo. As frações MhDCM-A10 a A16 foram reunidas (6,4 g) e submetidas à coluna cromatográfica (código MhDCM-A10.16-D) empacotada com sílica gel 0,040-0,063 mm em hexano, utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes. Foram obtidas 35 frações (MhDCM-A10.16-D1 a 35). As frações MhDCM-A10.16-D21 a 25, após a análise por cromatografia em camada delgada comparativa (CCDC), foram reunidas (751 mg) e submetidas à coluna cromatográfica (código MAAS), empacotada com sílica 0,040-0,063 mm em hexano, utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes, e obteve-se 23 frações MhDCM-MAAS-01 a 23). As frações MhDCMMAAS-14 a 18, após a análise por CCDC, foram reunidas (38 mg) e a mistura (código MhDCM-MAAS-14.18) foi submetida à cromatografia em camada delgada preparativa (CCDP) com sílica gel PF254+366. Após quatro eluições da fase móvel (éter de petróleo:AcOEt 75:25), o resultado foi seis manchas (I a VI, sendo I a origem), sendo que da mancha III obteve-se a substância 1-h (5 mg) (Esquema 2, p. 30). A fração MhDCM-MAAS-20 (35 mg) foi submetida a CCDP com sílica gel HF254+366. Foram necessárias três eluições da fase móvel, uma mistura DCM:MeOH 98:2. O resultado foi cinco manchas (I a V, sendo I a origem) e da mancha II obteve-se a substância 4-h (8 mg), enquanto que da mancha III, obteve-se uma mistura binária (9 mg) contendo a substância 7-h (Esquema 2, p. 30). A fração MhDCM-A2 (103 mg) foi submetida à coluna cromatográfica (código MhDCM-A2-C) empacotada com SEPHADEX LH-20 em hexano. Utilizou-se como 28 Cap. 2 Experimental eluentes misturas de Hex:DCM, em gradiente crescente de polaridade, iniciando com um sistema de solventes Hex:DCM 9:1, e obteve-se 28 frações. Na fração MhDCMA2-C-20 foi isolada a substância 3-h (8 mg) (Esquema 3, p. 31). As frações MhDCM-A2-C-4 e 5, após a análise por CCDC, foram reunidas (38 mg) e a mistura (código MhDCM-A2-C-4.5) foi submetida a CCDP com sílica gel HF254+366. Foram necessárias quatro eluições da fase móvel, uma mistura Hex:DCM 6:4 e resultou em duas manchas (I e II, sendo I a de menor Rf), onde obteve-se na mancha I a substância 2-h (14 mg) e na mancha II, a substância 6-h (5 mg) (Esquema 3, p. 31). Nas frações MhDCM-A3 a A7 foi observado na mistura a presença de sólido amorfo de cor laranja e cristais amarelos, que foram separados por recristalização e identificados no mestrado. Os sobrenadantes das frações MhDCM-A3 a A7 foram reunidos (4,8 g) e submetidos à coluna cromatográfica (código MhDCM-A3.7-B) empacotada com sílica 0,040-0,063 mm em hexano, utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes, e foram obtidas 32 frações, denominadas MhDCM-A3.7-B1 a B32. No “bico” dessa coluna foi raspado, juntamente com a fração MhDCM-A3.7-B27, um precipitado branco, e assim obteve-se a substância 9-h (3 mg) (Esquema 4, p. 32). As frações MhDCM-A3.7-B12 a B15, após a análise por CCDC, foram reunidas (247 mg) e submetidas à coluna cromatográfica (código MhDCM-PDA) empacotada com hexano em sílica 0,040-0,063 mm, utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes. Foram obtidas 29 frações denominadas MhDCM-PDA-01 a 29. As frações MhDCM-PDA-18 a 20 foram reunidas (53 mg) e submetidas a CCDP com sílica gel HF254+366. Foram necessárias cinco eluições da fase móvel, uma mistura Hex:DCM 3:7. O resultado foi sete manchas (I a VII, sendo I a origem) e da mancha VI obteve-se a substância 5-h (6 mg) (Esquema 4, p. 32). As frações MhDCM-PDA-23 a 25 foram reunidas (29 mg) e submetidas a CCDP com sílica gel HF254+366. Foram necessárias duas eluições da fase móvel, uma mistura DCM:MeOH 99:1 e resultou em seis manchas (I a VI, sendo I a origem), onde da mancha II obtevese a substância 8-h (10 mg) (Esquema 4, p. 32). As frações MhDCM-A3.7-B62 a B29 foram reunidas (700 mg) e submetidas à coluna cromatográfica (código MhDCM-VHU) empacotada com hexano em sílica 0,040-0,063 mm, utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes. Foram obtidas 33 frações (MhDCM-VHU-01 a 33). Após análise por CCDC, a fração MhDCM-VHU-31 (53 mg) foi submetida a CCDP com sílica gel HF254+366. Após quatro eluições da fase móvel, uma mistura Hex:AcOEt 29 Cap. 2 Experimental 78:22, o resultado foi quatro manchas (I a IV, sendo I a origem) e da mancha III obteve-se a substância 10-h (10 mg) (Esquema 5, p. 33). Fase DCM das folhas de M. hiemalis (37,1 g) CC em silica gel Gradiente crescente Hex:AcOEt 26 frações MhDCM-A1 a A26 CCDC Frações A10 a A16: MhDCM-A10.16-D (6,4 g) CC em silica gel Gradiente crescente Hex:AcOEt 35 frações MhDCM-A10.16-D1 a D35 CCDC Frações D21 a D25: MhDCM-MAAS (751 mg) CC em silica gel Gradiente crescente Hex:AcOEt 23 frações MhDCM-MAAS-1 a 23 CCDC MhDCM-MAAS-14 a 18 (38 mg) CCDP Hex:AcOEt 95:5 MhDCM-MAAS-14.18-I a VI mancha III Substância 1-h (5 mg) MhDCM-MAAS-20 (35 mg) CCDP DCM:MeOH 98:2 MhDCM-MAAS-20-I a V mancha II Substância 4-h (8 mg) mancha III Substância 7-h (em mistura; 9 mg) Esquema 2: Fracionamento para isolamento das substâncias 1-h, 4-h e 7-h. 30 Cap. 2 Experimental Fase DCM das folhas de M. hiemalis (37,1 g) CC em silica gel Gradiente crescente Hex:AcOEt 26 frações MhDCM-A1 a A26 CCDC Fração A2: MhDCM-A2-C (103 mg) CC SEPHADEX LH-20 Gradiente crescente Hex:DCM 28 frações MhDCM-A2-C-1 a 28 CCDC MhDCM-A2-C-20 MhDCM-A2-C-4 e 5 (38 mg) CCDP Hex:DCM 6:4 Substância 3-h (8 mg) MhDCM-A2-C-4.5-I e II MhDCM-A2-C-4.5-I MhDCM-A2-C-4.5-II Substância 2-h (14 mg) Substância 6-h (5 mg) Esquema 3: Fracionamento para isolamento das substâncias 2-h, 3-h e 6-h. 31 Cap. 2 Experimental Fase DCM das folhas de M. hiemalis (37,1 g) CC em silica gel Gradiente crescente Hex:AcOEt 26 frações MhDCM-A1 a A26 CCDC Frações A3 a A7: MhDCM-A37-B (4,8 g) CC em silica gel Gradiente crescente Hex:AcOEt 32 frações MhDCM-A37-B1 a B32 CCDC MhDCM-A37-B27 Frações B12 a B15: MhDCM-PDA (247 mg) ppt coletado no “bico da coluna” CC em silica gel Gradiente crescente Hex:AcOEt 29 frações Substância 9-h (5 mg) MhDCM-PDA-1 a 29 CCDC MhDCM-PDA-18 a 20 (53 mg) CCDP Hex:DCM 3:7 MhDCM- PDA-18.20-I a VII mancha II Substância 5-h (5 mg) MhDCM-PDA-23 a 25 (29 mg) CCDP DCM:MeOH 99:1 MhDCM- PDA-23.25-I a VI mancha II Substância 8-h (10 mg) Esquema 4: Fracionamento para isolamento das substâncias 5-h, 8-h e 9-h. 32 Cap. 2 Experimental Fase DCM das folhas de M. hiemalis (37,1 g) CC em silica gel Gradiente crescente Hex:AcOEt 26 frações MhDCM-A1 a A26 CCDC Frações A3 a A7: MhDCM-A37-B (4,8 g) CC em silica gel Gradiente crescente Hex:AcOEt 32 frações MhDCM-A37-B1 a B32 CCDC Frações B26 a B29: MhDCM-VHU (700 mg) CC em silica gel Gradiente crescente Hex:AcOEt 33 frações MhDCM-VHU-1 a 33 CCDC MhDCM-VHU-31 (53 mg) CCDP Hex:AcOEt 78:22 MhDCM- VHU-31-I a IV mancha III Substância 10-h (10 mg) Esquema 5: Fracionamento para isolamento da substância 10-h. 33 Cap. 2 Experimental 2.5.3. Fracionamento da Fase Hexânica das Folhas de M. hiemalis A fase hexânica (127,4 g) foi submetida a uma coluna cromatográfica (código MhHex), empacotada a seco com gel de sílica 60-230 mesh. Utilizou-se como eluentes inicialmente hexano puro e, em seguida, misturas de Hex:AcOEt em gradiente crescente de polaridade até chegar a AcOEt 100%. Obteve-se 10 frações de aproximadamente 500 mL cada, denominadas MhHex-1 a 10. Após a evaporação do solvente, todas as frações desta coluna foram submetidas a cromatografia em camada delgada comparativa (CCDC) e, após análise dos resultados, algumas frações foram reunidas e submetidas a outros fracionamentos cromatográficos. As frações MhHex-2 a 4 foram reunidas (14,2 g) e submetidas à coluna cromatográfica (código MhHex-2.4) empacotada com sílica 0,040-0,063 mm em hexano. Utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes e foram obtidas 46 frações denominadas MhHex-2.4-1 a 46. As frações HexVeu-27 a 29, após a análise por CCDC, foram reunidas (106 mg) e a mistura (código HexVeu-27.29) foi submetida a CCDP preparada com uma mistura de sílica gel PF254+366 e GF254 na proporção 1:1. Foram necessárias quatro eluições da fase móvel, uma mistura Hex:AcOEt 99:1 e resultou em sete manchas (I a VII, sendo I a origem). Obteve-se na mancha IV, 25 mg da substância 11-h (Esquema 6, p. 35). As frações HexVeu-20 a 22, após a análise por CCDC, foram reunidas (56 mg) e a mistura (código HexVeu-20.22) foi submetida à cromatografia em camada delgada preparativa (CCDP) preparada com uma mistura de sílica gel PF254+366 e GF254 na proporção 1:1. Foram necessárias quatro eluições da fase móvel, uma mistura Hex:AcOEt 99:1. O resultado foi cinco manchas (I a V, sendo I a origem) e obteve-se na mancha IV, 30 mg da substância 12-h (Esquema 6, p. 35). Da análise das frações obtidas da fase hexânica, por RMN de 1H e/ou análise por CCDC, verificou-se a existência de material graxo como componente majoritário. 34 Cap. 2 Experimental Fase Hexânica das folhas de M. hiemalis (127,4 g) CC filtrante em silica gel Gradiente crescente Hex:AcOEt 10 frações MhHex-1 a 10 CCDC MhHex-2.4 (14,2 g) CC em silica gel Gradiente crescente Hex:AcOEt 46 frações MhHex-2.4-1 a 46 CCDC MhHex-2.4-24.25 (3,8 g) CC em silica gel Gradiente crescente Hex:AcOEt 58 frações HexVeu-1 a 58 CCDC HexVeu-27 a 29 (106 mg) CCDP Hex:AcOEt 99:1 HexVeu-27.29-I a VII mancha IV Substância 11-h (25 mg) HexVeu-20 a 22 (56 mg) CCDP Hex:AcOEt 99:1 HexVeu-20.22-I a V mancha IV Substância 12-h (30 mg) Esquema 6: Fracionamento para isolamento das substâncias 11-h e 12-h. 35 Cap. 2 Experimental 2.5.4. Fracionamento da Fase Diclorometânica das Folhas de M. myrtifolia A fase diclorometânica (38,0 g) foi submetido a uma coluna cromatográfica (código MmDCM), empacotada a seco com gel de sílica 60-230 mesh e utilizou-se, como eluentes, inicialmente hexano e, em seguida, misturas de Hex:AcOEt em gradiente de polaridade crescente até chegar a AcOEt 100%. Obteve-se 10 frações de aproximadamente 400 mL cada, denominadas MmDCM-1 a 10. Após a evaporação do solvente, todas as frações desta coluna foram submetidas à cromatografia em camada delgada comparativa (CCDC) e, após análise dos resultados, algumas frações foram reunidas e submetidas a outros fracionamentos cromatográficos. A fração MmDCM-8 (1,83 g) foi submetida à coluna cromatográfica empacotada com sílica 0,040-0,063 mm em hexano. Utilizou-se misturas de Hex: Acetona em gradiente crescente de polaridade como eluentes e foram obtidas 23 frações denominadas MmDCM-8-1 a 23. Obteve-se na fração MmDCM-8-13 a substância 13-m (57 mg) (Esquema 7, p. 38). A fração MmDCM-2 (741 mg) foi submetida à coluna cromatográfica empacotada com sílica 0,040-0,063 mm em hexano e utilizou-se, como eluentes, misturas de Hex:AcOEt em gradiente crescente de polaridade. Foram obtidas 9 frações denominadas MmDCM-2-1 a 9. Após a análise por CCDC, as frações MmDCM-2-6 e 7 foram reunidas (67 mg) e a mistura (código MmDCM-2-6.7) foi submetida à cromatografia em camada delgada preparativa (CCDP) preparada com sílica gel HF254+366. Foram necessárias cinco eluições da fase móvel, uma mistura éter de petróleo:AcOEt 97:3 e resultou em sete manchas (I a VII, sendo I a origem). As frações MmDCM-2-6.7-VI e VII apresentaram sólido branco que foram, individualmente, solubilizados com uma mistura de Hex:DCM 8:2 e, em seguida, as soluções foram filtradas numa pipeta de Pasteur, contendo sílica gel 0,040-0,063 mm. Dessa maneira, obteve-se da fração MmDCM-2-6.7-VI, a substância 15-m (7 mg), enquanto que da MmDCM-2-6.7-VII, obteve-se a substância 14-m (14 mg) (Esquema 8, p. 39). A fração MmDCM-3 (3,7 g) foi submetida à coluna cromatográfica empacotada com sílica 0,040-0,063 mm em hexano e utilizou-se, como eluentes, misturas de Hex:AcOEt em gradiente crescente de polaridade. Foram obtidas 20 frações (MmDCM-3-1 a 20) que foram analisadas por CCDC. As frações MmDCM-3-13 a 16 foram reunidas (765 mg) e a mistura (código MmDCM-3-13.16) foi submetida à coluna cromatográfica empacotada com sílica 36 Cap. 2 Experimental 0,040-0,063 mm em hexano. Utilizou-se misturas de Hex:AcOEt em gradiente crescente de polaridade como eluentes e foram obtidas 30 frações denominadas MmDCM-3-13.16-1 a 30. Na fração MmDCM-3-13.16-16 (108 mg) obteve-se a substância 19-m (Esquema 9, p. 40). As frações MmDCM-3-13.16-17 a 20 foram agrupadas (54 mg), e submetidas a CCDP preparada com sílica gel HF254+366. Utilizou-se como fase móvel uma mistura éter de petróleo:AcOEt 97:3 e foram necessárias quatro eluições. O resultado foi seis manchas (MmDCM-3-13.16-17.20-I a VI, sendo I a origem), sendo que o sólido branco existente na fração MmDCM-3-13.16-17.20-V foi solubilizado com uma mistura de Hex:DCM 7:3 e, em seguida, foi filtrado numa pipeta de Pasteur, contendo sílica gel 0,040-0,063 mm. Assim, obteve-se da fração MmDCM-3-13.16-17.20-V-1, a substância 18-m (8 mg) (Esquema 9, p. 40). A fração MmDCM-3-17 (540 mg) apresentou sólido branco em mistura que foi separado da fração por filtração com funil analítico. Para isso, utilizou-se uma mistura Hex:DCM 7:3 que solubilizou a fração, exceto o sólido que ficou retido num algodão utilizado como elemento filtrante. A análise por CCDC do sólido (código MmDCM-3-171) revelou que se tratava de uma mistura (52 mg), que foi submetida a CCDP preparada com sílica gel HF254+366. Utilizou-se como fase móvel uma mistura Hex:DCM 1:9 e foram necessárias quatro eluições. O resultado foi cinco manchas (MmDCM-317-1-I a V, sendo I a origem), sendo que da mancha II obteve-se a substância 17-m (30 mg) (Esquema 10, p. 41). A fração MmDCM-3-18 (643 mg) apresentou cristais brancos em mistura, que inicialmente foram separados da fração por filtração em funil analítico contendo algodão como elemento filtrante, sendo que para dissolver a fração, exceto os cristais, utilizou-se um sistema Hex:DCM 9:1. Em seguida, os cristais foram purificados por filtração realizada numa pipeta de Pasteur com sílica gel 0,040-0,063 mm e para solubilizar os cristais utilizou-se uma mistura de Hex:DCM 4:6. Obteve-se no filtrado a substância 22-m (62 mg), cristais em forma de agulhas (Esquema 10, p. 41). A fração MmDCM-4 (2,86 g) apresentou sólido branco em mistura que foi separado por filtração. Para isso, utilizou-se uma mistura Hex:DCM 7:3 que solubilizou a fração, exceto o sólido que ficou retido num algodão utilizado como elemento filtrante. A análise por CCDC do sólido (código MmDCM-4-S) revelou que se tratava de uma mistura, com pelo menos três substâncias. Essa mistura MmDCM-4-S (544 mg) foi submetida à coluna cromatográfica empacotada com sílica 0,040-0,063 mm em hexano e utilizou-se, como eluentes, misturas de Hex:DCM em gradiente crescente de polaridade. Foram obtidas 26 frações (MmDCM-4-S-1 a 26) que foram analisadas por CCDC. 37 Cap. 2 Experimental As frações MmDCM-4-S-2 e 4 (32 mg e 38 mg, respectivamente) foram individualmente submetidas a CCDP, preparada com sílica gel HF254+366. Foram necessárias quatro eluições da fase móvel, uma mistura DCM:MeOH 98:2, e resultaram em quatro manchas (I a IV, sendo I a origem) em cada cromatoplaca. Da mancha MmDCM-4-S-2-II obteve-se a substância 16-m (8 mg) e da mancha MmDCM4-S-4-II obteve-se a substância 20-m (12 mg) (Esquema 11, p. 42). Na fração MmDCM-4-S-13 (80 mg) obteve-se uma mistura binária das substâncias 20-m e 21-m (Esquema 11, p. 42). Fase DCM das folhas de M. myrtifolia (38,0 g) CC filtrante em silica gel Gradiente crescente Hex:AcOEt 10 frações MmDCM-1 a 10 CCDC MmDCM-8 (1,83 g) CC em silica gel Gradiente crescente Hex:Acetona 23 frações MmDCM-8-1 a 23 CCDC MhDCM-8-13 Substância 13-m (57 mg) Esquema 7: Fracionamento para isolamento da substância 13-m. 38 Cap. 2 Experimental Fase DCM das folhas de M. myrtifolia (38,0 g) CC filtrante em silica gel Gradiente crescente Hex:AcOEt 10 frações MmDCM-1 a 10 CCDC MmDCM-2 (741 mg) CC em silica gel Gradiente crescente Hex:AcOEt 09 frações MmDCM-2-1 a 9 CCDC MhDCM-2-6 e 7 (67 mg) CCDP Éter petróleo:AcOEt 97:3 MhDCM-2-6.7-I a VII CCDC MhDCM-2-6.7-VI Filtração em pipeta de Pasteur com sílica gel Hex:DCM 8:2 MhDCM-2-6.7-VII Filtração em pipeta de Pasteur com sílica gel Hex:DCM 8:2 MhDCM-2-6.7-VI-1 MhDCM-2-6.7-VII-2 Substância 15-m (7 mg) Substância 14-m (14 mg) Esquema 8: Fracionamento para isolamento das substâncias 14-m e 15-m. 39 Cap. 2 Experimental Fase DCM das folhas de M. myrtifolia (38,0 g) CC filtrante em silica gel Gradiente crescente Hex:AcOEt 10 frações MmDCM-1 a 10 CCDC MmDCM-3 (3,7 g) MmDCM-3-1 a 20 CC em silica gel Gradiente crescente Hex:AcOEt 20 frações CCDC MhDCM-3-13 a 16 (765 mg) CC em silica gel Gradiente crescente Hex:AcOEt 30 frações MhDCM-3-13.16-1 a 30 CCDC MhDCM-3-13.16-17 a 20 (54 mg) MhDCM-3-13.16-16 CCDP Éter petróleo:AcOEt 97:3 MhDCM-3-13.16-17.20-I a VI Substância 19-m (108 mg) CCDC MhDCM-3-13.16-17.20-V Filtração em pipeta de Pasteur com sílica gel Hex:DCM 7:3 MhDCM-3-13.16-17.20-V-1 Substância 18-m (8 mg) Esquema 9: Fracionamento para isolamento das substâncias 18-m e 19-m. 40 Cap. 2 Experimental Fase DCM das folhas de M. myrtifolia (38,0 g) CC filtrante em silica gel Gradiente crescente Hex:AcOEt 10 frações MmDCM-1 a 10 CCDC MmDCM-3 (3,7 g) CC em silica gel Gradiente crescente Hex:AcOEt 20 frações MmDCM-3-1 a 20 CCDC MmDCM-3-18 (642 mg) MmDCM-3-17 (540 mg) MhDCM-3-17 (Sobrenadante) Filtração do ppt Hex:DCM 7:3 MhDCM-3-17-1 (52 mg) CCDP Hex:DCM 1:9 MhDCM-3-17-1-I a V CCDC MhDCM-3-18 (Sobrenadante) 1) Filtração dos cristais Hex:DCM 9:1 2) Filtração em pipeta de Pasteur com sílica gel Hex:DCM 7:3 MhDCM-3-18-1 (cristais) CCDC Substância 22-m (62 mg) mancha II Substância 17-m (30 mg) Esquema 10: Fracionamento para isolamento da substância 17-m e 22-m. 41 Cap. 2 Experimental Fase DCM das folhas de M. myrtifolia (38,0 g) CC filtrante em silica gel Gradiente crescente Hex:AcOEt 10 frações MmDCM-1 a 10 CCDC MmDCM-4 (2,86 g) MhDCM-4 (Sobrenadante) Filtração do ppt Hex:DCM 7:3 MmDCM-4-S (544 mg) CC em silica gel Gradiente crescente Hex:DCM 26 frações MhDCM-4-S-1 a 26 CCDC MmDCM-4-S-2 (32 mg) CCDP DCM:MeOH 98:2 MmDCM-4-S-2-I a IV MmDCM-4-S-4 (38 mg) CCDP DCM:MeOH 98:2 MmDCM-4-S-4-I a IV CCDC CCDC mancha II mancha II Substância 16-m (8 mg) MmDCM-S-13 CCDC Substâncias 20-m e 21-m (em mistura; 80 mg) Substância 20-m (12 mg) Esquema 11: Fracionamento para isolamento das substâncias 16-m, 20-m e 21-m. 42 Capítulo 3 3. RESULTADOS E DISCUSSÃO 3.1. Constituintes Químicos Isolados Através do procedimento experimental com as folhas de Myrcia hiemalis e de Myrcia myrtifolia, descrito anteriormente (p. 26-42), foram isoladas as seguintes substâncias (Tabela 3, p. 44): M. hiemalis: Substância 1-h: 7-hidróxi-6,8-dimetil-5-metóxi-isoflavona Substância 2-h: 5-hidróxi-6,8-dimetil-7-metoxiflavanona Substância 3-h: 6,8-dimetil-5,7-dimetoxiflavanona Substância 4-h: 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona Substância 5-h: 2’,4’-di-hidróxi-3’,5’-dimetil-4,6’-dimetoxichalcona Substância 6-h: 2’-hidróxi-3’,5’-dimetil-4’,6’-dimetoxichalcona Substância 7-h: 2’,6’-di-hidróxi-3’,5’-dimetil-4’-metoxichalcona Substância 8-h: eudesm-5(15)-eno-7,11-diol Substância 9-h: 2,3,21-tri-hidroxitaraxastan-28,20-olídeo Substância 10-h: ácido cinâmico Substância 11-h: -tocoferol Substância 12-h: acetato de geranilgeranila M. myrtifolia: Substância 13-m: quercetina Substância 14-m: 2’-hidróxi-2,3’-dimetil-4’,6’-dimetoxipropiofenona Substância 15-m: 2’-hidróxi-3’-metil-4’,6’-dimetoxibutirofenona Substância 16-m: ácido betulínico Substância 17-m: ácido betulônico Substância 18-m: betulinaldeído Substância 19-m: betulona Substância 20-m: ácido oleanólico Substância 21-m: ácido ursólico Substância 22-m: estigmasterol Cap. 3 Resultados e Discussão Tabela 3: Constituintes químicos isolados das folhas de M. hiemalis e M. myrtifolia CH3 CH3 HO O 2 9 7 4' CH3 O O 7 9 1' H3C 3 4 5 O 1' 2 H3C O 5 4' H3C OH O 5-hidróxi-6,8-dimetil-7-metoxiflavanona (2-h) 7-hidróxi-6,8-dimetil-5-metóxi-isoflavona (1-h) 4' CH3 CH3 4' CH3 HO O O 1' 2 1' O 7 2 9 OH 9 7 3 H3C 3 H3C 5 5 O O O H3C O H3C 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona (4-h) 6,8-dimetil-5,7-dimetoxiflavanona (3-h) O CH3 CH3 5' HO CH3 4 1 O CH3 1' H3C OH 5' 1' H3C 1 CH3 10 5 2' OH 14 1 OH 4' O 2’-hidróxi-3’,5’-dimetil-4’,6’-dimetoxichalcona (6-h) 4 CH3 4 O 2’,6’-di-hidróxi-3’,5’-dimetil-4’-metoxichalcona (7-h) 2' O 2’,4’-di-hidróxi-3’,5’-dimetil-4,6’-dimetoxichalcona (5-h) O 1' 2' CH3 1 O 4' H3C OH 4 CH3 5' O 4' CH3 H CH2 15 OH 7 11 H3C CH3 13 OH 12 eudesm-4(15)-eno-7,11-diol (8-h) Continua 44 Cap. 3 Resultados e Discussão 30 H3C O 29 OH H3C CH3 HO 28 22 18 13 11 25 26 O 20 O 17 CH3 OH 14 ácido cinâmico (10-h) 9 1 10 CH3 7 3 27 5 HO H3C 24 CH3 23 2,3,21-tri-hidroxitaraxastan-28,20-olídeo (9-h) CH3 H3C O 1 9' CH3 4' CH3 8' 5 14' CH3 CH3 13' 18' CH3 20' 2 HO 1' CH3 -tocoferol (11-h) O 4' 9' 14' CH3 CH3 CH3 19' CH3 1' 1 H3C O 2' 7' CH3 17' 12' 20' acetato de geranilgeranila (12-h) HO 3' O OH 4' OH 2' H3C HO 9 O 2 4' H3C 1' 7 CH3 O O CH3 OH 4 5 2’-hidróxi-2,3’-dimetil-4’,6’-dimetoxipropiofenona (14-m) O OH CH3 2 1 1' quercetina (13-m) O OH 30 CH3 2' H3C 29 1 1' 2 CH3 20 H2C 4' H3C O 18 O 25 CH3 22 13 11 O 17 26 CH3 28 14 CH3 1 9 HO 10 2’-hidróxi-3’-metil-4’,6’-dimetoxibutirofenona (15-m) 3 7 CH3 27 5 HO H3C 24 CH3 23 ácido betulínico (16-m) Continuação da Tabela 3 45 Cap. 3 Resultados e Discussão 30 30 CH3 29 CH3 29 20 H2C 18 25 17 26 CH3 9 9 27 CH3 24 H 3 27 5 H3C 23 CH3 7 HO H3C CH3 24 23 ácido betulônico (17-m) betulinaldeído (18-m) 30 30 CH3 29 28 10 5 O 26 CH3 1 CH3 7 29 CH3 H3C 20 H2C 20 18 CH3 9 3 7 H3C 7 27 5 HO H3C CH3 24 CH3 3 27 5 O OH 10 CH3 28 14 9 1 HO 10 O 17 26 CH 3 CH3 28 14 1 13 11 25 17 26 CH3 22 18 22 13 11 25 O 17 14 HO 10 3 CH3 28 22 13 11 25 O 14 1 18 22 13 11 CH3 20 H2C CH3 23 24 23 ácido oleanólico (20-m) betulona (19-m) 29 30 CH3 29 H3C 21 20 18 14 7 24 CH3 H3C 26 14 10 27 23 13 1 CH3 5 17 H CH3 24 25 CH3 11 CH3 9 OH 10 3 19 28 27 22 20 O 9 1 H3C 18 22 17 26 CH3 CH3 HO H3C 13 11 25 CH3 28 H 3 HO 7 H 5 estigmasterol (22-m) ácido ursólico (21-m) Continuação da Tabela 3 46 Cap. 3 Resultados e Discussão 3.2. Identificação e Determinação Estrutural dos Constituintes Químicos Isolados das folhas de M. hiemalis 3.2.1. Substância 1-h A substância 1-h (5 mg), sólido amorfo de cor amarela e solúvel em clorofórmio, foi isolada do fracionamento da fase diclorometânica (p. 28 e 30). A determinação estrutural da substância 1-h foi realizada com base na análise dos espectros de RMN de 1H, 13 C, HSQC-TOCSY e gHMBC (Anexo A, p. 115-120), e pela comparação com dados reportados na literatura (DAO et al., 2010) (Tabela 4, p. 49). O espectro de RMN de 1H apresentou dois multipletos, um em 7,36-7,44 e outro em 7,53-7,55, integrando para três e dois hidrogênios, respectivamente, que permitiram sugerir a presença de um grupo fenílico monossubstituído. Foram observados também, um singleto em 7,90, integrando para um hidrogênio, e três singletos em 2,26, 2,31 e 3,84, integrando para três hidrogênios cada, sendo que estes três últimos sinais foram atribuídos a hidrogênios de dois grupos metílicos benzílicos e um grupo metoxílico, respectivamente. No espectro de RMN de 13 C foram observados dezesseis sinais para a substância 1- h, com exceção do sinal em 29,9 (típico de material graxo). Os sinais em 8,3, 8,5 e 61,9 foram atribuídos a dois carbonos metílicos e um carbono metoxílico, respectivamente. Os outros treze sinais foram exibidos na faixa de 107,2 a 175,5, considerando que os sinais em 128,6 e em 129,5 apresentaram intensidade para dois carbonos cada, foi possível sugerir a estrutura de um flavonoide, com esqueleto básico C6-C3-C6 (HARBORNE, 1982). Diante disso, os sinais em 128,2, 128,6, 129,5 e em 132,5, confirmaram a presença de um grupo fenílico, conforme observado no espectro de RMN de 1H. Os sinais em 125,9 e 151,2 foram atribuídos a carbonos olefínicos e carbonílico, respectivamente, e o sinal do carbono carbonílico apareceu em 175,5. Além disso, os sinais em 107,2, 113,3, 115,7, 155,2, 156,5 e 156,9 possibilitaram identificar a presença de um segundo anel aromático, sendo que os deslocamentos químicos dos três últimos são típicos de carbonos oxigenados. No espectro de HSQC-TOCSY, o sinal de hidrogênio em 7,90 mostrou correlação com o sinal em 151,2, atribuído ao carbono olefínico -carbonílico, enquanto que no espectro de gHMBC este sinal de hidrogênio apresentou correlações com os seguintes sinais de carbonos: 175,5 (carbonílico), 125,9 (-olefínico), 132,5 e 155,2 (Figura 5, 47 Cap. 3 Resultados e Discussão p. 48). Diante dos dados obtidos nos espectros de RMN de 1H e 13 C e das correlações descritas acima, foi possível identificar que a substância 1-h é uma isoflavona. Outras correlações foram observadas no espectro de gHMBC e permitiram posicionar os grupos substituintes no anel aromático A (Figura 5). O sinal dos hidrogênios do grupo metílico em 2,25 mostrou correlações com 156,5 (C-5), 115,7 (C-6) e 156,9 (C-7), enquanto o sinal em 2,31, dos hidrogênios do outro grupo metílico, exibiu correlações com 156,9 (C-7), 107,2 (C-8) e 155,2 (C-9). O sinal em 3,84, referente aos hidrogênios do grupo metoxílico, apresentou correlação com 156,5 (C-5). Sendo assim, foi possível definir o grupo metoxílico na posição 5, o grupo hidroxílico na posição 7, e os grupos metílicos nas posições 6 e 8. A disposição dos grupos substituintes está de acordo com a biossíntese dos flavonoides C-metilados, pois o anel A é proveniente da via do acetato e isso proporciona oxidações nas posições 5, 7 e 9 (ver p. 7). 2,31 CH3 107,2 HO 7 156,9 2 H 7,90 155,2 115,7 2,26 O 125,9 156,5 H3C 175,5 5 O 132,5 O 4' H3C 3,84 Figura 5: Correlações selecionadas do espectro de gHMBC da substância 1-h As informações acima possibilitaram identificar a substância 1-h como 7-hidróxi-6,8dimetil-5-metóxi-isoflavona (Figura 6). Este é o segundo relato do isolamento deste composto, sendo que a primeira vez foi também de uma espécie de Myrtaceae (Cleistocalyx operculatus) (DAO et al., 2010). CH3 HO O 2 9 7 1' H3C 4 5 O H3C O 4' Figura 6: Estrutura da 7-hidróxi-6,8-dimetil-5-metóxi-isoflavona (1-h) 48 Cap. 3 Resultados e Discussão Tabela 4: Dados de RMN de 1H e 13C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da substância 1-h e dados da literatura [125 MHz (13C), CDCl3, (ppm)]. 1-h H (mult.; J em Hz) 1 - - - 2 151,2 7,90 (s) 151,0 3 125,9 - 125,7 4 175,5 - 175,4 5 156,5 - 156,3 6 115,7 - 115,5 7 156,9 - 156,7 8 107,2 - 106,9 9 155,2 - 154,9 10 113,3 - 113,1 1’ 132,5 - 132,2 2’ 129,5 7,53-7,55 (m) 129,2 3’ 128,6 7,36-7,44 (m) 128,4 4’ 128,2 7,36-7,44 (m) 127,9 5’ 128,6 7,36-7,44 (m) 128,4 6’ 129,5 7,53-7,55 (m) 129,2 HO – 7 - 5,45 (s) - H3C – 6 8,5 2,26 (s) 8,2 H3C – 8 8,3 2,31 (s) 8,1 H3CO – 5 61,9 3,84 (s) 61,7 Nº (DAO et al., 2010) 13 C 1 13 C 49 Cap. 3 Resultados e Discussão 3.2.2. Substância 2-h A substância 2-h (14 mg), sólido branco, solúvel em clorofórmio e com faixa de fusão de 201,7-202,2 ºC, foi isolada do fracionamento da fase diclorometânica (p. 29 e 31). Sua determinação estrutural foi realizada com base na análise dos espectros de RMN de 1H, 13 C, gHMQC e gHMBC (Anexo A, p. 120-123), e pela comparação com dados reportados na literatura (MAYER, 1990) (Tabela 5, p. 54). O espectro de RMN de 1H apresentou três singletos em 2,11, 2,12 e 3,76, integrando para três hidrogênios cada, característicos de hidrogênios de dois grupos metílicos benzílicos e de um grupo metoxílico, respectivamente. Exibiu um multipleto em 7,40-7,50, integrando para cinco hidrogênios, que permitiu sugerir a presença de um grupo fenílico monossubstituído. Foi observado também um singleto largo em 12,03, característico de hidrogênio de grupo hidroxílico envolvido em ligação de hidrogênio intramolecular. Além disso, foram observados três duplos dubletos, integrando para um hidrogênio cada, em 2,89 (2J = 17,0 e 3J = 3,0 Hz), em 3,07 (2J = 17,0 e 3J = 13,0 Hz) e em 5,43 (2J = 13,0 e 3J = 3,0 Hz), que foram atribuídos a hidrogênios alifáticos em sistema ABX (SILVERSTEIN e WEBSTER, 2000). Neste caso, os deslocamentos químicos, multiplicidades e constantes de acoplamento dos duplos dubletos são típicos de H-3 equatorial, H-3 axial e H-2 axial, respectivamente, do anel C de uma flavanona (LIU, 2011; R. M. ARAÚJO et al., 2009). Este anel possui conformação preferencial de meia-cadeira, onde o valor da constante J = 17,0 Hz corresponde ao acoplamento geminal de H-3 axial com H-3 equatorial e a constante com valor J = 13,0 Hz refere-se ao acoplamento axial-axial de H-2 com H-3. O valor de J = 3,0 Hz corresponde ao acoplamento axial-equatorial de H-2 com H-3 equatorial. O espectro de RMN de C apresentou sinais em 197,3, 43,7 e 78,6 que foram 13 atribuídos a carbonos carbonílico, alifático e oximetínico carbonílico, respectivamente, característicos de C-4, C-3 e C-2 do anel C de uma flavanona (HARBORNE, 1982). Foram observados sinais em 128,6,128,8, 125,9 e 138,9, que ao considerar os dois primeiros sinais com intensidade para dois carbonos, confirmam a existência de um grupo fenílico monossubstituído (anel B), conforme exibiu o espectro de RMN de 1H. Além disso, os sinais em 105,0,109,7, 111,4, 157,8, 159,3 e 165,5, possibilitaram identificar a presença de um segundo anel aromático (anel A), sendo que os deslocamentos químicos dos três últimos são típicos de carbonos oxigenados. Os sinais em 7,9, 8,5 e 60,1, são compatíveis com dois carbonos metílicos e um metoxílico, respectivamente. Os deslocamentos químicos dos sinais dos carbonos sustentaram que a substância 2-h é uma flavanona. As posições dos substituintes do anel A (dois grupos metílicos, um metoxílico e 50 Cap. 3 Resultados e Discussão um hidroxílico), foram atribuídas com base na rota biossíntética das flavanonas C-metiladas (ver p. 7) e com a possibilidade da existência de uma hidroxila quelada na estrutura, conforme mostrou o espectro de RMN de 1H. Sendo assim, foram atribuídas as posições 5 para o grupo hidroxílico, 7 para o grupo metoxílico e 6 e 8 para os grupos metílicos. As correlações diretas entre hidrogênios e carbonos foram realizadas a partir do espectro de gHMQC, enquanto que a partir do espectro de gHMBC, foi possível confirmar as posições dos substituintes. No gHMQC foram observadas as seguintes correlações: 2,11 com 8,5; 2,12 com 7,9; 3,76 com 60,1; 2,89 e 3,07 com 43,7; 5,43 com 78,6; e, o multipleto em 7,40-7,50 com 125,9, 128,6 e128,8. No gHMBC foram observadas as seguintes correlações: 2,11 com 109,7 (C-8) e 157,8 (C-9); 2,12 com 111,4 (C-6), 159,3 (C-5) e 165,5 (C-7); 2,89 e 3,07 com 78,6 (C-2) e 138,9 (C-1’); 5,43 com 138,9 (C-1’) e 125,9 (C-2’ e C-6’); e, 12,03 com 105,0 (C-10), 111,4 (C6) e 159,3 (C-5) (Figura 7). 2,11 3,76 CH3 CH3 109,7 O 9 7 2,12 H3C 165,5 111,4 159,3 4' 125,9 O 2 5,43 157,8 78,6 138,9 1' 3 105 2,89 3,07 5 OH O 12,03 Figura 7: Correlações selecionadas do espectro de gHMBC da substância 2-h Diante das informações discutidas acima, foi possível identificar que a substância 2-h é a 5-hidróxi-6,8-dimetil-7-metoxiflavanona (Figura 8). O valor de []D para essa substância foi de []20D –34,0 (MeOH, c 0,4), confirmando a configuração absoluta como 2S. Este é o primeiro relato da ocorrência desta substância no gênero Myrcia, entretanto existem relatos do isolamento a partir de espécies da família Myrtaceae (Leptospermum scoparium e Cleistocalyx operculatus) (MAYER, 1990; DAO et al., 2010). CH3 4' CH3 O O 7 1' 2 9 3 H3C 5 OH O Figura 8: Estrutura da 5-hidróxi-6,8-dimetil-7-metoxiflavanona (2-h) 51 Cap. 3 Resultados e Discussão 3.2.3. Substância 3-h A substância 3-h (8 mg), obtida sob a forma de cristais incolores, solúvel em clorofórmio e com ponto de fusão na faixa de 199,1-199,8 ºC, foi isolada do fracionamento da fase extrato diclorometânica (p. 29 e 31). A determinação estrutural da substância 3-h foi realizada com base na análise dos espectros de RMN de 1H, 13C, gHMQC e gHMBC (Anexo A, p. 123-125), e pela comparação com dados reportados na literatura (MITSCHER et al., 1973) (Tabela 5, p. 54). Pela análise dos espectros de RMN de 1H e de 13 C foi possível identificar que a substância 3-h possui semelhança estrutural com a substância 2-h. Entretanto, a diferença observada foi a presença de dois singletos em 3,76 e 3,83, integrando para três hidrogênios cada, característicos de hidrogênios de dois grupos metoxílicos, enquanto que a substância 2-h apresentou apenas um singleto nessa região. Diante disso, concluiu-se que a substância 3-h difere da 2-h apenas por possuir como substituinte na posição 5 um grupo metoxílico, ao invés de um hidroxílico. O espectro de RMN de 1H apresentou um multipleto em 7,40-7,50, integrando para cinco hidrogênios, e um singleto em 2,18, integrando para seis hidrogênios, que confirmaram a presença de um grupo fenílico (anel B) e de dois grupos metílicos (C-6 e C-8 do anel A), respectivamente. Além disso, foram observados três duplos dubletos, integrando para um hidrogênio cada, em 2,86 (2J = 16,5 e 3J = 3,3 Hz), em 3,00 (2J = 16,8 e 3J = 12,9 Hz) e em 5,43 (2J = 12,9 e 3J = 3,3 Hz), que foram atribuídos a hidrogênios alifáticos em sistema ABX (SILVERSTEIN e WEBSTER, 2000). Estes deslocamentos químicos, multiplicidades e constantes de acoplamento dos duplos dubletos são típicos de H-3 equatorial, H-3 axial e H-2 axial, respectivamente, do anel C de uma flavanona (LIU, 2011; R. M. ARAÚJO et al., 2009). A constante J ≈ 16,5 Hz corresponde ao acoplamento geminal de H-3 axial com H-3 equatorial, a constante com valor J = 12,9 Hz refere-se ao acoplamento axial-axial de H-2 com H-3, enquanto que o valor de J = 3,3 Hz corresponde ao acoplamento axial-equatorial de H-2 com H-3 equatorial. O espectro de RMN de C apresentou sinais em 8,6, 9,1, 60,1 e 61,1, típicos 13 de dois carbonos metílicos e de dois metoxílicos, respectivamente. Os sinais em 190,2, 45,8 e 78,6 foram atribuídos aos carbonos carbonílico, alifático e oximetínico carbonílico, respectivamente, característicos de C-4, C-3 e C-2 do anel C de uma flavanona (HARBORNE, 1982). Além disso, exibiu sinais em 125,8,128,8, 128,5 e 139,2, sendo os dois primeiros sinais com intensidade para dois carbonos cada, que confirmaram a presença de um grupo fenílico (anel B), enquanto os sinais em 111,7,115,6, 118,8, 52 Cap. 3 Resultados e Discussão 157,7, 159,7 e 163,5, permitiram confirmar a presença de um segundo anel aromático (anel A), sendo que os deslocamentos químicos dos três últimos são típicos de carbonos oxigenados. A rota biossíntética das flavanonas C-metiladas (ver p. 7) e a existência de dois grupos metoxílicos na estrutura, permitiram identificar as posições dos substituintes no anel A. Sendo assim, foram atribuídas as posições 5 e 7 para os grupos metoxílicos e 6 e 8 para os grupos metílicos. As correlações observadas nos espectro de gHMQC e gHMBC foram úteis para fazer a atribuição dos sinais de acordo com a conectividade dos átomos. No gHMQC foram observadas as seguintes correlações: 2,18 com 8,6 e 9,1; 3,76 com 60,1; 3,83 com 61,1; 2,86 e 3,00 com 45,8 (C-3); 5,43 com 78,6 (C-4); e, o multipleto em 7,407,50 com 125,8 (C-3’ e C-5’), 128,8 (C-2’ e C-6’),128,5 (C-4’) e 139,2 (C-1’). No gHMBC foram observadas as seguintes correlações: 2,18 com 115,6, 118,7, 157,7 (C-5), 159,7 (C-9) e 163,5 (C-7); 3,76 com 163,5 (C-7); 3,83 com 157,7 (C-5); 2,89 e 3,00 com 78,57 (C-2) e 190,21 (C-4) (Figura 9). 2,18 3,76 CH3 4' CH3 115,6 * O 7 O 9 163,5 118,7 * 2,18 157,7 H3C 3 5 O 3,83 1' 2 159,7 O H3C * A atribuição pode estar trocada. Figura 9: Correlações selecionadas do espectro de gHMBC da substância 3-h Diante das informações acima, constatou-se que a substância 3-h é a 6,8-dimetil5,7-dimetoxiflavanona (Figura 10). O valor de []D para essa substância foi de []20D –9,0 (MeOH, c 0,5), confirmando a configuração absoluta como 2S. Este é o primeiro relato da ocorrência desta substância no gênero Myrcia, entretanto existe um relato sobre a ocorrência em uma espécie da família Myrtaceae (Eugenia javanica) (WU-NAN e HUANG, 2005). CH3 4' CH3 O O 1' 2 9 7 3 H3C 5 O O H3C Figura 10: Estrutura da 6,8-dimetil-5,7-dimetoxiflavanona (3-h) 53 Cap. 3 Resultados e Discussão Tabela 5: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] da 13 substâncias 2-h e 3-h e dados da literatura. 2-h 1 Nº 13 C H (mult.; J em Hz) 2 78,6 5,43 1 C 13 78,6 3-h C H (mult.; J em Hz) 78,6 5,43 1 (dd; 13,0 e 3,0) 3 43,7 2 13 H (mult.; J em Hz) 1 5,44 (dd) (dd; 12,9 e 3,3) 2,89 43,7 45,8 2,86 (dd; 17,0 e 3,0) (dd; 16,5 e 3,3) 3,07 3,00 (dd; 17,0 e 13,0) (dd; 16,8 e 12,9) 2,85 (d) 2,99 (d) 4 197,3 - 197,3 190,2 - - 5 159,3 - 159,3 157,7 - - 6 111,4 - 111,3 118,7ª - - 7 165,5 - 165,4 163,5 - - a - - 8 109,7 - 109,7 115,6 9 157,8 - 157,8 159,7 - - 10 105,0 - 105,0 111,8 - - 1’ 138,9 - 138,8 139,2 - - 2’ 125,9 7,40-7,50 (m) 125,9 125,8 7,40-7,50 (m) 7,47 (s) 3’ 128,8 7,40-7,50 (m) 128,8 128,8 7,40-7,50 (m) 7,47 (s) 4’ 128,6 7,40-7,50 (m) 128,6 128,5 7,40-7,50 (m) 7,47 (s) 5’ 128,8 7,40-7,50 (m) 128,8 128,8 7,40-7,50 (m) 7,47 (s) 6’ 125,9 7,40-7,50 (m) 125,9 125,8 H3C – 6 7,9 2,12 (s) 8,5 7,40-7,50 (m) 7,47 (s) b 2,18 (s) 2,18 (s) b 8,6 H3C – 8 8,4 2,11 (s) 7,9 9,1 2,18 (s) 2,18 (s) H3CO – 5 - - - 61,1 3,83 (s) 3,83 (s) H3CO – 7 60,1 3.76 (s) 60,1 60,1 3,76 (s) 3,75 (s) HO - 5 - 12,03 (sl) - - - - Letras em sobrescrito indicam que a atribuição dos sinais pode estar trocada 1- MAYER, 1990 [75 MHz ( C), CDCl3, (ppm)]. 13 2- MITSCHER et al., 1973 [ 60 MHz ( H), CDCl3, (ppm)]. 1 54 Cap. 3 Resultados e Discussão 3.2.4. Substância 4-h A substância 4-h (8 mg), sólido amorfo de cor marrom e solúvel em clorofórmio, foi isolada do fracionamento da fase diclorometânica (p. 28 e 30). Sua determinação estrutural foi realizada com base na análise dos espectros de RMN de 1H, 13 C, gHMQC e gHMBC (Anexo A, p. 126-129), e pela comparação com dados reportados na literatura (DAO et al., 2010) (Tabela 6, p. 57). A partir da análise dos espectros de 1H e 13 C, verificou-se que a substância 4-h apresenta semelhança estrutural com a 2-h. A diferença observada foi a ausência de um duplo dubleto na região de 5,0-5,5 (dd) e de um singleto em aproximadamente 12,0, referente aos hidrogênios H-2 e HO-5, respectivamente, observados no espectro de RMN de 1H da substância 2-h. O espectro de RMN de 1H da substância 4-h apresentou três singletos em 2,04, 2,10 e 3,99, integrando para três hidrogênios cada, característicos de hidrogênios de dois grupos metílicos benzílicos e de um grupo metoxílico, respectivamente. Apresentou dois multipletos, um em 7,22-7,28, integrando para três hidrogênios, e outro em 7,30-7,31, integrando para dois hidrogênios, característicos de hidrogênios de um grupo fenílico monossubstituído. Além disso, foram observados dois dubletos, integrando para um hidrogênio cada, em 3,16 (2J = 14,0 Hz) e 3,25 (2J = 14,0 Hz), que foram atribuídos a hidrogênios alifáticos em sistema AB. O valor da constante J = 14,0 Hz está compatível com o acoplamento geminal de H-3 axial com H-3 equatorial. A multiplicidade destes sinais corrobora com a inexistência de um hidrogênio ligado a C-2. O espectro de RMN de C apresentou sinais em 7,2, 7,9 e 61,7, 13 compatíveis com dois carbonos metílicos e um metoxílico, respectivamente. Os sinais em 193,7 e 42,1 foram atribuídos aos carbonos carbonílico e alifático carbonílico, respectivamente. Para as flavanonas, o sinal do carbono hidrogenado alifático carbonílico (C-2) normalmente é exibido na região de 40-50, entretanto, para a substância 4-h não foi observado nenhum sinal nesta região. Considerando que os sinais passíveis de serem atribuídos a C-2 apresentaram-se na região 100-110, então, devido a este maior valor de deslocamento químico, provavelmente deve existir também um grupo hidroxílico como substituinte e, neste caso, compatível com a possibilidade de C-2 ser um hemiacetal (SILVERSTEIN e WEBSTER, 2000). Exibiu sinais em 101,6,103,8, 104,4, 109,2, 155,2, 162,3 e 168,0, sendo que três dos quatro primeiro sinais pertencem ao anel A e outro deve ser atribuído a C-2, 55 Cap. 3 Resultados e Discussão enquanto que os três últimos são compatíveis com os carbonos oxigenados do anel A. Também foram observados sinais em 128,4,130,6, 127,4 e 133,0, no qual os dois primeiros sinais apresentaram intensidade para dois carbonos cada, que foram atribuídos a um grupo fenílico (anel B). As correlações observadas nos espectros de gHMQC e gHMBC possibilitaram posicionar os grupos substituintes, bem como, fazer a atribuição dos sinais. No gHMQC foram observadas as seguintes correlações: 2,04 com 7,9; 2,10 com 7,2; 3,99 com 61,7; 3,16 e 3,25 com 42,1; 7,22-7,28 com 127,4 e 128,4; e, 7,30-7,31 com 130,6. As posições dos substituintes no anel A da flavanona foram realizadas de acordo com as seguintes correlações observadas no gHMBC: 2,04 com 109,3 (C-6), 155,2 (C-5) e 162,3 (C-7); 2,10 com 101,6 (C-8), 162,3 (C7) e 168,0 (C-9); e, 3,99 com 155,2 (C-5). Adicionalmente, foram identificadas, no gHMBC, as correlações dos sinais em 3,16 e 3,25 com 103,8 (C-2), 193,7 (C-4), 133,0 (C-1’) e 130,6 (C-2’ e C-6’), que permitiram confirmar que C-2 sustenta um grupo hidroxílico (Figura 11). 2,10 4' CH3 101,6 HO 162,3 5 H3C 133,0 130,6 193,7 155,2 O 3,99 HO 1' O 2 168,0 103,8 109,3 2,04 9 3,16 ; 3,25 O H3C Figura 11: Correlações selecionadas do espectro de gHMBC da substância 4-h As informações expostas acima possibilitaram identificar que a substância 4-h é a 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona (Figura 12, p. 57). O valor de []D para essa substância foi de []20D –9,0 (MeOH, c 0,65). Este é o segundo relato do isolamento deste composto, sendo que a primeira vez também foi de uma espécie de Myrtaceae (Cleistocalyx operculatus) (DAO et al., 2010). 56 Cap. 3 Resultados e Discussão 4' CH3 HO 1' O 7 2 9 OH 3 H3C 5 O O H3C Figura 12: Estrutura da 2,7-di-hidróxi-6,8-dimetil-5-metoxiflavanona (4-h) Tabela 6: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] 13 da substância 4-h e dados da literatura [125 MHz (13C), CDCl3, (ppm)]. 4-h 13 H (mult.; J em Hz) 1 - - - 2 103,8 - 103,8 3 42,1 - 42,0 4 193,7 - 193,7 5 155,2 - 155,2 6 109,3 - 109,3 7 162,3 - 162,3 8 101,6 - 101,6 9 168,0 - 167,9 10 104,4 - 104,8 1’ 133,0 - 132,9 2’ 130,6 7,29-7,31 (m) 130,6 3’ 128,4 7,22-7,28 (m) 128,3 4’ 127,4 7,22-7,28 (m) 127,4 5’ 128,4 7,22-7,28 (m) 128,3 6’ 130,6 7,29-7,31 (m) 130,6 H3C – 6 7,9 2,04 (s) 7,2 H3C – 8 7,2 2,10 (s) 7,9 H3CO - 5 61,7 3,99 (s) 61,7 Nº (DAO et al., 2010) C 1 13 C 57 Cap. 3 Resultados e Discussão 3.2.5. Substância 5-h A substância 5-h (4 mg) foi isolada do fracionamento da fase diclorometânica (p. 29 e 32), sob a forma de um sólido amorfo de cor laranja, solúvel em clorofórmio. A determinação estrutural da substância 5-h foi realizada com base na análise dos espectros de RMN de 1H, dados de RMN de 1H e 13 C, gHMQC e gHMBC (Anexo A, p. 129-135). Os 13 C estão na Tabela 7 (p. 61). O espectro de RMN de 1H apresentou quatro singletos em 2,14, 2,16, 3,67 e 3,87, integrando para três hidrogênios cada, característicos de hidrogênios de dois grupos metílicos ligados a anel aromático e de dois grupos metoxílicos, respectivamente. Foi observado ainda, um singleto largo em 13,68, integrando para um hidrogênio, característico de hidrogênio de grupo hidroxílico envolvido em ligação de hidrogênio intramolecular. Além disso, exibiu dois dubletos em 6,94 (3J = 9 Hz) e em 7,61 (3J = 9 Hz), integrando para dois hidrogênios cada, característicos de grupo fenílico 1,4dissubstituído. Apresentou ainda, outros dois dubletos em 7,83 (3J = 15,5 Hz) e 7,88 (3J = 15,5 Hz), integrando para um hidrogênio cada, compatíveis com dois hidrogênios olefínicos vicinais acoplados entre si. A constante de acoplamento de 15,5 Hz indica a configuração trans. No espectro de RMN de 13 C foram observados dezessete sinais para esta substância. Os sinais em 7,8, 8,4,55,6 e 62,5, foram atribuídos a dois carbonos metílicos e dois carbonos metoxílicos, respectivamente. Apresentou dez sinais para doze carbonos aromáticos em 106,5, 108,9, 109,3, 114,6, 128,4, 130,4, 159,0, 159,1, 161,7 e 162,2, sendo que os sinais em 114,6 e 130,4 exibiram intensidade para dois carbonos cada e os quatro últimos são característicos de carbonos aromáticos oxigenados. Além desses, exibiu sinais em 193,51, 124,52 e 143,23, que foram atribuídos aos carbonos carbonílico e olefínicos e carbonílico, respectivamente. Diante das informações obtidas foi possível determinar que a substância 5-h possui um esqueleto carbônico C6-C3-C6, sendo que a unidade C3 é formada por uma carbonila e dois carbonos olefínicos hidrogenados, o que possibilitou definir que a substância 5-h é uma chalcona. Constatou-se também que esta substância possui três carbonos aromáticos oxigenados anel B (C-2’, C-4’ e C-6’) e um no anel A (C-4). Além disso, foi possível confirmar que o substituinte na posição 2’ do anel B é um grupo hidroxílico, devido existência de uma hidroxila quelada na estrutura, conforme mostrou o espectro de RMN de 1H (Figura 13, p. 59). 58 Cap. 3 Resultados e Discussão OR CH3 5' RO 4' OR 4 A B H3C 1 1' 2' OH O Figura 13: Estrutura parcial da substância 5-h Para determinar as posições dos dois grupos metoxílicos e fazer a atribuição correta dos sinais foi necessário observar as correlações entre os hidrogênios e os carbonos nos espectros de gHMQC e gHMBC. No espectro de gHMQC foram observadas as seguintes correlações: 2,14 com 7,8; 2,16 com 8,4; 3,67 com 62,5; 3,87 com 55,6; 6,94 com 114,6; e, 7,61 com 130,4. No espectro de gHMBC foram observadas as seguintes correlações: 2,14 com 106,5 (C-3’) e 162,2 (C-2’); 2,16 com 108,9 (C-5’) e 159,0 (C-6’); 3,67 com 159,0 (C-6’); 3,87 com 161,7 (C-4); 6,94 com 114,6 (C-3 ou C-5) e 128,4 (C-1); 7,61 com 130,4 (C-2 ou C-6), 143,2 (C-) e 161,7 (C-4) (Figura 14). 3,67 2,16 7,61 CH3 HO 5' 108,9 H3C 2' 143,2 1' 106,5 2,14 O 159,0 4' O CH3 161,7 4 128,4 1 3,87 CH3 114,6 6,94 130,4 162,2 OH O Figura 14: Correlações selecionadas do espectro de gHMBC da substância 5-h Para o posicionamento do grupo metoxílico ligado ao anel B sugeriu-se a posição 6’, pois comparou-se os deslocamentos químicos dos carbonos aromáticos oxigenados com os observados para chalconas similares e verificou-se maior compatibilidade com as que contém este padrão de substituição no referido anel (ver Tabela 7, p. 61). As informações acima permitiram propor que a substância 5-h é a 2’,4’-dihidróxi-3’,5’-dimetil-4,6’-dimetoxichalcona (5-h) (Figura 15, p. 60). Após identificar a estrutura desta substância foi realizada uma pesquisa na literatura e não foi 59 Cap. 3 Resultados e Discussão encontrado qualquer relato sobre o isolamento da mesma. Entretanto, foram encontradas duas referências contendo substâncias com estruturas similares, a 2’,4’,4tri-hidróxi-3’,5’-dimetil-6’-metoxichalcona isolada de Cleistocalyx operculatos (DAO et al., 2010) e a 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona isolada de Syzygium samarangense (AMOR et al., 2007; SRIVASTAVA et al., 1995) (Figura 16), ambas pertencentes a família Myrtaceae. Esta última substância também foi isolada no estudo anterior com M. hiemalis (SILVA, 2007). Sendo assim, esta é a primeira vez que se relata o isolamento da substância 5-h. O CH3 CH3 5' HO CH3 4 1 O 4' 1' H3C 2' OH O Figura 15: Estrutura da 2’,4’-di-hidróxi-3’,5’-dimetil-4,6’-dimetoxichalcona (5-h) OH CH3 CH3 5' HO 1 O 1' OH O 1 4' 1' H3C 4 O 2' CH3 5' HO 4' H3C CH3 4 2' OH O Figura 16: Substâncias encontradas na literatura com estrutura similar a 5-h 60 Cap. 3 Resultados e Discussão Tabela 7: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] 13 da substância 5-h e dados da literatura de substâncias similares. OH CH3 CH3 5' HO 1 O 1' 1' H3C 2' OH O O 2 1 Nº 13 H (mult.; J em Hz) 1 128,4 - 128,1 135,3 2 130,4 7,61 (d; 9,0) 131,4 128,9 3 114,6 6,94 (d; 9,0) 116,9 128,4 4 161,7 - 160,7 130,2 5 114,6 6,94 (d; 9,0) 116,9 128,4 6 130,4 7,61 (d; 9,0) 131,4 128,9 C=O 193,5 193,8 193,4 124,5 7,83 (d; 15,5) 124,4 126,7 143,2 7,88 (d; 15,5) 144,3 142,9 1’ 109,3 - 109,2 106,6 2’ 162,2 - 162,7 162,0 3’ 106,5 - 107,9 109,0 4’ 159,1 - 161,4 159,3 5’ 108,9 - 110,6 109,0 6’ 159,0 - 159,8 158,8 H3C – 3’ 7,77 2,14 (s) 8,3 8,2 H3C – 5’ 8,42 2,16 (s) 9,0 7,6 H3CO – 4 55,6 3,87 (s) - - H3CO – 6’ 62,5 3,67 (s) 62,6 62,3 HO – 2’ - 13,68 (sl) - - C 1 4 1 O 4' 2' OH 5-h CH3 5' HO 4' H3C CH3 4 13 C 13 C 1 - DAO et al., 2010 [125 MHz ( C), CDCl3, (ppm)] (Estrutura similar a 5-h). 13 2 - AMOR et al., 2007 [100 MHz ( C), CDCl3, (ppm)] (Estrutura similar a 5-h). 13 61 Cap. 3 Resultados e Discussão 3.2.6. Substância 6-h A substância 6-h (5 mg), obtida como sólido amorfo de cor amarela e solúvel em clorofórmio, foi isolada do fracionamento da fase diclorometânica (p. 29 e 31). A determinação estrutural da substância 6-h foi realizada com base nos espectros de RMN de 1H, 13 C e gHMBC (Anexo A, p. 136-139), e pela comparação com dados reportados na literatura (FACUNDO e BRAZ-FILHO, 2004) (Tabela 8, p. 66). Pela análise dos espectros de RMN de 1H e de 13 C foi possível identificar que a substância 6-h possui semelhança estrutural com a substância 5-h. Entretanto, a diferença observada foi a presença de dois multipletos em 7,44-7,49 e 7,69-7,72, integrando para três e dois hidrogênios, respectivamente, característicos de hidrogênios de um grupo fenílico monossubstituído. Diante disso, constatou-se que a substância 6-h é uma chalcona que não possui substituintes no anel A. O espectro de RMN de 1H apresentou quatro singletos em 2,22, 2,23, 3,71 e 3,81, integrando para três hidrogênios cada, característicos de hidrogênios de dois grupos metílicos ligados a anel aromático e de dois grupos metoxílicos, respectivamente. Foi observado ainda, um singleto largo em 13,15, integrando para um hidrogênio, característico de um hidrogênio em ligação de hidrogênio intramolecular. Além disso, exibiu dois dubletos em 7,88 (3J = 15,9 Hz) e 8,00 (3J = 15,6 Hz), integrando para um hidrogênio cada, compatíveis com dois hidrogênios olefínicos vicinais acoplados entre si com configuração trans. No espectro de RMN de C foram observados sinais em 8,7, 8,8,60,1 e 13 62,3, que foram atribuídos a dois carbonos metílicos e dois carbonos metoxílicos, respectivamente. Os sinais em 194,1, 126,6 e 143,4 foram atribuídos aos carbonos carbonílico e olefínicos e carbonílico, respectivamente. Além disso, apresentou sinais para doze carbonos aromáticos em 111,9, 115,7, 128,5, 129,0, 130,4, 135,2, 158,7, 161,7 e 163,6, sendo que os sinais em 128,52 e 128,97 exibiram intensidade para dois carbonos cada, e os três últimos são característicos de carbonos oxigenados. As correlações observadas nos espectro de gHMBC foram importantes para posicionar os substituintes no anel A e realizar a atribuição dos sinais. Foram observadas as seguintes correlações: 2,22 com 115,7 (C-3’), 161,7 (C-2’) e 163,6 (C-4’); 2,23 com 115,7 (C-5’) e 158,7 (C-6’); 3,71 com 158,7 (C-6’); e, 3,81 com 163,6 (C-4’) (Figura 17, p. 63) 62 Cap. 3 Resultados e Discussão 2,23 3,81 CH3 4' 115,7 H3C 2' 1 O 115,7 163,6 4 CH3 5' O 2,22 3,71 CH3 158,7 1' 161,7 OH O Figura 17: Correlações selecionadas do espectro de gHMBC da substância 6-h Diante do exposto, constatou-se que a substância 6-h é a 2’-hidróxi-3’,5’dimetil-4’,6’-dimetoxichalcona (Figura 18). Os dados encontrados na literatura para esta substância (FACUNDO e BRAZ-FILHO, 2004) estão compatíveis com os obtidos neste estudo. Este é o primeiro relato da ocorrência desta substância na família Myrtaceae. CH3 CH3 5' O 1 O 4' 1' H3C 4 CH3 2' OH O Figura 18: Estrutura da 2’-hidróxi-3’,5’-dimetil-4’,6’-dimetoxichalcona (6-h) 63 Cap. 3 Resultados e Discussão 3.2.7. Substância 7-h A substância 7-h foi obtida do fracionamento da fase diclorometânica em mistura com um sesquiterpeno (aproximadamente 1:1 em massa, calculado pelo valor da integração do espectro de RMN de 1H). Essa mistura binária (9 mg) apresentou aspecto de cera de cor laranja, solúvel em clorofórmio (p. 28 e 30). A determinação estrutural da substância 7-h foi realizada com base nos espectros de RMN de 1H, 1 13 C e gHMBC (Anexo A, p. 139-142). Os dados de RMN de 13 H e C estão na Tabela 8 (p. 66). Pela análise dos espectros de RMN de 1H e de 13 C foi possível identificar que a substância 7-h possui semelhança estrutural com a substância 6-h. Entretanto, a diferença observada foi a presença de um grupo metoxílico, enquanto que na substância 6-h foram observados dois grupos metoxílicos. Sendo assim, a substância 7-h é uma chalcona que apresenta um grupo metoxílico e dois grupos hidroxílicos, como substituintes nas posições 2’, 4’ e 6’, restando definir o posicionamento do grupo metoxílico. O espectro de RMN de 1H para esta substância mostrou três singletos em 2,17, 2,18 e 3,69, integrando para três hidrogênios cada, atribuídos a hidrogênios de dois grupos metílicos e de um grupo metoxílico, respectivamente. Exibiu ainda, dois dubletos em 7,07 (3J = 16 Hz) e 7,45 (3J = 16 Hz), com integração para um hidrogênio cada, e que foram atribuídos a hidrogênios olefínicos e carbonílico, respectivamente, e dois multipletos em 7,37-7,38 e 7,56-7,58, com integração para três e dois hidrogênios, respectivamente, que foram atribuídos a hidrogênios de um grupo fenílico monossubstituído. O espectro de RMN de 13C exibiu sinais em 8,7, 9,7, 62,5, 129,1, 143,8 e 193,8, que foram atribuídos a dois carbonos metílicos, um metoxílico, dois carbonos olefínicos e carbonílico e um carbonílico, respectivamente. Além disso, exibiu sinais para o anel A em 128,4, 128,8, 130,3 e 135,0, sendo os dois primeiros com intensidade para dois carbonos, e para o anel B em 112,4, 113,0, 121,6, 153,2, 154,6 e 155,0. No gHMBC foram observadas algumas correlações entre hidrogênios e carbonos a duas e três ligações que possibilitaram identificar as posições dos substituintes e fazer as atribuições dos sinais: 2,17 com 112,4, 154,6 e 155,0; 2,18 com 113,0 e 153,2; 3,69 com 155,0; 7,07 com 135,0 (C-1) e 193,8; 7,45 com 128,4 (C-2 e C-6) e 193,8; 7,37-7,38 com 135,0; e, 7,56-7,58 com 130,3 (Figura 19, p. 65). 64 Cap. 3 Resultados e Discussão 2,18 3,69 CH3 CH3 5' O 112,4 2,17 H3C 2' 1 OH 113,0 4' 155,0 4 128,4 153,2 7,45 1' 7,07 135,0 154,6 193,8 OH O Figura 19: Correlações selecionadas do espectro de gHMBC da substância 7-h Além disso, em estudo anterior com M. hiemalis foi relatado o isolamento da chalcona 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona (SILVA, 2007) e ao realizar a comparação do espectros de RMN de 1H e de 13 C dessa substância com a 7-h verificou-se diferenças significativas nos deslocamentos químicos dos sinais (Figura 20), que corroboram com a proposta de que a substância 7-h é a 2’,6’-di-hidróxi-3’,5’dimetil-4’-metoxichalcona, um isômero da isolada anteriormente. Após identificar a estrutura da substância 7-h foi realizada uma busca na literatura e não foi encontrado qualquer relato sobre o isolamento da mesma. 2,17 2,18 3,69 9,7 CH3 CH3 OH 4' 155,0 153,2 1' 112,4 H3C 2,17 121,6 OH 1 7,45 143,8 7,37-7,38 7,56-7,58 HO 108,9 7,6 2’,6’-di-hidróxi-3’,5’-dimetil-4’-metoxichalcona O 158,8 4 1 8,00 142,9 H3C 2,15 O 7,41-7,44 CH3 4' 159,3 1' 108,9 7,07 129,1 154,6 8,7 CH3 4 113,0 O 3,70 8,2 7,37-7,38 106,6 7,85 126,6 162,0 OH 7,41-7,44 7,64-7,67 O 2’,4’-di-hidróxi-3’,5’-dimetil-6’-metoxichalcona Figura 20: Comparação de alguns deslocamentos químicos observados para os isômeros Não foi possível propor uma estrutura para o sesquiterpeno obtido em mistura com a substância 7-h, pois não observou-se nos espectros de RMN de 1H, 13 C, gHMQC, gHMBC e NOESY algumas informações necessárias para sua determinação estrutural. Diante disso, houve a necessidade de adquirir novamente esses espectros, entretanto, o espectro de RMN de 1H revelou que o sesquiterpeno degradou. 65 Cap. 3 Resultados e Discussão Tabela 8: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] 13 das substâncias 6-h e 7-h e dados da literatura. CH3 4 CH3 5' HO 1 O 4' 1' H3C 6-h 1 7-h 2' OH O 2 Nº 13 C H (mult.; J em 1 C 13 13 C Hz) H (mult.; J em 1 13 C Hz) 1 135,2 - 135,2 135,0 - 135,25 2 128,5 7,69-7,72 (m) 128,5 128,8 7,56-7,58 (m) 128,89 3 129,0 7,44-7,49 (m) 128,9 128,4 7,37-7,38 (m) 128,37 4 130,4 7,44-7,49 (m) 130,4 130,3 7,37-7,38 (m) 130,19 5 129,0 7,44-7,49 (m) 128,9 128,4 7,37-7,38 (m) 128,37 6 128,5 7,69-7,72 (m) 128,5 128,8 7,56-7,58 (m) 128,89 C=O 194,1 194,1 193,8 - 193,35 126,6 7,88 (d; 15,9) 125,9 129,1 7,07 (d; 16) 126,61 143,4 8,00 (d; 15,6) 143,4 143,8 7,45 (d; 16) 142,89 1’ 111,9 - 111,9 121,6 - 106,59 2’ 161,7 - 161,6 154,6 - 161,98 3’ 115,7 - 115,7 112,4 - 108,95 4’ 163,6 - 163,6 155,0 - 159,30 5’ 115,7 - 115,7 113,0 - 108,95 6’ 158,7 - 158,7 153,2 - 158,78 H3C – 3’ 8,7 2,22 (s) 8,7 8,7 2,17 (s) 7,57 H3C – 5’ 8,8 2,23 (s) 8,8 9,7 2,18 (s) 8,24 H3CO – 4’ 60,1 3,81 (s) 60,1 62,5 3,69 (s) - H3CO – 6’ 62,3 3,71 (s) 62,3 - - 62,33 HO – 2’ - 13,15 (sl) - - 1- FACUNDO e BRAZ-FILHO, 2004 [125 MHz ( C), CDCl3, (ppm)]. 13 2- SILVA, 2007 [75 MHz ( C), CDCl3, (ppm)] (Estrutura similar a 7-h) 13 66 Cap. 3 Resultados e Discussão 3.2.8. Substância 8-h A substância 8-h (10 mg), com aspecto de cera incolor, solúvel em clorofórmio, foi isolada do fracionamento da fase diclorometânica (p. 29 e 32). A determinação estrutural da substância 8-h foi realizada com base nos espectros de RMN de 1H, 13 C, DEPT 135º, gHMQC, gHMBC e gCOSY (Anexo A, p. 142-148), e pela comparação com dados reportados na literatura (WANG et al., 2008) (Tabela 9, p. 69). O espectro de RMN de 1H apresentou três singletos em 0,70, 1,27 e 1,28, integrando para três hidrogênios, característicos de hidrogênios de grupos metílicos ligados a carbonos quaternários, dois multipletos em 4,41 e 4,72, ambos integrando para um hidrogênio, que foram atribuídos a hidrogênios olefínicos geminais. Além desses, foram observados vários multipletos entre 1,29 – 2,40. Pela análise do espectro de RMN de 13 C e em comparação com o de DEPT 135º constatou-se a presença de quinze carbonos dessa substância, sendo três metílicos (15,5, 24,9 e 25,0), sete metilênicos (23,7, 26,7, 29,6, 36,5, 37,1, 41,6 e 105,4), um metínico (44,4) e quatro não hidrogenados (35,7, 75,7, 76,5, 151,1). Destes, os sinais em 75,7 e 76,5 foram atribuídos a carbonos oxigenados, enquanto os sinais em 105,4 e 151,1 foram atribuídos a carbonos olefínicos. Esses dados permitiram propor a fórmula molecular C15H26O2 e assim obter o IDH igual a 3, compatível com a existência de uma ligação dupla e dois anéis. O espectro de gHMQC exibiu as seguintes correlações: 0,70 com 15,5; 1,27 com 25,0; 1,28 com 24,9; e, 4,41 e 4,72 com 105,4. No gHMBC foram observadas as seguintes correlações que permitiram propor a estrutura parcial A (Figura 21): 1,27 com 24,9 e 75,7; 1,28 com 25,0 e 75,7. Outras correlações foram observadas e permitiram propor a estrutura parcial B (Figura 21): 0,70 com 35,7, 41,6 e 44,4; 4,41 e 4,72 com 37,1 e 44,4. 37,1 1,28 CH3 24,9 HO 1,27 25,0 4,41 4,72 105,4 41,6 H2C 44,4 H3C 75,7 . . 35,7 0,70 15,5 . . A CH3 . . B Figura 21: Estruturas parciais A e B com correlações selecionadas do gHMBC 67 Cap. 3 Resultados e Discussão Além disso, foram observadas no gHMBC, correlações do sinal em 1,53 (m) com 44,4 e 35,7. O espectro de gCOSY mostrou os acoplamentos de multipletos, que foram úteis para a atribuição dos sinais: 1,53 com 2,21; 1,64 com 2,302,37; e, 4,41 e 4,72 com 2,21 e 2,02-2,08. A figura 22 mostra as correlações observadas para os hidrogênios em 1,53 do grupo metileno ligado a estrutura parcial B e algumas correlações do espectro de gCOSY selecionadas para o sinal em 2,21. 37,1 H 4,41 41,6 4,72 H 1,53 H 44,4 35,7 CH3 2,21 H 0,70 15,5 . 29,62 . . . . Figura 22: Correlações selecionadas do gHMBC () para o sinal em 1,53 e correlações selecionadas do gCOSY (–) para o sinal em 2,21 Diante dessas informações, para propor a estrutura da substância 8-h considerou-se a existência de dois anéis fundidos, sendo que um deles corresponde a estrutura parcial B e o outro foi determinado como tendo também seis carbonos, devido a existência de outros três carbonos metilênicos e um não hidrogenado, que ainda não haviam sido posicionados na estrutura. Logo, a estrutura parcial A, foi posicionada no segundo anel ligada a esse carbono oxigenado não hidrogenado (76,5). Considerando o que foi exposto a substância 8-h é um sesquiterpeno com esqueleto eudesmano, o eudesm-4(15)-eno-7,11-diol (Figura 23). O valor de []D para 8-h foi de []20D –26,0 (MeOH, c 0,15). Os dados de RMN e de []D encontrados na literatura para este composto estão compatíveis com os obtidos neste trabalho (WANG et al., 2008). 14 1 CH3 10 2 5 4 H CH2 15 OH 7 11 H3C CH3 13 OH 12 Figura 23: Estrutura do eudesm-4(15)-eno-7,11-diol (8-h) 68 Cap. 3 Resultados e Discussão Tabela 9: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, (ppm)] 13 da substância 8-h e dados da literatura [75 MHz (13C), CDCl3, (ppm)]. 8-h Nº 1 (WANG et al., 2008) 13 H (mult.; J em Hz) 41,6 1,33-137 (m) C 1 13 C 41,3 1,64 (m) 2 23,7 * 23,4 3 37,1 2,02-2,08 (m) 36,8 2,30-2,37 (m) 4 151,1 - 150,8 5 44,4 2,21 (m) 44,1 6 29,6 1,53 (m) 29,3 7 76,5 - 76,2 8 26,7 * 26,4 9 36,5 * 36,2 10 35,7 - 35,4 11 75,7 - 74,5 12 25,0 1,27 (s) 24,7 13 24,9 1,28 (s) 24,6 14 15,5 0,70 (s) 16,5 15 105,4 4,41 (m) 107,0 4,72 (m) * Os sinais não foram identificados 69 Cap. 3 Resultados e Discussão 3.2.9. Substância 9-h A substância 9-h (3 mg), um sólido branco e solúvel em clorofórmio, foi isolada do fracionamento da fase diclorometânica (p. 29 e 32). A determinação estrutural da substância 9-h foi realizada com base nos espectros de RMN de 1H, 13 C, DEPT 135º, gHMQC, gHMBC (Anexo A, p. 149-160) (Tabela 10, p. 75). O espectro de RMN de 1H mostrou seis singletos em 0,82, 0,91, 0,94, 0,95, 1,02 e 1,54, e um dubleto em 1,30 (3J = 7,5 Hz), integrando para três hidrogênios cada, característicos de hidrogênios de grupos metílicos de triterpenos. Exibiu um dubleto em 2,99 (3J = 9,0 Hz), um multipleto em 3,71 e um duplo duplo dubleto em 3,95 (2J ≈ 11,5, 3J ≈ 7,0 e 4J ≈ 2,1 Hz), integrando para um hidrogênio cada, que foram atribuídos a hidrogênios ligados a carbonos oxigenados. Apresentou um duplo quarteto de dubletos em 1,74 (2J ≈ 7,5, 3J ≈ 5,7 e 4J ≈ 2,1 Hz), um duplo dubleto em 2,08 (2J = 7,0 e 3J = 4,5), ambos com integração para um hidrogênio, e um duplo tripleto em 1,88 (3J = 4,5 Hz), com integração para dois hidrogênios. Além disso, exibiu três duplos dubletos em 2,38 (2J = 14,0 e 3J ≈ 11,5 Hz), em 1,90 (2J = 14,0 e 3J = 7,0 Hz) e em 1,34 (2J ≈ 11,5 e 3J ≈ 5,7 Hz), e alguns multipletos em 0,80, 0,89, 1,14, 1,35, 1,37, 1,43, 1,58, 1,63, 1,66 e 2,04, todos em sobreposição. Pela análise do espectro de RMN de 13 C e em comparação com o de DEPT 135º constatou-se a presença de trinta carbonos para esta substância, sendo sete metílicos (14,2, 15,7,16,5, 17,5, 19,3, 22,2 e 28,4), oito metilênicos (18,2, 21,0, 24,9, 26,9, 27,0, 33,8, 43,1 e 46,7), oito metínicos (42,4, 42,6, 48,7, 50,4, 55,5, 56,7, 69,2 e 84,0) e sete não hidrogenados (38,5, 39,2, 40,6, 41,2, 42,5, 85,0 e 175,2). Destes, os sinais em 56,7, 69,2, 84,0 e 85,0 foram atribuídos a carbonos saturados oxigenados, enquanto o sinal em 175,2 foi atribuído a um carbono carbonílico. Esses dados permitiram propor a fórmula molecular C30H48O4 e assim obter o IDH igual a 7, compatível com a existência de seis anéis e um grupo carbonílico de éster. Para propor a estrutura da substância 9-h foi necessário analisar os espectros de gHMQC, gHMBC e gCOSY. O espectro de gHMQC exibiu as seguintes correlações: 0,80 com 55,5; 0,82 com 16,5; 0,89 e 2,08 com 46,7; 0,91 com 17,5; 0,94 com 15,7; 0,95 com 14,2; 1,02 com 28,4; 1,14 e 2,04 70 Cap. 3 Resultados e Discussão com 26,9; 1,30 com 19,3; 1,34 com 48,7; 1,35 com 50,4; 1,37 e 1,43 com 33,8; 1,54 com 22,2; 1,58 com 21,0; 1,63 e 1,66 com 24,9; 1,74 com 42,4; 1,88 com 27,0; 1,90 e 2,38 com 43,1; 2,99 com 84,0; 3,71 com 69,2; 3,95 com 56,7. No espectro de gHMBC foram observadas as seguintes correlações que possibilitaram propor a estrutura parcial A, que provavelmente se refere ao anel A de um triterpeno, conforme apresentada na figura abaixo (Figura 24): 0,82 com 28,4, 39,2, 55,5 e 84,0; 0,91 com 38,5 e 55,5; 1,02 com 16,5, 55,5 e 84,0; 2,08 com 38,5, 55,5, 69,2 e 84,0. 17,5 46,7 0,91 CH3 . 2,08 17,5 HO 69,2 84,0 38,5 . . 55,5 HO 28,4 H3C . CH3 46,7 HO CH3 . 69,2 38,5 84,0 55,5 HO 16,5 1,02 . . 39,20 28,4 H3C . CH3 0,82 Figura 24: Estrutura parcial A com correlações selecionadas do gHMBC As constantes de acoplamento dos hidrogênios metínicos em 2,99 e 3,71 permitiram determinar a configuração relativa dos grupos hidroxílicos da estrutura parcial A. O hidrogênio em 2,99 (d; 3J = 9,0 Hz), ligado ao carbono em 84,0, acopla com o hidrogênio em 3,71 (m), ligado ao carbono em 69,2 com uma constante J = 9,0 Hz, compatível com um acoplamento axial-axial. Sendo assim, o grupo hidroxílico ligado ao carbono em 69,2 está na posição , enquanto o outro ligado ao carbono em 84,0 está na posição (MANDAL et al., 2006). Outras correlações observadas no gHMBC, apresentadas na figura abaixo (Figura 25, p. 72), possibilitaram propor a estrutura parcial B, que provavelmente se refere ao anel E de um triterpeno: 1,30 com 42,4, 48,7 e 85,0; 1,34 com 19,3, 42,5 e 175,2; 1,54 com 42,4, 56,7 e 85,0; 1,88 com 43,1; 1,90 com 48,7, 56,7 e 175,2; e, 2,38 com 48,7. Foram observadas ainda as correlações: 0,93 com 40,6 e 41,2; e, 0,94 com 26,9 e 42,6. Além disso, o espectro de gCOSY mostrou acoplamentos que 71 Cap. 3 Resultados e Discussão corroboraram com o que foi observado no espectro de gHMBC: 1,90 com 2,38 e 3,95; e, 3,95 com 2,38 e 1,54 (Figura 26, p. 72). 22,2 1,54 19,3 CH3 1,30 H3C 42,4 . CH3 85,0 19,3 OH O 56,7 48,7 . . 175,2 . * Sobreposição dos sinais. 42,4 43,1 1,90* 2,38 1,34 43,1 42,50 48,7 . O 1,88 * 85,0 H3C OH 56,7 O 175,2 O . . . Figura 25: Estrutura parcial B com correlações selecionadas do gHMBC H 1,54 OH H3C O H 3,95 O . H . H 1,90 2,38 . . Figura 26: Estrutura parcial B com correlações selecionadas do gCOSY Diante dessas informações constatou-se que a substância 9-h é um triterpeno com esqueleto ursano ou taraxastano (dependendo da configuração relativa do grupo metílico ligado a C-19), contendo um grupo lactona 2820. A existência do grupo lactona faz com que o anel E possua conformação em barco. A configuração relativa do grupo hidroxílico ligado a C-21 foi determinada considerando as constantes de acoplamento de H-21 com os hidrogênios do grupo metilênico vizinho (H-22 e H-22) e com H-19. O sinal de H-21 (3,95; ddd) acopla com os hidrogênios metilênicos vicinais com constantes de J ≈ 11,5 e ≈ 7,0 Hz, e com H-19 com uma constante de J = 2,1 Hz, que pode ser atribuída a um acoplamento de longo alcance em W. Este acoplamento em W 4J só é possível se ambos H-21 e H-19 estiverem na posição (Figura 27, p. 73). Os dubletos em 2,38 (2J = 14,0 e 3J ≈ 11,5 Hz) e 1,90 (2J = 14,0 e 3J = 7,0 Hz) foram atribuídos aos hidrogênios metilênicos ligados a C-22, onde a constante de acoplamento de 2 J = 14,0 refere-se ao acoplamento geminal H-22 com H-22, enquanto que as constantes de 3J ≈ 11,5 Hz 72 Cap. 3 Resultados e Discussão e 3J = 7,0 Hz são compatíveis com acoplamentos de H-22 com H-21 e de H-22 com H-21, respectivamente. A configuração relativa do grupo metílico ligado a C-19 foi determinada com base nas constantes de acoplamento dos hidrogênios H-18 e H-19. O hidrogênio metínico H-19 (1,74; dqd) apresentou constantes de acoplamento de 3J≈ 7,5, 3J≈ 5,7, atribuídas ao acoplamento com os hidrogênios metílicos (H-29) e com H-18ax, respectivamente, e 4J ≈ 2,1 Hz, que pode ser atribuída a um acoplamento de longo alcance em W com H-21, o que corrobora com a proposta de que o grupo metílico ligado a C-19 esteja na posição . O hidrogênio metínico H-18 (1,34; dd) apresentou constantes de acoplamento de 3J ≈ 11,5 e 3J = 5,7 Hz, típicas de acoplamento H-18ax com H-13ax e de H-18ax com H-19, respectivamente (Figura 27). Ao determinar o grupo H3C-29 na posição , foi possível definir que o triterpeno possui esqueleto do tipo taraxastano. Além disso, ao definir H-21 na posição , foi estabelecido que o grupo HO-21 está na posição . Cabe ressaltar que o espectro de NOESY não apresentou correlações conclusivas para a determinação da configuração relativa dos grupos hidroxílicos e metílico-29. H O H 2 . . H . 13 . HO HO . 22 3 . H O 19 H . 21 H HO Figura 27: Estrutura em conformação de cadeira da substância 9-h Diante dessas informações constatou-se que a substância 9-h é um triterpeno com esqueleto taraxastano, o 2,321-tri-hidroxitaraxastan-28,20-olídeo (Figura 28, p. 74). O valor de []D para 9-h foi de []20D –15,0 (MeOH, c 0,17). Não foi encontrado qualquer relato sobre o isolamento desta substância, entretanto, foram encontrados dois relatos sobre a obtenção de uma substância similar, que difere da 9h por não possuir substituinte na posição 21 (MANDAL et al., 2006; DAS e MAHATO, 1982) (Figura 29, p. 74). Sendo assim, este é o primeiro relato do isolamento desta substância. 73 Cap. 3 Resultados e Discussão 30 H3C O 29 OH H3C 20 25 CH3 HO 28 22 18 13 11 O 17 CH3 26 14 9 1 10 CH3 7 3 27 5 HO CH3 H3C 23 24 Figura 28: Estrutura do 2,321-tri- hidroxitaraxastan-28,20-olídeo (9-h) 30 H3C O 29 H3C 20 18 25 CH3 HO 13 11 26 17 CH3 22 28 O 14 9 1 10 7 3 CH3 27 5 HO H3C 24 CH3 23 Figura 29: Estrutura de substância similar a 9-h, o 2,3-di-hidroxitaraxastan-28,20olídeo 74 Cap. 3 Resultados e Discussão Tabela 10: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, 13 (ppm)] da substância 9-h e dados da literatura de substância similar [125 MHz (13C), Piridina-d5, (ppm)]. 9-h (MANDAL et al., 2006) Nº 13C 1H (mult.; J em Hz) 13C 1 46,7 0,89* (m) 48,2 2,08 (dd; 7,0 e 4,5) 2 69,2 3,71 (m; ≈ 9,0 e ≈ 5,0) 68,9 3 84,0 2,99 (d; 9,0) 83,8 4 39,2 - 39,9 5 55,5 0,80* (m) 56,1 6 18,2 ** 18,7 7 33,8 1,37* (m) 34,3 1,43* (m) 8 40,6 - 40,9 9 50,4 1,35 (m) 50,9 10 38,5 - 38,7 11 21,0 1,58* (m) 22,3 12 24,9 1,63* (m) 25,4 1,66* (m) 13 42,6 ** 43,2 14 41,2 - 41,4 15 26,9 1,14 (m) 27,7 2,04* (m) 16 27,0 1,88* (dt; 4,5) 28,1 17 42,5 - 42,2 18 48,7 1,34* (dd; ≈ 11,5 e ≈ 5,7) 48,4 19 42,4 1,74 (dqd; ≈ 7,5, ≈ 5,7 e ≈ 2,1) 42,4 20 84,0 - 83,9 21 56,7 3,95 (ddd; ≈ 11,5, ≈ 7,0 e ≈ 2,1) 27,3 22 43,1 H: 1,90* (dd; 14,0 e 7,0) 32,3 H: 2,38 (dd; 14,0 e ≈ 11,5) 23 28,4 1,02 (s) 29,2 24 16,5 0,82 (s) 17,5 25 17,5 0,91 (s) 17,8 26 15,7 0,94 (s) 15,9 27 14,2 0,95 (s) 14,4 28 175,2 - 176,7 29 19,3 1,30 (d; 7,5 Hz) 18,6 30 22,2 1,54 (s) 24,1 * em sobrepsição; ** os sinais não foram identificados 75 Cap. 3 Resultados e Discussão 3.2.10. Substância 10-h A substância 10-h (10 mg), um sólido branco, solúvel em acetona e com ponto de fusão na faixa de 133,1-133,7 ºC, foi isolada do fracionamento da fase diclorometânica (p. 29 e 33). A determinação estrutural da substância 10-h foi realizada com base no espectro de RMN de 1H (Anexo A, p. 161) e pela comparação com dados reportados na literatura (KALINOWOSKA et al., 2007) (Tabela 11). O espectro de RMN de 1H apresentou dois dubletos em 6,25 (J ≈ 16,0 Hz) e 7,49 (J ≈ 16,0 Hz), integrando para um hidrogênio cada, característicos de hidrogênios olefínicos vicinais acoplados entre si. A constante de acoplamento de ≈ 16,0 Hz indica a configuração trans. Além disso, foram observados dois multipletos em 7,20-7,22 e 7,35-7,38, integrando para três e dois hidrogênios, respectivamente, que permitiram sugerir a presença de um grupo fenílico monossubstituído. Diante dessas informações, constatou-se que a substância 10-h é o ácido cinâmico (Figura 30), um precursor dos flavonoides. Os dados encontrados na literatura para este composto estão compatíveis com os obtidos neste trabalho. 2' 1' 4' 5' O 2 1 OH Figura 30: estrutura do ácido cinâmico (10-h) Tabela 11: Dados de RMN de 1H [300 MHz (1H), acetona-d6 + CDCl3, (ppm)] da substância 11-h e dados da literatura (RMN de 1H em DMSO-d6) 12-h (KALINOWSKA et al., 2007) Nº H (mult.; J em Hz) H (mult.; J em Hz) 2 6,25 (d; ≈ 16,0) 6,53 3 7,49 (d; ≈ 16,0) 7,68 2’ 7,35-7,38 7,56 3’ 7,20-7,22 7,40 4’ 7,20-7,22 7,47 5’ 7,20-7,22 7,40 6’ 7,35-7,38 7,56 1 1 76 Cap. 3 Resultados e Discussão 3.2.11. Substância 11-h A substância 11-h (25 mg), com aspecto de cera e coloração laranja, solúvel em clorofórmio, foi isolada do fracionamento da fase hexânica (p. 34 e 35). Da análise dos espectros de RMN de 1H, 13 C, DEPT 135º, gHMQC e gHMBC (Anexo A, p. 162-165) e pela comparação com dados reportados na literatura (Tabela 12, p. 81) foi possível propor uma estrutura para a Substância 11-h. O espectro RMN 13 C apresentou vinte e nove sinais, que através da análise do espectro DEPT 135º permitiu definir a presença de oito sinais referentes a carbonos metílicos (11,3, 11,8, 12,2, 19,6, 19,7, 22,6, 22,7 e 23,8), onze a metilênicos (20,7, 21,0, 24,4, 24,8, 31,6, 37,3, 37,4, 37,45, 37,5, 39,4 e 39,8), três a metínicos (28,0, 32,7 e 32,8), e sete a carbonos não hidrogenados (seis aromáticos em 117,3, 118,5, 121,0, 122,6, 144,5 e 145,5, sendo os dois últimos ligados a grupos OR, e um oxigenado em 74,5). Assim, pode-se sugerir uma fórmula molecular C29H50O2 e um índice de deficiência de hidrogênio (IDH) igual a 5, compatível com a presença de dois anéis, sendo um deles aromático. O espectro de RMN de 1H apresentou dois singletos em 2,13 e 2,18, integrando para seis e três hidrogênios, respectivamente, e que correlacionaram no espectro de gHMQC com três sinais de 13C em 11,3, 12,2 e 11,8. Estes sinais são característicos de grupos metílicos ligados a anel aromático. Como o espectro de RMN de 1H não apresentou nenhum sinal de hidrogênio ligado a anel aromático, sugeriu-se como substituintes, além de dois grupos -OR, três grupos metílicos e, ainda, um grupo metilênico. Os hidrogênios deste grupo metilênico apareceram no espectro de RMN de H como um tripleto em 2,62 (J= 6 Hz), e apresentaram correlação no gHMQC com o 1 sinal de carbono em 20,8. No gHMBC este tripleto em 2,62 exibiu correlação com os sinais em 31,6, 74,5, 117,3, 118,5 e 145,5 (Figura 31, p. 78). Os hidrogênios dos grupos metílicos ligados ao anel aromático apresentaram no gHMBC as seguintes correlações: 2,13 com 117,3, 118,5, 121,0 e 145,5; 2,18 com 121,0, 122,6 e 144,5. O sinal dos hidrogênios do grupo metílico em 1,25 apresentou correlação no gHMQC com 23,8, enquanto que no gHMBC apresentou correlação com 39,8 e com 74,5. Além disso, o multipleto em 1,55 apresentou correlação no gHMQC com 39,8 e no gHMBC com 23,8 (Figura 31, p. 78). 77 Cap. 3 Resultados e Discussão 2,13 23,8 1,25 CH3 2,18 4' CH 3 H3C 122,6 121,0 144,5 HO O 1 74,5 39,8 1,55 . . 145,5 117,3 . 31,6 2 1' 118,5 2,62 CH3 20,8 2,13 Figura 31: Correlações selecionadas do gHMBC para a estrutura parcial da substância 11-h Adicionalmente ao que foi descrito, os sinais de carbonos metílicos em 19,6, 19,7, 22,6 e 22,7, de carbonos metilênicos em 21,0, 24,4, 24,8, 37,3, 37,4, 37,45, 37,5 e 39,4, e de grupos metínicos em 28,0, 32,7 e 32,8, sugeriram a existência de quatro unidades isoprenóides ligadas entre si, sendo uma delas condensada com o anel aromático. Diante do exposto, foi possível identificar que a Substância 11-h trata-se de um composto fenólico, formado a partir da condensação do fitol com uma hidroquinona seguido de ciclização, o -tocoferol (Vitamina E) (Figura 32). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (CARVALHO et al., 1998; MATSUNO e URANO, 1976). CH3 H3C 1 O 4' CH3 9' CH3 8' 5 14' CH3 13' 18' CH3 20' 2 HO CH3 1' CH3 Figura 32: Estrutura do -tocoferol (11-h) 78 Cap. 3 Resultados e Discussão 3.2.12. Substância 12-h A substância 12-h (30 mg), com aspecto de cera com coloração laranja, solúvel em clorofórmio, foi isolada do fracionamento da fase hexânica (p. 34 e 35). A análise dos espectros de RMN de 1H, 13 C, DEPT 135º, gHMQC e gHMBC (Anexo A, p. 166-170) e a comparação com dados reportados na literatura (Tabela 12, p. 81) permitiram propor uma estrutura para a Substância 12-h. O espectro RMN 13 C apresentou vinte e dois sinais, que através da análise do espectro DEPT 135º permitiu definir a presença de seis sinais de carbonos metílicos (15,96, 16,0, 16,4, 17,6, 21,0 e 25,6), sete de metilênicos (26,2, 26,6, 26,7, 39,5, 39,66, 39,7 e 61,4), quatro de olefínicos metínicos (118,3, 123,6, 124,2 e 124,4), cinco de carbonos não hidrogenados, sendo quatro olefínicos (131,2, 134,9, 135,4 e 142,2) e um carbonílico, típico de éster (171,0). Assim, pode-se sugerir uma fórmula molecular C22H36O2 e um índice de deficiência de hidrogênio (IDH) igual a 5, compatível com a presença de quatro ligações duplas e um grupo carbonílico. O espectro de RMN de 1H exibiu um dubleto em 4,58 (J = 7,2 Hz), com integração para dois hidrogênios, que foi atribuído a um grupo oximetilênico. Este dubleto apresentou correlação no gHMQC com 61,4, enquanto no gHMBC correlacionou com 118,3, 142,2 e 171,0, e apresentou acoplamento no gCOSY com o multipleto em 5,34. O multipleto em 5,34 exibiu correlação no gHMQC com 118,3 e no gHMBC com 16,4 e 39,5. Foram observadas ainda as seguintes correlações no gHMQC: o singletos em 1,60 com 15,96, 16,0 e 17,6; em 1,68 com 25,6; em 1,70 com 16,4; e, em 2,05 com 21,0; os multipletos em 2,0 com 39,5; em 2,07 com 26,6; e, em 5,12 com 123,6, 124,2 e 124,4. No gHMBC, além das correlações citadas, foram observadas ainda: 1,60 com 124,4, 131,2 e 135,4 e com 39,7; 1,68 com 124,4 e 131,2; 2,0 com 26,6, 118,3, 123,6, 134,9 e 142,2; e, 2,05 com 171,0 (Figura 33, p. 80). 79 Cap. 3 Resultados e Discussão CH3 O 142,2 H3C O 21,0 CH3 123,6 118,3 . 134,9 26,6 2,0 . . (a) O 61,4 171,0 2,05 CH3 4,58 H3C O 2,07 39,5 123,6 1,68 CH3 CH3 CH3 135,4 134,9 142,2 5,34 1,60 1,60 1,70 39,7 124,2 131,2 39,66 124,4 CH3 1,60 118,3 (b) Figura 33: Correlações selecionadas em (a) e (b) do espectro de HMBC da substância 12-h Essas informações permitiram propor que a substância 12-h possui em sua estrutura um grupo acetato ligado a um grupo formado por quatro unidades de isopreno ligadas entre si (“cabeça-cauda”) e, sendo assim, trata-se de um precursor de diterpenos, o acetato de geranilgeranila (Figura 34). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (PIANARO, 2007). Cabe ressaltar que não é comum a ocorrência de diterpenos na família Myrtaceae e não há relatos em espécies de Myrcia. O 9' CH3 19' 14' CH3 CH3 1' 1 H3C 4' CH3 O 2' 7' 12' 17' CH3 20' Figura 34: Estrutura do acetato de geranilgeranila (12-h) 80 Cap. 3 Resultados e Discussão Tabela 12: Dados de RMN de 1H e 13C [300 MHz (1H) e 75 MHz (13C), CDCl3, (ppm)] das substâncias 11-h e 12-h e dados da literatura. No. 11-h 13 C 1 H (mult.; J em Hz) 1 13 12-h C 13 2 H (mult.; J em Hz) 1 C 13 C 1 145,5 - 145,5 171,0 - 172,50 2 117,3 - 122,4 21,0 2,05 (s) 21,10 3 118,5 - 115,7 - - 4 144,5 - 144,4 - - 5 121,0 - 119,5 - - 6 122,6 - 122,4 - - 1’ 20,8 2,62 (t; 6,6) 25,7 61,4 4,58 (d; 7,2) 61,42 2’ 31,6 1,8 (q; 6,6) 32,4 118,3 5,34 (m; 7,0) 118,24 3’ 74,5 - 74,4 142,2 2,62 (t; 6,6) 144,50 4’ 23,8 1,25 (s) 23,6 16,4 1,70 (s) 16,50 5’ 39,8 1,55 (m) 39,3 39,5 2,0 (m) 39,74 6’ e 21,0 * 24,6 26,6 2,07 (m) 26,22 7’ 37,3ª * 37,4 123,6 5,12 (m) 123,61 8’ b * 37,7 134,9 - 135,51 19,2 a 1,60 (s) 16,10 b * 39,69 c 9’ 10’ 32,7 c 19,6 a 37,4 e 0,86 (d) * 37,7 17,6 39,7 11’ 24,4 * 24,5 26,2 * 26,64 12’ 37,45ª 13’ 14’ * 37,4 124,2 5,12 (m) 124,19 b * 37,8 135,4 - 135,00 c 0,86 (d) 19,2 15,96ª 1,60 (s) 16,00 37,4 39,66 b * 39,55 c 32,8 19,7 15’ 37,5ª 16’ e 24,8 * 24,8 26,7 * 26,77 17’ 39,4 * 39,3 124,4 5,12 (m) 124,40 18’ 28,0 * 27,9 131,2 - ** 19’ d 0,88 (d) 22,7 a 16,0 1,60 (s) 17,70 d 0,88 (d) 22,7 25,6 1,68 (s) 25,71 H3C – 3 f 11,3 2,13 (s) 11,6 - - H3C – 5 11,8 2,18 (s) 11,4 - - H3C – 6 f 2,13 (s) 11,7 - - 20’ 22,6 22,7 12,2 * Letras em sobrescrito indicam que a atribuição dos sinais pode estar trocada * Os sinais não foram identificados; ** Sem atribuição 1 - CARVALHO et al., 1998 [50,3 MHz ( C), CDCl3, (ppm)]. 13 2 – PIANARO, 2007 [500 MHz ( C), CDCl3, (ppm)]. 13 81 Cap. 3 Resultados e Discussão 3.3. Identificação e Determinação Estrutural dos Constituintes Químicos Isolados das folhas de M. myrtifolia 3.3.1. Substância 13-m A substância 13-m (57 mg), sólido amarelo, solúvel em acetona e com faixa de fusão de 305-306 ºC, foi isolada do fracionamento da fase diclorometânica (p. 36 e 38). A determinação estrutural da substância 13-m foi realizada com base na análise dos espectros de RMN de 1H, 13 C, gHSQC e gHMBC (Anexo B, p. 171-173), e pela comparação com dados reportados na literatura (ADEROGBA et al., 2006) (Tabela 13, p. 83). O espectro de RMN de 1H apresentou dubletos em 6,28 (4J = 2,0 Hz), 6,54 (4J = 2,0 Hz), 7,00 (3J = 8,5 Hz) e 7,84 (4J = 2,0 Hz), além de um duplo dubleto em 7,72 (3J = 8,5 e 4J = 2,0 Hz), sendo todos os sinais integrando para um hidrogênio cada. Os deslocamentos químicos dos sinais são característicos de hidrogênios ligados a anel aromático, sendo que as constantes de 2,0 Hz e 8,5 Hz são compatíveis com acoplamentos em meta e orto, respectivamente. Essas informações possibilitaram identificar a presença de dois anéis aromáticos, um 1,2,3,5-tetrassubstituído e o outro 1,3,4-trissubstituído. Além disso, foi observado um singleto largo em 12,18, característico de hidrogênio de grupo hidroxílico envolvido em ligação de hidrogênio intramolecular. No espectro de RMN de C foram observados quinze sinais entre 93,6 a 13 175,7 para esta substância, que permitiu sugerir a estrutura de um flavonóide, com esqueleto básico C6-C3-C6 (HARBORNE, 1982). Os sinais em 93,6, 98,3, 103,2, 114,9, 115,3, 120,6, 122,9, 145,0, 147,5, 156,9, 161,4 e 164,1 foram atribuídos aos carbonos dos dois anéis aromáticos, enquanto os sinais em 175,7, 135,9 e 146,1, foram atribuídos aos carbonos carbonílico, olefínicos e carbonílico, respectivamente. A análise do espectro de gHSQC e de gHMBC permitiu realizar a atribuição dos sinais. No gHSQC foram observadas as seguintes correlações: 6,28 com 98,3; 6,54 com 93,6; 7,00 com 115,3; 7,72 com 120,6; e, 7,84 com 114,9. O espectro de gHMBC exibiu as seguintes correlações: 6,28 com 161,4 (C-5) e 164,1 (C-7); 6,54 com 156,9 (C-9) e 164,1 (C-7); 7,00 com 122,9 (C-1’), 145,0 (C-3’) e 147,5 (C-4’); 7,72 com 146,1 (C-) e 147,5 (C-4’); 7,84 com 146,1 (C-) e 147,5 (C-4’) (Figura 35, p. 83). 82 Cap. 3 Resultados e Discussão As informações acima possibilitaram identificar que a substância 13-m é um flavonol, a quercetina. Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (ADEROGBA et al., 2006). A quercetina é um flavonoide amplamente distribuído no reino vegetal. HO 7,84 3' 145,0 4' 6,54 HO 7 156,9 164,1 6,28 5 122,9 O 9 2 7,00 146,1 7,72 OH 4 161,4 OH 147,5 O OH Figura 35: Estrutura da quercetina (13-m) com correlações selecionadas do espectro de gHMBC. Tabela 13: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), acetona-d6, 13 (ppm)] da substância 13-m e dados da literatura [75 MHz (13C), DMSO-d6, (ppm)] 13-m H (mult.; J em Hz) 2 146,19 - 146,8 3 135,9 - 135,8 4 175,7 - 175,9 5 161,4 - 160,7 6 98,3 6,28 (d; 2,0) 98,2 7 164,1 - 163,9 8 93,6 6,54 (d; 2,0) 93,4 9 156,9 - 156,2 10 103,2 - 103,0 1’ 122,9 - 122,0 2’ 114,9 7,84 (d; 2,0) 115,1 3’ 145,0 - 145,1 4’ 147,5 - 147,7 5’ 115,3 7,00 (d; 8,5) 115,6 6’ 120,6 7,72 (dd; 8,5 e 2,0) 120,0 HO – 5 - 12,18 (sl) - Nº (ADEROGBA et al., 2006) 13 C 1 13 C 83 Cap. 3 Resultados e Discussão 3.3.2. Substância 14-m A substância 14-m (14 mg), sólido branco, solúvel em clorofórmio e com ponto de fusão na faixa de 102,8-103,2 ºC, foi isolada do fracionamento da fase diclorometânica (p. 36 e 39). A determinação estrutural da substância 14-m foi realizada com base na análise dos espectros de RMN de 1H, 13 C, gHMQC e gHMBC (Anexo B, p. 173-178), e pela comparação com dados reportados na literatura (DASTLIK et al., 1989) (Tabela 14, p. 88). O espectro de RMN de 1H exibiu um dubleto em 1,16 (3J= 6,5 Hz) e um septeto em 3,78 (3J= 6,5 Hz), com integração para seis e um hidrogênios, respectivamente, característicos de hidrogênios de um grupo isopropílico. Apresentou três singletos em 2,02, 3,89, 3,91, com integração para três hidrogênios cada, sendo o primeiro compatível com hidrogênios de um grupo metílico ligado a anel aromático e os outros dois com hidrogênios de dois grupos metoxílicos. Além disso, exibiu dois singletos em 5,97 e 13,95, com integração para um hidrogênio cada, que foram atribuídos a um hidrogênio aromático e um hidrogênio de grupo hidroxílico envolvido em ligação de hidrogênio intramolecular, respectivamente. Da análise do espectro de RMN de 13 C em comparação com DEPT 135º foi possível identificar a existência de 13 carbonos, sendo cinco metílicos (7,4, 19,5 e 55,6, estes dois últimos apresentaram intensidade para dois carbonos cada), dois metínicos (39,8 e 86,1) e seis não hidrogenados (105,1, 106,2, 161,1, 163,3, 164,2 e 210,8). Os sinais em 19,5 e 39,8 foram atribuídos a carbonos de um grupo isopropílico, enquanto que os sinais em 86,1, 105,1, 106,2, 161,1, 163,3 e 164,2 foram atribuídos a carbonos de um anel aromático. O sinal em 210,8 é característico de um carbono carbonílico de uma cetona. Essas informações possibilitaram identificar a presença de uma estrutura isopropilfenilcetona, sendo que o grupo fenílico possui como substituintes um grupo metílico, dois grupos metoxílicos e um grupo hidroxílico quelado. A análise dos espectros de gHMQC e gHMBC permitiu a identificação das posições dos substituintes. No espectro de gHMQC foram observadas as seguintes correlações: 2,02 com 7,4; 3,90 e 3,91 com 55,6; e, 5,97 com 86,1. O espectro de gHMBC exibiu as seguintes correlações: 1,16 com 19,5 (C-3 e H3C–2), 39,8 (C-2) e 210,8 (C-1); 2,02 com 106,2 (C-3’), 163,3 (C-4’) e 164,2 (C-2’); 3,78 com 19,5 (C-3 e H3C–2) e 210,8 (C-1); 3,90 com 163,3 (C-4’); 3,91 com 161,1 (C84 Cap. 3 Resultados e Discussão 6’); 5,97 com 105,1 (C-1’), 106,2 (C-3’), 161,1 (C-6’) e 163,3 (C-4’); e, 13,95 com 105,1 (C-1’), 106,2 (C-3’) e 164,2 (C-2’) (Figura 36). 13,95 O HO 2,02 H3C 164,2 105,1 106,2 H3C 3,90 210,8 163,3 1,16 19,5 CH3 3,78 39,8 161,1 CH3 O O 5,97 CH3 3,91 Figura 36: Correlações selecionadas do espectro de gHMBC da substância 14-m As informações acima possibilitaram identificar que a substância 14-m é um derivado do floroglucinol, a 2’-hidróxi-2,3’-dimetil-4’,6’-dimetoxipropiofenona, conhecido como Baeckeol (Figura 37). Foram encontrados alguns relatos sobre a ocorrência deste composto em espécies de Myrtaceae, tais como Thryptomene saxicola (DASTLIK et al., 1989), Calythrix angulata (BOWYER e JEFFERIES, 1962), Baeckea frutensis L. (SPOELSTRA, 1931) e Baeckea gunniana (PENFOLD, 1925). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (DASTLIK et al., 1989). O OH 2' H3C 1' 1 4' H3C O 2 CH3 CH3 O CH3 Figura 37: Estrutura da 2’-hidróxi-2,3’-dimetil-4’,6’-dimetoxipropiofenona (14-m) 85 Cap. 3 Resultados e Discussão 3.3.3. Substância 15-m A substância 15-m (7 mg), sólido branco, solúvel em clorofórmio e com ponto de fusão na faixa de 110,9-111,3 ºC, foi isolada do fracionamento da fase diclorometânica (p. 36 e 39). A determinação estrutural da substância 15-m foi realizada com base nos espectros de RMN de 1H, 13 C, gHMQC e gHMBC (Anexo B, p. 179-184). Os dados de RMN estão apresentados na Tabela 14 (p. 88). Pela análise dos espectros de RMN de 1H e de 13C foi possível identificar que a substância 15-m possui semelhança estrutural com a substância 14-m. A diferença observada foi a presença de dois tripletos em 1,00 (3J = 7,5 Hz) e 2,99 (3J = 7,5 Hz), com integração para três e dois hidrogênios, respectivamente, e um sexteto em 1,73 (3J= 7,5 Hz), integrando para dois hidrogênios, enquanto que a substância 14-m apresentou um dubleto em 1,16 (3J= 6,5 Hz) e um septeto em 3,78 (3J= 6,5 Hz), integrando para seis e um hidrogênios, respectivamente. Essas informações permitiram identificar que a substância 15-m possui um grupo propílico ligado ao carbono carbonílico, enquanto a 14-m possui um grupo isopropílico. Além desses sinais, o espectro de RMN de 1H exibiu três singletos em 2,03, 3,90 e 3,92, com integração para três hidrogênios cada, que foram atribuídos a hidrogênios de um grupo metílico e de dois grupos metoxílicos, respectivamente, e outros dois singletos em 5,98 e 14,06, com integração para um hidrogênio cada, característicos de um hidrogênio aromático e um hidrogênio de um grupo hidroxílico quelado, respectivamente. A análise do espectro de RMN de 13 C em comparação com DEPT 135º confirmou a existência de 13 carbonos, sendo quatro metílicos (7,2, 14,0, 55,4 e 55,4), dois metilênicos (18,3 e 46,4), um metínicos (85,7) e seis não hidrogenados (105,7, 105,8, 161,3, 163,2, 163,8 e 206,2). Os sinais em 14,0, 18,3 e 46,4 foram atribuídos aos carbonos do grupo propílico. Os sinais em 85,7, 105,7, 105,8, 161,3, 163,2 e 163,8 foram atribuídos aos carbonos do anel aromático, e o sinal em 206,2 a um carbono carbonílico de uma cetona. Esses dados confirmaram a presença de uma estrutura propilfenilcetona, contendo como substituintes no anel aromático um grupo metílico, dois grupos metoxílicos e um grupo hidroxílico quelado. A análise dos espectros de gHMQC e gHMBC permitiu identificar as posições dos substituintes. No espectro de gHMQC foram observadas as seguintes correlações: 1,00 com 14,0; 1,73 com 18,3; 2,03 com 7,2; 3,90 com 55,4; 3,92 com 55,4; e, 5,98 com 85,7. O espectro de gHMBC exibiu as seguintes 86 Cap. 3 Resultados e Discussão correlações: 1,00 com 18,3 (C-3), 46,4 (C-2); 1,73 com 14,0 (C-4), 46,4 (C-2) e 206,2 (C-1); 2,99 com 14,0 (C-4), 18,3 (C-3) e 206,2 (C-1); 2,03 com 105,7 (C-3’), 163,2 (C4’) e 163,8 (C-2’); 3,90 com 163,2 (C-4’); 3,92 com 161,3 (C-6’); 5,98 com 105,7 (C3’), 161,3 (C-6’) e 163,2 (C-4’) (Figura 38). O OH 2,03 H3C 105,7 163,8 18,3 206,2 14,0 CH3 2,99 1,00 46,4 163,2 161,3 H3C O O 3,90 1,73 5,98 CH3 3,92 Figura 38: Correlações selecionadas do espectro de gHMBC da substância 15-m As informações acima possibilitaram identificar que a substância 15-m, assim como a 14-m, é um derivado do floroglucinol, a 2’-hidróxi-3’-metil-4’,6’- dimetoxibutirofenona (Figura 39). Realizou-se uma busca no Scifinder para avaliar o ineditismo desta substância e foram encontradas três referências. ROBERTSON e SANDROCK (1933) relatam a síntese deste composto, enquanto PYYSALO e WIDEN (1979) e AYRAS e WIDEN (1978b) reportam a ocorrência como produto natural, entretanto, somente este último possui dados de RMN e não está acessível na rede e o periódico não consta para a solicitação via COMUT e, por isso, não houve a comparação com os dados obtidos neste trabalho. Além desses, AYRAS e WIDEN (1978a) e SINGH e BHARATE (2006) relatam a ocorrência como produto natural de alguns derivados do floroglucinol com estrutura similar a da substância 15-m. O OH 2' H3C 1 1' 2 CH3 4' H3C O O CH3 Figura 39: Estrutura da 2’-hidróxi-3’-metil-4’,6’-dimetoxibutirofenona (15-m) 87 Cap. 3 Resultados e Discussão Tabela 14: Dados de RMN de 1H e C [500 MHz (1H) e 125 MHz (13C), CDCl3, 13 (ppm)] das substâncias 14-m e 15-m e dados da literatura. 14-m H (mult.; J em Hz) C=O 210,78 - 210,54 206,2 2 39,81 3,78 (sep; 6,5) 39,60 46,4 2,99 (t; 7,5) 3 19,48 1,16 (d; 6,5) 19,29 18,3 1,73 (sxt; 7,5) 4 - - - 14,0 1,00 (t; 7,5) 1’ 105,13 - 105,85 105,8 - 2’ 164,18 - 160,89 163,8 - 3’ 106,16 - 104,86 105,7 - 4’ 163,27 - 163,07 163,2 - 5’ 86,07 5,97 (s) 85,79 85,7 5,98 (s) 6’ 161,09 - 163,99 161,3 - H3C – 2 19,48 1,16 (d; 6,5) 19,29 - - H3C – 3’ 7,42 2,02 (s) 7,24 7,2 2,03 H3CO – 4’ 55,61 - 55,38 55,4 3,92 H3CO – 6’ 55,61 - 55,38 55,4 3,90 HO – 2’ - 13,95 (s) - - 14,06 C 1 15-m 13 Nº 1 13 C 13 C H (mult.; J em Hz) 1 1 – DASTLIK et al., 1989 [75,5 MHz ( C), CDCl3, (ppm)] 13 88 Cap. 3 Resultados e Discussão 3.3.4. Substância 16-m A substância 16-m (8 mg), sólido branco, solúvel em clorofórmio e com ponto de fusão na faixa de 299,2-300,0 ºC, foi isolada do fracionamento da fase diclorometânica (p. 38 e 42). A determinação estrutural da substância 16-m foi realizada com base na análise dos espectros de RMN de 1H, 13 C e DEPT 135º (Anexo B, p. 184-187), e pela comparação com dados encontrados na literatura (ARAÚJO et al., 2009; MAHATO e KUNDU, 1994) (Tabela 15, p. 94). O espectro de RMN de 1H mostrou seis singletos em 0,76, 0,83, 0,94, 0,97, 0,98 e 1,70, integrando para três hidrogênios cada, característicos de hidrogênios de grupos metílicos de triterpenos. O sinal em 1,70 sugere um grupo metílico ligado a um carbono olefínico. Exibiu um duplo dubleto em 3,19 (3J = 11,5 e J = 4,5 Hz) e um duplo duplo dubleto em 3,00 (3J = 11,0, 3J = 10,5 e 3J ≈ 5 Hz), 3 ambos com integração para um hidrogênio, característicos de hidrogênios metínicos H-3 e H-19 de triterpenos. Além disso, apresentou um singleto largo em 4,62 e um dubleto em 4,75 (2J = 2,0 Hz), com integração para um hidrogênio cada, característicos de hidrogênios geminais olefínicos. Essas informações permitiram propor um esqueleto de triterpeno pentacíclico do tipo lupano para a substância 16-m. Pela análise do espectro de RMN de 13 C e em comparação com o de DEPT 135º constatou-se a presença de trinta carbonos, sendo seis metílicos (14,9, 15,5, 16,2, 16,3, 19,6 e 28,2), onze metilênicos (18,5, 21,0, 25,6, 25,7, 29,9, 30,7, 32,3, 34,5, 37,2, 38,9 e 109,9), seis metínicos (38,6, 47,1, 49,5, 50,7, 55,5 e 79,2) e sete não hidrogenados (37,4, 39,1, 40,9, 42,6, 56,5, 150,6 e 180,2). Destes, o sinal em 79,21 foi atribuído a um carbono oximetínico (C-3), enquanto os sinais em 109,9 e 150,6 foram atribuídos a carbonos olefínicos (C-29 e C-20, respectivamente). O sinal em 180,2 foi atribuído a um carbono (C-28) de um grupo carboxílico. As informações acima permitiram identificar que a substância 16-m é o ácido betulínico (Figura 40, p. 93). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (F. C. V. ARAÚJO et al., 2009; MAHATO e KUNDU, 1994). 89 Cap. 3 Resultados e Discussão 3.3.5. Substância 17-m A substância 17-m (30 mg), sólido branco, solúvel em clorofórmio e com ponto de fusão na faixa de 246,7-247,3 ºC, foi isolada do fracionamento da fase diclorometânica (p. 37 e 41). A determinação estrutural da substância 17-m foi realizada com base nos espectros de RMN de 1H, 13C e DEPT 135º (Anexo B, p. 187-189), e pela comparação com dados encontrados na literatura (LIU et al., 2010; F. C. V. ARAÚJO et al., 2009) (Tabela 15, p. 94). Pela análise dos espectros de RMN de 1H e de 13 C foi possível identificar que a substância 17-m possui semelhança estrutural com a substância 16m. As diferenças observadas foram que a 17-m não apresentou sinais referentes a H3 e C-3 , que apareceram em 3,19 e 79,2, nos espectros de RMN de 1H e 13 C, respectivamente, da 16-m, entretanto, observou-se a presença de um sinal em 218,2, característico de um carbono carbonílico. Essas informações permitiram identificar que a substância 17-m, assim como a 16-m, possui um esqueleto de triterpeno pentacíclico do tipo lupano, porém contém um grupo oxo na posição 3. O espectro de RMN de 1H exibiu seis singletos em 0,94, 0,99, 1,01, 1,03, 1,09 e 1,71, integrando para três hidrogênios cada, característicos de hidrogênios de grupos metílicos. Exibiu um duplo duplo dubleto em 3,02 (3J = 11,0, 3J = 10,5 e 3J ≈ 5 Hz), com integração para um hidrogênio, característico de hidrogênio metínico H19, um singleto largo em 4,62 e um dubleto em 4,76 (2J = 2,0 Hz), com integração para um hidrogênio cada, característicos de hidrogênios geminais olefínicos. O espectro de RMN de 13 C em comparação com o de DEPT 135 apresentou trinta carbonos, sendo seis metílicos (14,6, 15,8, 16,0, 19,4, 21,0 e 26,6), onze metilênicos (19,6, 21,4, 25,5, 29,7, 30,6, 32,1, 33,6, 34,1, 37,0, 39,6 e 109,8), cinco metínicos (38,5, 46,9, 49,2, 49,9 e 55,0) e oito não hidrogenados (36,9, 40,7, 42,5, 47,3, 56,4, 150,3, 181,4 e 218,2). Os sinais em 109,8 e 150,3 foram atribuídos a carbonos olefínicos (C-29 e C-20, respectivamente), enquanto o sinal em 181,4 foi atribuído a carbono de um grupo carboxílico (C-28). As informações acima permitiram identificar que a substância 17-m é o ácido betulônico (Figura 41, p. 93). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (LIU et al., 2010; F. C. V. ARAÚJO et al., 2009). 90 Cap. 3 Resultados e Discussão 3.3.6. Substância 18-m A substância 18-m (8 mg), sólido branco, solúvel em clorofórmio e com ponto de fusão na faixa de 187,1-188,0 ºC, foi isolada do fracionamento da fase diclorometânica (p. 37 e 40). A determinação estrutural da substância 18-m foi realizada com base nos espectros de RMN de 1H, 13C e DEPT 135º (Anexo B, p. 190-192), e pela comparação com dados encontrados na literatura (MAHATO e KUNDU, 1994) (Tabela 15, p. 94). Pela análise dos espectros de RMN de 1H e de 13 C foi possível identificar que a substância 18-m possui semelhança estrutural com a substância 16-m. As diferenças observadas foram a presença dos sinais de um hidrogênio em 9,68 e de um carbono em 206,71, característicos de um grupo formílico, e não observou-se o sinal de C-28 (em 180,2) referente a carbono de grupo carboxílico, como exibido para a 16-m. Essas informações permitiram identificar que a substância 18-m possui, assim como a 16-m, um esqueleto de triterpeno pentacíclico do tipo lupano, entretanto contém um grupo formílico na posição 28. O espectro de RMN de 1H exibiu seis singletos em 0,76, 0,83, 0,92, 0,97, 0,98 e 1,70, integrando para três hidrogênios cada, característicos de hidrogênios de grupos metílicos de triterpenos. Exibiu um duplo dubleto em 3,19 (3J ≈ 10,8 e 3J ≈ 5,4 Hz) e um duplo duplo dubleto em 2,87 (3J = 11,4, 3J = 10,8 e 3J = 6 Hz), com integração para um hidrogênio cada, característicos de hidrogênios metínicos H-3 e H19 de triterpenos. Além disso, observou-se um singleto largo em 4,63 e um dubleto em 4,76 (2J = 1,2 Hz), com integração para um hidrogênio cada, característicos de hidrogênios geminais olefínicos. O espectro de RMN de 13 C e em comparação com o de DEPT 135 exibiu trinta carbonos, sendo seis metílicos (14,3, 15,3, 15,9, 16,1, 19,0 e 29,0), onze metilênicos (18,3, 20,8, 25,6, 27,4, 28,8, 29,3, 29,9, 33,2, 34,3, 38,7 e 110,2), sete metínicos (38,75, 40,9, 47,6, 48,1, 50,5, 55,3 e 79,0) e seis não hidrogenados (37,2, 38,9, 40,8, 42,6, 59,3, 149,7). Destes, os sinais em 110,2 e 149,7 foram atribuídos a carbonos olefínicos (C-29 e C-20, respectivamente), enquanto o sinal em79,0 foi atribuído a um carbono oximetínico (C-3). As informações acima permitiram identificar que a substância 18-m é o betulinaldeído (Figura 42, p. 93). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (MAHATO e KUNDU, 1994). 91 Cap. 3 Resultados e Discussão 3.3.7. Substância 19-m A substância 19-m (108 mg), apresentou-se como gel incolor (mesmo após tentativas de cristalização), solúvel em clorofórmio, foi isolada do fracionamento da fase diclorometânica (p. 37 e 40). A determinação estrutural da substância 19-m foi realizada com base nos espectros de RMN de 1H, 13 C e DEPT 135º (Anexo B, p. 193-195) (Tabela 15, p. 94), e pela comparação com dados encontrados na literatura (LIU et al., 2010). Pela análise dos espectros de RMN de 1H e de 13 C foi possível identificar que a substância 19-m possui semelhança estrutural com a substância 16-m. As diferenças observadas foram presença de dois dubletos, um em 3,33 (2J = 11,0 Hz) e outro em 3,78 (2J = 10,5 Hz), com integração para um hidrogênio cada, compatíveis com hidrogênios oximetilênicos, e a presença no espectro de RMN de C de sinais em 60,4 e 13 218,2. Não foram exibidos sinais característicos de H-3 e C-3 oximetínicos, como observado para a 16-m, em 3,19 e 79,2, respectivamente. Além disso, não apresentou sinal de carbono carbonílico para C-28, como apareceu em 180,2 para a 16-m. Essas informações sugeriram que a substância 19-m, assim como a 16-m, possui um esqueleto de triterpeno pentacíclico do tipo lupano, porém contém um grupo oxo na posição 3 e um grupo hidroxílico na posição 28. O espectro de RMN de 1H exibiu seis singletos em 0,93, 0,99, 1,02, 1,06, 1,07 e 1,68, integrando para três hidrogênios cada, característicos de hidrogênios de grupos metílicos de triterpenos. Exibiu um singleto largo em 4,58 e um dubleto em 4,68 (J= 2,0 Hz), com integração para um hidrogênio cada, característicos de hidrogênios geminais olefínicos. O espectro de RMN de 13 C e em comparação com o de DEPT 135 apresentou trinta carbonos, sendo seis metílicos (14,7, 15,8, 15,9, 19,1, 21,0 e 26,6), doze metilênicos (19,7, 21,4, 25,2, 27,0, 29,1, 29,8, 33,5, 34,0, 34,1, 39,6, 60,4 e 109,7), cinco metínicos (37,4, 47,8, 48,7, 49,7 e 54,9) e sete não hidrogenados (36,9, 40,9, 42,8, 47,3, 47,8, 150,4 e 218,2). Destes, os sinais em 109,72 e 150,39 foram atribuídos a carbonos olefínicos (C-29 e C-20, respectivamente), enquanto o sinal em 60,40 foi atribuído a um carbono oximetilênico (C-28). As informações acima permitiram identificar que a substância 19-m é a betulona (Figura 43, p. 93). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (LIU et al., 2010). 92 Cap. 3 Resultados e Discussão 30 CH3 29 20 H2C 18 25 CH3 22 13 11 O 17 26 CH3 28 14 1 9 HO 10 3 7 CH3 27 5 HO H3C CH3 24 23 Figura 40: Estrutura do ácido betulínico (16-m) 30 CH3 29 20 H2C 18 CH3 22 13 11 25 O 17 26 CH3 28 14 1 9 HO 10 3 7 CH3 27 5 O H3C CH3 24 23 Figura 41: Estrutura do ácido betulônico (17-m) 30 CH3 29 20 H2C 18 25 CH3 22 13 11 O 17 26 CH3 28 14 1 9 H 10 3 7 CH3 27 5 HO H3C 24 CH3 23 Figura 42: Estrutura do betulinaldeído (18-m) 30 CH3 29 20 H2C 18 25 CH3 22 13 11 17 26 CH3 28 14 1 9 HO 10 3 7 CH3 27 5 O H3C 24 CH3 23 Figura 43: Estrutura da betulona (19-m) 93 Cap. 3 Resultados e Discussão Tabela 15: Dados de RMN de 13C [125 MHz (13C), CDCl3, (ppm)] das substâncias 16-m, 17-m, 18-m e 19-m e dados da literatura. Nº 16-m 1 17-m 2 18-m 3 19-m 4 1 38,9 38,7 37,0 39,6 38,7 38,7 39,59 39,6 2 27,6 27,4 34,1 34,1 27,4 27,3 34,11 34,1 3 79,2 78,9 218,2 218,1 79,0 78,9 218,18 218,1 4 39,1 38,8 47,3 47,3 38,9 38,8 47,32 47,3 5 55,5 55,3 55,0 55,0 55,3 55,5 54,90 54,9 6 18,5 18,3 19,6 19,6 18,3 18,2 19,66 19,6 7 34,5 34,3 33,6 33,6 34,3 34,3 33,52 33,5 8 40,9 40,7 40,7 40,7 40,8 40,8 40,86 40,9 9 50,7 50,5 49,9 49,9 50,5 50,4 49,74 49,7 10 37,4 37,2 36,9 36,9 37,2 37,1 36,86 36,9 11 21,0 20,8 21,4 21,4 20,8 20,7 21,37 21,3 12 25,7 25,5 25,5 25,5 25,6 25,5 25,22 25,2 13 38,6 38,4 38,5 38,5 38,75 38,7 37,41 37,4 14 42,6 42,2 42,5 42,5 42,6 42,5 42,77 42,8 15 30,7 30,5 30,6 30,5 29,3 29,2 27,04 27,0 16 32,3 32,1 32,1 32,1 28,8 28,8 29,14 29,1 17 56,5 56,3 56,4 56,2 59,3 59,3 47,77 47,8 18 47,1 46,8 49,2 49,2 48,1 48,0 48,69 48,7 19 49,5 49,2 46,9 46,8 47,6 47,5 47,77 47,7 20 150,6 150,3 150,3 150,3 149,7 149,7 150,39 150,4 21 29,9 29,7 29,7 29,7 29,9 29,8 29,75 29,7 22 37,2 37,0 37,0 37,0 33,2 33,2 33,97 33,9 23 28,2 27,9 26,6 26,6 28,0 27,9 26,65 26,6 24 15,5 15,3 21,0 21,0 15,3 15,4 21,03 21,0 25 16,2 16,0 16,0 16,0 15,9 15,9 15,94 15,9 26 16,3 16,1 15,8 15,8 16,1 16,1 15,79 15,8 27 14,9 14,7 14,8 14,6 14,3 14,2 14,68 14,7 28 180,2 180,5 181,4 179,5 206,7 205,6 60,40 60,5 29 109,9 109,6 109,8 109,8 110,2 110,1 109,72 109,7 30 19,6 19,4 19,4 19,4 19,0 19,0 19,09 19,1 1 e 3 - MAHATO e KUNDU, 1994. 2 e 4 - LIU et al., 2010 [125 MHz ( C), CDCl3, (ppm)]. 13 94 Cap. 3 Resultados e Discussão 3.3.8. Substância 20-m A substância 20-m (12 mg), sólido branco, solúvel em clorofórmio e com faixa de fusão de 282,4-283,1 ºC, foi isolada do fracionamento da fase diclorometânica (p. 38 e 42). A determinação estrutural da substância 20-m foi realizada com base na análise dos espectros de RMN de 1H, 13C e DEPT 135º (Anexo B, p. 196-198) (Tabela 16, p. 99), e pela comparação com dados encontrados na literatura (MAHATO e KUNDU, 1994; OLEA e ROQUE, 1990). O espectro de RMN de 1H mostrou sete singletos em 0,77, 0,78, 0,91, 0,92, 0,94, 0,96 e 1,14, integrando para três hidrogênios cada, característicos de hidrogênios de grupos metílicos de triterpenos. Exibiu um tripleto em 5,29 (3J = 3,6 Hz), com integração para um hidrogênio, compatível com um hidrogênio olefínico. Apresentou ainda, dois duplos dubletos, um em 2,81 (H-18, 3J ≈ 13,5 e 3J ≈ 4,2 Hz) e outro em 3,22 (H-3, 3J ≈ 10,5 e 3J ≈ 5,0 Hz) e um singleto largo em 3,65, todos integrando para um hidrogênio. O espectro de RMN de 13 C e em comparação com o de DEPT 135 apresentou trinta carbonos para esta substância, sendo sete metílicos (15,3, 15,5, 17,1, 23,6, 25,9, 28,1 e 33,1), dez metilênicos (18,3, 22,9, 23,4, 27,2, 27,7, 32,4, 32,6, 33,8, 38,4 e 45,9), cinco metínicos (41,0, 47,6, 55,2, 79,0 e 122,6) e oito não hidrogenados (30,7, 37,1, 38,8, 39,3, 41,6,46,5, 143,6 e 182,5). Destes, os sinais em 122,6 e 143,6, foram atribuídos a carbonos olefínicos e o sinal em 182,5, a um carbono de um grupo carboxílico. As informações acima permitiram propor um esqueleto de triterpeno pentacíclico do tipo oleanano (12) com um grupo carboxílico na posição 28. Diante disso, constatou-se que a substância 20-m é o ácido oleanólico (Figura 44). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (MAHATO e KUNDU, 1994; OLEA e ROQUE, 1990). 30 29 CH3 H3C 20 18 26 CH 3 CH3 14 28 OH 10 CH3 7 3 O 17 9 1 22 13 11 25 27 5 HO H3C 24 CH3 23 Figura 44: Estrutura do ácido oleanólico (20-m) 95 Cap. 3 Resultados e Discussão 3.3.9. Substância 21-m A substância 21-m foi obtida do fracionamento da fase diclorometânica em mistura com a substância 20-m. Essa mistura binária (80 mg, sendo aproximadamente 20-m:21-m 2:1 em massa, calculado pelo valor da integral do espectro de RMN de 1H) apresentou aspecto de sólido amorfo branco, solúvel em clorofórmio (p. 38 e 42). A determinação estrutural da substância 21-m foi realizada com base nos espectros de RMN de 1H e 13 C (Anexo B, p. 198-200) (Tabela 16, p. 99), e pela comparação com dados encontrados na literatura (LEMES e FERRI, 2011). Pela análise dos espectros de RMN de 1H e de 13 C foi possível perceber que a substância 21-m possui semelhança estrutural com a substância 20-m, o ácido oleanólico. Apesar de ter sobreposição de alguns sinais, foi possível observar diferenças em relação a multiplicidade dos sinais dos hidrogênios metílicos, devido a presença de dois dubletos em 0,86 (3J = 6,5 Hz) e 0,95 (3J = 6,5 Hz). Essas informações possibilitaram identificar que a substância 21-m possui um grupo metílico ligado a C19 e outro a C-20, enquanto a 20-m possui dois grupos metílicos ligados a C-20. Além disso, observou-se diferenças nos deslocamentos químicos dos carbonos olefínicos, que se apresentaram em 125,87 e 137,95. No espectro de RMN de 1H foram observados ainda, para essa substância, cinco singletos, sendo três em sobreposição com sinais da 20-m em 0,78, 0,94 e 1,0, e dois em 0,79 e 1,09, todos característicos de hidrogênios de grupos metílicos de triterpenos. Além disso, exibiu um tripleto em 5,29 (3J = 3,6 Hz), compatível com um hidrogênio olefínico e um duplo dubleto em 3,22 (H-3, 3J ≈ 10,5 e J ≈ 5,0 Hz), além de um singleto largo em 3,65, todos em sobreposição com os da 3 20-m. O espectro de RMN de C exibiu para essa substância, sinais em 15,5, 13 15,6, 17,0, 17,1, 21,2, 23,0, e 28,1, atribuídos a carbonos metílicos; em 18,3, 23,3, 24,2, 27,2, 28,0, 30,6, 33,0, 36,7, e 38,8, atribuídos a carbonos metilênicos; em 38,6, 39,1, 47,6, 52,7, 55,2, 79,0 e 125,9, atribuídos a carbonos metínicos; e, em 38,8, 39,5, 37,0, 137,9, 42,0,47,9 e 182,0, atribuídos a carbonos não hidrogenados. Esses dados, descritos acima, permitiram propor um esqueleto de triterpeno pentacíclico do tipo ursano (12) com um grupo carboxílico na posição 28. Diante disso, constatou-se que a substância 21-m é o ácido ursólico (Figura 45, p. 97). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para 96 Cap. 3 Resultados e Discussão esta substância (LEMES e FERRI, 2011; MAHATO e KUNDU, 1994; OLEA e ROQUE, 1990). 30 CH3 29 H3C 20 18 25 22 13 11 O 17 26 CH3 CH3 14 9 1 OH 10 7 3 28 CH3 27 5 HO H3C 24 CH3 23 Figura 45: Estrutura do ácido ursólico (21-m) 97 Cap. 3 Resultados e Discussão 3.3.10. Substância 22-m A substância 22-m (62 mg) foi isolada do fracionamento da fase diclorometânica (p. 37 e 41) e apresentou-se como cristais brancos e solúveis em clorofórmio, com ponto de fusão na faixa de 163,3-163,9 ºC. A determinação estrutural da substância 22-m foi realizada com base na análise dos espectros de RMN de 1H, 13 C e DEPT 135º (Anexo B, p. 201-203) (Tabela 16, p. 99), e pela comparação com dados encontrados na literatura (FORGO e KÖVÉR, 2004). O espectro de RMN de 1H mostrou sinais de hidrogênios de grupos metílicos na região de 0,72–1,05. Exibiu dois duplos dubletos em 5,04 (3J = 15,0 e 3J = 8,5 Hz) e em 5,17 (3J = 15,0 e 3J = 8,5 Hz), com integração para um hidrogênio cada, compatíveis com dois hidrogênios olefínicos vicinais acoplados entre si, sendo que a constante de acoplamento de 15,0 Hz indica a configuração trans. Apresentou ainda, dois multipletos em 3,54 e 5,37, com integração para um hidrogênio cada, característicos de H-3 de esteróides e de um hidrogênio olefínico, respectivamente. O espectro de RMN de 13 C e em comparação com o de DEPT 135 apresentou vinte e nove carbonos para esta substância, sendo seis metílicos (12,1, 12,2, 19,0, 19,4, 21,1 e 21,2), dez metilênicos (21,1, 24,4, 25,4, 28,9, 31,7, 31,9, 37,3, 39,7 e 42,3), onze metínicos (31,88, 31,92, 40,5, 50,2, 51,2, 56,0, 56,9, 71,8, 121,7, 129,3 e 138,3) e três não hidrogenados (36,5, 42,2 e 140,8). Destes, os sinais em 121,7, 129,3, 138,3 e 140,8, foram atribuídos a carbonos olefínicos, enquanto o sinal em 71,8, foi atribuído a carbono oximetínico (C-3). Diante das informações acima, constatou-se que a substância 22-m é um esteróide do tipo estigmastano (5,22), o estigmasterol (Figura 46). Os dados de RMN de 1H e 13 C estão de acordo com os encontrados na literatura para esta substância (FORGO e KÖVÉR, 2004). 29 CH3 28 21 H3C 18 19 17 H 13 CH3 24 25 CH3 11 CH3 27 22 20 H3C 26 14 9 1 10 H 3 HO 7 H 5 Figura 46: Estrutura do estigmasterol (22-m) 98 Cap. 3 Resultados e Discussão Tabela 16: Dados de RMN de C [125 MHz (13C), CDCl3, (ppm)] das substâncias 13 20-m, 21-m e 22-m e dados da literatura. Nº 20-m 1 21-m 2 22-m 3 1 38,4 38,5 38,8 38,0 37,3 37,6 2 27,2 27,4 27,2 27,3 31,7 31,9 3 79,0 78,7 79,0 77,6 71,8 72,0 4 38,8 38,7 38,8 39,3 42,3 42,5 5 55,2 55,2 55,2 54,5 140,8 140,8 6 18,3 18,3 18,3 17,6 121,7 121,8 7 32,6 32,6 33,0 32,0 31,9 32,1 8 39,3 39,3 39,5 39,7 31,88 32,2 9 47,7 47,6 47,5 46,6 50,2 50,2 10 37,1 37,0 37,0 38,8 36,5 36,5 11 22,9 23,1 23,3 22,5 21,1 21,2 12 122,6 122,1 125,9 124,5 39,7 40,0 13 143,6 143,4 137,9 137,6 42,2 42,2 14 41,6 41,6 42,0 41,6 56,9 57,1 15 27,7 27,7 28,0 30,0 25,4ª 25,4 16 23,4 23,4 24,2 23,8 28,9 28,9 17 46,5 46,6 47,9 47,6 56,0 56,3 b 18 41,0 41,3 52,7 52,0 12,2 12,2 19 45,9 45,8 39,1 38,4 19,4 19,5 20 30,7 30,6 38,6 38,2 40,5 40,4 21 33,8 33,8 30,6 30,0 21,1 21,4 22 32,4 32,3 36,7 36,0 138,3 138,3 23 28,1 28,1 28,1 27,6 129,3 129,7 24 15,5 15,6 15,5 16,5 51,2 51,5 25 15,3 15,3 15,6 16,4 31,92 32,2 26 17,1 16,8 17,1 16,8 21,2 21,2 27 25,9 26,0 23,0 22,7 19,0 19,2 28 182,5 181,0 182,0 179,2 24,4ª 25,4 b 29 33,1 33,1 16,98 16,8 12,1 12,2 30 23,6 23,6 21,97 20,6 - - 1- MAHATO e KUNDU, 1994. 2- LEMES et al., 2011 [50 MHz ( C), CDCl3/DMSO-d6, (ppm)]. 13 3- FORGO e KÖVÉR, 2004 [50 MHz ( C), CDCl3, (ppm)]. 13 99 Cap. 3 Resultados e Discussão 3.4. Considerações Gerais Este trabalho resultou no isolamento de compostos fenólicos, principalmente flavonoides C-metilados, e de terpenos, sendo a maioria triterpenos. Compostos pertencentes a essas classes são amplamente distribuídos no reino vegetal e existem vários relatos sobre atividades biológicas apresentadas por muitos deles. O interesse econômico nos flavonoides é decorrente de suas diferentes propriedades, tais como, suas contribuições na nutrição e sabor dos alimentos (SIMÕES et al., 1999). Os flavonoides contribuem para a prevenção de importantes patologias relacionadas ao dano oxidativo, que resulta do acúmulo de radicais livres, substâncias que danificam as células. O dano causado pelo estresse oxidativo contribui para o surgimento de muitas doenças, tais como doenças cardiovasculares, câncer e outras (HARBORNE, 1992). Muitos flavonoides, além de outras funções biológicas, são ativos contra alguns microrganismos (WEIDENBÖRNER et al., 1990) e os lipofílicos metilados podem oferecer proteção contra fungos e bactérias, por causa da facilidade que eles têm em penetrar nas membranas plasmáticas (WOLLENWEBER et al., 1981). Além dessas, são atribuídas muitas propriedades farmacológicas aos representantes desta classe, tais como: atividade antioxidante, anti-inflamatória, antialérgica, anti-ulcerogênica, antivirais, antitumoral, regulador de atividade hormonal, inibidora de enzimas, anti-hepatotóxica, antiespasmolítica, diurética, antifúngica, bactericida, antiparasitária e analgésica (AMOR et al., 2007; COWAN, 1999; DAO et al., 2010; FOTIE, 2008; HARBORNE e WILLIANS, 2000; PETERSON e DWYER, 1998), entre outras (FERREIRA et al., 2006; LUNARDI et al., 2003; LIU et al., 2003; OLIVELLA et al., 2001; PIÑERO et al., 2006; RICE-EVANS e PACKER, 2003; SALEM e WERBOVETZ, 2006; SORIANO et al., 2004; TASDEMIR et al., 2006; YOKOMIZO e MORIAKI, 2006). Algumas chalconas e flavanonas são citadas na literatura por apresentarem alta atividade contra os protozoários Trypanosoma cruzi (doença de Chagas), espécies de Leishmania (leishmaniose) e Plasmodium falciparum (malaria) (FOTIE, 2008; HERMOSO et al., 2003; LUNARDI et al., 2003; LIU et al., 2003; PIÑERO et al., 2006; SALEM e WERBOVETZ, 2006; SIANNE e HEERDEN, 2002; TASDEMIR et al., 2006) . Além disso, há relato da atividade anti-AIDS de chalconas (WU et al., 2003). Uma grande quantidade de compostos derivados do floroglucinol também apresentaram atividades biológicas, tais como: antiviral, antibacteriana, antifúngica, antiparasitária, entre outras. Além disso, também são utilizados no tratamento de 100 Cap. 3 Resultados e Discussão doenças intestinais, biliares, degenerativas e contra bulimia (SINGH e BHARATE, 2006). Em relação aos terpenos, o número desses metabólitos isolados é muito superior a qualquer outro grupo de produtos naturais. Sua concentração é geralmente elevada nas estruturas reprodutivas das plantas e folhagens durante e imediatamente após a floração. São também importantes componentes de resinas vegetais. Dentre as atividades exercidas nas plantas, destaca-se o funcionamento como infoquímicos e como repelentes ou atraentes, uma vez que são responsáveis pelo aroma típico de muitas plantas (óleos essenciais que são ricos em monoterpenos). Por outro lado, altas concentrações dessas substâncias podem ser tóxicas e são, portanto, uma arma importante contra herbívoros e patógenos (THEIS e LERDAU, 2003; CROWELL, 1997). Muitas propriedades biológicas são atribuídas aos terpenos, tais como: anticâncer, antiviral, antibacteriana, antifúngica, antiparasitária, antialérgica, antiplasmódica, anti-hiperglicêmica, anti-inflamatória e imunomodulatória (CHANBACAB e PEÑA-RODRIGUEZ, 2001; COWAN, 1999; LIU, 2011; PADUCH et al., 2007; SALEM e WERBOVETZ, 2006; THEIS e LERDAU, 2003). Alguns também apresentaram atividade sobre o sistema nervoso central, destacando-se as atividades sedativa, ansiolítica, antinociceptiva, anticonvulsivante e pró-convulsivante (PASSOS et al., 2009). Além disso, foi relatado que alguns destes compostos podem ser utilizados como inseticidas naturais (VIEGAS JR., 2003). 101 4. CONCLUSÃO Adicionalmente ao estudo químico das folhas de Myrcia hiemalis, iniciado em 2005, foram isolados e identificados, do fracionamento da fase diclorometânica, sete flavonoides C-metilados (uma isoflavona, três flavanonas e três chalconas), além de dois terpenos (um sesquiterpeno e um triterpeno) e um composto fenólico, enquanto que da fase hexânica, foram isolados um diterpeno e um composto fenólico. Do estudo químico das folhas de M. myrtifolia foram isolados, do fracionamento da fase diclorometânica, um flavonóide, dois derivados do floroglucinol, seis triterpenos (quatro do tipo lupano, um oleanano e um ursano) e um esteróide. Os metabólitos isolados corroboram com a quimiotaxonomia da família Myrtaceae. Das substâncias isoladas de M. hiemalis são inéditas a 2’,4’-di-hidróxi-3’,5’dimetil-4,6’-dimetoxichalcona (5-h), a 2’,6’-di-hidróxi-3’,5’-dimetil-4’-metoxichalcona (7-h) e o 2,3,21-tri-hidroxitaraxastan-28,20-olídeo (9-h). Este estudo contribuiu para a busca de novos compostos produzidos por espécies vegetais e para o conhecimento químico do gênero Myrcia (Myrtaceae), pois, incluindo o trabalho de mestrado com M. hiemalis, estes são os únicos relatos sobre os constituintes químicos não-voláteis das espécies M. myrtifolia e M. hiemalis, o que também motiva a sua continuidade. Além disso, tendo em vista os inúmeros relatos existentes na literatura sobre atividades biológicas de terpenos e flavonoides, os constituintes químicos isolados neste estudo tornam-se promissores para futuros testes biológicos. 5. REFERÊNCIAS ADEROGBA, M. A.; OGUNDAINI, A. O.; ELOFF, J. N. Isolation of two flavonoids from Bauhinia monandra leaves and their antioxidative effects. African Journal of Traditional, Complementary and Alternative Medicines, 2006, 03 (4), 59-65. AMARAL, A.C.; KUSTER, R.M.; BESSA, W. S.; BARNES, R. A.; KAPLAN, M.A.C.; WESSJOHANN, L. A. Flavonoids and other phenolics from leaves of two Marlierea species (Myrtaceae). Biochemical Systematics and Ecology, 2001, 29 (6), 653-654. AMOR, E.C.; VILLASEÑOR, I.M.; ANTEMANO, R.; PERVEEN, Z.; CONCEPCION, G.P. Cytotoxic C-methylated chalcones from Syzygium samarangense. Pharmaceutical Biology, 2007, 45 (10), 777-783. ARAÚJO, F. C. V.; MARQUES, F. G.; DA SILVA, C. C.; SANTIN, S. M. O. Terpenos isolados de Coussearea platyphylla Müll. Arg (Rubiaceae). Química Nova, 2009, 32 (7), 1760-1763. ARAÚJO, R. M.; LIMA, M. A. S.; SILVEIRA, E. R. Pterocarpans and a Novel Flavanone from Harpalyce brasiliana Roots. Journal Of The Brazilian Chemical Society, 2009, 20 (5), 935-938. AYRAS, P.; WIDEN, C. J. NMR Spectroscopy of Naturally Occurring Phloroglucinol Derivatives. Part. I: The Carbon-13 Spectral Properties of Some Model Compounds. Planta Medica, 1978a, 34, 144-152. AYRAS, P.; WIDEN, C. J. NMR Spectroscopy of Naturally Ocurring Phloroglucinol Derivatives. Part II: Use of the additivity of substituent parameters in carbon-13 NMR spectral analysis of mono- and dimethyl ethers of methyl- and acyl- substituted phloroglucinols. Finnish Chemical Letters, 1978b, 8, 264-266. BARREIRO, E. J.; FRAGA, C. A. M. Química medicinal: as bases moleculares da ação dos fármacos. 1ª ed. Artmed: Porto Alegre, 2001. Referências BARROSO, G. M.; GUIMARÃES, E. F.; ICHASO, C. L. F.; COSTA, C. G.; PEIXOTO, A. L.; LIMA, H. C. Sistemática de angiospermas do Brasil, Vol 2, 1ª ed., Viçosa, Universidade Federal de Viçosa – Imprensa Universitária, 1991. BOWYER, R. C.; JEFFERIES, P.R. New Sources and Synthesis of Torquatone. Australian Journal of Chemistry, 1962, 15 (1), 145-149. BRAZ-FILHO, R. Contribuição da Fitoquímica para o Desenvolvimento de um País Emergente. Química Nova, 2010, 33 (1), 229-239. BRITTO, I. C.; DE QUEIROZ, L. P.; GUEDES, M.L.S.; DE OLIVEIRA, N.C.; DA SILVA, L.B. Flora fanerogâmica das dunas e lagoas do Abaeté, Salvador, Bahia. Sitientibus, 1993, 11, 31-46. CARVALHO, M. G.; VELANDIA, J. R.; OLIVEIRA, L. F.; BEZERRA, F. B. Triterpenos Isolados de Eschweilera longipes Miers (Lecythidaceae). Química Nova, 1998, 21 (6), 740-743. CERQUEIRA, M. D. Dissertação de Mestrado (Química Orgânica – UFBA): Estudo Fitoquímico de Myrcia rotundifolia (Berg.) Legrand. (Myrtaceae). Universidade Federal da Bahia, 2002. CHAN-BACAB, M.J.; PEÑA-RODRÍGUEZ, L.M. Plant natural products with leishmanicidal activity. Natural Products Reports, 2001, 18, 674–688. CHIN, Y.W.; BALUNAS, M.J.; CHAI, H.B.; KINGHORN, A.D. Drug Discovery From Natural Sources. The AAPS Journal, 2006, 8 (2), E239-E253. COWAN, M.M. Plant products as antimicrobial agents. Clinical Microbiology Reviews, 1999, 12 (4), 564-582. CRONQUIST, A. An integrated system of classification of flowering plants, Columbia University, New York, 1981. CROWELL, P. L. Monoterpenes in breast cancer chemoprevention. Breast Cancer Research and Treatment, 1997, 46 (2-3), 191-197. 104 Referências CRUZ, A.V.M.; KAPLAN, M.A.C. Estudo Comparativo do Perfil Químico e do Uso Popular de Espécies das Famílias Myrtaceae e Melastomataceae. XXVI Reunião Anual sobre Evolução, Sistemática e Ecologia Micromoleculares, Instituto de Química, Universidade Federal Fluminense, 2004. DAO, T. T.; TUNG, B. T.; NGUYEN, P. H.; THUONG, P. T.; YOO, S. S.; KIM, E. H.; KIM, S. K.; OH, W. K. C-Methylated Flavonoids from Cleistocalyx operculatus and Their Inhibitory Effects on Novel Influenza A (H1N1) Neuraminidase. Journal of Natural Products, 2010, 73, 1636-1642. DAS, M. C. e MAHATO, S. B. Triterpenoid sapogenols from the leaves of Careya arborea: Structure of careyagenolide. Phytochemistry, 1982, 21, 2069–2073. DASTLIK, K. A.; GHISALBERTI, E. L.; JEFFERIES, P. R. Phloroacylphenones in the Essential Oil of Thryptomene saxicola. Phytochemistry, 1989, 28, 12, 3543 – 3544. DEWICK, P. M. Medicinal natural products: a biosynthetic approach. 2nd. School of Pharmaceutical Sciences. University of Nottingham, UK. Jhon Wiley & Sons, LTD, 2001. FACUNDO, V.A. e BRAZ-FILHO, R. C-methylated flavonoids from the roots of Piper carniconnectivum C.DC. Biochemical Systematics and Ecology, 2004, 32, 1215-1217. FEHLBERG, I. Dissertação de Mestrado (Química Orgânica – UFBA): Estudo Fitoquímico e Avaliação das Atividades Antimicrobianas e Antiparasitárias das Substâncias Isoladas de Myrcia guianensis (Myrtaceae). Universidade Federal da Bahia, 2006. FERREIRA, A.C.F.; NETO, J.C.; da SILVA, A.C.M.; KUSTER, R.M.; CARVALHO, D.P. Inhibition of Thyroyd Peroxidase by Myrcia uniflora Flavonoids. Chemical Research in Toxicology, 2006, 19, 351-355. FORGO e KÖVÉR, K. E. Gradient enhanced selective experiments in the 1H NMR chemical shift assignment of the skeleton and side-chain resonances of stigmasterol, a phytosterol derivative. Steroids, 2004, 69 (1), 43-50. FURUYA, T.; ORIHARA, Y.; HAYASHI, C. Triterpenoids from Eucalyptus perriniana cultured cells, Phytochemistry, 1987, 26 (3), 715-719. 105 Referências FOTIE, J. The Antiprotozoan Potential of Flavonoids. Pharmacognosy Reviews, 2008, 2 (3), 6-19. GIULIETTI, A. M., BOCAGE NETA, A. L., CASTRO, A. A. J. F. Diagnóstico da vegetação nativa do bioma da caatinga. In: Biodiversidade da Caatinga: áreas e ações prioritárias para a conservação. Brasília: MMA-UFPE, 2004. p.47-90. GIULIETTI, A.M.; HARLEY, R.M.; QUEIROZ, L.P.; BARBOSA, M.R.V.; BOCAGE NETA, A.L.; FIGUEIREDO, M.A. Plantas endêmicas da caatinga. 2002. p.103-115 In: vegetação e flora das caatingas (SAMPAIO, E.V.S.B.; GIULIETTI, A.M.; VIRGÍNIO, J.; GAMARRA-ROJAS, C.F.L.). ed. APNE / CNIP, Recife, PE. GOTTLIEB, O. R.; da SILVA, M. L.; MAIA, J.G.S. Eucalyptin from Eugenia and Myrcia species. Phytochemistry, 1972, 11 (3), 1185. GRESSLER, E.; PIZO, M. A.; MORELLATO, P. C. Polinização e dispersão de sementes em Myrtaceae do Brasil. Revista Brasileira de Botânica, 2006, 29 (4), 509-530. HÄBERLEIN, H.; TSCHIERSCH, K. On the occurrence of methylated and methoxylated flavonoids in Leptospermum scoparium. Biochemical Systematics and Ecology, 1998, 26 (1), 97-103. HARBORNE, J. B. The Flavonoids: Advances in Research since 1986. Chapman and Hall Ltd. New York, USA, 1992. HARBORNE, J. B.; MABRY, T. J. The Flavonoids: Advances in Research. Chapman and Hall Ltd. New York, USA, 1982. HARBORNE, J.B.; WILLIANS, C.A. Advances in flavonoid research since 1992. Phytochemistry, 2000, 52, 481-504. HARVEY, A.L. Natural products in drug discovery. Drug Discovery Today, 2008, 13 (19/20), 894-900. HEIKKI, P.; WIDEN, C.J. Glass capillary gas chromatographic separation of naturally occurring phloroglucinols. I. Investigation of some monocyclic acylphloroglucinol derivatives. Journal of Chromatography, 1979, 168, 1, 246-249. 106 Referências HERMOSO, A.; JIMÉNEZ, I. A.; MAMANI, Z. A.; BAZZOCCHI, I. L.; PIÑERO, J. E.; RAVELO, A. G.; VALLADARES, B. Antileishmanial Activities of Dihydrochalcones from Piper elongatum and Synthetic Related Compounds. Structural Requirements for Activity. Bioorganic & Medicinal Chemistry, 2003, 11, 3975-3980. INSTITUTO NACIONAL DE PESQUISAS ESPACIAIS (INPE). PRODES 2011 – Estimativa da Taxa de Desmatamento da Amazônia em 2010-2011. 2011. Disponível em: <http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=182&idConte udo=10775> JOLY, A. B. Introdução à taxonomia vegetal, São Paulo, CEN, 1966. KALINOWSKA, M., ŚWISLOCKA, R., LEWANDOWSKI, W. The spectroscopic (FT-IR, FT-Raman and 1H, 13 C NMR) and theoretical studies of cinnamic acid and alkali metal cinnamates. Journal of Molecular Structure, 2007, 834, 572-580. LEE, K.H. Current Developments in the Discovery an Design of New Drug Candidates from Plant Natural Products Leads. Journal of Natural Products, 2004, 67, 273-283. LEE, C. Ursane triterpenoids from leaves of Melaleuca leucadendron. Phytochemistry, 49 (4), 1119-1122, 1998. LEE, M.; NISHIMOTO, S.; YANG, L.; YEN, K.; HATANO, T.; YOSHIDA, Y.; OKUDA, T. Two macrocyclic hydrolysable tannin dimmers from Eugenia uniflora. Phytochemistry, 1997, 44 (7), 1343-1349. LEMES, G. F.; FERRI, P. H. Constituintes Químicos de Hyptidendron canum (Pohl ex Benth.) R. Harley (Lamiaceae). Química Nova, 2011, 34 (1), 39-42. LIU, M.; WILAIRAT, P.; CROFT, S. L.; TAN, A. L.; GO, M. Structure-Activity Relationships of Antileishmanial and Antimalarial Chalcones. Bioorganic & Medicinal Chemistry, 2003, 11, 2729-2738. LIU, W. J. H. Traditional Herbal Medicine Research Methods: Identification, Analysis, Bioassay, and Pharmaceutical and Clinical Studies. 1st. e-book: John Wiley & Sons, 2011. 448p. 107 Referências LIU, Z.; JIANG, W.; DENG, Z. W.; LIN, W. H. Assignment of the absolute stereochemistry of an unusual diterpenoid from the mangrove plant Excoecaria agallocha L. Journal of Chinese Pharmaceutical Sciences, 2010, 19, 387-392. LUNARDI, F.; GUZELA, M.; RODRIGUES, A.T.; CORREA, R.; EGER-MANGRICH, I.; STEINDEL, M.; GRISARD, E. C.; ASSREUDY, J.; CALIXTO, J. B.; SANTOS, A.R.S. Trypanocidal and Leishmanicidal Properties os Substiution-Containing Chalcones. Antimicrobial. Agents and Chemotherapy, 2003, 47 (4), 1449-1451. MAHATO, S. B. e KUNDO, A. P. Review: 13 C NMR Spectra of Pentacyclic Triterpenoids – A Compilation and Some Salient Features. Phytochemistry, 1994, 37 (6), 1517-1575. MANDAL, D.; PANDA, N.; KUMAR, S.; BANERJEE, S.; MANDAL, N.B.; SAHU, N.P. A triterpenoid saponin possessing antileishmanial activity from the leaves of Careya arborea. Phytochemistry, 2006, 67, 183-190. MATSUDA, H.; NISHIDA, N.; YOSHIKAWA, M. Antidiabetic principles of natural medicines. V. Aldose reductase inhibitors from Myrcia multiflora DC. (2): Strucutures of myrciacitrins III, IV and V. Chemical Pharmaceutical Bulletin, 2002, 50 (3), 429-431. MATSUNO, M. e URANO, S. 13 C NMR spectra of tocopherols and 2,2- dimethylchromanols. Tetrahedron, 1976, 32, 229-231. MAYER, R. Flavonoids from Leptospermum scoparium. Phytochemistry, 1990, 29 (4), 1340-1342. McCHESNEY, J.D.; VENKATARAMAN, S.K.; HENRI, J.T. Plant natural products: Back to the future or into extinction?. Phytochemistry, 2007, 68, 2015-2022. MITSCHER, L. A.; WU, W.N.; BEAL, J. L. Isolation and Structural Characterization of 5O-methyldemethoxymatteucinol from Eugenia javanica. Lloydia, 1973, 36 (4), 422-425. MINISTÉRIO DO MEIO AMBIENTE (MMA). Monitoramento dos Biomas Brasileiros – Caatinga. 2011a. Disponível em: <http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=72&idConteu do=7422&idMenu=7508> 108 Referências MINISTÉRIO DO MEIO AMBIENTE (MMA). Monitoramento dos Biomas Brasileiros – Cerrado. 2011b. Disponível em: <http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=72&idConteu do=7422&idMenu=7508> MINISTÉRIO DO MEIO AMBIENTE (MMA). Monitoramento dos Biomas Brasileiros – Mata Atlântica. 2010a. Disponível em: <http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=72&idConteu do=7422&idMenu=7508> MINISTÉRIO DO MEIO AMBIENTE (MMA). Monitoramento dos Biomas Brasileiros – Bioma Pampa. 2010b. Disponível em: <http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=72&idConteu do=7422&idMenu=7508> MINISTÉRIO DO MEIO AMBIENTE (MMA). Monitoramento dos Biomas Brasileiros – Bioma Pantanal. 2010c. Disponível em: <http://www.mma.gov.br/sitio/index.php?ido=conteudo.monta&idEstrutura=72&idConteui d=7422&idMenu=7508> MINISTÉRIO DO MEIO AMBIENTE (MMA). Panorama da conservação dos ecossistemas costeiros e marinhos no Brasil - Gerência de Biodiversidade Aquática e Recursos Pesqueiros. 2012. MOHAMMED, A.M.A.; COOMBES, P.H.; CROUCH, N.R.; MULHOLLAND, D.A. Nonvolatile isolates of two Heteropyxis species: A first chemotaxonomic assessment of subfamily Psiloxyloideae (Myrtaceae). Biochemical Systematics and Ecology, 2009, 37, 241-243. MUSTAFA, K. A.; PERRY, N. B.; WEAVERS, R. T. 2-Hydroxyflavanones from Leptospermum polygalifolium subsp. polygalifolium Equilibrating sets of hemiacetal isomers. Phytochemistry, 2003, 64, 1285-1293. MUSTAFA, K. A.; PERRY, N. B.; WEAVERS, R. T. Lipophilic C-methylflavonoids with no B-ring oxygenation in Metrosideros species (Myrtaceae). Biochemical Systematics and Ecology, 2005, 33, 1049-1059. 109 Referências NEWMAN, D.J. Natural Products as Leads to Potential Drugs: An Old Process or the New Hope for Drug?. Journal of Medicinal Chemistry, 2008, 51, 2589-2599. OLEA, R.S.G.; ROQUE, N.F. Análise de Misturas de Triterpenos por RMN de 13 C. Química Nova, 1990, 13 (4), 278-281. OLIVELLA, M.S.; ZARELLI, V. E. P.; PAPPANO, N.B.; DEBATTISTA, N.B. A comparative study of bacteriostatic activity of synthetic hydroxylated flavonoids. Brazilian Journal of Microbiology, 2001, 32, 229-232. PADUCH, R.; KANDEFER-SZERSZEN, M.; TRYTEK, M.; FIEDUREK, J. Review: Terpenes: substances useful in human healthcare. Archivum Immunologiae et Therapiae Experimentalis, 2007, 55, 315-327. PASSOS, C. S.; ARBO, M. D.; RATES, S. M. K.; VON POSER, G. L. Terpenoides com atividade sobre o Sistema Nervoso Central (SNC). Revista Brasileira de Farmacognosia, 2009, 19 (1A), 140-149. PETERSON, J.; DWYER, J. Flavonoids: Dietary occurrence and biochemical activity. Nutrition Research, 1998, 18 (12), 1995-2018. PIANARO, A. Dissertação de Mestrado (Química Orgânica – UNICAMP): ECOLOGIA QUÍMICA DE ABELHAS BRASILEIRAS: Melipona rufiventris, Melipona scutellaris, Plebeia droryana, Nannotrigona testaceicornis, Tetragonisca angustula e Centris trigonoides. Universidade Estadual de Campinas, 2007. PIÑERO, J.; TEMPORAL, R. M.; SILVA-GONÇALVES, A. J.; JIMÉNEZ, I. A.; BAZZOCCHI, I. L.; OLIVA, A.; PERERA, A.; LEON, L. L.; VALLADARES, B. New administration model of trans-chalcone biodegradable polymers for the treatment of experimental leishmaniais. Acta Tropica, 2006, 98, 59-65. QUEIROZ, E. P. Levantamento florístico e georreferenciamento das espécies com potencial econômico e ecológico em restinga de Mata de São João, Bahia, Brasil. Biotemas, 2007, 20 (4), 41-47. RAO, J.R.; RAO, R.S. Syzalterin, a new 6,8-di-C-methylflavone from Syzygium alternifolium leaves. Indian Journal of Chemistry, 1991, 30 B, 60-67. 110 Referências RICE-EVANS, C. A., and PACKER, L. Flavonoids in Health and Disease. Marcel Dekker, New York, 2003. ROBERTSON, A. e SANDROCK, W. F. Constituents of Filix Mas. Part I. Aspidinol. Journal of the Chemical Society, 1933, 819-823. SALEM, M. M.; WERBOVETZ, K. A. Natural Products from Plants as Drugs Candidates and Lead Compounds Against Leishmaniasis and Trypanosomiasis. Current Medicinal Chemistry, 2006, 13, 2571-2598. SANTOS, G.G.; ALVES, J.C.N.; RODILLA, J.M.L.; DUARTE, A.P.; LITHGOW, A.M.; URONES, J.G. Terpenoids and other constituents of Eucalyptus globulus. Phytochemistry, 1997, 44 (7), 1309-1312. SARKER, S.D.; BARTHOLOMEW, B.; NASH, R.J.; SIMMONDS, M.S.J. Sideroxylin and 8-demethylsideroxylin from Eucayiptus saligna (Myrtaceae). Biochemical Systematics and Ecology, 2001, 29 (7), 759-762. SCHRÖDER, J.; RAIBER, S.; BERGER, T.; SCHMIDT, J.; SOARES-SELLO, A.M.; BARDSHIRI, E.; STRACK, D.; SIMPSON, T.J.; VEIT, M.; SCHRÖDER, G. Plant Polyketide Synthases: A Chalcone Synthase-Type Enzime Wich Performs a Condensation Reaction with Methylmalonyl-CoA in the Biosynthesis of C-Methylated Chalcones. Biochemistry, 1998, 37, 8417-8425. SCHWIKKARD, S.; VAN HEERDEN, F. R. Antimalarial activity of plant metabolites. Natural Products Reports, 2002, 19, 675-692. SIDDIQUI, B.S.; SULTANA, I.; BEGUM, S. Triterpenoidal constituents from Eucalyptus camaldulensis var. obtusa leaves. Phytochemistry, 2000, 54 (8), 861-865. SILVA, P. D. Dissertação de Mestrado (Química Orgânica – UFBA): Estudo Fitoquímico e Avaliação das Atividades Antimicrobianas e Antiparasitárias dos Flavonóides Isolados de Myrcia hiemalis (Myrtaceae). Universidade Federal da Bahia, 2007. SILVA, S. M. Diagnóstico das restingas no Brasil. In: Avaliação e ações prioritárias para a conservação da zona costeira e marinha [Internet]. São Paulo: Banco de Dados Tropical. 1999. Disponível em: <www.anp.gov.br/brasil-rounds/round7/round7> 111 Referências SILVERSTEIN, R.M.; WEBSTER, F.X. Identificação Espectrométrica de Compostos Orgânicos – 6ª Edição. São Paulo, Editora: LTC, 2000. SIM ES, C. M. O. MARIO , A. M . , SC: Editora da UFSC, 2003. SIMÕES, C.M.O.; SCHENKEL, E.P.; GOSMAN, G.; MELLO, J.C.P.; MENTZ, L.A.; PETROVCK, P.R. Farmacognosia: da Planta ao Medicamento 2ª ed. Porto Alegre/Florianópolis: UFRGS/UFSC, 1999. SINGH, I. P.; BHARATE, S .B. Review: Phloroglucinol compounds of natural origin. Natural Products Reports, 2006, 23, 558-591. SLOWING, K.; SÖLLHUBER, M.; CARRETERO, E.; VILLAR, A. Flavonoid glycosides from Eugenia jambos. Phytochemistry, 1994, 37 (1), 225-258. SORIANO, M.; BONILLA, P.; ARROYO, J.; PEREYRA, S. Actividad Cicatrizante Tópica de los Metabolitos Secundarios en el Extracto Etanólico de Hojas de Senecio culcitoides Weed. Folia Dermatológica Peruana, 15 (3), 155-159, 1029-1733, sep./dic. 2004. SOUZA, V.C.; LORENZI, H. Botânica Sistemática: Guia ilustrado para identificação das famílias de Angiospermas da flora brasileira, baseado em APG II. 2ª Ed. Nova Odessa, Instituto Plantarum, 2008. SPOELSTRA, D.B. Die Aetherischen Öle Von Baeckea Frutescens L. und von Dalbergia Parviflora Roxb. Reweil des Travaux Chimiques des Pays-Bas, 1931, 50 (5), 433-440. SRIVASTAVA, R.; SHAW, A. K. and KULSHRESHTHA, D. K. Triterpenoids and chalcone from Syzygium samarangense. Phytochemistry, 1995, 38 (3), 687-689. TANAKA, T.; ORII, Y.; NONAKA, G.; NISHIOKA, I.; KUONO, I. Syzyginins A and B, two ellagitannins from Syzygium aromaticum. Phytochemistry, 1996, 43 (6), 1345-1348. TASDEMIR, D.; KAISER, M.; BRUN, R.; YARDLEY, V.; SCHMIDT, T.J.; TOSUN, F.; RÜEDI, P. Antitrypanosomal and Antileishmanial Activities of Flavonoids and Their Analogues: In Vitro, In Vivo, Structure-Activity Relationship, and Quantitative Structure112 Referências Activity Relationship Studies. Antimicrobial Agents and Chemotherapy, 2006, 50 (4), 1352-1364. THEIS, N.; LERDAU, M. The evolution of function in plant secondary metabolites. International Journal of Plant Sciences, 2003, 164 (3), S93-S102. VIANA, B. F.; DA SILVA, F. O.; KLEINERT, A. M. P. A flora apícola de uma área restrita de dunas litorâneas, Abaeté, Salvador, Bahia. Revista Brasileira de Botânica, 2006, 29 (1), 3-25. VIEGAS JR., C. Terpenos com atividade inseticida: uma alternativa para o controle químico de insetos. Química Nova, 2003, 26 (3), 390-400. VIEGAS JR, C.; BOLZANI, V.S.; BARREIRO, E.J. Os Produtos Naturais e a Química Medicinal Moderna. Química Nova, 2006, 29 (2), 326-337. VIEIRA, T.R.; BARBOSA, L.C.A.; MALTHA, C.R.A.; PAULA, V.F.; NASCIMENTO, E.A. Constituintes Químicos de Melaleuca alternifólia (Myrtaceae). Química Nova, 2004, 27 (4), 536-539. YANG, L.; LEE, C.; YEN, K. Induction of apoptosis by hydrolizable tannins from Eugenia jambos L. on human leukemia cells. Cancer Letters, 2000, 157 (1), 65-75. YE, C.; LU, Y.; WEI, D. Flavonoids from Cleistocalix operculatus. Phytochemistry, 2004, 65, 445-447. YOKOMIZO, A.; MORIWAKI, M. Effects of Uptake of Flavonoids on Oxidative Stress Induced by Hidrogen Peroxide in Human Intestinal Caco-2 Cells. Bioscience, Biotechnology and Biochemistry, 2006, 70, 1317-1324. YOSHIDA, T.; MARUYAMA, T.; NITTA, T.O. An hydrolizable tannin and accompanying polyphenols from Melaleuca leucadendron. Phytochemistry, 1996, 42 (4), 1171-1173. YOSHIKAWA, M.; SHIMADA, H.; NISHIDA, N.; TOGUSHIDA, I.; MATSUDA, H.; YAMAHARA, J. Antidiabetic principles of natural medicines. II. Aldose reductase and alpha-glucosidase inhibitors from Braziliam natura medicine, the leaves of Myrcia 113 Referências multiflora DC. (Myrtaceae): Structures of myrciacitrins I and II and myrciaphenones A and B. Chemical & Pharmaceutical Bulletin, 1998, 46 (1), 113-119. WANG, H.; FUGIMOTO, Y. Triterpene esters from Eucalyptus tereticornis. Phytochemistry, 1993, 33 (1), 151-153. WANG, H.X.; LIU, C.M.; LIU, Q.; GAO, K. Three types of sesquiterpenes from rhizomes of Atractylodes lancea. Phytochemistry, 2008, 69, 2088-2094. WEIDENBÖRNER, M.; HINDORF, H.; CHANDRA, J.H.; TSOTSONOS, P. Antifungal activity of flavonoids against storage fungi of the genus Aspergillus. Phytochemistry, 1990, 29 (4), 1103-1105. WESTON, R.J. Composition of essential oil from leaves of Eucalyptus delegatensis. Phytochemistry, 1984, 23 (9), 1943-1945. WILSON, .G. O’BRIEN, M.M.; GADEK, P.A.; QUINN, C.J.. Myrtaceae revisited: a reassessmente of infrafamilial groups. American Journal of Botany, 2001, 88, 20132025. WOLLENWEBER, E.; BENNET, J.P.; GOMPERTS,B.D. Inhibitory effects of natural flavonoids on secretion from mast cells and neutrophils. Arzneimittelforschung, 1981, 31 (3), 433-437. WOLLENWEBER, E.; WEHDE, R.; DÖRR, M.; LANG, G.; STEVENS, J.F. C-methyl flavonoids from the leaf waxes of some Myrtaceae. Phytochemistry, 2000, 55 (8), 965970. WU, J.; WANG, X.; YI, Y.; LEE, K. Anti-AIDS Agents 54. Potent Anti-HIV Chalcone and Flavonoids from Genus Desmos. Bioorganic & Medicinal Chemistry Letters, 2003, 13, 1813-1815. WU-NAN, W. e HUANG, C.H. Structural characterization of flavonols and flavanones in nanogram quantities by API-ionspray tandem mass spectrometry. Chinese Pharmaceutical Journal, 2005, 57 (1), 7-17. 114 ANEXOS ANEXO A: Espectros de RMN dos Constituintes Químicos Isolados das folhas de M. hiemalis A.1. Substância 1-h E.1: Espectro de RMN de H da substância 1-h [500 MHz, CDCl3, (ppm)] 1 E.2: Ampliação de 2,1-3,9 do espectro de RMN de H da substância 1-h [500 MHz, CDCl3, (ppm)] 1 Espectros de RMN E.3: Ampliações do espectro de RMN de H da substância 1-h [500 MHz, CDCl3, (ppm)] 1 E.4: Espectro de RMN de C da substância 1-h [125 MHz, CDCl3, (ppm)] 13 E.5: Espectro de gHSQCTOCSY da substância 1-h 116 Espectros de RMN E.6: Ampliação de 0,0-4,5 ( H) do espectro de gHSQCTOCSY da substância 1-h 1 E.7: Ampliação de 7,2-7,92 ( H) do espectro de gHSQCTOCSY da substância 1-h 1 117 Espectros de RMN E.8: Espectro de gHMBC da substância 1-h E.9: Ampliação de 100-180 ( C) do espectro de gHMBC da substância 1-h 13 118 Espectros de RMN E.10: Ampliação de 145-166 ( C) do espectro de gHMBC da substância 1-h 13 E.11: Ampliação de 7,28-7,96 ( H) do espectro de gHMBC da substância 1-h 1 119 Espectros de RMN E.12: Ampliação de 2,0-2,47 ( H) do espectro de gHMBC da substância 1-h 1 A.2. Substância 2-h E.13: Espectro de RMN de H da substância 2-h [500 MHz, CDCl3, (ppm)] 1 120 Espectros de RMN E.14: Ampliações do espectro de RMN de H da substância 2-h [500 MHz, CDCl3, (ppm)] 1 E.15: Espectro de RMN de C da substância 2-h [125 MHz, CDCl3, (ppm)] 13 E.16: Espectro de gHMQC da substância 2-h 121 Espectros de RMN E.17: Espectro de gHMBC da substância 2-h E.18: Ampliação de 7,0-12,5 ( H) do espectro de gHMBC da substância 2-h 1 122 Espectros de RMN E.19: Ampliação de 1,78-2,44 ( H) do espectro de gHMBC da substância 2-h 1 A.3. Substância 3-h E.20: Espectro de RMN de H da substância 3-h [500 MHz, CDCl3, (ppm)] 1 123 Espectros de RMN E.21: Ampliações do espectro de RMN de H da substância 3-h [500 MHz, CDCl3, (ppm)] 1 E.22: Espectro de RMN de C da substância 3-h [125 MHz, CDCl3, (ppm)] 13 E.23: Espectro de gHMQC da substância 3-h 124 Espectros de RMN E.24: Ampliação de 1,7-3,9 ( H) do espectro de gHMBC da substância 3-h 1 E.25: Ampliação de 2,0-3,8 ( H) do espectro de gHMBC da substância 3-h 1 125 Espectros de RMN A.4. Substância 4-h E.26: Espectro de RMN de H da substância 4-h [500 MHz, CDCl3, (ppm)] 1 E.27: Ampliação do espectro de RMN de H da substância 4-h [500 MHz, CDCl3, (ppm)] 1 126 Espectros de RMN E.28: Espectro de RMN de C da substância 4-h [125 MHz, CDCl3, (ppm)] 13 E.29: Espectro de gHMQC da substância 4-h 127 Espectros de RMN E.30: Ampliação de 1,75-2,35 ( H) do espectro de gHMBC da substância 4-h 1 E.31: Espectro de gHMBC da substância 4-h 128 Espectros de RMN E.32: Ampliação de 3,1-4,04 ( H) do espectro de gHMBC da substância 4-h 1 A.5. Substância 5-h E.33: Espectro de RMN de H da substância 5-h [500 MHz, CDCl3, (ppm)] 1 129 Espectros de RMN E.34: Ampliação do espectro de RMN H da substância 5-h [500 MHz, CDCl3, (ppm)] 1 (a) (b) E.35: Ampliações de (a) 2,18-2,24 e (b) 7,82-7,92 do espectro de RMN H da substância 5-h [500 1 MHz, CDCl3, (ppm)] 130 Espectros de RMN E.36: Ampliação de 7,7-14,0 do espectro de RMN H da substância 5-h [500 MHz, CDCl3, (ppm)] 1 E.37: Ampliação de 6,88-8,0 do espectro de RMN H da substância 5-h [500 MHz, CDCl3, (ppm)] 1 E.38: Espectro de RMN de C da substância 5-h [125 MHz, CDCl3, (ppm)] 13 131 Espectros de RMN E.39: Ampliação de 0-65 do espectro de RMN de 13 C da substância 5-h [125 MHz, CDCl3, (ppm)] E.40: Ampliação de 106-196 do espectro de RMN de C da substância 5-h [125 MHz, CDCl3, 13 (ppm)] 132 Espectros de RMN E.41: Espectro de gHMQC da substância 5-h E.42: Espectro de gHMBC da substância 5-h 133 Espectros de RMN E.43: Ampliação de 106-178 ( C) do espectro de gHMBC da substância 5-h 13 E.44: Ampliação de 2,0-4,0 ( H) do espectro de gHMBC da substância 5-h 1 134 Espectros de RMN E.45: Ampliação de 6,86-7,72 ( H) do espectro de gHMBC da substância 5-h 1 E.46: Ampliação de 2,0-7,7 ( H) do espectro de gHMBC da substância 5-h 1 135 Espectros de RMN A.6. Substância 6-h E.47: Espectro de RMN de H da substância 6-h [500 MHz, CDCl3, (ppm)] 1 E.48: Ampliação de 7,38-8,14 do espectro de RMN H da substância 6-h [500 MHz, CDCl3, (ppm)] 1 136 Espectros de RMN E.49: Ampliação de 2,18-3,9 do espectro de RMN de H da substância 6-h [500 MHz, CDCl3, (ppm)] 1 E.50: Espectro de RMN de C da substância 6-h [125 MHz, CDCl3, (ppm)] 13 E.51: Ampliação de 0,0-66 do espectro de C da substância 6-h [125 MHz, CDCl3, (ppm)] 13 137 Espectros de RMN E.52: Ampliação de 100-196 do espectro de 13 C da substância 6-h [125 MHz, CDCl3, (ppm)] E.53: Ampliação de 2,1-3,95 ( H) do espectro de gHMBC da substância 6-h 1 138 Espectros de RMN E.54: Ampliação de 1,95-2,5 ( H) do espectro de gHMBC da substância 6-h 1 A.7. Substância 7-h E.55: Espectro de RMN de H da mistura contendo a substância 7-h [500 MHz, CDCl3, (ppm)] 1 139 Espectros de RMN E.56: Ampliação do espectro de RMN de H da mistura contendo a substância 7-h [500 MHz, CDCl3, 1 (ppm)] E.57: Espectro de RMN de C da mistura contendo a substância 7-h [125 MHz, CDCl3, (ppm)] 13 140 Espectros de RMN E.58: Ampliação de 7,00-7,60 ( H) do espectro de gHMBC da mistura contendo a substância 7-h 1 E.59: Ampliação de 3,55-3,88 ( H) do espectro de gHMBC da mistura contendo a substância 7-h 1 141 Espectros de RMN E.60: Ampliação de 1,84-2,41 ( H) do espectro de gHMBC da mistura contendo a substância 7-h 1 A.8. Substância 8-h E.61: Espectro de RMN de H da substância 8-h [500 MHz, CDCl3, (ppm)] 1 142 Espectros de RMN E.62: Ampliação de 0,68-1,31 do espectro de RMN de H da substância 8-h [500 MHz, CDCl3, 1 (ppm)] E.63: Ampliação de 1,31-1,71 do espectro de RMN de H da substância 8-h [500 MHz, CDCl3, 1 (ppm)] 143 Espectros de RMN E.64: Ampliação de 2,0-2,39 do espectro de RMN de H da substância 8-h [500 MHz, CDCl3, (ppm)] 1 E.65: Ampliação de 2,78-5,44 do espectro de RMN de H da substância 8-h [500 MHz, CDCl3, 1 (ppm)] E.66: Espectro de RMN de C da substância 8-h [125 MHz, CDCl3, (ppm)] 13 144 Espectros de RMN E.67: Ampliação do espectro de RMN de C da substância 8-h [125 MHz, CDCl3, (ppm)] 13 E.68: Espectro de RMN de DEPT 135º da substância 8-h [125 MHz, CDCl3, (ppm)] 145 Espectros de RMN E.69: Espectro de gHMQC da substância 8-h E.70: Espectro de gHMBC da substância 8-h 146 Espectros de RMN E.71: Ampliação de 4,48-7,52 ( H) do espectro de gHMBC da substância 8-h 1 E.72: Ampliação de 0,4-1,68 ( H) do espectro de gHMBC da substância 8-h 1 147 Espectros de RMN E.73: Espectro de gCOSY da substância 8-h E.74: Ampliação do espectro de gCOSY da substância 8-h 148 Espectros de RMN A.9. Substância 9-h E.75: Espectro de RMN de H da substância 9-h [500 MHz, CDCl3, (ppm)] 1 E.76: Ampliação do espectro de RMN de H da substância 9-h [500 MHz, CDCl3, (ppm)] 1 149 Espectros de RMN E.77: Ampliação de 1,68-2,44 do espectro de RMN de H da substância 9-h [500 MHz, CDCl3, 1 (ppm)] E.78: Ampliação de 2,96-3,98 do espectro de RMN de H da substância 9-h [500 MHz, CDCl3, 1 (ppm)] 150 Espectros de RMN E.79: Ampliação de 0,78-1,56 do espectro de RMN de H da substância 9-h [500 MHz, CDCl3, 1 (ppm)] E.80: Ampliação de 0,78-1,48 do espectro de RMN de H da substância 9-h [500 MHz, CDCl3, 1 (ppm)] 151 Espectros de RMN E.81: Espectro de RMN de C da substância 9-h [125 MHz, CDCl3, (ppm)] 13 E.82: Ampliação de 14-51 do espectro de RMN de C da substância 9-h [125 MHz, CDCl3, (ppm)] 13 E.83: Ampliação de 54-180 do espectro de RMN de C da substância 9-h [125 MHz, CDCl3, (ppm)] 13 152 Espectros de RMN E.84: Espectro de DEPT 135º da substância 9-h [125 MHz, CDCl3, (ppm)] E.85: Espectro de gHMQC da substância 9-h 153 Espectros de RMN E.86: Ampliação de 0,7-2,5 do espectro de gHMQC da substância 9-h E.87: Ampliação de 0,78-2,3 do espectro de gHMQC da substância 9-h 154 Espectros de RMN E.88: Ampliações de 2,96-4,0 do espectro de gHMQC da substância 9-h E.89: Ampliações de 1,68-2,44 do espectro de gHMQC da substância 9-h 155 Espectros de RMN E.90: Ampliação de 1,5-2,4 do espectro de gHMQC da substância 9-h E.91: Espectro de gHMBC da substância 9-h 156 Espectros de RMN E.92: Ampliação de 0,7-2,48 do espectro de gHMBC da substância 9-h E.93: Ampliação de 0,8-2,4 do espectro de gHMBC da substância 9-h 157 Espectros de RMN E.94: Ampliação de 0,7-3,1 do espectro de gHMBC da substância 9-h E.95: Ampliações de 0,4-2,7 do espectro de gHMBC da substância 9-h 158 Espectros de RMN E.96: Ampliações de 0,7-3,8 do espectro de gHMBC da substância 9-h E.97: Ampliações de 0,7-2,7 do espectro de gHMBC da substância 9-h 159 Espectros de RMN E.98: Ampliações de 1,0-2,44 do espectro de gHMBC da substância 9-h E.99: Espectro de gCOSY da substância 9-h 160 Espectros de RMN A.10. Substância 10-h E.100: Espectro de RMN de H da substância 10-h [300 MHz, CDCl3 e Acetona-d6, (ppm)] 1 E.101: Ampliação do espectro de RMN de H da substância 10-h [300 MHz, CDCl3 e Acetona-d6, 1 (ppm)] 161 Espectros de RMN A.11. Substância 11-h E.102: Espectro de RMN de H da substância 11-h [300 MHz, CDCl3, (ppm)] 1 E.103: Ampliação do espectro de RMN de H da substância 11-h [300 MHz, CDCl3, (ppm)] 1 162 Espectros de RMN E.104: Espectro de RMN de C da substância 11-h [75 MHz, CDCl3, (ppm)] 13 E.105: Ampliação de 10,6-25,2 do espectro de RMN de 13 C da substância 11-h [75 MHz, CDCl3, (ppm)] E.106: Ampliação de 27-40,4 do espectro de RMN de C da substância 11-h [75 MHz, CDCl3, 13 (ppm)] 163 Espectros de RMN E.107: Ampliação de 72-148 do espectro de RMN de C da substância 11-h [75 MHz, CDCl3, (ppm)] 13 E.108: Espectro de RMN de DEPT 135º da substância 11-h [75 MHz, CDCl3, (ppm)] 164 Espectros de RMN E.109: Ampliação de 0,0-2,8 ( H) do espectro espectro de gHMQC da substância 11-h 1 E.110: Espectro de gHMBC da substância 11-h 165 Espectros de RMN A.12. Substância 12-h E.111: Espectro de RMN de H da substância 12-h [300 MHz, CDCl3, (ppm)] 1 E.112: Ampliação de 10,6-25,2 do espectro de RMN de 13 C da substância 12-h [75 MHz, CDCl3, (ppm)] 166 Espectros de RMN E.113: Ampliação de 27-40,4 do espectro de RMN de C da substância 12-h [75 MHz, CDCl3, 13 (ppm)] E.114: Espectro de RMN de C da substância 12-h [75 MHz, CDCl3, (ppm)] 13 167 Espectros de RMN E.115: Ampliação de 10-80 do espectro de RMN de C da substância 12-h [75 MHz, CDCl3, (ppm)] 13 E.116: Ampliação de 110-175 do espectro de RMN de C da substância 12-h [75 MHz, CDCl3, 13 (ppm)] 168 Espectros de RMN E.117: Espectro de RMN de DEPT 135º da substância 12-h [75 MHz, CDCl3, (ppm)] E.118: Espectro de RMN de DEPT 90º da substância 12-h [75 MHz, CDCl3, (ppm)] 169 Espectros de RMN E.119: Espectro de gHMBC da substância 12-h E.120: Ampliação de 0,0-130 ( C) do espectro de gHMBC da substância 12-h 13 170 Espectros de RMN ANEXO B: Espectros de RMN dos Constituintes Químicos Isolados das folhas de M. myrtifolia B.1. Substância 13-m E.121: Espectro de RMN de H da substância 13-m [500 MHz, Acetona-d6, (ppm)] 1 E.122: Ampliação do espectro de RMN de H da substância 13-m [500 MHz, Acetona-d6, (ppm)] 1 171 Espectros de RMN E.123: Espectro de RMN de C da substância 13-m [125 MHz, Acetona-d6, (ppm)] 13 E.124: Ampliação do espectro de RMN de 13 C da substância 13-m [125 MHz, Acetona-d6, (ppm)] E.125: Espectro de gHSQC da substância 13-m 172 Espectros de RMN E.126: Espectro de gHMBC da substância 13-m B.2. Substância 14-m E.127: Espectro de RMN de H da substância 14-m [500 MHz, CDCl3, (ppm)] 1 173 Espectros de RMN E.128: Ampliação de 1,0-4,0 do espectro de RMN de H da substância 14-m [500 MHz, CDCl3, 1 (ppm)] E.129: Ampliação de 6,8-14 do espectro de RMN de H da substância 14-m [500 MHz, CDCl3, 1 (ppm)] 174 Espectros de RMN E.130: Espectro de RMN de C da substância 14-m [125 MHz, CDCl3, (ppm)] 13 E.131: Ampliação de 6-58 espectro de RMN de C da substância 14-m [125 MHz, CDCl3, (ppm)] 13 175 Espectros de RMN E.132: Ampliação de 87-211 ( C) espectro de RMN de 13 C da substância 14-m [125 MHz, CDCl3, 13 (ppm)] E.133: Espectro de RMN de DEPT 135º da substância 14-m [125 MHz, CDCl3, (ppm)] 176 Espectros de RMN E.134: Espectro de gHMQC da substância 14-m E.135: Ampliação de 0,0-45 ( C) do espectro de gHMBC da substância 14-m 13 177 Espectros de RMN E.136: Ampliação de 50-118 ( C) do espectro de gHMBC da substância 14-m 13 E.137: Ampliação de 161-220 ( C) do espectro de gHMBC da substância 14-m 13 178 Espectros de RMN B.3. Substância 15-m E.138: Espectro de RMN de H da substância 15-m [500 MHz, CDCl3, (ppm)] 1 E.139: Ampliação de 3,6-14,4 do espectro de RMN de H da substância 15-m [300 MHz, CDCl3, 1 (ppm)] 179 Espectros de RMN E.140: Ampliação de 0,88-2,18 do espectro de RMN de H da substância 15-m [500 MHz, CDCl3, 1 (ppm)] E.141: Ampliações de 0,88-2,18 e 3,05-6,04 do espectro de RMN de H da substância 15-m [500 1 MHz, CDCl3, (ppm)] 180 Espectros de RMN E.142: Espectro de RMN de C da substância 15-m [125 MHz, CDCl3, (ppm)] 13 E.143: Espectro de RMN de DEPT 135º da substância 15-m [75 MHz, CDCl3, (ppm)] 181 Espectros de RMN E.144: Espectro de gHMQC da substância 15-m E.145: Espectro de gHMBC da substância 15-m 182 Espectros de RMN E.146: Ampliação de 1,9-6,0 ( H) do espectro de gHMBC da substância 15-m 1 E.147: Ampliação de 1,9-6,0 ( H) do espectro de gHMBC da substância 15-m 1 183 Espectros de RMN E.148: Ampliação de 0,96-2,06 ( H) do espectro de gHMBC da substância 15-m 1 B.4. Substância 16-m E.149: Espectro de RMN de H da substância 16-m [500 MHz, CDCl3, (ppm)] 1 184 Espectros de RMN E.150: Ampliação de 0,6-1,36 do espectro de RMN de H da substância 16-m [500 MHz, CDCl3, 1 (ppm)] E.151: Ampliação de 2,9-5,2 do espectro de RMN de H da substância 16-m [500 MHz, CDCl3, 1 (ppm)] 185 Espectros de RMN E.152: Espectro de RMN de C da substância 16-m [125 MHz, CDCl3, (ppm)] 13 E.153: Ampliação de 13-35 do espectro de RMN de C da substância 16-m [500 MHz, CDCl3, 13 (ppm)] E.154: Ampliação 35-58 do espectro de RMN de 13 C da substância 16-m [500 MHz, CDCl3, (ppm)] 186 Espectros de RMN E.155: Espectro de RMN de DEPT 135º da substância 16-m [75 MHz, CDCl3, (ppm)] B.5. Substância 17-m E.156: Espectro de RMN de H da substância 17-m [500 MHz, CDCl3, (ppm)] 1 187 Espectros de RMN E.157: Ampliação do espectro de RMN de H da substância 17-m [500 MHz, CDCl3, (ppm)] 1 E.158: Espectro de RMN de C da substância 17-m [125 MHz, CDCl3, (ppm)] 13 188 Espectros de RMN E.159: Ampliação de 14-57 do espectro de RMN de C da substância 17-m [500 MHz, CDCl3, 13 (ppm)] E.160: Ampliação de 109,8-220 do espectro de RMN de C da substância 17-m [500 MHz, CDCl3, 13 (ppm)] E.161: Espectro de DEPT 135º da substância 17-m [125 MHz, CDCl3, (ppm)] 189 Espectros de RMN B.6. Substância 18-m E.162: Espectro de RMN de H da substância 18-m [300 MHz, CDCl3, (ppm)] 1 E.163: Ampliação de 0,1-2,4 do espectro de RMN de H da substância 18-m [300 MHz, CDCl3, 1 (ppm)] 190 Espectros de RMN E.164: Ampliações de 14-59 do espectro de RMN de H da substância 18-m [300 MHz, CDCl3, 1 (ppm)] E.165: Espectro de RMN de C da substância 18-m [125 MHz, CDCl3, (ppm)] 13 E.166: Ampliação de 79-208 do espectro de RMN de 13 C da substância 18-m [125 MHz, CDCl3, (ppm)] 191 Espectros de RMN E.167: Ampliação de 14-59 do espectro de RMN de C da substância 18-m [125 MHz, CDCl3, 13 (ppm)] E.168: Espectro de RMN de DEPT 135º da substância 18-m [125 MHz, CDCl3, (ppm)] 192 Espectros de RMN B.7. Substância 19-m E.169: Espectro de RMN de H da substância 19-m [500 MHz, CDCl3, (ppm)] 1 E.170: Ampliação de 3,3-5,35 do espectro de RMN de H da substância 19-m [500 MHz, CDCl3, 1 (ppm)] 193 Espectros de RMN E.171: Ampliação de 0,7-1,28 do espectro de RMN de H da substância 19-m [500 MHz, CDCl3, 1 (ppm)] E.172: Espectro de RMN de C da substância 19-m [125 MHz, CDCl3, (ppm)] 13 194 Espectros de RMN E.173: Ampliação de 12-62 do espectro de RMN de C da substância 19-m [125 MHz, CDCl3, 13 (ppm)] E.174: Espectro de RMN de DEPT 135º da substância 19-m [75 MHz, CDCl3, (ppm)] 195 Espectros de RMN B.8. Substância 20-m E.175: Espectro de RMN de H da substância 20-m [300 MHz, CDCl3, (ppm)] 1 E.176: Ampliação de 0,7-2,4 do espectro de RMN de H da substância 20-m [500 MHz, CDCl3, 1 (ppm)] 196 Espectros de RMN E.177: Ampliação de 0,7-2,4 do espectro de RMN de H da substância 20-m [500 MHz, CDCl3, 1 (ppm)] E.178: Espectro de RMN de C da substância 20-m [75 MHz, CDCl3, (ppm)] 13 E.179: Ampliação de 14-57 do espectro de RMN de C da substância 20-m [75 MHz, CDCl3, (ppm)] 13 197 Espectros de RMN E.180: Ampliação de 72-200 do espectro de RMN de C da substância 20-m [75 MHz, CDCl3, 13 (ppm)] B.9. Substância 21-m (em mistura com a 20-m) E.181: Espectro de RMN de H da mistura das substâncias 20-m e 21-m [500 MHz, CDCl3, (ppm)] 1 198 Espectros de RMN E.182: Espectro de RMN de C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] 13 E.183: Ampliação de 120-186 do espectro de RMN de 13 C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] 199 Espectros de RMN E.184: Ampliação de 14-43 do espectro de RMN de 13 C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] E.185: Ampliação de -81 do espectro de RMN de 13 C da mistura das substâncias 20-m e 21-m [125 MHz, CDCl3, (ppm)] 200 Espectros de RMN B.10. Substância 22-m E.186: Espectro de RMN de H da substância 22-m [500 MHz, CDCl3, (ppm)] 1 E.187: Ampliação de 0,64-1,36 do espectro de RMN de H da substância 22-m [500 MHz, CDCl3, 1 (ppm)] 201 Espectros de RMN E.188: Ampliação de 3,26-5,36 do espectro de RMN de H da substância 22-m [500 MHz, CDCl3, 1 (ppm)] E.189: Espectro de RMN de C da substância 22-m [125 MHz, CDCl3, (ppm)] 13 202 Espectros de RMN E.190: Espectro de RMN de DEPT 135º da substância 22-m [125 MHz, CDCl3, (ppm)] 203
Download