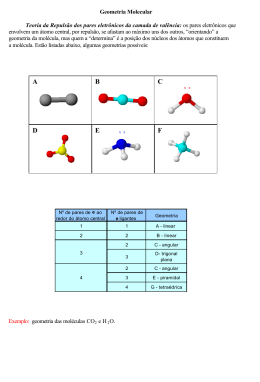
Disciplina de Física e Química A – 10ºAno Ano letivo 2014/2015 Vamos aos “Gritos”… Geometria das moléculas !!! O que é a geometria das moléculas? A geometria das moléculas está relacionada como são as moléculas de um ponto de vista 3D. Estamos sempre a estudá-las, a saber as suas fórmulas químicas e o tipo de ligação que formam, a geometria está relacionada com isso tudo mas dá-nos mais informação ainda. Que tipos de geometria existem? Existem vários tipos mas só alguns serão estudados este ano! Assim temos: Geometria linear Geometria angular Geometria trigonal plana Geometria piramidal trigonal Geometria tetraédrica Como sabemos a geometria de uma molécula? Para sabermos a geometria de uma molécula temos que, em primeiro lugar, saber a sua composição, ou seja, a sua fórmula química. Fazemos a configuração eletrónica dos elementos que a constituem para termos uma noção de quantas ligações irão fazer e quantos eletrões de valência têm. Depois é uma questão de vermos as possibilidades de ligação de maneira a Vamos aos Gritos – Geometria das Moléculas Página 1 ficarem todos quimicamente satisfeitos, o que geralmente acontece quando têm dois ou oito eletrões de valência. Digo geralmente porque existem exceções. No entanto, há pequenos truques que podemos usar para nos ajudar a determinar a geometria este ano dado que não vamos estudar moléculas difíceis… Se contarmos o número de átomos que constituem uma molécula podemos reduzir o número de possibilidades para a geometria. A tabela tenta resumir esse truque: Número de átomos que Geometrias mais Exemplos de compõem a prováveis moléculas Observações molécula Todas as 2 Geometria linear O2, H2, F2, HCl, HF, N2 moléculas diatómicas só podem ter geometria linear Se o átomo central tiver Geometria linear 3 Geometria angular CO2 (linear) H2O (angular) eletrões não ligantes a geometria será angular caso contrário é linear Vamos aos Gritos – Geometria das Moléculas Página 2 Geometria trigonal plana 4 Geometria Se o átomo NH3 (piramidal central tiver trigonal) eletrões não BH3 (trigonal ligantes a plana) geometria será a piramidal trigonal Geometria 5 tetraédrica piramidal São as mais CH4 fáceis de identificar! Pela tabela verificamos que os pares de eletrões não ligantes são muito importantes para definir a geometria de uma molécula e entre duas opções são eles que definem qual das geometrias é! A figura ao lado mostra modelos das diferentes geometrias. a) geometria linear b) geometria angular c) geometria trigonal plana d) geometria piramidal trigonal e) geometria tetraédrica Que exemplos mais importantes temos que saber? As moléculas que compõem a atmosfera são, sem dúvida, as mais Vamos aos Gritos – Geometria das Moléculas Página 3 importantes que têm que saber! Vejamos alguns exemplos: Molécula de CO2 com geometria linear, repara que tem três átomos mas o carbono, que é o átomo central não tem eletrões não ligantes por isso a geometria é linear e não angular. Os ângulos da ligação são de 180º. Temos 2 ligações covalente duplas, num total de quatro pares de eletrões ligantes e quatro pares de eletrões não ligantes. O trihidreto de boro, BH3, tem geometria trigonal plana e é uma exceção à regra do octeto pois o boro, que só tem três eletrões de valência, não tem oito eletrões em seu redor mas a verdade é que é uma molécula estável. Os ângulos são de 120º. Temos 3 ligações covalente simples. A água, H2O, tem geometria angular, com um ângulo de ligação de 104,5º. Neste caso o oxigénio tem eletrões não ligantes que empurram as ligações e por isso não temos uma geometria linear. Vamos aos Gritos – Geometria das Moléculas Página 4 O metano, CH4, tem geometria tetraédrica. Temos quatro ligações covalente simples e nenhum par de eletrões não ligantes. O amoníaco, NH3, como o azoto tem dois eletrões não ligantes tem geometria piramidal trigonal com ângulos de 107º. Este é um CFC de nome triclorofluormetano, CCl3F, que terá geometria tetraédrica. Vamos aos Gritos – Geometria das Moléculas Página 5
Baixar