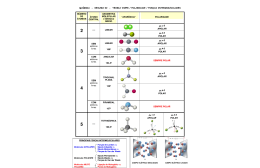
Frente 3 Módulo 01 01. d 03. d 05. a 07. VFVVF 10. 02. a 04. e 06. a 08. b a) 09. 14 10. e 11. a) PN3 b) H2S c) CF4 12. Configurações eletrônicas: C: 1s2|2s2 2p2; N: 1s2|2s2 2p3; O: 1s2|2s2 2p4 As moléculas de CO2 são sempre monoméricas, pois os átomos de carbono e de oxigênio não têm elétron desemparelhado, ou seja, os átomos estão estabilizados. As moléculas de NO2 combinam-se duas a duas originando dímeros, pois o átomo de nitrogênio tem um elétron desemparelhado disponível para a ligação. A molécula de NO2 é denominada molécula ímpar. A equação química do processo: O2N ⋅ +⋅ NO2 → O2N ⋅⋅NO2 o SF6 não segue a regra do octeto b)o N2O e H2O são moléculas polares 11. a) Estado gasoso b) O = C = O. A moléculas de dióxido de carbono é apolar porque sendo apolar possuem momento dipolar nulo. 12. a) H2O maior diferença de eletronegatividade b) NH3 geometria piramidal (CH4 é apolar) ou 2NO2 → N2O4 13. a) por ligações covalentes b) CCl4 (tetracloreto de carbono) 13. a) 14. a) com o hidrogênio e o carbono b) H – Cl 15. a) H2O, H2O2, HCl, NaCl. b) H2O, covalente; H2O2, covalente; HCl, covalente; NaCl, iônica. MED.01.11.01-E Módulo 02 01. 04 03. b 05. c 07. b 09. 24 02. d 04. e 06. e 08. a b) C6H6 é apolar e H2O é polar portanto são líquidos imiscíveis (mistura heterogênea). C6H6 é apolar e CCl4 é apolar portanto são líquidos miscíveis (mistura homogênea). 14. CO2 é molécula linear e NO2 é molécula angular 149 149 15. a) Todas as ligações entre Si e Cl, entre As e H e entre Se e H são ligações polares devida à diferença de eletronegatividade existente entre os diferentes elementos. Portanto, o número de ligações apolares é zero, todas são polares.. b) O Si pertence ao grupo IV e tem então 4 elétrons de valência. No composto SiCl4, o Si compartilha os seus 4 elétrons com os Cl para formar 4 ligações covalentes. Portanto, não possui pares eletrônicos livres. O As pertence ao grupo V, tem 5 elétrons de valência e formam 3 ligações covalentes no composto AsH3, sobrando 2 elétrons livres. Portanto, o composto AsH3 possui 1 par eletrônico livre. O Se pertence ao grupo 6, tem 6 elétrons de valência e formam 2 ligações covalentes no composto SeH2, sobrando 4 elétrons livres. Portanto, no composto SeH2, há 2 pares eletrônicos livres. No total, são então 3 pares eletrônicos livres. c) Considerando a geometria dos três compostos determinada a partir da teoria VSEPR e dada abaixo, é possível dizer que um composto é apolar, SiCl4, e dois são polares, AsH3 e SeH2. Módulo 03 01. b 03. d 05. a 07. b 09. - 11. - 02. b 04. e 06. d 08. d 10. 12. - 13. a) b) 1CH 4( g ) + 2O2( g ) → 1CO2( g ) + 2H2O( l ) c) A partir do petróleo (por destilação) e a partir de matéria orgânica em decomposição. 14. Gab: p-Dimetil-benzeno 15. a) b)22000L c)CH4(g) + 2 O2(g) → CO2(g) = 2H2O(v) 150 Módulo 04 01. e 02. a 03. c 04. e 05. d 06. d 07. c 08. c 09. 10. I - ligação de hidrogênio e II - dipolo-dipolo. 11. b 12. t-Butóxi-benzeno ou éter t-butilfenílico 13. Propanal 14. Ciclo-hexanona 15.
Baixar