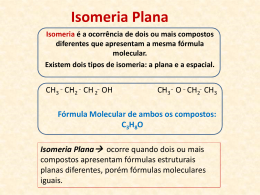
1 PROCESSO SELETIVO 2006 QUESTÕES DISCURSIVAS QUÍMICA – QUESTÕES DISCURSIVAS A O álcool ciclohexanol (C6H11OH, de massa molar igual a 100 g mol-1), ao ser aquecido em meio que contém ácido -1 sulfúrico, converte-se em ciclohexeno (C6H10, de massa molar igual a 82 g mol ), com um rendimento de 75% (m/m). A.1) Demonstre, com uma casa decimal, qual a massa de ciclohexanol comercial, de pureza 95% (m/m), que é necessária para a produção de 30 g de ciclohexeno. Comentário: A.2) Demonstre, com uma casa decimal, a pureza do ciclohexeno obtido. Comentário: 2 A.3) Considerando as massas atômicas de H = 1, C = 12 e O = 16, calcule o número de moléculas da outra substância produzida nessa reação. Comentário: B A fotossíntese é, reconhecidamente, uma reação química vital para quase todas as formas vivas do planeta Terra. Nos aspectos químico e termodinâmico, a reação pode ser representada pela equação: 6 CO2 + 6 H2O clorofila luz do sol C6H12O6 + 6 O2 3 ∆H = +2,8x10 kJ Do ponto de vista energético, comente a reação acima, destacando a grande virtude desse fenômeno. Comentário: Do ponto de vista energético, a reação ocorre com absorção de energia luminosa e transformação em energia química. A grande virtude desse fenômeno é o aproveitamento da energia proveniente da luz do sol na formação de um produto com grande entalpia (C6H12O6 Þ carboidrato) que será utilizado pelos seres vivos como fonte de energia. C Com base no conceito de isomeria, responda as questões abaixo: C.1) Defina isomeria estrutural e estereoisomeria. Comentário: Isomeria é o fenômeno da existência de compostos diferentes com a mesma fórmula molecular. Isomeria estrutural (isomeria plana): os isômeros podem ser distinguidos pelas suas fórmulas estruturais planas. Estereoisomeria (isomeria espacial): os isômeros só podem ser distinguidos pelas suas fórmulas estruturais espaciais. C.2) Cite quatro tipos de isomeria estrutural. Comentário: Isomeria de função Isomeria de cadeia Isomeria de posição Isomeria de compensação (metameria) 3 C.3) Utilizando a fórmula molecular C4H10O, dê um exemplo para cada tipo de isomeria estrutural mencionado e um exemplo de estereoisômero óptico. Comentário: D A reação de decomposição da água oxigenada (2H2O2(aq) → 2H2(g) + O2(g); ∆H < 0), quando acompanhada através da variação da massa de água oxigenada em função do tempo, revela o comportamento apresentado pelo seguinte gráfico: 220 200 massa de H2O2 / g 180 160 140 120 100 80 60 40 -1 0 1 2 3 4 5 tempo / min Com base no gráfico apresentado, responda: 6 7 8 9 4 D.1) Qual a velocidade média de decomposição da água oxigenada no intervalo de 2 a 4 minutos? Expresse a -1 velocidade em g min . Comentário: Vm = Vm = Dm H 2 O 2 g = Dt min 150 - 110 4-2 Þ Vm = 20g . min -1 D.2) Sabendo que essa reação obedece à equação de Arrhenius, explique como o aumento da temperatura afeta a velocidade dessa reação. Comentário: Um aumento na temperatura aumenta a energia cinética das moléculas, ocorrendo mais colisões efetivas, aumentando assim a velocidade da reação. D.3) Como o aumento da temperatura afeta o rendimento dessa reação? Comentário: Para alterar o rendimento da reação, temos que deslocar o equilíbrio. Nesse caso, o aumento da temperatura desloca o equilíbrio para a esquerda (reação endotérmica), diminuindo o rendimento da reação. 5 E Usando o método da ligação de valência e a teoria da hibridização, explique a estrutura da molécula de HCN, caracterizando o tipo das ligações químicas entre os átomos, os ângulos entre as ligações e, quando houver, a hibridização apresentada pelos átomos da molécula. Comentário:
Baixar