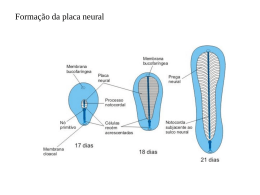
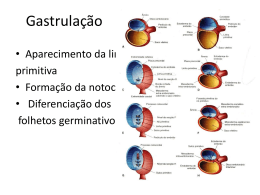
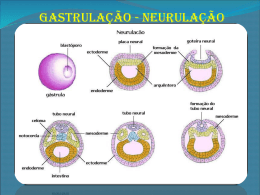
Somitogênese e Campo de Membros Somitos Origem mesodérmica (Paraxial) Originam: Ossos e cartilagens do tronco, músculos esqueléticos e derme dorsais PADRONIZAÇÃO Modificações de forma e contatos intercelulares, dependente de movimentos celulares A) Epithelial cells •••~. ~~ • ~4"'~~-w "A~~ ~1(. • ~~~~~~ ~,Ly~,Ly~~P?- ~~ : r~~~~~~~~~~~~~ ~~-· ~~~~?~~~~$v Mesenchymal cells Formed som i te B) :l7 /iFTill"F]~~~~~~.-P'~ Somite forming Mesoderma Intermediário Mesoderma Paraxial Notocorda Rins e Gônadas Mesoderma Lateral Sistema Vascular e Músculo, Hematopoiético Anexos ossos, cart., etc Extraembrionários O que será formado a partir dos somitos? À medida que o somito amadurece/diferencia ele “desmancha” no sentido antero/posterior (i.e. anterior amadurece primeiro) (A) 2-day embryo Central dermamyotome Epidermis Neural tube Som i te >) Late 4-day embryo (A) Central dermamyotome Epidermis Dorsal root -+---tt-\\ ganglia Neural tube o Sclerotome Myotome Myotome Sclerotome Hypax.ial ornitic bud Estrutura da pele e músculo subjacente EPIDERME DERME MÙSCULO 3-day embryo 2-day chlck embryo Dorsal neural tube /epidermis Dorsal 4-day embryo dermomyotome myotome Dorsal dermatome Lateral -migrating muscle cells O sclerotome D dermomyotome Dermátomo derme Miótomo Músculo Esclerótomo vértebras e costelas Os esclerótomos se RESSEGMENTAM para formar as vértebras Esclerótomos individuais Fusão da região posterior do Esclerótomo A com a região anterior do Esclerótomo B A A B B Sulco neural c o Esclerótomo O Estágios na história de vida de um somito em um embrião humano. fase epitelial do somito no estágio de tubo pré-neural. r a transformação epiteliomesenqu1mal da porção ventromedial no esclerótomo. C aparência de um m1ótomo separado do dermomiótomo original. _ fase IniCial da quebra do dermátomo ep1telial em fibroblastos dérm1cos. A Quadro 6.1 Compartimentos dos somitos e seus derivados Ectododerme \ / Dermomiótomo Tubo Esclerótomo Ventral: corpos vertebrais e seus discos intervertebrais Lateral: costelas distais, alguns tendões Dorsal: parte dorsal do arco neural, processo espinhoso Central: pedículos e partes ventrais dos arcos neurais, costelas proximais, ou processos transversos das vértebras Mediai (meningótomo): menmges e vasos sanguíneos das meninges Artrótomo Discos intervertebrais, superfícies articulares vertebrais e costelas proximais Dermátomo Derme, lâmina da escápula Miótomo Dorsomedial: músculos das costas Intrínsecos (epaxial) Ventrolateral: músculos dos membros ou músculos da parede ventrolateral do corpo (hipoaxial) Neurótomo Células endoneurais e perineural Sindetomo Tendões da musculatura epax1al neural ~ ~ Miótomo Esclerótomo dorsal Esclerótomo central Esclerótomo lateral "- Endoderme 8 ,--..... / Dermátomo Sindetomo Meningótomo Tubo -"'\1~----.;;,__ Esclerótomo central Adaptado de Christ B, Huang R, Scaal M: Dev Dyn 236:2383, 2007. Esclerótomo ventral Esclerótomo lateral Organização de somitos nas fases de desenvolvimento inicial ( ' e final (B). (Baseado em Christ 8, Huang R, Scaal M: Anat Embryol 208:333-350, 2004) Mas como surgem os somitos periodicamente em pares??? Ordem específica ao longo do eixo ântero-posterior Células-tronco somitogênicas em torno do nó (Epiblasto) (Somitômeros) Pareados Modelo de Frente de Onda + Relógio de segmentação (FGF8 e seus amigos) FGF8 + Ácido Retinóico regulam padronização e propagação FGF8 Frente de onda Padronização ântero-posterior precoce Valor posicional (Identidade Posicional) Adquirido precocemente também!! Proliferação Por proliferação FGF8 ↓ e Ác. Retinóico ↑ Frente de onda = limiar de concentrações permissivas de FGF8 e RA onde é disparada a DETERMINAÇÃO Mesp-2 é expresso NESTE limiar. Frente de Determinação e Frente de Segmentação Após o limiar passar pelas células do mesoderma pré-somítico inicia-se o relógio de segmentação Expressão periódia de c-hairy e lunatic fringe Ephrina B Ephrina B O gene hairy1 é expresso periodicamente no mesoderma présomítico Fase I: células pré-somíticas caudais expressando hairy1 Fase II: desaparecimento da expressão de hairy1 caudal Fase III: formação do somito e restrição da expressão de Hairy a porção posterior do somito a ser formado Hairy 1 e o relógio de segmentação O “relógio” interno serviria para : 1) Definir o grupo de células que farão parte do mesmo somito 2) Definir o momento da formação de um somito ~ Notch\ Lfringe _. Clock Mesp2 Modelo para determinação de segmentos no mesoderma presomítico Fgf8 A formação antero-posterior de somitos é determinada por uma “Onda” de FGF gerada pela região mais posterior do embrião Olivier Pourquié, "Segmentation and somitogenesis in vertebrates," in AccessScience lct I SJ~ O .'( r I V" ~~ .. l So \ :; su~ o SJ~ O so --- • I • f . <( I ~·• I : - ' \ \ .. 11 DI o o -- Segmentação Eph A – Ephrina B O sistema Ephrina-ephrina de formação de fronteiras teciduais: Ephrina (Eph) = Receptor tirosina quinase de membrana Ephrina = Ligante transmembrana Nature Reviews Molecular Cell Biology 3, 475-486 (July 2002) Ephrinas e a determinação do limite somítico In situ para EphA4 (Durbin et al., 1998) O contato do Receptor Ephrina (anterior) pelo ligante ephrina (posterior) causa repulsão celular Develop. Growth Differ. (2008) 50, S149–S155 Durbin L et al. Genes Dev. 1998;12:3096-3109 ©1998 by Cold Spring Harbor Laboratory Press Os fatores de transcrição do “relógio” interno induzem a expressão do Receptor Ephrina mesp1 EphA4 Wnt-6 (ectodérmico) Paraxis (mesodérmico) Snail Shh e nogging Pax1 explosão de mitose e perda de N-caderinas células epiteliais voltam a morfologia mesenquimal (mesênquima secundário) A ~ ~ Mesoderme ~·\ ~ intermediário Paráxis c Pax-1, Pax-9, Noggin B Pax-3 c-met Pax-1 , Pax-9 / Pax-1, Pax-9 Esclerótomo M!obla~I?S ; :~: m1gratonos Fíg 6 1 Eventos moleculares envolvidos na diferenciação dos somitos. Moléculas de Sinalização são representadas por setas pretas. S1na1s inibitórios são representados por linhas vermelhas. Os genes expressos em tecidos responsivos estão Indicados em itálico. BMP. proteína morfogenétlca óssea; SF, fator de dispersão; Shh, sonic hedgehog. (Adaptado de Brand-Saberi B and others· lnt J Dev B•ol40.477-420., 1996.) Digits, segments, somites… A type of structure which is frequently encountered in higher organisms consists of a sequence of similar but not identical substructures. Segments in insects, the somites and the digits of vertebrates are examples. Usually their total number is precisely regulated As the basic mechanism we proposed that cell states are involved that locally exclude each other but activate each other on long range Meinhardt and Gierer (1980); J. theor. Biol., 85, 429-450 Digits, segments, somites… This mechanism found strong support by the later discovered logic in the engrailed-wingless interaction: engrailed and wingless are locally exclusive; engrailed activates wingless in the adjacent cell via hedgehog. In turn, wingless molecules, transported in vesicles, are absolutely required for the engrailed activation in the neighboring cell. As predicted, wingless and engrailed activation is autocatalytic. In engrailed, the selfenhancement is direct, that of wingless involves sloppy paired. Digits, segments, somites… To illustrate the properties of such a type of interaction I used the following set of equations: 2 ∂a c s p a ∂2a = − α a + Da 2 + ρ0 ∂t ∂x r ∂p c sa p 2 ∂2 p = − α p + Dp 2 + ρ0 r ∂t ∂x ∂r = c s p a 2 + c sa p 2 − β r ∂t ∂sa ∂ 2 sa = γ (a − sa ) + Dsa 2 ∂t ∂x ∂s p ∂2sp = γ ( p − s p ) + Dsp ∂t ∂x 2 This is Eq. 12.1 from the 82-book; only g1 and g2 is substituted by a and p as a label for the compartmental specifications a and p describe the local autocatalytic feedback loops, sa and sp the mutual long-ranging help. In this example it is assumed that the mutual repression occurs by a common repressor r which is produced by both autocatalytic loops and that acts on both. This mutual local exclusion has the consequence that in one cell only one of the feedback loop can be active. Booth loops require the help from the other cell state; a and p expressing cells will appear next to each other. The mutual repression can also be direct (see below) Digits, segments, somites… To illustrate the properties of such a type of interaction I used the following set of equations: 2 ∂a c s p a ∂2a = − α a + Da 2 + ρ0 ∂t ∂x r ∂p c sa p 2 ∂2 p = − α p + Dp 2 + ρ0 r ∂t ∂x ∂r = c s p a 2 + c sa p 2 − β r ∂t ∂sa ∂ 2 sa = γ (a − sa ) + Dsa 2 ∂t ∂x ∂s p ∂2sp = γ ( p − s p ) + Dsp ∂t ∂x 2 In this simulation the homogeneous distribution of a and p becomes instable, high a and high p expression occur in adjacent cells. This mechanism show a good sizeregulation after partial removal of one cell type. Digits, segments, somites… 2 ∂a c s p a ∂2a = − α a + Da 2 + ρ0 ∂t ∂x r ∂p c sa p 2 ∂2 p = − α p + Dp 2 + ρ0 r ∂t ∂x ∂r = c s p a 2 + c sa p 2 − β r ∂t ∂sa ∂ 2 sa = γ (a − sa ) + Dsa 2 ∂t ∂x ∂s p ∂2sp = γ ( p − s p ) + Dsp ∂t ∂x 2 If the autocatalytic components are not diffusible, the border between the two regions will be absolutely sharp. This is the case in the engrailed-wingless interaction for the compartment formation in Drosophila: the clonal borders are sharp and cannot be moved, as observed. However, if only one cell type remain, a partial reprogramming may be possible (as observed after fragmentation of of imaginal discs) Digits, segments, somites… 2 ∂a c s p a ∂2a = − α a + Da 2 + ρ0 ∂t ∂x r ∂p c sa p 2 ∂2 p = − α p + Dp 2 + ρ0 r ∂t ∂x ∂r = c s p a 2 + c sa p 2 − β r ∂t ∂sa ∂ 2 sa = γ (a − sa ) + Dsa 2 ∂t ∂x ∂s p ∂2sp = γ ( p − s p ) + Dsp ∂t ∂x 2 An important feature of such a system is that it can generate stripes. Since the different cell types need each other for mutual stabilization, a long common border leads to a most stable situation. The ability to form stripes is required for many such systems. (In this simulation above pattern formation is initiated by a slightly higher level of p (red) in the right half of the field). Digits, segments, somites… ∂a ∂t ∂2a c a2 − α a + Da 2 + ρ0 2 2 (a + p ) ( sa + ε / p ) ∂x ∂p ∂2 p c p2 = − α p + Dp 2 + ρ0 2 2 ∂t (a + p ) s p ∂x ∂sa ∂ 2 sa = γ (a − sa ) + Dsa 2 ∂t ∂x ∂s p ∂t = γ ( p − s p ) + Dsp (see Eq. 12.2 in the 82-book) ∂2sp ∂x 2 In this alternative example, the interaction between the two feedback loops occurs not by a long-ranging mutual activation but by a self-inhibition (a2/sa). In competing systems, a help for the other feedback loop or a self-inhibition is equivalent. The mutual exclusion is direct (a2 + p 2 ). The term ε / p in the first equation can lead to a threshold decisive for a transition for between an oscillating and an excitable system (see below). Combining oscillations and spatial pattterning To see how the oscillation derived for insect segmentation and patterning in space can be combined, it is essential to see that the mechanism shown above can act also as an oscillator. For instance, if only A cells are present, the P-cell state will get strong support, while the support of the A state by the P cells is missing. Thus, cells will switch from A to P and for the same reason back to A, i.e, they will oscillate between the two states. This works in the same way if self-inhibition is involved. Now imagine that only one A cell exists initially at the anterior end. The direct Pneighors will be be stabilized, while the other will continue to oscillate. With each complete cycle there would be one new pair of A/P specifications (half-somites). Conversion of an oscillating pattern into a periodic pattern that is stable in time In this way the oscillation gives rise to a regular pattern in space. The non-trivial prediction was made that a boundary between a stable and an oscillating pattern sweeps from anterior to posterior over the field. This raises, however, the question: what makes the first border? Position Combining oscillations and spatial pattterning The assumption was that at the posterior terminal position a gradient is generated and that a certain concentration is required to keep the oscillation going. Cells below a threshold are unable to oscillate. Now it is clear that this prediction was correct, the gradient shown in the simulation in yellow has been identified as FGF. Palmeirim et al. (1997). Cell 91, 639-648 A comparison with the observation of Palmeirim et al., 1997 shows the striking correspondence between the 82-model and the 1997 observation. Combining oscillations and spatial pattterning ε A switch between an oscillating or an excitable system can be accomplished by a baseline inhibitor level or a MichaelisMenten type constant. If ε is large enough, the a activation can no longer trigger spontaneously since the denominator remains finite. The positional information p (yellow) lowers the influence of ε . Thus, if p is high enough (in the posterior), the system oscillates, otherwise it is arrested in the p state. ∂a c a2 ∂2a = − α a + Da 2 + ρ0 2 2 ∂t (a + p ) ( sa + ε / p ) ∂x (Hox) gene activation under the influence of the oscillation The aim was to also explain the sequential activation of specifying genes. The model proposed offered a very convenient mechanism. The number of the oscillations a cell has been made corresponds unambiguously to its position. Each more posteriorly located pair of halfsomites proceeds exactly through one more oscillation cycles. As shown above for insects, this can be used to activate specifying (HOX) genes (lowest panel) Although the precise mechanism of the coupling between the oscillation and Hox gene activation is still unclear, there is some evidence for it: Dubrulle, et al., (2001). Fgf signaling controls somite boundary position and regulates segmentation clock control of spatiotemporal hox gene activation. Cell 106,219-232 Zakany et al., (2001). Localized and transient transcription of hox genes suggests a link between patterning and the segmentation clock. Cell 106,207-217 https://www.youtube.com/watch?v=9wrBROwoRSk Ainda temos ????? Região Posterior EphA4 Região Anterior Limites laterais O mesoderma paraxial não tem sinalização BMP A expressão de noggin na região paraxial inibe BMP, permitindo a somitogênese O que acontece se adicionarmos noggin A MAIS do lado direito? Genes Hox e identidade antero-posterior dos somitos Genes Hox Superfamília Homeobox Fatores de transcrição 4 agrupamentos em vertebrados Colinearidade Anterior definido/posterior nem tanto genes Hox a4 a9 a11 aJO b9 b4 c5 cB c6 d4 C1 c9 elO --,....-- d9d10 51 T1 DDDDDDDDDDDDDD· · · · · · c11 d71d12 mesoderme Ca1 • • • • • • • • • vértebras somitos •••••••••• b4 a4 c4 vértebras Ca1 a9 =======::j bl c5 c6 cB c9 dB d9 d10 d11d12 =======~ genes Hox C=cervical T=torácica L=lombar S=sacral Ca=caudal Chick Mo use mesoderme Código de barras Transformação homeótica Comprometimento precoce A notocorda inibe a sinalização do BMP (Bone Morphogenic Protein), um ligante da família TGF-beta Existe um gradiente antero-posterior de Wnt, BMPs, FGFs e ácido retinóico Esta diferença de expressão persiste até estágios posteriores Àcido Retinóico O ácido retinóico determina o padrão de expressão de Hox nos somitos normal Sem ácido retinóico Ácido retinóico altera a identidade das vértebras CONTROLE LIMITE POSTERIOR Campo de Membro Mesoderme da Mesoderme paraxial Tubo neural placa l a t e \ Anterior Ectoderme Broto do membro A Veia umbilical direita Posterior Veia umbilical esquerda Fig. 10.1 Secção transversal através do tronco em um estágio inicial do desenvolvimento dos brotos dos membros, mostrando sua localização em relação à dos somitos (dermátomo) e às outras estruturas importantes. O broto do membro é uma saliência da parede do corpo (mesoderma da placa lateral). Fig. 10.2 A, Interações moleculares envolvidas na iniciação do desenvolvimento dos membros. FGF. fator de crescimento dos fibroblastos. 8 , Ausência de formação dos membros anteriores após eliminação do Tbx-5 nos membros. (B, De Minguillon c; De!Buono J, Logan MP: DevCe/1 8:75-84, 2005). O padrão axial gerado pelos Hox é refinado por outros genes Tbx5 Membro Tbx4 Posterior Forelimb bud ) Ectopic Tbx4 expresston Hindlimb ) bud @ 2000 Sinauer &sociates, Iw::. O mesoderma pré-somítico produz FGF10 O FGF10 não é mais produzido na região entre os futuros membros O FGF10 dos futuros brotos de membros induz a produção de FGF8 do ectoderma superficial, que por sua vez mantém a produção de FGF10 Lembra algo... Tubo neural Axônios sensitivos e células de Schwann vindos da crista neural Axônios motores vindos do tubo neural Mioblastos e precursores das células endoteliais derivados dos somitos Mesoderme vindo da placa lateral Células endoteliais vindas dos vasos do tronco Células pigmentares vindas da crista neural Fig. 10.1 O Os diferentes tipo de células que penetram no broto de membro. Crista Ectodérmica Apical 2 c u Fig 10.7 Micrografia eletrônica de varredura de um embrião humano de 5 semanas (1O mm). Os brotos do braço e da perna (asteriscos) estão no estágio de remo achatado. C, coração; U, cordão umbilical; 1, 2, arcos farfngeos 1 e 2. (De Jirásek JE: Atlas of human prenatal morphogenesis, Amsterdam, 1983, Martinus Nijhoff). Fig 10.8 Os três superiores, Efeito da remoção da crista ectodérmica apical em estágios sucessivamente posteriores do desenvolvimento do broto da asa de ave. Quanto mais maduro o broto de asa, maior é a quantidade de elementos esqueléticos que se formam após a remoção da crista apical. As estruturas ausentes são mostradas em cinza-claro. Embaixo, Desenvolvimento normal de um broto de asa não intocado. (Baseado em Saunders JW J Exp Zoo/708:363-403, 7948). Zona de Atividade Polarizadora FGF8 ZAP Shh Segmentação de membros Hox!!! Padronização de eixos
Baixar