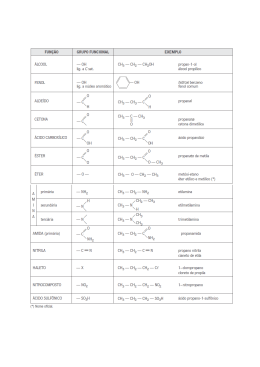
UNIVERSIDADE FEDERAL RURAL DO RIO DE JANEIRO DECANATO DE ENSINO DE GRADUAÇÃO DEPARTAMENTO DE ASSUNTOS ACADÊMICOS E REGISTRO GERAL DIVISÃO DE REGISTROS ACADÊMICOS PROGRAMA ANALÍTICO DISCIPLINA CÓDIGO: IC-369 NOME: ELEMENTOS ESTRUTURAIS DE QUÍMICA ORGÂNICA CRÉDITOS 2 (T-02 P-0) Cada Crédito corresponde a 15h/ aula DEPARTAMENTO DE QUÍMICA INSTITUTO DE CIÊNCIAS EXATAS OBJETIVO DA DISCIPLINA: Fornecer ao aluno oriundo do ensino médio subsídios para a compreensão de tópicos fundamentais da Química e em especial da Química Orgânica, através do aperfeiçoamento de conteúdos já vistos, de modo diferenciado e apresentação de outros fundamentais à compreensão da química moderna. EMENTA: 1. O mundo macroscópico atômico e simbólico dos químicos. 2. Química Orgânica e Inorgânica: uma comparação (moléculas, íons e cristais iônicos). 3. Arquitetura das moléculas orgânicas: teoria estrutural. Forma e Comportamento: estrutura e propriedades físicas. 4. A Linguagem escrita da Química Orgânica: fórmulas (molecular, estrutural, espacial ). Cadeias e Funções. 5. A Linguagem falada da Química Orgânica: nomeclatura. 6. Moléculas Diferentes com as mesmas Ligações: isomeria, quiralidade (estereoisomeria) CONTEUDO PROGRAMÁTICO: 1234- Os mundos em que os químicos trabalham: O macroscópico, o atômico e o simbólico A importância da utilização de modelos em química O estudo da Química Orgânica e Inorgânica: Ligações iônicas e covalentes A importância do modelo espacial das moléculas para o estudo atual da Química; o uso de modelos moleculares. A hibridação sp3, sp2 e sp do carbono. 5- O significado das fórmulas como linguagem da química e especialmente da química orgânica: Fórmula mínima, molecular, estrutural, eletrônica de Lewis e tridimensional. A relação das fórmulas com os modelos moleculares. 6- Sinópse das principais funções orgânicas e nomenclatura de compostos orgânicos representativos; algumas reações importantes. 7- Fórmula molecular e estrutural : O uso do grau de insaturação na determinação da fórmula estrutural 8- Fórmulas de Lewis a) Construção das fórmulas eletrônica de Lewis b) Cálculo de cargas formais e sua importância na representação das fórmulas de ressonância 9- Teoria da ressonância a) Sua utilidade para explicar o comportamento de compostos. b) Regras para escrever fórmulas de ressonância 10- Geometria molecular: Arranjo espacial dos átomos e sua representação no plano. Configuração tetraédrica (sp3), trigonal (sp 2 )e linear (sp) 11- Estereoisomeria: Tipos de fórmulas que que representam a estrutura tetraédrica do carbono (tridimensional, de Fischer, de Newman); Diferenças entre Isomeria configuracional e conformacional. Quiralidade 12- Análise conformacional : etano, butano e cicloexano. O uso das fórmulas de projeção de Newman. BIBLIOGRAFIA: 1. Bodner,G. M.; Pardue H. L. Chemistry an Experimental Science. New York, John Wiley & Sons, Inc.1989 2. Atkins, P.; Jones, L. Chemistry: Molecules, Matter, and Change 3ª ed., New York W.H.Freeman and Company,1997. 3. Solomons T., W.G. Organic Chemistry, 2ª ed, New York, John Wiley & Sons, Inc.1980 4. Allinger N. L. e Allinger J. Estrutura de moléculas orgânicas São Paulo, Edgard Blücher Ltda, 1969 5. Allinger, N. L. e outros. Química Orgânica, Rio de Janeiro, Guanabara Dois, 1978 6. Reusch, H.W.Química Orgânica vol.I, McGraw-Hill do Brasil Ltda, 1979 7. Meislich, H., Nechamkin.H. e Sharefkin, J. Química Orgânica, 2ª ed., São Paulo, Makron Books do Brasil Editora,1994. 8. Quiñoá, E. e Riguera, R. Questões e Exercícios de Química Orgânica, Makron Books do Brasil Editora,1994.
Baixar