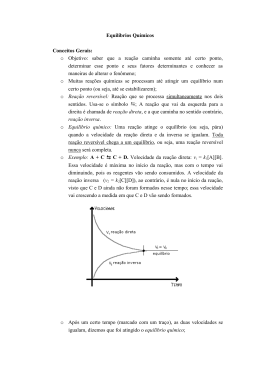
1 ALISON CARONE DA SILVA 390130776 ANDERSON ZANETTI 390130833 CRISTIAN FABRICIUS BUENO 390130771 GUILHERME COLETI 390130778 HENRIQUE CARRARA 390130713 JOÃO GUILHERME FERREIRA 390130862 LUCAS CARVALHO 390130810 DETERMINAÇÃO DA FÓRMULA DE UM SAL HIDRATADO Relatório apresentado à disciplina Laboratório de Química 1 sob a responsabilidade do Prof. Dr. Sérgio Arnosti Junior, como parte da avaliação do primeiro semestre de 2013. . PIRACICABA – SP MAIO / 2013 2 SUMÁRIO 1. INTRODUÇÃO .............................................................................................................3 2 OBJETIVO .....................................................................................................................4 3 MATERIAIS E REAGENTES ........................................................................................5 4 PROCEDIMENTO EXPERIMENTAL ...........................................................................6 4.1 Metodologia da determinação .......................................................................................6 4.2 Cálculos da determinação .............................................................................................7 4.2.1 Cálculos da Massa do sal ...........................................................................................7 4.2.2 Cálculos do número de Mols da Água .......................................................................7 5. RESULTADOS .............................................................................................................9 6 DISCUSSÃO ................................................................................................................ 10 7 CONCLUSÃO .............................................................................................................. 11 8 REFERÊNCIAS BIBLIOGRÁFICAS ........................................................................... 12 3 1. INTRODUÇÃO A massa molar dos elementos é baseada no átomo de carbono, onde a massa molar de cada elemento expressa quantas vezes este mesmo é maior que um doze avos da massa molar do átomo de carbono, que é igual a doze. Para moléculas, a massa molar é a soma da massa molar de todos os átomos contidos na composição do elemento (FOGAÇA, 2012). Tanto a massa molar como o número de mols de um determinado elemento se relacionam com o número do Avogadro, número este que representa que em 1 g de um determinado elemento há 6,02 x 1023 entidades (moléculas) deste elemento. Por exemplo, 1 mol (6,02 x 1023 átomos) de oxigênio pesam 16 g, portando 32g de oxigênio valem 2 mols (FOGAÇA, 2012). A determinação da massa molar de certos elementos pode ser realizada através de experimentos em laboratório, como evaporação, titulação, pesagem, entre outros (ELMAS, 2010). No caso deste relatório, foi realizada a determinação do número de mols de água em um sulfato de cobre, através da pesagem, evaporação deste elemento e repesagem. Experimento denominado remoção da água de cristalização, muito importante na engenharia (HECK, 2010). O processo de cristalização consiste na remoção de um soluto de uma solução saturada, pela formação de um composto sólido (tipicamente cristalino), através da perda da solubilidade provocada por um método físico, muito utilizado na extração do alumínio, por exemplo, (HECK, 2010). Embora a água seja considerada um solvente universal, muitas vezes há a ligação com outros elementos, ou seja, com o soluto de uma solução, por exemplo, alterando a fórmula química deste composto. No caso do sulfato de cobre, há a alteração para a coloração azulada quando em contato com a água (MOLINA, 2011). Essa formação de compostos cristalinos como a do sulfato de cobre hidratado é denominada hidrato, sendo, um termo usado em química inorgânica e química orgânica para indicar que uma substância contém água (MOLINA, 2011). 4 2 OBJETIVO Determinar o número de mols de água de hidratação do sulfato de cobre (II). 5 3 MATERIAIS E REAGENTES A tabela 1 informa os materiais e reagentes utilizados para a execução do experimento. Tabela 1 – Materiais e reagentes utilizados no experimento. MATERIAIS E REAGENTES DO EXPERIMENTO Materiais Reagentes Espátula Sulfato de Cobre Hidratado Balança analítica Cadinho Tela de amianto Triângulo de porcelana Tripé Bico de Bunsen Pinça Metálica 6 4 PROCEDIMENTO EXPERIMENTAL 4.1 Metodologia da determinação Adaptou-se um triângulo de porcelana em um tripé de metal. Colocou-se sobre o triângulo um cadinho de porcelana limpo e seco. Aqueceu-se o cadinho com o bico de Bunsen (figura 1) por aproximadamente 3 minutos para eliminar a umidade presente no cadinho. Figura 1 – Eliminação da umidade do cadinho. A seguir, pegou-se o cadinho segurando-o com a pinça, apoiado na tela de amianto e levou-o ao dessecador. Após o cadinho ter atingido a temperatura ambiente, foi pesado em uma balança analítica. Com o auxílio da espátula, adicionou-se certa quantidade de sulfato de cobre hidratado (CuSO4.nH2O) até menos da metade da capacidade do cadinho (figura 2). Na mesma balança pesada anteriormente, foi determinada a massa do sal. Figura 2 – Cor azul característica do sulfato de cobre hidratado 7 Aqueceu-se suavemente o cadinho até grande parte da água ser evaporada (mudança de cor, conforme a figura 3) e logo em seguida aqueceu-se por 5 minutos com fogo forte. Figura 3 – Perda gradual da cor azul do sulfato de cobre devido à evaporação da água. Calculou-se a quantidade de água presente no sal hidratado pela diferença de massa antes e depois do aquecimento do sal, e determinou-se o número de mols presentes no sal hidratado. 4.2 Cálculos da determinação 4.2.1 Cálculos da Massa do sal Massa total do sal: Massa do cadinho cheio – Massa do cadinho vazio (1) Massa perdida de Água: Massa total do Sal – (Massa do cadinho cheio - Massa do cadinho c/ Sal desidratado) (2) 4.2.2 Cálculos do número de Mols da Água Utilizando a massa molar da água de acordo com a tabela periódica (1 mol = 18 g), juntamente com as equações 1 e 2, descobriu-se o número de mols de água perdidos: 8 (3) Com uma fórmula semelhante, descobriu-se também o nº de mols de sulfato de cobre desidratado após o aquecimento: (4) 9 5. RESULTADOS A tabela 2 expressa a massa dos elementos obtidos com o experimento e a massa molar dos elementos, estes obtidos através da tabela periódica do site Syvum. Os cálculos para os valores expressos nessa tabela foram obtidos através das equações 1, 2, 3 e 4. Tabela 2 – Dados obtidos com o experimento a partir das equações propostas. DADOS OBTIDOS NO EXPERIMENTO Substância Fórmula Massa (g) Massa Molar (g) Nº Mols Sulfato de Cobre (II) Hidratado CuSO4.nH2O 5,2772 - - Sulfato de Cobre (II) Desidratado CuSO4 3,3606 159,5 0,02107 Água Evaporada H2O 1,9166 18 0,106478 Observando-se a tabela 2, houve aproximadamente 5 moléculas de Água para cada molécula de Sulfato de Cobre II. 10 6 DISCUSSÃO O sulfato de cobre possui cor característica azul quando penta-hidratado, isto é, com 5 moléculas de água (PONTO CIÊNCIA, 2012). Dividindo o número de mols da água evaporada pelo número de mols do sulfato desidratado, obtém-se um valor de 5,04 mols de água para cada mol do sulfato de cobre. Portanto, houve um erro de 8% do valor esperado no experimento, ou seja, pode ter havido algum descuido no manuseio do elemento quando fora do dessecador, o que fez com que a amostra de CuSO4 absorvesse água do ambiente. Há a possibilidade também do aquecimento não foi suficiente tanto da retirada de umidade do cadinho como na desidratação do composto, entre outros possíveis erros (AGUIAR, 2012). 11 7 CONCLUSÃO O experimento foi de grande auxílio para a aprendizagem do cálculo no número de mols. Pode-se calcular o valor em massa e em mols da água evaporada através da pesagem antes e depois da evaporação e embora mesmo com um erro de 8% no valor final esperado do experimento, obteve-se um valor aproximado para afirmar que o sal era pentahidratado. 12 8 REFERÊNCIAS BIBLIOGRÁFICAS AGUIAR, Dayane Sales. Sulfato de cobre penta hidratado. Universidade Estadual do Rio de Janeiro, 2010. ELMAS, Fernanda. Determinação da massa molar do Magnésio. Universidade Estadual do Rio de Janeiro, 2010. FOGAÇA, Jennifer Rocha Vargas. Fórmula Mínima ou Empírica. Disponível em> http://www.alunosonline.com.br/quimica/formula-minima-ou-empirica.html, 2012. Acesso em> 01.05.2013. MOLINA, Bianca; SIMÕES, Franciele; LEAL, Leandro; VINICIUS, Marcus. Determinação da água de cristalização de um hidrato. Faculdade de Ciências e Tecnologia de Presidente Prudente, 2011. HECK, Nestor Cezar. Cristalização. O Que É?. Disponível em> http://www.ct.ufrgs.br/ntcm/graduacao/ENG06631/Cristalizacao.pdf, 2010. Acesso em> 01.05.2013. PONTO CIÊNCIA. Aprenda Como Tirar Água de Pedra!. Disponível em> http://pontociencia.org.br/gerarpdf/index.php?experiencia=524, 2012. Acesso em> 01.05.2013. SYVUM. Tabela Periódica dos Elementos. Disponível em> http://br.syvum.com/materia/quimica/tabela_periodica.html, 2012. Acesso em> 01.05.2013. 13 FUNDAÇÃO MUNICIPAL DE ENSINO DE PIRACICABA – FUMEP ESCOLA DE ENGENHARIA DE PIRACICABA – EEP ENGENHARIA MECÂNICA LABORATÓRIO DE QUÍMICA FUNDAMENTAL 1 DETERMINAÇÃO DA FÓRMULA DE UM SAL HIDRATADO ALISON CARONE DA SILVA 390130776 ANDERSON ZANETTI 390130833 CRISTIAN FABRICIUS BUENO 390130771 GUILHERME COLETI 390130778 HENRIQUE CARRARA 390130713 JOÃO GUILHERME FERREIRA 390130862 LUCAS CARVALHO 390130810 PIRACICABA – SP MAIO / 2013
Baixar