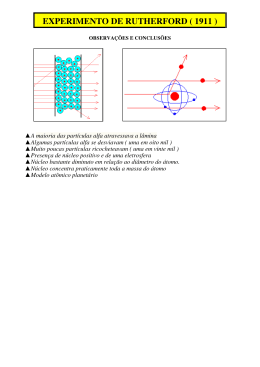
Lista de exercícios 04 Modelos atômicos incluindo Böhr - Revisão Observação teórica - Os postulados de Böhr A partir das suas descobertas científicas, Niels Böhr propôs cinco postulados: 1o.) Um átomo é formado por um núcleo e por elétrons extranucleares, cujas interações elétricas seguem a lei de Coulomb. 2o.) Os elétrons se movem ao redor do núcleo em órbitas circulares. 3o.) Quando um elétron está em uma órbita ele não ganha e nem perde energia, dizemos que ele está em uma órbita discreta ou estacionária ou num estado estacionário. 4o.) Os elétrons só podem apresentar variações de energia quando saltam de uma órbita para outra. 5o.) Um átomo só pode ganhar ou perder energia em quantidades equivalentes a um múltiplo inteiro (quanta). O modelo de Böhr serviu de base sólida para o desenvolvimento dos modelos e conceitos atuais sobre a estrutura do átomo. 01. (PUCMG) Numere a segunda coluna de acordo com a primeira, relacionando os nomes dos cientistas com os modelos atômicos. 1. Dalton 2. Rutheford 3. Niels Bohr 4. J. J. Thomson (___) Descoberta do átomo e seu tamanho relativo. (___) Átomos esféricos, maciços, indivisíveis. (___) Modelo semelhante a um "pudim de passas" com cargas positivas e negativas em igual número. (___) Os átomos giram em torno do núcleo em determinadas órbitas. Assinale a seqüência CORRETA encontrada: a) 1 - 2 - 4 – 3 b) 1 - 4 - 3 - 2 c) 2 - 1 - 4 – 3 d) 3 - 4 - 2 - 1 e) 4 - 1 - 2 – 3 02. (UFMG) Ao resumir as características de cada um dos sucessivos modelos do átomo de hidrogênio, um estudante elaborou o seguinte resumo: MODELO ATÔMICO: Dalton CARACTERÍSTICAS: átomos maciços e indivisíveis. MODELO ATÔMICO: Thomson CARACTERÍSTICAS: elétron, de carga negativa, disperso em uma esfera de carga positiva. A carga positiva está distribuída, homogeneamente, por toda a esfera. www.sotaodaquimica.com.br Contato: [email protected] 1 MODELO ATÔMICO: Rutherford CARACTERÍSTICAS: elétron, de carga negativa, em órbita em torno de um núcleo central, de carga positiva. Não há restrição quanto aos valores dos raios das órbitas e das energias do elétron. MODELO ATÔMICO: Bohr CARACTERÍSTICAS: elétron, de carga negativa, em órbita em torno de um núcleo central, de carga positiva. Apenas certos valores dos raios das órbitas e das energias do elétron são possíveis. O número de ERROS cometidos pelo estudante é: a) 0 b) 1 c) 2 d) 3 03. (UFRS) Associe as contribuições relacionadas na coluna I com o nome dos pesquisadores listados na coluna II. Coluna I – Contribuições 1 - Energia da luz é proporcional à sua freqüência. 2 - Modelo pudim de ameixa. 3 - Princípio da incerteza. 4 - Elétron apresenta comportamento ondulatório. 5 - Carga positiva e massa concentrada em núcleo pequeno. 6 - Órbita eletrônica quantizada. 7 - Em uma reação química, átomos de um elemento não desaparecem nem podem ser transformados em átomos de outro elemento. Coluna II – Pesquisadores (___) Dalton (___) Thomson (___) Rutherford (___) Bohr A relação numérica, de cima para baixo, da coluna II, que estabelece a seqüência de associações corretas é a) 7 - 3 - 5 – 4 b) 7 - 2 - 5 - 6 c) 1 - 2 - 4 – 6 d) 1 - 7 - 2 - 4 e) 2 - 7 - 1 – 4 04. (UNB) O entendimento da estrutura dos átomos não é importante apenas para satisfazer à curiosidade dos cientistas; possibilita a produção de novas tecnologias. Um exemplo disso é a descoberta dos raios catódicos, feita pelo físico William Crookes, enquanto estudava as propriedades da eletricidade. Tal descoberta, além de ter contribuído para um melhor entendimento a respeito da constituição da matéria, deu origem aos tubos de imagem dos televisores e dos monitores dos computadores. Alguns grandes cientistas que contribuíram para o entendimento da estrutura do átomo foram: Dalton (1766-1844), Rutherford (1871-1937), Bohr (1885-1962) e Linus Pauling (1901-1994). Com relação à estrutura da matéria, julgue os itens seguintes. (0) Ao passar entre duas placas eletricamente carregadas, uma positivamente e outra negativamente, as partículas alfa desviam-se para o lado da placa negativa. (1) O átomo é a menor partícula que constitui a matéria. (2) Cada tipo de elemento químico é caracterizado por um determinado número de massa. (3) O modelo atômico que representa exatamente o comportamento do elétron é o modelo de Rutherford-Bohr. www.sotaodaquimica.com.br Contato: [email protected] 2 05. (CFTMG) Referindo-se à evolução dos modelos atômicos, é INCORRETO afirmar que a) a energia de um elétron é quantizada, isto é, restrita a determinados valores, segundo Bohr. b) as partículas alfa de carga positiva sofrem desvios, porque são repelidas pelos elétrons, de acordo com Rutherford. c) a formação dos materiais ocorre através de diferentes associações entre átomos iguais ou diferentes, conforme Dalton. d) a descontinuidade dos espectros de absorção ou emissão de energia pelo átomo de hidrogênio evidencia a existência de níveis de energia. 06. (ENEM) Na investigação forense, utiliza-se luminol, uma substância que reage com o ferro presente na hemoglobina do sangue, produzindo luz que permite visualizar locais contaminados com pequenas quantidades de sangue, mesmo superfícies lavadas. É proposto que, na reação do luminol (I) em meio alcalino, na presença de peróxido de hidrogênio (II) e de um metal de transição (M(n)+), forma-se o composto 3-aminoftalato (III) que sofre uma relaxação dando origem ao produto final da reação (IV), com liberação de energia (hv) e de gás nitrogênio (N2). (Adaptado. "Química Nova", 25, no. 6, 2002. pp. 1003-10) Na reação do luminol, está ocorrendo o fenômeno de a) fluorescência, quando espécies excitadas por absorção de uma radiação eletromagnética relaxam liberando luz. b) incandescência, um processo físico de emissão de luz que transforma energia elétrica em energia luminosa. c) quimiluminescência, uma reação química que ocorre com liberação de energia eletromagnética na forma de luz. d) fosforescência, em que átomos excitados pela radiação visível sofrem decaimento, emitindo fótons. e) fusão nuclear a frio, através de reação química de hidrólise com liberação de energia. 07. (PUCMG) "As diferentes cores produzidas por distintos elementos são resultado de transições eletrônicas. Ao mudar de camadas, em torno do núcleo atômico, os elétrons emitem energia nos diferentes comprimentos de ondas, as cores." ("O Estado de São Paulo", Caderno de Ciências e Tecnologia, 26/12/92) O texto anterior está baseado no modelo atômico proposto por: a) Niels Bohr b) Rutherford c) Heisenberg d) John Dalton e) J. J. Thomson 08. (UFMG) Com relação ao modelo atômico de Bohr, a afirmativa FALSA é a) cada órbita eletrônica corresponde a um estado estacionário de energia. b) o elétron emite energia ao passar de uma órbita mais interna para uma mais externa. c) o elétron gira em órbitas circulares em torno do núcleo. d) o elétron, no átomo, apresenta apenas determinados valores de energia. e) o número quântico principal está associado à energia do elétron. www.sotaodaquimica.com.br Contato: [email protected] 3 09. (UFRS) Uma moda atual entre as crianças é colecionar figurinhas que brilham no escuro. Essas figuras apresentam em sua constituição a substância sulfeto de zinco. O fenômeno ocorre porque alguns elétrons que compõem os átomos dessa substância absorvem energia luminosa e saltam para níveis de energia mais externos. No escuro, esses elétrons retomam aos seus níveis de origem, liberando energia luminosa e fazendo a figurinha brilhar. Essa característica pode ser explicada considerando o modelo atômico proposto por a) Dalton. b) Thomson. c) Lavoisier. d) Rutherford. e) Bohr. 10. (UNESP) Considere as seguintes afirmações sobre átomos e moléculas. I. No modelo proposto por Rutherford, o átomo tem praticamente toda sua massa concentrada num núcleo pequeno e os elétrons estão a uma grande distância do núcleo. II. No modelo proposto por Bohr para o átomo de hidrogênio, os elétrons se movem em órbitas circulares, cujas energias podem assumir quaisquer valores. III. Molécula é a menor porção de uma substância covalente que mantém sua composição. Está(ão) correta(s): a) apenas I. b) apenas II. c) apenas III. d) apenas I e II. e) apenas I e III. 11. (UECE) No diagnóstico da septicemia, utilizamos um exame chamado de hemocultura, cujo resultado é dado em 48h. Hoje, com a utilização de computadores e a introdução de um ativador químico, o resultado pode ser dado em aproximadamente 8h, ajudando, dessa maneira, a salvar muitas vidas. O ativador químico usado nos meios de hemoculturas são ativados através do CO2, produzidos pelas bactérias que faz com que um elétron de uma camada interna salte para camadas mais externa, ficando o elétron numa posição instável. A energia emitida pelos elétrons ao retornar à sua camada primitiva, é na forma de ondas: a) eletromagnéticas, que pode ser luz visível ou não, dependendo do salto eletrônico. b) eletromagnéticas, de luz verde, de comprimento de onda maior que a luz vermelha. c) eletromagnéticas, de luz vermelha, de comprimento de onda menor que a luz violeta. d) não eletromagnéticas. 12. (UFSC – adaptada) Analise as duas afirmações: A luz emitida nos luminosos a base de gás neônio, (10Ne20), são originadas em tubos de baixa pressão com descarga elétrica de alta voltagem. Os chineses, desde o século X, utilizavam efeitos luminosos pela queima de fogos de artifício. Analise a(s) proposição(ões) e diga se são verdadeiras ou falsas. I. A luz emitida pelo gás neônio ocorre pela reação química entre todos os átomos presentes no tubo. II. A luz emitida tanto pelo gás neônio, quanto pelos fogos de artifício pode ser explicada através do salto dos elétrons para níveis mais energéticos. Esta luz será liberada quando da volta do elétron à sua camada de origem. www.sotaodaquimica.com.br Contato: [email protected] 4 13. (UFPI) O sulfeto de zinco-ZnS tem a propriedade denominada de fosforescência, capaz de emitir um brilho amarelo-esverdeado depois de exposto à luz. Analise as afirmativas a seguir, todas relativas ao ZnS, e marque a opção correta: a) salto de núcleos provoca fosforescência. b) salto de nêutrons provoca fosforescência. c) salto de elétrons provoca fosforescência. d) elétrons que absorvem fótons aproximam-se do núcleo. e) ao apagar a luz, os elétrons adquirem maior conteúdo energético. 14. (UECE) Cada elemento químico apresenta um espectro característico, e não há dois espectros iguais. O espectro é o retrato interno do átomo e assim é usado para identificá-lo, conforme ilustração dos espectros dos átomos dos elementos hidrogênio, hélio e mercúrio. Bohr utilizou o espectro de linhas para representar seu modelo atômico, assentado em postulados, cujo verdadeiro é: a) ao mudar de órbita ou nível, o elétron emite ou absorve energia superior à diferença de energia entre as órbitas ou níveis onde ocorreu esta mudança. b) todo átomo possui um certo número de órbitas, com energia constante, chamadas estados estacionários, nos quais o elétron pode movimentar-se sem perder nem ganhar energia. c) os elétrons descrevem, ao redor do núcleo, órbitas elípticas com energia variada. d) o átomo é uma esfera positiva que, para tornar-se neutra, apresenta elétrons (partículas negativas) incrustados em sua superfície. 15. (UFRJ - adaptada) As telas de televisão plana e de telefones celulares usam como visores os chamados OLED, que são equivalentes a "microlâmpadas" coloridas, formadas por camadas de compostos metalorgânicos depositadas entre dois eletrodos. Um dos metais mais utilizados como emissor de fótons é o alumínio, ligado a um composto orgânico, a quinolina [Al(quinolina)3]. A emissão de luz nesses dispositivos pode ser explicada pelo modelo de Bohr. O diagrama de energia (figura 1) refere-se ao OLED de [Al(quinolina)3]. Com base no diagrama de energia referente ao OLED de [Al(quinolina)3] e utilizando o gráfico de conversão e a escala de cores (figura 2), determine o comprimento de onda — e a cor da luz emitida pelo OLED de [Al(quinolina)3]. www.sotaodaquimica.com.br Contato: [email protected] 5 Respostas 01. C 02. A 03. B 04. V F F F 12. I - Falsa; II - Verdadeira. 13. C 05. B 06. C 07. A 08. B 09. E 10. E 11. A 14. B 15. O comprimento de onda é de 520 nm o que corresponde ao verde. Veja as figuras a seguir. www.sotaodaquimica.com.br Contato: [email protected] 6
Download