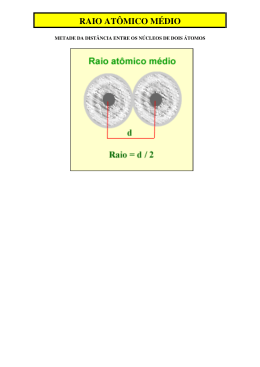
Questão 05 De acordo com as propriedades periódicas dos elementos químicos, analise as proposições abaixo. I. O tamanho do raio atômico dos elementos químicos cresce da direita para a esquerda nos periódicos e cresce de cima para baixo nos grupos. II. O tamanho do raio atômico dos elementos químicos cresce da esquerda para direita nos periódicos, assim como a eletropositividade. III. O iodo apresenta raio atômico menor do que o cloro. IV. O nitrogênio apresenta raio atômico maior do que o flúor. Analise a alternativa correta. a) Somente a afirmativa I é verdadeira. b) Somente as afirmativas II e III são verdadeiras. c) Somente as afirmativas I e III são verdadeiras. d) Somente as afirmativas I e IV são verdadeiras. e) Somente as afirmativas II e IV são verdadeiras. Módulo 06 - Exercício 13 Questão 01 Dois ou mais íons ou, então, um átomo e um íon que apresentam o mesmo número de elétrons denominamse espécies isoeletrônicas. Comparando-se as espécies isoeletrônicas F-, Na+, Mg2+, e Al3+, conclui-se que: a) a espécie Mg2+ apresenta o menor raio iônico. b) a espécie Na+ apresenta o menor raio iônico. c) a espécie F- apresenta o maior raio iônico. d) a espécie Al3+ apresenta o maior raio iônico. e) a espécie Na+ apresenta o maior raio iônico. Questão 02 Questão 06 Com relação à classificação periódica dos elementos, pode-se afirmar que o: a) hidrogênio é um metal alcalino localizado na 1ª coluna. b) nitrogênio é o elemento mais eletropositivo da 15ª coluna. c) sódio é o elemento mais eletronegativo do 3° período. d) mercúrio é um ametal líquido à temperatura ambiente. e) potássio tem maior raio atômico que o Br. O efeito fotoelétrico consiste na emissão de elétrons provenientes de superfícies metálicas, através da incidência de luz de frequência apropriada. Tal fenômeno é inversamente proporcional ao potencial de ionização dos metais, os quais têm sido largamente utilizados na confecção de dispositivos fotoeletrônicos, tais como: fotocélulas de iluminação pública, câmeras fotográficas, etc. Com base nestas informações, assinale a alternativa que representa o metal mais susceptível a exibir o efeito fotoelétrico. a) Fe. b) Hg. c) Cs. d) Mg. e) Ca. Questão 03 Considere as espécies abaixo e indique qual é a alternativa que apresenta corretamente a ordem crescente do raio atômico delas. - Mg (Z = 12) - Mg2+ - O (Z = 8) - O2a) Mg, Mg2+, O, O2-. b) Mg, O, Mg2+, O2-. c) O, O2-, Mg, Mg2+. d) Mg2+, Mg, O2-, O. e) Mg2+, O, O2-,Mg. Questão 07 Sobre o processo de ionização de um átomo A, mostrado abaixo: A(g) + energia → A+(g) + esão feitas as seguintes afirmativas: I. A energia de ionização aumenta à medida que o raio atômico diminui; sendo assim, é necessária 2 uma quantidade de energia maior para remover elétrons de átomos menores. II. O cátion formado possui um raio maior que o raio do átomo pelo fato de a perda do elétron deixar o átomo carregado mais positivamente e assim diminuir a atração entre os elétrons resultantes e o núcleo, o que promove a expansão da nuvem eletrônica. III. A primeira energia de ionização é sempre a maior e, consequentemente, a remoção de elétrons sucessivos do mesmo átomo se torna mais fácil. IV. A energia de ionização em átomos localizados no mesmo período da tabela periódica aumenta no mesmo sentido do aumento da carga nuclear. Estão corretas as afirmativas a) I e III b) II e IV c) II e III d) I e IV e) I, II e IV Questão 04 Considerando as propriedades periódicas, indique a alternativa correta: a) Para elementos de um mesmo período, a primeira energia de ionização é sempre maior que a segunda. b) Com o aumento do número de camadas, o raio atômico, em um mesmo grupo, diminui. c) Para íons de elementos representativos, o número do grupo coincide com o número de elétrons que o átomo possui no último nível. d) Os elementos com caráter metálico acentuado possuem grande afinidade eletrônica. e) Para elementos de um mesmo grupo, o raio atômico aumenta com o aumento do número de camadas eletrônicas. Viva essa experiência. 1 www.colegiocursointellectus.com.br Questão 08 As configurações eletrônicas no estado fundamental dos átomos dos elementos E1, E2 e E3 são: E1: 1s2 2s2 2p6 3s1 E2: 1s2 2s2 2p6 3s2 3p5 E3: 1s2 2s2 2p6 3s2 3p6 4s1 A alternativa correta é: a) o elemento E2 tem maior raio atômico que o elemento E1. b) o elemento E1 tem maior potencial de ionização que o elemento E3. c) o elemento E3 tem maior afinidade eletrônica que o elemento E2. d) os elementos E1 e E2 são metais e o elemento E3 é não metal. e) o elemento E3 e os íons E-2 e E+1 são isoeletrônicos. Questão 09 O gráfico a seguir indica a primeira variação do potencial de ionização, em função dos números atômicos. Analise o gráfico, consulte a tabela periódica e responda às questões a seguir: a) Considere os elementos Na, F e S. Coloque-os em ordem crescente de potencial de ionização. b) O gráfico mostra que os gases nobres apresentam altos ou baixos potenciais de ionização em relação aos seus números atômicos? Explique. Questão 10 As sucessivas energias de ionização do nitrogênio estão representadas no gráfico. a) EXPLIQUE a variação observada nos valores de energia de ionização entre o primeiro e o quinto elétron. b) EXPLIQUE por que o valor da energia de ionização do sexto elétron é muito maior do que a do quinto. Viva essa experiência. 2 www.colegiocursointellectus.com.br
Baixar