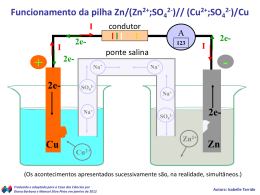
√ Eletroquímica é a área da química que estuda a tendência que os elétrons possuem em se transferirem em uma determinada reação química através de sua concentração e das espécies envolvidas. Reações de Oxidação e Redução -são reações que envolvem perda e ganho de elétrons, ou seja, espécies que se oxidam e espécies que se reduzem. Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g) -na reação acima temos o ataque ácido ao elemento Fe, tratandose de uma reação de óxido-redução; -quando introduzimos um fio de Cu em uma solução de AgNO3, podemos observar depois de um tempo ocorre a formação de um depósito de prata no fio de Cu e a solução adquire coloração azul característica dos íons Cu2+: Cu(s) → 2Ag+(aq) Cu(s) Cu2+(aq) + + 2e- → 2e2Ag(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s) Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s) -nota-se na reação acima uma transferência de elétrons com mudança na carga elétrica das espécies químicas (número de oxidação); Número de Oxidação -nos compostos iônicos o número de oxidação corresponde à própria carga do íon; -nas moléculas não existe transferência definitiva de elétrons, sendo o número de oxidação correspondente aos elétrons que o átomo iria adquirir se a ligação fosse rompida; Número de Oxidação nas Reações de OxidaçãoRedução Cu(s) → Cu2+(aq) + 2e- perda e-: sofreu oxidação; ag. redutor 2Ag+(aq) + 2e- → 2Ag(s) ganho de e-: sofreu redução; ag. oxidante -as semi-reações nos mostram que ocorre a perda de e- (reação de oxidação) e que ocorre o ganho de e- (reação de redução) simultaneamente; Cu0 sofreu oxidação, portanto, é o agente redutor pois ao ceder e- aos íons Ag+, provoca sua redução; íons Ag+ sofrem redução, portanto, agem como agente oxidante pois ao receberem e- do Cu, provocam sua oxidação. Resumindo: Cu0: perde e- → sofre oxidação Ag+: ganho e- → sofre redução → agente redutor → agente oxidante Balanceamento das Equações das Reações de Oxidação e Redução -reações de oxidação e redução ocorrem com transferência de e-, portanto, para balanceá-las é preciso igualar o número de eperdidos e recebidos pelas espécies envolvidas; -lâmina de Al em solução de CuSO4 com formação de Cu(s) e Al2(SO4)3: -vamos determinar as espécies envolvidas e a ∆Nox: Al(s) + Cu2+(aq) → Al3+(aq) + Cu(s) perdeu e-: sofreu oxidação; ag. redutor ∆Nox= 3 ganhou e-: sofreu redução; ag. oxidante ∆Nox= 2 1 átomo de Al perde 3e- → 2 átomos de Al perdem 6e1 íon de Cu2+ recebe 2e- → 3 íons de Cu2+ recebem 6e- 2Al(s) + 3Cu2+(aq) → 2Al3+(aq) + 3Cu(s) MnO2(aq) + KClO3(aq) + KOH → KCl(aq) + K2MnO4(aq) + H2O(l) perdeu e-: sofreu oxidação, ag. redutor ∆Nox= 2 e- ganhou e-: sofreu redução, ag. oxidante ∆Nox= 6 e- -temos que todo Mn presente na solução original sofreu oxidação originando K2MnO4; -enquanto todo o Cl presente na solução original sofreu redução dando origem ao KCl; 3MnO2(aq) + 1KClO3(aq) + 6KOH → KCl(aq) + 3K2MnO4(aq) + 3H2O(l) -solução de KMnO4 reage com solução de HCl: KMnO4(aq) + HCl(aq) → KCl(aq) + MnCl2(aq) + Cl2(g) + H2O(l) ganhou e-: sofreu redução; ag. oxidante ∆Nox= 5 perdeu e-: sofreu oxidação; ag. redutor ∆Nox= 1*2= 2 -temos que todo Mn presente na solução original sofreu redução originando MnCl2; -já o Cl presente no HCl originou KCl, MnCl2 e Cl2, mas somente uma parte dos seus átomos oxidou, originando de fato Cl2; 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O Balanceamento de Equações Redox -a equação redox deve exibir a oxidação e a redução; -vamos considerar aquelas que ocorrem sem um solvente, ou seja, estaremos munidos somente das fórmulas para todos os reagentes e produtos; Balanceamento de Equações Número de Oxidação pelo Método do Etapa 1: atribuir número de oxidação a todos os átomos; Etapa 2: observar qual átomo que perde e- e qual átomo que ganha e-, determinado quantos e- são ganhos e perdidos; Etapa 3: se há mais de um átomo ganhando ou perdendo e- em uma fórmula unitária, determine o total de número de e- perdidos ou recebidos por fórmula unitária; Etapa 4: iguale o ganho de e- pelo agente oxidante ao da perda pelo agente redutor colocando o coeficiente apropriado antes da fórmula de cada um, no lado esquerdo da equação; Etapa 5: complete o balanceamento por tentativa, balanceando os átomos que ganharam ou perderam elétrons, posteriormente todos os outros átomos, à exceção de O e H; e por fim os átomos de O e por último os átomos de H. Células Galvânicas -células eletroquímicas onde uma reação química espontânea é usada para gerar uma corrente elétrica, p.ex: uma bateria é um conjunto de células galvânicas unidas em série para produzir determinada voltagem; Pilhas -primeiro estudo se deu com Alessandro Volta 1800; -experimento constituído por conjunto de placas metálicas de Zn e Cu chamadas de eletrodos, imersos em solução eletrolítica; -posteriormente foi aperfeiçoada por Daniell em 1836 que dividiu esses eletrodos em duas semicelas; Descrição da Pilha de Daniell -transformação da energia química em energia elétrica; -essa energia química provém da transformação do Zn em ZnSO4, ou seja, o Zn vai sendo consumido; -dois eletrodos metálicos unidos por fio condutor e duas semicelas unidas por uma ponte salina contendo solução iônica; -a medida que a pilha funciona, ↑ o número de íons Zn ao redor do ânodo, porém, como esse eletrodo é negativo e os íons Zn positivo, o ↑ da quantidade desses íons faz ↓ a ddp entre o Cu e o Zn, ↓ sua intensidade; -ponte salina atua no sistema permitindo o escoamento de íons de uma semicela para outra. no eletrodo de Zn temos no eletrodo de Cu temos -espessamento da lâmina -corrosão da lâmina -diminuição da [Cu2+] -aumento da [Zn2+] -esses fatos podem ser explicados pelas semi-reações de redução e oxidação respectivamente: Cu2+(aq) + 2e- → Cu(s) Ânodo: Cátodo: Zn(aq) + Zn(s) → Zn2+ + 2e- Zn(s) → Zn2+ + 2eCu2+(aq) + 2e- → Cu(s) Cu2+(aq) ∴ representação da pilha: → Zn2+(aq) + Cu(s) Zn I Zn2+ II Cu2+ I Cu Potencial de Redução e Oxidação de Pilhas √ Pilha de Daniell -eletrodos de Zn e Cu; -ambos íons Zn2+(aq) e Cu2+(aq) têm a tendência de receber e-, porém, os íons Cu2+(aq) são os que sofrem redução; -podemos concluir que a tendência dos íons Cu2+(aq) em sofrer redução é maior que a do Zn2+(aq); -dizemos então que os íons Cu2+ têm maior potencial de redução (Ered); Cu2+(aq) + 2e- → Cu Ered Cu2+ > Ered Zn2+ -e o Zn sofrerá oxidação apresentando assim, maior potencial de oxidação (Eoxid); Zn(s) → Zn2+(aq) + 2e- Eoxid Zn > Eoxid Cu -podemos concluir que em uma pilha, a espécie que apresenta maior Ered sofre redução enquanto a outra espécie de maior Eoxid sofre oxidação; Potencial de uma Pilha -os e- fluem do eletrodo que ocorre a oxidação (ânodo) para o eletrodo em que ocorre a redução (cátodo) gerando uma ddp (∆E); A ddp (∆E) -depende das espécies químicas envolvidas; -das suas concentrações e da temperatura; -∆E é medido em condição-padrão que corresponde a espécies com concentração 1 mol L-1, 1 atm e 250C; ∆E0 = (E0red cátodo) - (E0red ânodo) ∆E0 = (E0 oxid ânodo) - (E0oxid ou cátodo) Medição dos Potenciais -para determinar os Ered e os Eoxid foi escolhido como eletrodo padrão o eletrodo de hidrogênio sendo E0red e E0oxid = 0; Pilha de Zn e H2 para determinar o E0 do Zn Zn(s) → Zn2+(aq) 2H+(aq) + 2e- → Zn(s) + 2H+(aq) → + 2eH2(g) Zn2+(aq) + H2(g) -o zinco sofre oxidação e provoca a redução dos íons H+ com formação de H2. ∆Ε pode ser calculada: ∆Ε0 = (E0red cátodo) - (E0red ânodo) -como tivemos redução de íons H+, seu potencial é maior que o do Zn, e o voltímetro forneceu ∆Ε0 = 0,76 V; 0,76 V = (0) - (E0red ânodo ) E0red ânodo = -0,76 V -analisando a Tabela de potencial-padrão de redução podemos perceber que o Li+ apresenta menor potencial de redução enquanto que o F2(g) apresenta o maior potencial de redução; Li+(aq) + F2(g) + e- → 2e- → Li(s) 2F-(aq) E0red = -3,05 V E0red = +2,87 V -F2(g) apresenta o maior potencial de redução sendo, portanto, o melhor agente oxidante; -como a redução é um processo inverso à oxidação, quanto maior o E0red de uma espécie, menor será sua facilidade em sofrer oxidação, portanto, quanto maior o Ered menor será o Eoxid. Li+(aq) + F2(g) + e- → 2e- → Li(s) E0red = -3,05 V E0oxid = +3,05 V 2F-(aq) E0red = +2,87 V E0oxid = -2,87 V -Li(s) apresenta o maior potencial de oxidação sendo, portanto, o melhor agente redutor; Cálculo da ddp (∆Ε ∆Ε) ∆Ε -pilha formada por eletrodos de Al e Cu; Espontaneidade de uma Reação -pilhas funcionam através de reações espontâneas apresentando sempre ∆Ε0 > 0; fluxo e- menor E0red maior tendência em perder e- reação espontânea maior E0red maior tendência em receber ereação não-espontânea -para determinarmos se uma reação é espontânea e, portanto, constituir uma pilha devemos separar a reação global nas duas semi-reações: 2Al3+(aq) + 3Pb(s) Al3+(aq) Pb(s) → + 3e→ 2Al(s) → + 3Pb2+(aq) Al(s) Pb2+(aq) + 2e- 10 semi-reação: redução do alumínio E0red = -1,66 V 20 semi-reação: oxidação do chumbo E0red = -0,13 V ∆Ε0 = E0(red cátodo) - E0(red ânodo) = – 1,68 – (-0,13) ∆Ε0 = -1,55 V (não-espontânea, não caracterizando uma pilha). Corrosão de Metais -processo eletroquímico pelo qual ocorre reação de óxidoredução; Corrosão Fe -uma vez que E°red(Fe2+) < E°red(O2), o Fe pode ser oxidado pelo oxigênio; -o oxigênio dissolvido em água normalmente provoca a oxidação do Fe; Fe(s) → Fe2+(aq) + 2eO2(g) + 2H2O(l) + 4e- 4OH-(aq) → 2 Fe(s) + O2(g) + 2H2O(l) → 4 Fe(OH)2(s) + O2(g) + 2H2O(l) 2Fe(OH)2(s) → 4Fe(OH)3(s) -o Fe2+ inicialmente formado pode ser ainda mais oxidado, para Fe3+, que forma a ferrugem, Fe2O3.xH2O(s); -a oxidação ocorre no local com a maior concentração de O2 ou ainda em superfícies rugosas. Prevenindo a Corrosão do Fe -a corrosão pode ser impedida através do revestimento do ferro com tinta ou um outro metal; -o ferro galvanizado é revestido com uma fina camada de zinco; Eletrodo de sacrifício -proteção de um metal, no caso do Fe, utilizamos um metal que apresente maior tendência a perder e- ( < E0red ou > E0oxid). -o zinco protege o ferro uma vez que o Zn é o anodo e Fe é o catodo: Zn2+(aq) +2e- → Zn(s) E°red = -0,76 V Fe2+(aq) + 2e- → Fe(s) E°red = -0,44 V -com os potenciais padrão de redução acima, o Zn é mais facilmente oxidável do que o Fe; -o zinco funciona como uma “VITAMINA” para o ferro!!! -as vitaminas são antioxidantes, ou seja, “oxidam antes”, para prevenir (ou controlar) a oxidação de alimentos e de substâncias. Nos organismos vivos atuam principalmente ao impedir a formação de radicais livres; -vários alimentos são ricos em outras substâncias antioxidantes, como os flavonóides em chás e vinho.
Download