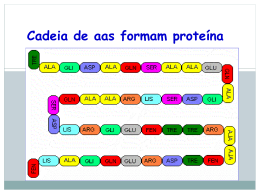
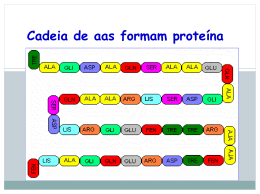
BIOQUÍMICA Profa. Denise Esteves Moritz - UNISUL AULA 03 AMINOÁCIDOS PROFA. DENISE ESTEVES MORITZ Nutrição – UNISUL - Tubarão 1 AMINOÁCIDOS • Estruturas monoméricas formam proteínas por ligações peptídicas. • 1806 – descoberta do primeiro aminoácido, ASPARAGINA, encontrado no aspargo. • até 1938 – descoberta dos 20 aminoácidos existentes, o último foi a TREONINA. •Todos 20 AAs são -aminoácidos. Possuem grupo carboxila (COO-) e amino (NH3+) ligados ao mesmo átomo de carbono (carbono α). • Diferem nas cadeias laterais, ou grupos R (RADICAL). RADICAL 2 Profa. Denise Esteves Moritz - UNISUL AMINOÁCIDOS •AA variam na estrutura, tamanho e carga elétrica que influenciam a sua solubilidade em água. •Todos os AA exceto a glicina, o carbono está ligado a 4 diferentes grupos: carboxila, amino, grupo R e H+. •Na glicina o grupo R é um outro átomo de H+. GLICINA 3 Profa. Denise Esteves Moritz - UNISUL Propriedades Gerais fisiológico os grupos NH+3 e COOH dos 20 AAs ionizam-se. • EM pH •Substâncias anfóteras - Os AAs podem atuar como ácido ou base. • Moléculas que carregam grupos de polaridade oposta como os AAs são conhecidas como íons dipolares. • São solúveis em água e insolúveis em solventes orgânicos. 4 Profa. Denise Esteves Moritz - UNISUL CLASSIFICAÇÃO E CARACTERÍSTICAS DOS AMINOÁCIDOS Os AAs são classificados de acordo com a Polaridade das cadeias laterais: 1. Grupo R - apolares 2. Grupo R - aromáticos 3. Grupo R - polares não-carregados 4. Grupo R - polares carregados positivamente 5. Grupo R – polares carregados negativamente 5 Profa. Denise Esteves Moritz - UNISUL Grupo R - apolar e alifático Glicina Alanina Grupo R - aromáticos Valina Fenilalanina Tirosina Triptofano Grupo R - polares carregados positivamente Leucina Metionina Isoleucina Grupo R - polares não-carregados Serina Treonina Cisteína Lisina Histidina Arginina Grupo R - polares carregados negativamente Prolina Asparagina Glutamina Aspartato Glutamato 6 Profa. Denise Esteves Moritz - UNISUL Classificação aa Aa Alifáticos: 7 Profa. Denise Esteves Moritz - UNISUL Classificação aa Aa Aromáticos 8 Profa. Denise Esteves Moritz - UNISUL Classificação aa Aa Básicos 9 Profa. Denise Esteves Moritz - UNISUL Classificação aa Aa Ácidos 10 Profa. Denise Esteves Moritz - UNISUL Classificação aa 11 Profa. Denise Esteves Moritz - UNISUL Classificação aa Aa APOLARES 12 Profa. Denise Esteves Moritz - UNISUL Generalidades: Vegetais fabricam aminoácidos a partir de cadeias de carbono obtidas na fotossíntese e de nitrato (NO-3) retirado do ambiente. Animais não produzem aminoácidos. Os seres humanos conseguem obter aminoácidos da quebra de proteínas. Os aminoácidos essenciais são aqueles que não podem ser obtidos da quebra de proteínas. Por isso devem estar presentes na alimentação. 13 Profa. Denise Esteves Moritz - UNISUL AMINOÁCIDOS ESSENCIAIS Arginina* NÃO ESSENCIAIS Alanina Histidina* Aspartato Isoleusina Asparagina Leusina Cisteína Lisina Glutamato Meteonina Glutamina Fenilalanina Glicina Treonina Prolina Triptofano Serina Valina Tirosina 14 Profa. Denise Esteves Moritz - UNISUL Estereoquímica: Para os AAs comuns, exceto glicina, o carbono α está ligado a 4 diferentes grupos e forma 2 arranjos espaciais. Os AAs apresentam 2 estereoisômeros – D (dextrógiro – desvia a luz polarizada p/ Direita)) e L – (Levógiro – desvio à esquerda). Toda molécula com centro quiral* são opticamente ativos: *Não são sobrepostas uma a outra. 15 Profa. Denise Esteves Moritz - UNISUL Importante: os aminoácidos biologicamente ativos são sempre levógiros(L). Os dextrógiros(D) não têm ação biológica. 16 Profa. Denise Esteves Moritz - UNISUL Nomenclatura 1 - Convenção de Fischer • São explicadas pelo sistema D, L proposto em 1891 por Emil Fischer. • Ex. Isômeros espaciais ou estereoisômeros, do gliceraldeído são designados D-gliceraldeído e Lgliceraldeído. • Cada centro assimétrico pode ter duas configurações possíveis. 17 Profa. Denise Esteves Moritz - UNISUL Nomenclatura Os carbonos são alinhados verticalmente e: OH para direita = D – gliceraldeído (Destrógira) OH para esquerda = L – gliceraldeído (Levógira) 18 Profa. Denise Esteves Moritz - UNISUL Nomenclatura Regra aplicada para os AAs: • D - aminoácidos = grupo NH3 na direita. • L - aminoácidos = grupo NH3 na esquerda. • Todos os AAs originários das proteínas apresentam configuração L. 19 Profa. Denise Esteves Moritz - UNISUL 20 Profa. Denise Esteves Moritz - UNISUL Ocorência de Aa nas células Só existem 20 Aa? 21 Profa. Denise Esteves Moritz - UNISUL Aminoácidos Incomuns: • Resultam da modificação específica de um resíduo de aminoácido após a síntese protéica. • Ocorre adição de grupos químicos nas cadeias laterais do AA: hidroxilação, metilação, acetilação, carboxilação e fosforilação. 22 Profa. Denise Esteves Moritz - UNISUL Aminoácidos Incomuns Ex: • 4 - hidroxiprolina, derivado da prolina encontrado na parede celular de plantas e no colágeno. • 5 - hidroxilisina, derivado da lisina encontrado no colágeno. • 6 - N-metil-lisina, constituinte da miosina (Proteína contrátil do músculo). • γ - carboxiglutamato, encontrado nos fatores de coagulação sangüínea (Protrombina, fator VII, fator IX, fator X, proteína C e S). • Desmosina, derivado de 4 resíduos de lisina, encontrada na elastina. • Selenocisteína, contêm Se ao invés de S da cisteína. Derivada da serina, constituinte de poucas proteínas conhecidas. • Outros 300 aminoácidos são encontrados nas células, mas não são constituintes das proteínas. 23 Profa. Denise Esteves Moritz - UNISUL Função aa FUNÇÕES BIOLÓGICAS DOS AAs Estrutura da célula. Hormônios. Receptores de proteínas e hormônios. Transporte de metabólitos e íons. Atividade enzimática. Imunidade. Gliconeogênese no jejum e diabetes. PROPRIEDADES ORTOMOLECULARES Antioxidante. Pro-oxidante. Metilação e remetilação. Quelante. Desintoxicante. Precursor de hormônios. 24 Profa. Denise Esteves Moritz - UNISUL Função aa FUNÇÕES ESPECIALIZADAS DOS AMINOÁCIDOS Funcionam como mensageiros químicos na comunicação entre células. • Glicina, ácido γ–aminobutírico (GABA) e a dopamina são neurotransmissores. • Histamina, produto da descaboxilação da histidina, potente mediador local em reações alérgicas. • Tiroxina, hormônio tireóideo, derivado da tirosina. 25 Profa. Denise Esteves Moritz - UNISUL Propriedades aa Propriedades ácido – base O grupo COO- (carga negativa) e NH3+ (carga positiva) são carregados em pH neutro, formando os zwintterions (anfóteros). Podem atuar tanto como ácido (doador de prótons), quanto base (receptor de prótons). 26 Profa. Denise Esteves Moritz - UNISUL Propriedades aa 27 Profa. Denise Esteves Moritz - UNISUL Propriedades aa 28 Profa. Denise Esteves Moritz - UNISUL PEPTÍDEOS Ligação aa São polímeros de α-aminoácidos, que se polimerizam por eliminação de um mol de H2O. Ligação peptídica. LIGAÇÃO PEPTÍDICA 29 Profa. Denise Esteves Moritz - UNISUL Ligação Peptídica O resíduo de AA na extremidade com o grupo α–amino é o resíduo terminal amino (N-terminal) e o resíduo na outra extremidade, grupo carboxila livre, é o resíduo terminal Profa. Denise Esteves Moritz - UNISUL carboxila (C-terminal) 30 LIGAÇÃO PEPTÍDICA 31 Profa. Denise Esteves Moritz - UNISUL CLASSIFICAÇÃO DOS PEPTÍDEOS São classificados de acordo com o número de resíduos de AA na cadeia: •Dipeptídeos – 2 resíduos de AA. •Tripeptídeos – 3 resíduos de AA. •Tetrapeptídeos – 4 resíduos de AA. •Pentapeptídeos – 5 resíduos de AA. •Oligopeptídeos – uns poucos resíduos de AA. •Polipeptídeos - são polímeros lineares de até 40 resíduos de AA. •Mais de 40 resíduos é considerado proteína. 32 Profa. Denise Esteves Moritz - UNISUL PEPTÍDEOS DE IMPORTÂNCIA BIOLÓGICA Peptídeos Os menores peptídeos podem ter efeitos biológicos importantes. Ex: Aspartame - L-aspartil-L-fenilalanil metil éster, adoçante artificial. • Hormônios são peptídeos pequenos: • Ocitocina (estimula contração uterina), • Bradicinina (inibe inflamação dos tecidos), • Tirotropina (hormônio da hipófise). • Venenos tóxicos de cogumelos e alguns antibióticos. • Insulina e Glucagon (hormônios pancreáticos). • Corticotropina (estimula córtex adrenal). 33 Profa. Denise Esteves Moritz - UNISUL PROTEÍNAS - Classificação - Definição - Composição - Ocorrência - Propriedades Físicas 34 Profa. Denise Esteves Moritz - UNISUL Proteínas DEFINIÇÃO Proteína vem do grego protos = primeiro São macromoléculas resultantes da condensação de moléculas aminoácidos através da ligação peptídica. As proteínas são polipeptídios que resultam na condensação de milhares de moléculas de aminoácidos. As sua macromoléculas possuem pesos moleculares variados desde alguns milhares até vários milhões. 35 Profa. Denise Esteves Moritz - UNISUL Proteínas Uma proteína pode conter até milhares de aminoácidos diferentes, podendo até virar macromoléculas tridimensionais. COMPOSIÇÃO Composição: Citocromo C: 13.000 Ribonuclease: 14.000 Mioglobulina: 17.000 Gliadina: 28.000 Pepsina: 35.500 Insulina: 36.000 Ovoalbunina: 45.000 Hemoglobina: 68.000 Soroglobulina: 180.000 Caseína: 375.000 Fribrinogênio: 450.000 Tiroglobulina: 630.000 Hemocianina: 2.800.000 Vírus: 250.000.000 - o - - Contém sempre: elementos organógenos: C, H, O, N menor proporção: S, P, I, Br Composição percentual: C: 50 à 55% H: 6 à 7% O: 19 à 24% N: 15 à 19% S: 0 à 2,5% 36 Profa. Denise Esteves Moritz - UNISUL Proteínas Ocorrência São muitas as fontes, e o número de proteínas existentes na Natureza é praticamente infinito, embora o número de aminoácidos que as constituem seja bastante reduzido, em torno de 20. Isto ocorre porque o número de associações dos aminoácidos (aa) se dá conforme possíveis combinações: 3 aa diferentes: A, B e C Conduzem a 6 tripeptídeos: ABC, ACB, BAC, BCA, CAB e CBA. (3! = 3 x 2 x 1 = 6) 4 aa diferentes: A, B, C e D - Conduzem a 24 tetrapeptídeos (4! = 4 x 3 x 2 x 1 = 24) 10 aa diferentes conduzem a mais de três milhões (3.628.800) de decapeptídeos, sem a inclusão dos possíveis isômeros ópticos. (10! = 10 x 9 x 8 x 7 x 6 x ...) 37 Profa. Denise Esteves Moritz - UNISUL Proteínas Exemplo de Proteínas Insulina – Pâncreas Hemoglobina – Sangue dos vertebrados Caseína – Leite Queratina – Chifres, unhas e cascos de animais Hemocianina – Sangue dos invertebrados Pepsina – Suco gástrico Albumina – Ovo, leite e sangue Clorofila – Vegetais verdes 38 Profa. Denise Esteves Moritz - UNISUL Proteínas 39 Profa. Denise Esteves Moritz - UNISUL IMPORTÂNCIA Proteínas Juntamente com os carboidratos e os lipídeos, as proteínas constituem a alimentação básica dos animais. No entanto, podemos dizer que as proteínas são ainda mais importantes, pois são fundamentais na estrutura, funcionamento e reprodução de todas as células vivas. 40 Profa. Denise Esteves Moritz - UNISUL Proteínas Propriedades Físicas As proteínas são substâncias sólidas, incolores, insolúveis em solventes orgânicos, e algumas solúveis em água, enquanto outras solúveis em soluções de sais, ácidos ou bases, produzindo colóides. 41 Profa. Denise Esteves Moritz - UNISUL Proteínas CLASSIFICAÇÃO 1. De acordo com a sua natureza química. 2. De acordo com seu papel biológico. 1. De acordo com seu valor nutritivo. • Simples • Conjugadas • Derivadas • Estruturais • Reguladoras • Protetoras • Simples • Conjugadas • Derivadas 42 Profa. Denise Esteves Moritz - UNISUL Classificação 1. De acordo com a sua natureza química a) Proteínas simples, homoproteínas ou holoproteínas: São as que por hidrólise, fornecem exclusivamente os aa. Ex: glicil-alanina + água glicina + alanina; Histonas: proteínas solúveis em água e insolúveis em solução de amônia e coaguláveis pelo calor. Ex: hemoglobina (sangue). Albuminas: são proteínas solúveis na água, solúveis em soluções diluídas de sais e coaguláveis pelo calor. Ex: ovoalbumina (clara de ovo); Globulinas: são proteínas insolúveis em água, solúveis em solução de sais e coaguláveis pelo calor. Ex: ovoglobulina (ovo), lactoglobulina (leite), soroblobulina (soro sangüíneo), amandina (amêndoas). Glutelinas: são proteínas insolúveis em água, solúveis em soluções de ácidos ou bases e, coaguláveis pelo calor. Ex: glutenina (trigo). Prolaminas ou gliadinas: são proteínas insolúveis em água, em soluções de sais, soluções de ácidos e soluções de bases. Ex: zeína (milho), gliadina (trigo), linina (malte). 43 Profa. Denise Esteves Moritz - UNISUL Classificação b) Proteínas conjugadas Complexas ou heteroproteínas: São as que por hidrólise, produzem aa ao lado de outros compostos denominados núcleo prostético ou grupo prostético. De acordo com a natureza do grupo prostético, as heteroproteínas podem ser: I. Glicoproteínas: grupo prostético = glicídeo. Ex: mucina (saliva), osseomucóide (ossos), gonadotrofina coriônica (ovário), tendomucóide (tendões). II. Fosfoproteínas: grupo prostético = ácido fosfórico. Ex: caseína (leite), vitelina (gema do ovo). III. Cromoproteínas: grupo prostético = pigmento (substância colorida). Ex: hemoglobina (sangue dos vertebrados), clorofila (vegetais verdes), hemocianina (sangue dos invertebrados). 44 Profa. Denise Esteves Moritz - UNISUL Classificação b) Proteínas conjugadas IV.Nucleoproteínas: grupo prostético = ácido nucleico (RNA ou ARN = ácido ribonucleico e DNA ou ADN = ácido desoxirribonucleico) Ex: citoglobulinas (citoplasma), nucleoplasma (núcleos celulares). V. Metaloproteínas: grupo prostético = metal. Ex: hemoglobina (sangue). VI.Lipoproteínas: grupo prostético = ácidos graxos VII.Lecitoproteínas: grupo prostético = lecitina 45 Profa. Denise Esteves Moritz - UNISUL c) Proteínas derivadas: Classificação São as derivadas da hidrólise parcial de proteínas naturais. Essas proteínas são produzidas durante a digestão das proteínas naturais do organismo. Ex: proteanas, metaproteínas, proteínas coaguladas, proteosas, peptonas, polipeptídeos. 46 Profa. Denise Esteves Moritz - UNISUL Classificação 2. Seu papel biológico a) Proteínas Estruturais ou de Construção: são as responsáveis pela construção dos tecidos. Colágeno (ossos, cartilagem, tendões e pele); Queratina (pelos, cabelo, unha); Miosina (músculos responsáveis pela contração); Albumina (plasma sangüíneo); - Hemoglobina (hemáceas – transporta gases). 47 Profa. Denise Esteves Moritz - UNISUL Classificação 2. Seu papel biológico b)Proteínas Reguladoras: são as que controlam e regulam as funções orgânicas. Enzimas (são catalisadoras das reações do metabolismo: amilase, maltase, pepsina, etc) Hormônios (regulam as funções orgânicas: insulina, gastrina ACTH e etc). 48 Profa. Denise Esteves Moritz - UNISUL Classificação 2. Seu papel biológico c) Proteínas Protetoras ou de Defesa: são os anticorpos que defendem o organismo e são produzidos por células específicas do sistema imunológico, chamadas linfócitos. - Antitoxinas: neutralizam as toxinas dos agentes de infecção, como as bactérias; - Aglutininas: aglutinam certos agentes de infecção; - Opsoninas: tornam os agentes de infecção mais facilmente atacados pelos fagócitos; - Lisinas: dissolvem certos agentes de infecção 49 Profa. Denise Esteves Moritz - UNISUL 3. Valor Nutritivo 1. • • • • • • • Classificação Chamadas também de Proteínas Completas: são as que provêm e mantêm o ser vivo. ALTO valor Biológico Caseína (leite) Ovoalbuminas e ovovitelinas (ovo) Glicinina (soja) Edestina e glutenina (cereais) Lactoalbuminas (leite e queijo) Albumina e miosina (carne) Excelsina (castanha do Pará) Contém Aa em quantidade e qualidade suficientes para suprir as necessidades! 2. Proteínas semi-completas: são as que provêm,mas não mantêm o ser vivo. • • • • Gliadina (trigo) Legunina (ervilha) Faseolina (feijão) Legumelina (soja) Contém Aa em quantidade ou qualidade insuficientes para suprir as necessidades! IMPORTANTE: Uma proteína é considerada de ALTO VALOR BIOLÓGICO – quando possui em sua composição TODOS os aminoácidos essenciais em quantidades adequadas. 50 Profa. Denise Esteves Moritz - UNISUL 3. Valor Nutritivo 3. - Classificação Proteínas incompletas ou não completas: são as proteínas incapazes de prover e manter a vida. Zeína (milho – falta triptofano e tirosina) Gelatina (falta triptofano e tirosina) Contém Aa em quantidade ou qualidade insuficientes para suprir as necessidades! Chamadas também de BAIXO valor Biológico - 51 Profa. Denise Esteves Moritz - UNISUL FIM! 52 Profa. Denise Esteves Moritz - UNISUL
Baixar