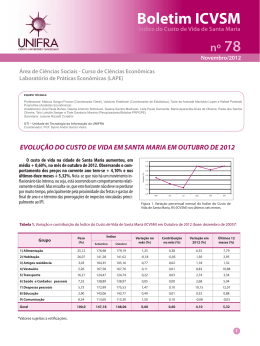
Trabalho Submetido para Avaliação - 17/09/2012 22:47:03 PRODUÇÃO DE MATERIAL VISUAL PARA SER INSERIDO NO PORTAL MAIS UNIFRA JANE KELLY LUDWIG ([email protected]) / Física Médica - Unifra, Santa Maria - RS RYENNE BAÑOLAS BUENO ([email protected]) / Física Médica - Unifra, Santa Maria - RS ORIENTADOR: ANTÔNIO VICENTE LIMA PORTO ([email protected]) / Física Médica - Unifra, Santa Maria RS Palavras-Chave: pressão, temperatura, volume, variáveis de estado, lei dos gases ideais A lei dos gases ideais é a equação de estado do gás ideal, um gás hipotético, onde se observa relações entre a temperatura, a pressão e o volume, e explica as propriedades de gases que se encontram a baixa pressão e com pequenos valores de massa específica - gás rarefeito - para que a distância entre as moléculas seja a maior possível. A temperatura absoluta de uma amostra de um gás de pequena massa específica é proporcional ao seu volume quando a pressão é constante, e é proporcional à sua pressão, quando o volume é constante. A equação P.V=n.R.T , descreve a relação entre a pressão, o volume, a temperatura e a quantidade de um gás ideal (HALLIDAY, D. et al., 2002; TIPLER, Paul A., 2000). Os processos são realizados mantendo constante uma de suas variáveis. Pressão, volume e temperatura estão ligados umas às outras, ao manter uma delas constante, as duas outras serão direta ou inversamente proporcionais. As leis do gás ideal são: a lei de Boyle-Mariotte, também chamado de processo isobárico, afirma que a temperatura constante, o volume do gás é inversamente proporcional à sua pressão; a lei de Charles e Gay-Lussac diz respeito às transformações isométricas, isto é, aquelas que se processam a volume constante, e a temperatura é diretamente proporcional a pressão; a lei de Amontons o volume é constante, a temperatura aumenta e a pressão também (HALLIDAY, D. et al., 2002; TIPLER, Paul A., 2000). O objetivo deste trabalho é observar experimentalmente a relação de dependência entre as variáveis de estado de um gás, pressão (P), volume (V) e temperatura (T) utilizando o equipamento da PHYWE, criado para tal procedimento (PHYWE; 1995). Assim, após a conclusão dos experimentos, será disponibilizado ao site mais unifra um módulo didático, em linguagem compatível ao portal digital. Para avaliar as relações de dependência, está sendo utilizado o equipamento chamado “Conjunto de experimentos para estudo das variáveis de estado do gás”, com reservatório de mercúrio (manômetro de mercúrio) e um sistema de aquecimento com circulador de água para alterar a temperatura do volume de ar (PHYWE; 1995). A partir do primeiro experimento, à pressão constante, o tempo decorrido para o levantamento de todos os dados foi de duas horas. Observou-se que nos resultados apresentados, há uma relação linear, satisfazendo a lei dos gases ideais, pois quando temos uma pressão constante a temperatura e o volume são diretamente proporcionais. REFERÊNCIAS: PHYWE; University Laboratory Experiments Physics; Göttingen; PHYWE SYSTEME GMBH; 1995. TIPLER, Paul A., MOSCA, Gene; TEMPERATURA E TEORIA CINÉTICA DOS GASES; W. H. Freeman and Company; Física Para Cientistas e Engenheiros; Rio de Janeiro; LTC; 577-582; 2009. HALLIDAY. David et al.; A TEORIA CINÉTICA DOS GASES; John Wiley & Sons, Inc.; Fundamentos de Física; Rio de Janeiro; LTC; 167-170; 2002.
Baixar