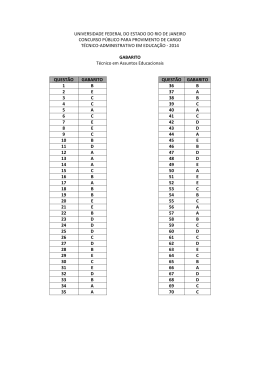
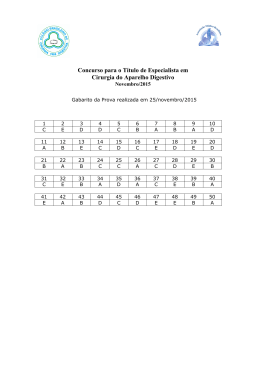
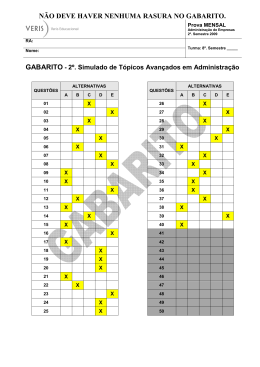
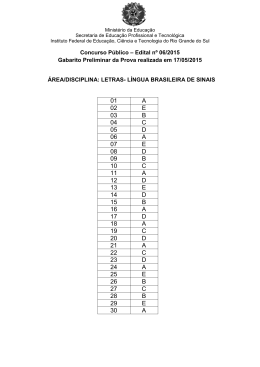
Acreditamos que a prática nos tornará aptos a vencer nossos desafios e assim aumentaremos no grau de conhecimento!!! Exercitem Bem!!! “Se vejo, esqueço; se leio lembro; SE ESTUDO, APRENDO” Confio muito no seu sucesso !!! A todos um ótimo estudo!! - Prof. Alexandre Lima – 1. Explique por que água pura exposta à atmosfera e sob pressão de 1,0 atm entra em ebulição em uma temperatura de 100°C, enquanto água pura exposta à pressão atmosférica de 0,7 atm entra em ebulição em uma temperatura de 90°C. Gabarito: A pressão de vapor de uma substância aumenta com o aumento da temperatura. Quando a pressão de vapor se iguala à pressão local (pressão atmosférica), o líquido entra em ebulição; portanto, em um local onde a pressão atmosférica é 0,7atm, a água entra em ebulição em uma temperatura menor que 100°C. 2. Analise as proposições sobre o ESTUDO DE LÍQUIDOS e de SOLUÇÕES. ( ) Sob mesma pressão, a temperatura da ebulição da água do mar é menor do que a da água pura. ( ) Duas soluções aquosas têm a mesma pressão de vapor-d'água desde que os solutos não sejam voláteis, sejam iônicos e as soluções tenham a mesma concentração, em mol/L. ( ) A pressão de vapor de um líquido puro mantém-se constante desde que a massa do mesmo fique constante. ( ) A temperatura de congelamento de uma solução aquosa 0,10mol/L de sal de cozinha é a mesma que a de uma solução aquosa 0,20mol/L de açúcar comum. ( ) As propriedades coligativas das soluções são aquelas que dependem da natureza do soluto e do solvente e não do número de partículas dissolvidas. Gabarito: F F F V F 3. Certas propriedades físicas de um solvente, tais como temperatura de ebulição e de solidificação, são alteradas quando nele dissolvemos um soluto não volátil. Para verificar esse fato, quatro sais distintos foram dissolvidos em frascos contendo a mesma quantidade de água, como indica o esquema a seguir: Coloque as soluções I, II, III e IV em ordem crescente de abaixamento da temperatura de solidificação que ocorre devido à adição do soluto Gabarito: IV < II < I < III 4. Unifor-CE Considere as seguintes transformações: I. Degelo de um “freezer”. II. Sublimação da naftalina. III. Formação de uma nuvem de chuva a partir do vapor d’água do ar. IV. Combustão do álcool comum. Dessas transformações, são exotérmicas somente: a) I e II b) II e III c) III e IV d) I, II e IV e) II, III e IV Gabarito: C 5. Os valores de energia de ligação entre alguns átomos são fornecidos no quadro abaixo. Considerando a reação representada por CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(v) o valor aproximado de ∆H em kJ é de: a) – 820 d) +360 b) – 360 e) + 820 c) +106 Gabarito: A 6. UFRS O carbeto de tungstênio, WC, é uma substância muito dura e, por esta razão, é utilizada na fabricação de vários tipos de ferramentas. A variação de entalpia da reação de formação do carbeto de tungstênio a partir dos elementos Cgrafite e W(s) é difícil de ser medida diretamente, pois a reação ocorre a 1.400ºC. No entanto, pode-se medir com facilidade os calores de combustão dos elementos Cgrafite, W(s) e do carbeto de tungstênio, WC(s): Pode-se, então, calcular o valor da entalpia da reação abaixo e concluir se a mesma é endotérmica ou exotérmica: A qual alternativa correspondem o valor de ∆H e o tipo de reação? Gabarito: C 7. Gabarito: C 8. Gabarito: D 9. Gabarito: 3,09Kcal 10. Gabarito: A 11. Gabarito: A
Baixar