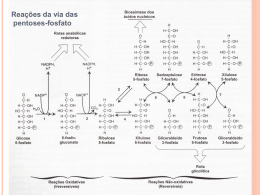
EM PORTUGUÊS MÉDICA BIOQUÍMICA MÉDICA John W. Baynes MS, PhD e Marek H. Dominiczak, MD, FRCPath 3ªEDIÇÃO • Oferece cobertura completa e atualizada dos mais recentes conceitos da área. Quadros de Conceitos Avançados • Utiliza quadros clínicos e integra tópicos de medicina clínica no texto para mostrar como a bioquímica é relevante para os problemas do dia a dia dos pacientes – ideal para cursos integrados baseados em problemas do cotidiano. Quadros de Exames Clínicos • Inclui quadros de conceitos avançados para cobertura em profundidade de tópicos importantes, incluindo pesquisas recentes em bioquímica. Ilustrações Coloridas • Incorpora formidáveis ilustrações coloridas, incluindo um sistema exclusivo de ícones que trazem a bioquímica à vida. Questões de Aprendizado • Ajuda os estudantes a guardar informações usando quadros de aprendizado ativo que testam o conhecimento no final de cada capítulo. O resultado é um pacote completo para o estudante de medicina. www.elsevier.com.br www.studentconsult.com.br A compra deste livro permite acesso gratuito ao www.studentconsult.com.br, que contém perguntas e respostas comentadas, links integrados, todos os quadros do livro impresso e banco de imagens. Além desses conteúdos em português, também permite o acesso gratuito ao conteúdo integral do livro em inglês no site www.studentconsult.com A aquisição desta obra habilita o acesso aos sites www.studentconsult.com e www.studentconsult.com.br. Os conteúdos publicados nestes sites permanecerão disponíveis até o lançamento da próxima edição em inglês e português respectivamente desta obra ou até que esta edição em inglês e português respectivamente não esteja mais disponível para venda pela Elsevier, o que ocorrer primeiro. John W. Baynes • Marek H. Dominiczak BIOQUÍMICA Quadros Clínicos • Explica conceitos difíceis usando casos clínicos para ajudar os estudantes a aplicar o conhecimento básico na medicina clínica. 3ªEDIÇÃO MÉDICA Este texto é ideal para apoiar o atual currículo de bioquímica, que mapeia o caminho para futuros médicos, apresentando a ciência básica e a prática médica de forma concisa e integrada. Organizado com características especiais, tais como Quadros Clínicos, Quadros de Conceitos Avançados, Quadros de Exames Clínicos, Ilustrações Coloridas e Questões de Aprendizado, mostra o conhecimento de forma clara e com grande estilo visual, perfeito para os estudantes de medicina de hoje. Este livro vem também com acesso ao site STUDENT CONSULT! Características especiais BIOQUÍMICA Baynes Dominiczak Classificação de Arquivo Recomendada BIOQUÍMICA TRADUÇÃO DA 3ª EDIÇÃO BIOQUÍMICA MÉDICA Médica Bioquímica TERCEIRA EDIÇÃO Baynes000.indd i 12/13/2010 3:02:48 PM BIOQUÍMICA MÉDICA TERCEIRA EDIÇÃO John W Baynes PhD Carolina Distinguished Professor Emeritus Department of Chemistry and Biochemistry GraduateSc ience Research Center UniversityofSou thC arolina Columbia,South Carolina USA Marek H Dominiczak MD FRCPath FRCP(Glas) Professorint he MedicalFac ulty UniversityofG lasgow ConsultantBioc hemist NHS Greater Glasgow and Clyde GartnavelG eneral Hospital Glasgow UK Baynes000.indd iii 12/13/2010 3:02:48 PM Do original: Medical Biochemistry, Third edition 1999, 2005 por Elsevier Limited Tradução autorizada do idioma inglês da edição publicada por Mosby – um selo editorial Elsevier Inc. ISBN: 978-0-323-05371-6 2011 Elsevier Editora Ltda. Todos os direitos reservados e protegidos pela Lei 9.610 de 19/02/1998. Nenhuma parte deste livro, sem autorização prévia por escrito da editora, poderá ser reproduzida ou transmitida sejam quais forem os meios empregados: eletrônicos, mecânicos, fotográficos, gravação ou quaisquer outros. ISBN: 978-85-352-3561-6 Capa Interface/Sergio Liuzzi Editoração Eletrônica Futura Assessoria e Serviços Ltda. Elsevier Editora Ltda. Conhecimento sem Fronteiras Rua Sete de Setembro, nº 111 – 16º andar 20050-006 – Centro – Rio de Janeiro – RJ Rua Quintana, nº 753 – 8º andar 04569-011 – Brooklin – São Paulo – SP Serviço de Atendimento ao Cliente 0800 026 53 40 [email protected] Preencha a ficha de cadastro no final deste livro e receba gratuitamente informações sobre os lançamentos e promoções da Elsevier. Consulte também nosso catálogo completo, os últimos lançamentos e os serviços exclusivos no site www.elsevier.com.br NOTA O conhecimento médico está em permanente mudança. Os cuidados normais de segurança devem ser seguidos, mas, como as novas pesquisas e a experiência clínica ampliam nosso conhecimento, alterações no tratamento e terapia à base de fármacos podem ser necessárias ou apropriadas. Os leitores são aconselhados a checar informações mais atuais dos produtos, fornecidas pelos fabricantes de cada fármaco a ser administrado, para verificar a dose recomendada, o método e a duração da administração e as contraindicações. É responsabilidade do médico, com base na experiência e contando com o conhecimento do paciente, determinar as dosagens e o melhor tratamento para cada um individualmente. Nem o editor nem o autor assumem qualquer responsabilidade por eventual dano ou perda a pessoas ou a propriedade originada por esta publicação. O Editor CIP-BRASIL. CATALOGAÇÃO-NA-FONTE SINDICATO NACIONAL DOS EDITORES DE LIVROS, RJ B347b Baynes, John Bioquímica médica / John W. Baynes e Marek H. Dominiczak ; [tradução de Jacyara Maria Brito Macedo... et al.]. - Rio de Janeiro : Elsevier, 2010. il. Tradução de: Medical biochemistry, 3rd ed Apêndice Inclui bibliografia e índice ISBN 978-85-352-3561-6 1. Bioquímica clínica. I. Dominiczak, Marek H. II. Título. 09-4970. Baynes000.indd iv CDD: 612.015 CDU: 612.015 12/13/2010 3:02:48 PM Sumário 1. Introdução ............................................ 1 6. Proteínas catalisadoras – Enzimas .... 59 J. W. Baynes e M. H. Dominiczak Bioquímica e medicina clínica.............................................1 Bioquímica em duas páginas ...............................................1 Palavra final ........................................................................2 J. Fujii Introdução.........................................................................59 Reações enzimáticas ..........................................................59 Cinética enzimática ...........................................................62 Mecanismos de ação das enzimas......................................64 Inibição enzimática ...........................................................65 Regulação da atividade enzimática ...................................68 Medida enzimática da glicose no sangue...........................70 2. Aminoácidos e Proteínas ...................... 5 N. Taniguchi Introdução...........................................................................5 Aminoácidos .......................................................................5 Tampões ............................................................................10 Peptídios e proteínas ..........................................................11 Purificação e caracterização das proteínas .......................14 Análise da estrutura das proteínas....................................17 3. Carboidratos e Lipídios ..................... 23 J. W. Baynes Introdução.........................................................................23 Carboidratos ......................................................................23 Lipídios ..............................................................................26 Estrutura das membranas biológicas ................................29 4. Sangue: Células e Proteínas Plasmáticas ......................................... 33 W. D. Fraser Introdução.........................................................................33 Plasma e soro ....................................................................33 Elementos figurados do sangue .........................................33 Proteínas plasmáticas .......................................................34 A resposta de fase aguda e proteína C reativa ...................40 5. Transporte de oxigênio ...................... 43 G. M. Helmkamp Introdução.........................................................................43 Características das proteínas globinas de mamíferos ........43 Modulação alostérica da afinidade da hemoglobina pelo oxigênio ..............................................................49 Tópicos selecionados .........................................................52 Baynes000.indd v 7. Hemostasia e Trombose . .................. 73 G. Lowe Introdução.........................................................................73 Hemostasia . ......................................................................73 A parede do vaso ...............................................................75 Prostaciclina e óxido nítrico ..............................................75 Plaquetas ...........................................................................76 Coagulação . ......................................................................78 Fibrinólise ..........................................................................83 8. Membranas e Transporte .................. 87 M. Maeda Introdução.........................................................................87 Tipos de processos de transporte .......................................87 9. Bioenergética e Metabolismo Oxidativo ........................................... 97 L. W. Stillway Introdução.........................................................................97 Oxidação como fonte de energia .......................................97 Energia livre ......................................................................98 Conservação de energia pelo acoplamento com a adenosina trifosfato .................................................99 Síntese mitocondrial de trifosfato de adenosina trifosfato a partir de coenzimas reduzidas ..................99 O sistema mitocondrial de transporte de elétrons .......... 101 Transferência de elétrons do NADH para a mitocôndria 104 Síntese de adenosina trifosfato – a hipótese quimiosmótica ........................................................ 107 Inibidores do metabolismo oxidativo .............................. 111 Regulação da fosforilação oxidativa ............................... 113 12/13/2010 3:02:48 PM vi Sumário 10. Função do Trato Gastrointestinal . . 115 U. V. Kulkarni e I. Broom Introdução...................................................................... 115 O trato gastrointestinal .................................................. 115 Digestão .......................................................................... 117 Digestão e absorção de carboidratos............................... 118 Digestão e absorção de lipídios ....................................... 121 Digestão e absorção de proteínas .................................... 124 11. Micronutrientes: Vitaminas e Minerais............................................ 129 M. H. Dominiczak e I. Broom Introdução...................................................................... 129 Vitaminas lipossolúveis .................................................. 129 Vitaminas hidrossolúveis ............................................... 130 Oligoelementos ............................................................... 140 12. Metabolismo Anaeróbico da Glicose nos Er itrócitos .................................. 143 J. W. Baynes Introdução...................................................................... 143 O eritrócito ..................................................................... 143 Glicólise .......................................................................... 144 Síntese de 2,3-bisfosfoglicerato ...................................... 149 A via das pentoses fosfato ............................................... 150 13. Armazenamento e Síntese de Carboidratos no Fígado e no Músculo ............................................ 155 J. W. Baynes Introdução...................................................................... 155 Estrutura do glicogênio .................................................. 156 Via de glicogênese a partir da glicose sanguínea no fígado ................................................................. 156 Via da glicogenólise no fígado......................................... 157 Regulação hormonal da glicogenólise hepática ............. 158 Mecanismo de ação do glucagon .................................... 158 Mobilização do glicogênio hepático pela epinefrina ....... 161 Glicogenólise no músculo ............................................... 163 Regulação da glicogênese ............................................... 164 Gliconeogênese ............................................................... 165 14. O Ciclo do Ácido Tricarboxílico ....... 173 L. W. Stillway Introdução ... .................................................................. 173 Funções do ciclo do ácido tricarboxílico ......................... 173 Piruvato carboxilase....................................................... 175 O complexo piruvato desidrogenase ............................... 175 Enzimas e reações do ciclo do ácido tricarboxílico.......... 177 O rendimento energético do ciclo do ácido tricarboxílico182 Regulação do ciclo do ácido tricarboxílico ..................... 183 Reações anapleróticas (“preenchimento”) ..................... 183 Baynes000.indd vi 15. Metabolismo Oxidativo de Lipídios no Fígado e no Músculo .................. 185 J. W. Baynes Introdução...................................................................... 185 Ativação de ácidos graxos e seu transporte para a mitocôndria............................................................. 185 Oxidação de ácidos graxos.............................................. 186 Cetogênese – uma via metabólica exclusiva do fígado . .. 189 16. Biossíntese e Armazenamento de Ácidos G raxos .................................. 195 U. V. Kulkarni e I. Broom Introdução...................................................................... 195 Síntese de ácido graxo . .................................................. 195 Alongamento do ácido graxo ......................................... 199 Dessaturação de ácidos graxos ....................................... 199 Ácidos graxos essenciais ................................................ 200 Armazenamento e transporte de ácidos graxos: a síntese de triacilgliceróis ......................................... 200 Regulação dos estoques de gordura corporal total ......... 201 17. Biossíntese de Colesterol e Esteroides ......................................... 205 M. H. Dominiczak e A. M. Wallace Introdução ..................................................................... 205 Estrutura do colesterol ................................................... 206 Colesterol livre e esterificado .......................................... 206 Absorção intestinal de colesterol .................................... 206 Biossíntese de colesterol ................................................. 206 Ácidos biliares ................................................................ 211 Hormônios esteroides ..................................................... 213 Vitamina D3 .................................................................... 216 18. Lipoproteínas e Transporte de Lipídios ............................................. 219 M. H. Dominiczak Introdução...................................................................... 219 Lipoproteínas.................................................................. 219 Receptores de lipoproteína ............................................. 221 Enzimas e enzimas de transferência que participam no metabolismo de lipoproteína .............................. 222 Vias do metabolismo da lipoproteína.............................. 222 Dislipidemias .................................................................. 225 Aterogênese .................................................................... 226 Avaliação do risco cardiovascular . ................................ 232 Controle clínico das dislipidemias .................................. 234 19. Biossíntese e Degradação de Aminoácidos .................................... 237 Allen B. Rawitch Introdução...................................................................... 237 12/13/2010 3:02:49 PM Sumário Metabolismo das proteínas da dieta e endógenas . ......... 237 Degradação de aminoácidos........................................... 239 Metabolismo dos esqueletos de carbono dos aminoácidos ............................................................ 245 Biossíntese de aminoácidos . .......................................... 247 Doenças hereditárias do metabolismo de aminoácidos ......248 20. Músculo: Metabolismo Energético e Contração ... ..................................... 253 J. A. Carson e J. W. Baynes Introdução ... .................................................................. 253 Estrutura do músculo ..................................................... 254 O processo de contração ................................................. 257 Metabolismo energético do músculo .............................. 259 Desenvolvimento e regeneração do músculo ................. 262 vii Avaliação da função renal .............................................. 315 Potássio .......................................................................... 316 Sistema renina-angiotensina . ....................................... 317 Integração da homeostase da água e do sódio ............... 321 24. Regulação da Concentração do Íon Hidrogênio (Equilíbrio Acidobásico) ..................................... 325 M. H. Dominiczak e M. Szczepanska-Konkel Os sistemas tampões corporais ....................................... 325 Pulmões: a troca gasosa ................................................. 327 Como os rins lidam com o bicarbonato . ........................ 330 Distúrbios do equilíbrio acidobásico ... ........................... 331 25. Metabolismo do Cálcio e do Osso .. 337 21. Homeostase da Glicose e Metabolismo Ener gético ................. 265 M. H. Dominiczak Homeostase da glicose .................................................... 266 Insulina .......................................................................... 266 Hipoglicemia .................................................................. 274 Ciclo alimentação-jejum ................................................ 274 Metabolismo durante o estresse ..................................... 278 Diabetes melito ............................................................... 279 Avaliação laboratorial do metabolismo energético e diabetes melito .................................... 284 Tratamento do diabetes . ................................................ 287 22. Nutrição e Balanço Energético ....... 291 M. H. Dominiczak Introdução...................................................................... 291 Regulação da ingestão de alimentos .............................. 291 Regulação do balanço energético ................................... 292 Definições na ciência nutricional ................................... 294 Nutrigenômica . ............................................................. 295 Principais classes de nutrientes ...................................... 296 Nutrientes essenciais (limitantes) .................................. 298 Minerais ......................................................................... 298 Avaliação nutricional ..................................................... 299 Desnutrição .................................................................... 301 Obesidade ....................................................................... 302 Dieta na saúde e na doença ............................................ 303 Nutrição e doenças crônicas .......................................... 305 23. Homeostase da Água e de Eletrólitos ......................................... 307 M. H. Dominiczak e M. Szczepanska-Konkel Introdução...................................................................... 307 Água .............................................................................. 307 Osmolalidade .................................................................. 309 Rins .............................................................................. 312 Baynes000.indd vii W. D. Fraser e M. H. Dominiczak Estrutura óssea e remodelamento ósseo......................... 337 Metabolismo do cálcio .................................................... 339 Distúrbios do metabolismo do cálcio e do osso ............... 343 Doença metabólica óssea . .............................................. 347 26. Carboidratos Com plexos: Glicoproteínas . ................................ 351 A. D. Elbein Introdução...................................................................... 351 Estruturas e ligações....................................................... 351 Interconversões dos açúcares da dieta ........................... 355 Outras vias do metabolismo de açúcares nucleotídeos.......358 Biossíntese de oligossacarídeos ....................................... 360 Funções das cadeias de oligossacarídeos das glicoproteínas.......................................................... 363 27. Lipídios Complexos ......................... 367 A. D. Elbein Introdução...................................................................... 367 Síntese e turnover de glicerofosfolipídios ......................... 367 Esfingolipídios ................................................................. 370 Doenças do armazenamento lisossomal resultante de defeitos na degradação de glicolipídios ..... ......... 372 Antígenos do grupo sanguíneo ABO .............................. 374 Outras substâncias dos grupos sanguíneos .................... 374 28. A Matriz Extracelular....................... 377 G. P. Kaushal, A. D. Elbein e W. M. Carver Introdução...................................................................... 377 Colágenos ..... ................................................................. 377 Proteínas não colagenosas na matriz extracelular ......... 381 Proteoglicanos.. .............................................................. 384 12/13/2010 3:02:49 PM viii Sumário 29. Papel do Fígado no Metabolismo... 389 34. Regulação da Expressão Gênica ..... 447 A. F. Jones Introdução...................................................................... 389 Estrutura do fígado ......................................................... 389 Fígado e metabolismo de carboidratos.. ......................... 391 Fígado e metabolismo proteico ....................................... 391 Síntese do heme .............................................................. 393 Metabolismo da bilirrubina ............................................ 393 Metabolismo de drogas ................................................... 395 Farmacogenômica .......................................................... 398 Genômica de doenças hepáticas ..................................... 399 Testes bioquímicos de função hepática........................... 399 Classificação de distúrbios hepáticos .............................. 400 J. R. Patton, D. M. Hunt e A. Jamieson Introdução...................................................................... 447 Mecanismos básicos da expressão gênica....................... 447 Receptores de esteroides ................................................. 452 Estratégias alternativas de regulação gênica em seres humanos ........................................................ 454 O Projeto Genoma Humano ........................................... 458 30. Biossíntese e Degradação de Nucleotídeos .................................... 403 A. Gugliucci e R. Thornburg Introdução...................................................................... 403 Metabolismo das purinas................................................ 403 Metabolismo das pirimidinas.......................................... 408 Formação de desoxinucleotídeos .................................... 409 31. Ácido Desoxirribonucleico ... .......... 413 R. Thornburg e A. Gugliucci Introdução .... ................................................................. 413 Estrutura do ácido desoxirribonucleico . ........................ 413 O ciclo celular em eucariotos.......................................... 416 Reparo do DNA ... ........................................................... 419 32. Ácido Ribonucleico . ........................ 423 G. A. Bannon e R. Thornburg Introdução ... .................................................................. 423 Anatomia molecular de moléculas de ácido ribonucleico ............................................................ 424 Polimerases de ácido ribonucleico .................................. 426 Ácido ribonucleico mensageiro: transcrição .................. 427 Processamento pós-transcricional de ácidos ribonucleicos ........................................................... 428 Degradação ou inativação seletiva do ácido ribonucleico ...432 33. Síntese e Reciclagem de Proteínas .......................................... 435 J. R. Patton e G. A. Bannon Introdução . .................................................................... 435 O código genético ........................................................... 435 A maquinaria de síntese proteica ... ............................... 436 O processo de síntese proteica ........................................ 439 Enovelamento de proteínas ............................................ 441 Direcionamento de proteínas e modificações póstraducionais ............................................................ 442 Baynes000.indd viii 35. Tecnologia do DNA Recombinante .. 461 W. S. Kistler, R. G. Best e A. Jamieson Introdução...................................................................... 461 Hibridização ................................................................... 461 Amplificação e clonagem do ácido desoxirribonucleico . ...467 Métodos específicos empregados na análise do ácido desoxirribonucleico ................................................. 472 Sequenciamento do ácido desoxirribonucleico .............. 477 36. Genômica, Proteômica e Metabolômica .................................. 481 A Pitt e W Kolch Introdução . .................................................................... 481 Genômica . ..................................................................... 482 Proteômica .... ................................................................ 490 Metabolômica ................................................................ .494 37. Oxigênio e Vida ............................... 499 J. W. Baynes Introdução...................................................................... 499 A não reatividade do oxigênio . ...................................... 499 Espécies reativas de oxigênio e estresse oxidante ............ 500 Espécies reativas de nitrogênio ....................................... 502 A natureza do dano causado por radicais de oxigênio ... 502 Defesas antioxidantes ..................................................... 503 Os efeitos benéficos das espécies reativas de oxigênio ... . 505 38. A Resposta Imune ............................ 509 J. A. Gracie e A. Farrell Introdução . .................................................................... 509 Resposta imune inata ..................................................... 509 Resposta imune adaptativa ............................................ 512 Linfócitos . ...................................................................... 513 Moléculas envolvidas em reconhecimento antigênico .......513 Complexo principal de histocompatibilidade . ................ 514 Os tecidos linfoides ......................................................... 515 Células apresentadoras de antígenos ............................. 516 Reação, resposta e a eliminação dos antígenos .............. 517 A resposta das células T .... ............................................. 518 A resposta imune humoral específica . ........................... 519 Vacinação ..... ................................................................. 520 12/13/2010 3:02:49 PM Sumário 39. Endocrinologia Bioquím ica ............. 525 42. Neurotransmissores......................... 579 R. K. Semple e F. F. Bolander Jr. Introdução...................................................................... 525 Hormônios ... .................................................................. 525 Princípios da ação hormonal ......................................... 526 Avaliação bioquímica da ação hormonal ....................... 529 Principais tipos de patologia endócrina.......................... 529 O sistema regulador hipotálamo-pituitária .................... 531 O eixo hipotálamo-pituitária-tireoide . ........................... 532 O eixo hipotálamo-pituitária-adrenal ............................ 536 O eixo hipotálamo-pituitária-gônodas ........................... 538 O eixo do hormônio do crescimento ............................... 544 O eixo da prolactina........................................................ 547 S. Heales Introdução...................................................................... 579 Definição de neurotransmissor....................................... 579 Classificação dos neurotransmissores ............................ 579 Neurotransmissão .......................................................... 580 Classes de neurotransmissores ....................................... 583 40. Receptores de Membrana e Transdução de Sinal ........................ 551 M. M. Harnett e H. S. Goodridge Introdução...................................................................... 551 Receptores de hormônios ............................................... 551 Receptor acoplado à transdução de sinal intracelular ... 553 Segundos mensageiros ................................................... 554 41. Neuroquímica................................... 569 E. J. Thompson Introdução...................................................................... 569 O encéfalo e os nervos periféricos ................................... 569 As células do sistema nervoso ........................................ 570 Transmissão sináptica .................................................... 572 O mecanismo da visão .................................................... 575 Baynes000.indd ix ix 43. Homeostasia Celular: Crescimento Celular, Diferenciação e Câncer ...... 593 M. M. Harnett e H. S. Goodridge Introdução...................................................................... 593 O ciclo celular ................................................................. 593 Fatores de crescimento ................................................... 594 Regulação do ciclo celular .............................................. 597 Apoptose......................................................................... 600 Câncer ............................................................................ 603 44. Envelhecimento ............................... 609 J. W. Baynes Introdução...................................................................... 609 Teorias do envelhecimento ............................................. 611 Modelos genéticos de aumento da expectativa de vida... 615 Intervenções antienvelhecimento – O que funciona e o que não funciona ........................................................... 617 Apêndice: Seleção de Faixas de Referência de Laboratório Clínico ..................................................................... 621 Yee Ping Teoh e M. H. Dominiczak Índice.............................................................................. 629 12/13/2010 3:02:49 PM Prefácio Temos o prazer de apresentar a terceira edição de Bioquímica Médica. Tem sido uma gratificação ver os textos das edições anteriores serem adotados em um número cada vez maior de universidades pelo mundo. Na terceira edição, nossas metas permanecem as mesmas: proporcionar uma base para o estudo da medicina clínica – com a máxima relevância prática. O objetivo é ajudar a moldar um clínico cientificamente informado. A terceira edição foi mais uma vez amplamente atualizada. Os capítulos sobre lipídios, bioquímica endócrina e homeostase da glicose foram reescritos e os sobre regulação da expressão gênica e tecnologia do DNA recombinante foram atualizados para incluir os recentes avanços nestes campos que estão em rápida evolução. Também recrutamos vários novos autores para proporcionar uma nova perspectiva na cobertura de alguns tópicos complexos como biossíntese de proteínas e de nucleotídeos, DNA e RNA. Adicionamos um novo capítulo sobre sistemas bioquímicos, as “ômicas”: genômica, proteômica e metabolômica, para complementar capítulos que já existem sobre biotecnologia e expressão gênica. Todos os capítulos foram revisados com ênfase na clareza da apresentação. Fomos também incisivos em remover assuntos redundantes ou desatualizados. As referências da literatura foram completamente atualizadas e existem agora muito mais referências nos sites relevantes. Nesta edição, retiramos o Banco de Questões (Autoavaliação), porque esse recurso e muitos outros estão disponíveis no site da Elsevier: www.studentconsult.com, para o qual o leitor é direcionado para consulta.* Incluímos muitas referências cruzadas novas: as quais levam o leitor a assuntos relacionados e casos clínicos, em diferentes capítulos do livro. Dessa forma, os Quadros Clínicos, de Exames Clínicos ou de Conceitos Avançados complementam o texto em diferentes capítulos. Lembrar, entretanto, que o uso dessas referências cruzadas é opcional: cada capítulo é uma história independente. Nesta edição o leitor verá maior ênfase nos sistemas de sinalização e cascatas de reações de regulação. Centralizamos nessas vias complexas porque a regulação da transdução de sinal promove um potencial enorme para o desenvolvimento de novas terapias. Uma palavra de atenção: em breve o leitor notará que a terminologia na expressão gênica e sinalização é muitas vezes difícil para não especialistas (bem como para o especialista!). Muitos nomes de genes e fatores de transcrição são enigmáticos, na melhor das hipóteses. Os que temos aqui incluídos não são para serem memorizados, mas para proporcionar uma imagem coerente e um modelo baseado em fatos para outros sistemas biológicos reguladores. A força desse livro é que ele reúne (esperamos alegremente) aspectos da bioquímica “convencional” com uma quantidade substancial de biologia molecular. Nosso julgamento sobre a quantidade incluída de cada um foi impulsionado pelo pragmatismo: a relevância de determinado tema para a prática da medicina de hoje. O texto aborda diversas interfaces interdisciplinares, sendo a mais importante entre a bioquímica e biologia molecular. Existem outras: os capítulos sobre água e metabolismo de eletrólitos e sobre equilíbrio acidobásico, no tradicional ensino associado à fisiologia. Acreditamos, entretanto, que eles são essenciais para o entendimento da bioquímica na medicina. Incluímos também uma quantidade substancial de bioquímica “diagnóstica” (clínica), a qual ilumina a interpretação de testes comumente usados na prática clínica. Isso não faz apenas o livro mais valioso para um estudante de medicina, mas estende sua utilidade ou para aqueles com base médica ou científica, que pretendam prosseguir uma carreira em medicina laboratorial. Esperamos que o livro ofereça ao leitor uma ampla perspectiva em bioquímica e em seu potencial futuro. Se isso for alcançado, é porque nossos colaboradores representam um grupo amplo com muitos conhecimentos – incluindo pesquisadores envolvidos em pesquisa básica de vanguarda, tanto quanto clínicos experientes, que gastam a maior parte do seu tempo em enfermarias e ambulatórios. Portanto, acreditamos que uma avaliação clássica de um livro de bioquímica médica não se aplica aqui: este não é um livro no qual médicos teorizam sobre a ciência, ou cientistas, sobre a prática clínica, é um trabalho integrado que realmente combina pesquisa e prática. Esperamos que esta seja uma agradável leitura. Estamos ansiosos para ouvir seus comentários e sugestões. Nota do Editor: As perguntas e respostas também estão disponíveis em português no www.studentconsult.com.br. Baynes000.indd xi 12/13/2010 3:02:49 PM Colaboradores Gary A Bannon PhD Marek H Dominiczak MD FRCPath FRCP(Glas) Director Section on Protein Analytics Regulatory Division Monsanto St Louis, MO, USA Professor in the Medical Faculty University of Glasgow; Consultant Biochemist cNHS Greater Glasgow and Clyde Gartnavel General Hospital Glasgow, UK John W Baynes PhD Carolina Distinguished Professor Emeritus Department of Chemistry and Biochemistry Graduate Science Research Center University of South Carolina Columbia, SC, USA Robert Best PhD Professor Division of Medical Genetics School of Medicine University of South Carolina Columbia, SC, USA Alan D Elbein PhD Professor and Chair Department of Biochemistry and Molecular Biology University of Arkansas for Medical Sciences Little Rock, AR, USA Alex Farrell FRCPath (deceased) Formerly Consultant Immunologist; Head of Department of Clinical Immunology, Immunopathology, Histocompatibility and Immunogenetics Western Infirmary Glasgow, UK Franklyn F Bolander Jr MD PhD Associate Professor in Biological Sciences Department of Biological Sciences University of South Carolina Columbia, SC, USA Iain Broom MBChB MIBiol FRCPath FRCP Professor of Clinical Biochemistry; Consultant in Clinical Biochemistry and Metabolic Medicine The Robert Gordon University School of Life Sciences Aberdeen, UK James A Carson PhD Associate Professor Department of Exercise Science University of Southern Carolina Columbia, SC, USA Wayne M Carver PhD Associate Professor Department of Cell and Developmental Biology and Anatomy University of South Carolina School of Medicine Columbia, SC, USA Baynes000.indd xiii William D Fraser BSc MD MRCP FRCPath Professor of Clinical Biochemistry Department of Clinical Chemistry Royal Liverpool University Hospital Liverpool, UK Junichi Fujii PhD Professor Department of Biomolecular Function Graduate School of Medical Science Yamagata University Yamagata, Japan Peter J Galloway DCH FRCP (Edin) FRCPath Consultant Chemical Pathologist NHS Greater Glasgow and Clyde Yorkhill Hospital for Sick Children Glasgow, UK Helen S Goodridge BSc PhD Research Scientist Immunobiology Research Institute Cedars-Sinai Medical Center Los Angeles, CA, USA 12/13/2010 3:02:49 PM xiv Colaboradores J Alastair Gracie BSc PhD W Stephen Kistler PhD Senior University Teacher Division of Immunology, Infection and Inflammation Glasgow Biomedical Research Centre University of Glasgow Glasgow, UK Professor of Biochemistry Department of Chemistry University of South Carolina Columbia, SC, USA Alejandro Gugliucci MD PhD Professor of Biochemistry Touro University Vallejo, CA, USA Margaret M Harnett BSc PhD Professor of Immune Signalling Division of Immunology, Infection and Inflammation Glasgow Biomedical Research Centre University of Glasgow Glasgow, UK Walter Kolch MD DR MED HAB Professor of Molecular Cell Biology Beatson Institute for Cancer Research Glasgow, UK Utkarsh V Kulkarni MBBS MD MRCP DipRCPath Senior Research Fellow Centre for Obesity Research and Epidemiology The Robert Gordon University Aberdeen, UK Gordon Lowe MD FRCP Simon Heales PhD FRCPath Consultant Clinical Scientist Department of Clinical Biochemistry National Hospital for Neurology and Neurosurgery London, UK Professor of Vascular Medicine Division of Cardiovascular Medical Sciences University of Glasgow Royal Infirmary Glasgow, UK George M Helmkamp Jr PhD Masatomo Maeda PhD Professor of Biochemistry Department of Biochemistry and Molecular Biology University of Kansas School of Medicine Kansas City, KS, USA Professor of Pharmaceutical Sciences Laboratory of Biochemistry and Molecular Biology Graduate School of Pharmaceutical Sciences Osaka University Osaka, Japan D Margaret Hunt BA PhD Associate Professor Department of Pathology and Microbiology University of South Carolina School of Medicine Columbia, SC, USA Andrew Jamieson MBChB(Hons) PhD FRCP(Glas) Consultant Physician Department of Medicine Hairmyres Hospital East Kilbride, UK Associate Professor Department of Pathology, Microbiology and Immunology School of Medicine University of South Carolina Columbia, SC, USA Andrew Pitt BSc DPhil Consultant Physician and Chemical Pathologist Department of Clinical Biochemistry and Immunology Birmingham Heartlands and Solihull NHS Trust Birmingham, UK Director Sir Henry Wellcome Functional Genomics Facility; Senior Lecturer Department of Integrative and Systems Biology University of Glasgow Glasgow, UK Gur Prasad Kaushal PhD Allen B Rawitch PhD Professor of Medicine Department of Medicine, Division of Nephrology University of Arkansas for Medical Sciences Little Rock, AR, USA Professor of Biochemistry and Molecular Biology Office of Academic Affairs University of Kansas Medical Center Kansas City, KS, USA Alan F Jones DPhil FRCP FRCPath Baynes000.indd xiv Jeffrey R Patton PhD 12/13/2010 3:02:49 PM Colaboradores Peter F Semple MD FRCP Yee Ping Teoh MBDS MRCP DipRCPath Senior Lecturer; Consultant Physician Department of Medicine and Therapeutics University of Glasgow Western Infirmary Glasgow, UK Consultant Chemical Pathologist Department of Medical Biochemistry Wrexham Maelor Hospital Wrexham, UK xv Edward J Thompson PhD MD DSc FRCPath FRCP Robert K Semple PhD MRCP Wellcome Trust Clinician Scientist Fellow Department of Clinical Biochemistry Cambridge University Cambridge, UK Professor of Neurochemistry Department of Neuroimmunology Institute of Neurology National Hospital for Nervous Diseases London, UK L William Stillway PhD Robert Thornburg PhD Professor of Biochemistry and Molecular Biology Department of Biochemistry and Molecular Biology Medical University of Southern Carolina Charleston, SC, USA Mirosława Szczepaùska-Konkel PhD Professor of Clinical Biochemistry Laboratory of Cellular and Molecular Nephrology Polish Academy of Sciences Medical Research Centre Medical School of Gdansk Gdansk, Poland Professor of Biochemistry Department of Biochemistry, Biophysics and Molecular Biology Iowa State University Ames, IA, USA A Michael Wallace BSc MSc PhD FRCPath Professor, University of Strathclyde Consultant Clinical Scientist Department of Clinical Biochemistry Royal Infirmary Glasgow, UKContributorsColaboradores Naoyuki Taniguchi MD PhD Professor Department of Biochemistry Osaka University Medical School Osaka, Japan Baynes000.indd xv 12/13/2010 3:02:49 PM Dedicatória John Baynes A todos os coautores, que têm contribuído com suas experiências e orientações à bioquímica médica Marek Dominiczak A meus professores, H. Gemmel Morgan e Stefan Angielski A Anna, meus pais e Peter Jacob A meus alunos e estagiários A todos que moldarão o futuro da bioquímica Baynes000.indd xvii 12/13/2010 3:02:49 PM Agradecimentos Agradecemos os colaboradores desta edição por seus esforços e conhecimentos técnicos e por lidar com os muitos pedidos dos editores. Agradecemos os novos colaboradores desta edição: Wayne Carver, Alistair Gracie, Alejandro Gugliucci, Walter Kolch, Utkarsh Kulkarni, Jeffrey Patton e Yee Ping Teoh. Novamente agradecemos Peter Semple, pela verificação dos quadros clínicos, e Peter Galloway, pela revisão e contribuição com muitos casos pediátricos para a segunda edição. Ficamos muito tristes com a morte prematura de Alex Farrell, que escreveu o capítulo original sobre o sistema imune. Agradecemos nossos estudantes por seus comentários, os quais partilham conosco nos laboratórios de ensino, em palestras e tutoriais, e pelas revisões, sugestões e críticas postadas Baynes000.indd xix na internet. Também estamos em falta com muitos médicos e enfermeiros com os quais nos encontramos nas visitas às enfermarias, especialmente os membros da equipe de nutrição, em Glasgow, onde discussões multidisciplinares canalizaram conhecimentos em diferentes áreas para assistência ao paciente. Agradecemos a equipe da Elsevier – Alex Stibbe, Kate Dimock, Nani Clansey e Kerrie-Anne McKinlay – que habilmente orientou esta edição desde a ideia inicial, por meio da escrita e provas, até a publicação. Somos gratos aos artistas, pelos seus persistentes esforços na preparação das ilustrações, e aos revisores Anne Powell e Punella Theakes, pelo rigor. Tal como antes, apreciamos muito o inestimável apoio de secretariado da Sra. Jacky Gardiner, em Glasgow. 12/13/2010 3:02:49 PM Abreviaturas A Å AADC ABC ABP AC Ac ACAT ACE Acetil-CoA ACh ACP ACTase ACTH ADAR ADC ADH ADH ADP AFP AG AGE AGE AGL AHF AICAR AIDS AINES AIR ALDH ALE ALL ALP ALT AMD AMG AML AMP AP-1 APC APO-1 apoA, B etc. APRT APTT ARDS ASO AST ATCase ATF ATM ATP ATPase Baynes000.indd xxi adenina ângstrom (medida de comprimento) aminoácido aromático descarboxilase periférica região no transportador que liga ATP (ATP binding cassete) proteína de ligação de androgênios anidrase carbônica adenilato ciclase [Ca] accilcolesterol aciltransferase enzima conversora de angiotensina [ECA] acetilcoenzima A acetilcolina proteína carreadora de acil aspartato carbamiltransferase hormônio adrenocorticotrópico adenosina desaminase que atua sobre o RNA complexo da demência ligada à AIDS álcool desidrogenase hormônio antidiurético (também conhecido como AVP) difosfato de adenosina alfafetoproteína [αFP] ácidos graxos ácidos graxos essenciais produto final de glicosilação avançada ácidos graxos livres fator anti-hemofílico 5-aminoimidazol-4-carboxamida ribonucleotídeo síndrome da imunodeficiência adquirida [SIDA] anti-inflamatório não esteroidal [NSAID] 5-aminoimidazol ribonucleotídeo aldeído desidrogenase produto final de lipoxidação avançada leucemia linfoblástica aguda fosfatase alcalina [FA] alanina aminotransferase degeneração macular relacionada à idade gene da amelogenina leucemia mieloblástica aguda [LMA] monofosfato de adenosina proteína ativadora 1 célula apresentadora de antígeno receptor Fas do domínio da morte apoproteína A, B etc. adenosina fosforribosil transferase tempo de tromboplastina parcialmente ativada [TPTA] síndrome da insuficiência respiratória aguda [SARA] oligonucleotídeo alelo-específico aspartato aminotransferase [TGO] aspartato transcarbamilase fator de ativação da transcrição gene mutado da ataxia telangiectasia trifosfato de adenosina enzima que hidrolisa o ATP AVP AZT 2,3-BPG BAC Bcl-2 BCR BH4 bp BrdU BUN bw C CA Ca CAD CAIR CAM cAMP CaSR CAT CBG CCVD CD CDGS CDK CDKI cDNA CDP CERP CETP CFDA SE CFTR cGMP CGRP CID ou CIVD cit CITP CK ou CPK CML CML(V) CMP CNS CNV CoA COAD ou COPD CODIS COMT CoQ10 COX-1 argininovasopressina (igual a hormônio antidiurético) 3’-azido-3’-desoxitimidina 2,3-bifosfoglicerato cromossomo bacteriano artificial proteína 2 de linfoma de célula B região de quebra (breakpoint cluster region) tetraidrobiopterina par de bases bromodesoxiuridina nitrogênio ureico, equivalente à ureia (não é sinônimo) peso corporal citosina anidrase carbônica [AC] adenilato ciclase [Ac] endonuclease dependente de caspase carboxiaminoimidazol ribonucleotídeo calmodulina AMP cíclico (AMPc) receptor sensível ao cálcio catalase globulina de ligação de corticosteroides canais de cálcio voltagem-dependente (ou dependentes de voltagem) [VDCC] designação de cluster: sistema de classificação para moléculas de superfície celular síndromes da glicoproteína deficiente em carboidrato cinase dependente de ciclina inibidor da cinase dependente de ciclina DNA complementar a um mRNA difosfato de citidina proteína reguladora do efluxo de colesterol proteína de transferência de éster de colesterol diacetato de carboxifluoresceína succinimidil éster não fluorescente regulador da condutância transmembrana da fibrose cística GMP cíclico (GMPc) peptídio relacionado com o gene da calcitonina coagulação intravascular disseminada [DIC] citocromo peptídeo de extensão do terminal carboxílico do pró-colágeno creatina cinase leucemia mieloide crônica [LMC] células musculares lisas (vasculares) monofosfato de citidina sistema nervoso central [SNC] variação de número de cópias coenzima A doença pulmonar obstrutiva crônica [DPOC] sistema combinado de índices de DNA catecol-O-metiltransferase coenzima Q10 (ubiquinona) ciclo-oxigenase-1 12/13/2010 3:02:49 PM xxii Abreviaturas CPD CPI CPK ou CK CPS I, II CPT I, II CRBP CRE CREB CRGP CRH CRP CS CSF CSF-1 CT CTP CTX CVS CVS Da (Dalton) DAG DAPI dATP DBP DCC ddATP DDC ddCTP ddGTP ddNTP ddTTP DEAE DEXA DGGE DHAP DHFR DHPR DHT DIC DIPF DMID DMNID DNA DNP dNTP Dol-P Dol-PP-GlcNAc DOPA DPOC DPPC DRPLA dsRNA DVT EBV ECA ECF ECM EDRF EDTA EF-1,2 EF2 EGF eIF-3 ELK EM EMSA Baynes000.indd xxii complexo piruvato desidrogenase ilha de CpG creatina fosfocinase carbamoil fosfato sintetase I, II carnitina palmitiltransferase I, II proteína citosólica de ligação de retinal elemento de resposta ao AMP cíclico proteína de ligação do elemento responsivo ao AMP cíclico gene do peptídeo relacionado à calcitonina hormônio de liberação de corticotropina proteína C-reativa citrato sintase líquido cerebroespinhal [LCR] fator estimulante de colônia 1 calcitonina trifosfato de citidina telopeptídeo carboxiterminal do colágeno biópsia de vilosidade coriônica célula vermelha do sangue [RBC] unidade de massa molecular dos aminoácidos diacilglicerol 4’-6’-diamidino-fenilindol-2HCl trifosfato de desoxiadenosina proteína de ligação da vitamina D gene de “deleção no carcinoma de cólon” trifosfato de didesoxiadenosina 2’-3’-didesoxicitidina trifosfato de didesoxicitidina trifosfato de didesoxiguanosina trifosfato de didesoxirribonucleosídeo trifosfato de didesoxitimidina dietilaminoetil absortometria de energia dupla de raios X eletroforese em gel com gradiente de desnaturante fosfato de di-hidroacetona di-hidrofolato redutase di-hidrobiopterina redutase di-hidrotestosterona coagulação intravascular disseminada [CID ou CIVD] diisopropilfosfofluoreto diabetes melito insulino-dependente diabetes melito não insulino-dependente [NIDDM] ácido desoxirribonucleico 2,4-dinitrofenol desoxirribonucleotídeo trifosfato dolicol fosfato dolicol pirofosfato-N-acetilglicosamina di-hidroxifenilalanina doença pulmonar obstrutiva crônica [COAD ou COPD] dipalmitilfosfatidilcolina atrofia dentato-rubro-pálido-luisiana RNA de dupla fita trombose venosa profunda vírus Epstein-Barr enzima conversora de angiotensina [ACE] líquido extracelular [LEC] matriz extracelular [MEC] fator de relaxamento derivado do endotélio (N0) ácido etilenodiaminotetracético fator de alongamento da tradução fator de alongamento de célula eucariótica fator de crescimento epidérmico fator de iniciação da tradução de célula eucariótica(-3) tipo de fator de transcrição espectrometria de massa [MS] ensaio de mudança de mobilidade eletroforética eNOS EPA EPO ER ERK ERN ERO ESI MS ESR FACIT FAD FADD FADH2 FAICAR FAP Fas F-ATPase FBPase FCγR FDP FGAR FGF FHH FI FISH FMN FMNH2 FP FRA16A FRAXA Fru-1,6-BP Fru-2,6-BP Fru-2,6-BPase Fru-6-P FSF FSH FT G G3PDH (GAPDH) G6PDH GABA GAG Gal Gal-1-P GalNAc GalNH2 GAP GAPDH GAR GDH GDP GDP-D-Man GDP-L-Fuc GDP-Man GFAP GGT ou γGT GH GHRH GIP GIT GK Glc Glc-1-P Glc-6-P Glc-6-Pase GlcN-6-P GlcNac óxido nítrico sintase endotelial ácido eicosapentaenoico eritropoetina retículo endoplasmático [RE] cinase regulada extracelularmente espécies reativas do nitrogênio [RNS] espécies reativas do oxigênio [ROS] espectrometria de massa com ionização tipo electrospray taxa de sedimentação de eritrócitos (glóbulos vermelhos) colágeno associado à fibrila com triplas hélices interrompidas flavina adenina dinucleotídeo proteína acessória do “domínio da morte” flavina adenina dinucleotídeo reduzido 5-formoilaminoimidazol-4-carboxamida ribonucleotídeo polipose adenomatosa familiar [PAF] molécula de sinalização da apoptose: proteína acessória do “domínio da morte” (CD95) ATPase do tipo associada a um fator frutose bifosfatase grupo de receptores de imunoglobulinas produto de degradação da fibrina formoilglicinamida ribonucleotídeo fator de crescimento dos fibroblastos hipercalcemia hipocalciúrica familiar fator intrínseco hibridização in situ por fluorescência flavina mononucleotídeo flavina mononucleotídeo reduzido flavoproteínas sítio A do 16 frágil síndrome do X frágil frutose-1,6-bifosfato frutose-2,6-bifosfato frutose-2,6 bifosfatase frutose-6-fosfato fator estabilizador da fibrina hormônio folículo-estimulante fator de transcrição (com qualificador) [TF] guanina gliceraldeído-3-fosfato desidrogenase glicose-6-fosfato desidrogenase ácido γ-aminobutírico glicosaminoglicana galactose galactose-1-fosfato N-acetilgalactosamina galactosamina proteína ativadora da guanosina trifosfatase gliceraldeído-3-fosfato desidrogenase glicinamida ribonucleotídeo glutamato desidrogenase difosfato de guanosina difosfato de guanosina-D-manose difosfato de guanosina-L-fucose difosfato de guanosina-manose proteína ácida fibrilar glial gamaglutamiltransferase/transpeptidase hormônio do crescimento hormônio liberador do hormônio do crescimento peptídeo insulinotrópico glicose-dependente trato gastrointestinal [TGI] glicocinase glicose glicose-1-fosfato glicose-6-fosfato glicose-6-fosfatase glicosamina-6-fosfato N-acetilglicosamina 12/13/2010 3:02:49 PM Abreviaturas xxiii GlcNAc-1-P GlcNAc-6-P GlcNH2 GlcUA GLP-1 GLUT GM1 GMP GnRH GPI GPIb-IXa etc. GPx GRE GSH GSSG GTP GTPase 5-HIAA 5-HT HAC HAT Hb, HB ou HGB HbA1c HbF HCG HCM Hct HDAC HDL HGF HGF-R HGPRT HHV-8 HIV HLA HLH HMG HMWK HNPCC hnRNA HPLC HPT HRE HRG HRT HSP HSV HTGL HTH HVA HVD ICAM-1 ICAT ICF ICTP IDDM IDL IdUA IFN(-γ) Ig IGF IGF-I IL IMB IMC IMP Inr IP1, I-1-P1, I-4-P1 etc. IP2, I-1, 3-P2, I-1, 4-P2 IP3 IP3, I-1, 4, 5-P3 Baynes000.indd xxiii N-acetilglicosamina-1-fosfato N-acetilglicosamina-6-fosfato glicosamina ácido-D-glicurônico peptídeo 1 semelhante ao glucagon transportador da glicose (GLUT-1-GLUT-5) monossialogangliosídeo 1 monofosfato de guanosina hormônio liberador de gonadotropina glicosilfosfatidilinositol receptor glicoproteico 1b-IXa etc. glutationa peroxidase elemento responsivo a glicocorticoides glutationa reduzida glutationa oxidada trifosfato de guanosina guanosina trifosfatase ácido 5-hidroxiindolacético 5-hidroxitriptamina cromossomo humano artificial histona acetiltransferase hemoglobina hemoglobina glicosilada hemoglobina fetal gonadotropina coriônica hipercalcemia associada à malignidade hematócrito [Ht] histona desacetilases lipoproteína de alta densidade [HDL] fator de crescimento de hepatócito receptor do fator de crescimento de hepatócito hipoxantina-guanina fosforribosiltransferase herpesvírus humano 8 vírus da imunodeficiência humana antígeno leucocitário humano (sistema de) hélice-alça-hélice (motivo) hidroximetilglutaril cininogênio de alto peso molecular câncer de colo e reto hereditário sem polipose ácido ribonucleico heteronuclear cromatografia líquida de alta eficiência hiperparatireoidismo elemento de resposta ao hormônio glicoproteína rica em histidina terapia de reposição hormonal [TRH] proteína de choque térmico (heat shock protein) vírus da herpes simples triglicerídeo lipase hepática hélice-volta-hélice (motivo) ácido homovanílico vírus da hepatite D molécula 1 de adesão intracelular marcador de afinidade codificado com isótopo líquido intracelular [LIC] telopeptídeo carboxi-terminal do colágeno tipo 1 diabetes melito tipo I (abreviatura substituída por diabetes melito tipo I) lipoproteína de densidade intermediária ácido L-idurônico interferon-γ imunoglobulina fator de crescimento de insulina fator de crescimento I semelhante à insulina interleucina (IL-1 – IL-29) índice de metabolismo basal índice de massa corpórea monofosfato de inositina iniciador (sequência de um gene) monofosfato de inositol difosfato de inositol inositol 1,4,5-trifosfato trifosfato de inositol IP4, I-1, 3, 4, 5-P4 IRE IRE-BP IRMA ITAM ITIM JAK JNK K Kb Kbp KCCT KIP2 Km LACI LCAT LCR LDH LDL LEC LH LIC LMA LMC LPL LPS LRP-LDL MAG Malonil-CoA Man Man-1-P Man-6-P MAO MAPK Mb MCH MCHC MCP-1 M-CSF-R MCV MD MDH MDR MEC MEK MEN-IIA MeSH met-tRNA MGUS MHC miRNAs MPO mRNA MRP MS MSH MSUD MyoD Na+/K+-ATPase NABQI NAC NAD + NADH tetrafosfato de inositol elemento responsivo ao ferro proteína de ligação do IRE ensaio imunorradiométrico domínio de ativação do imunorreceptor tipo tirosina cinase domínio de inibição do imunorreceptor tipo tirosina cinase Janus cinase cinase do N-terminal de Jun constante de equilíbrio quilobase par(es) de quilobase(s) tempo de coagulação do caulim-cefalina molécula reguladora do ciclo celular constante de Michaelis inibidor da coagulação associado à lipoproteína lecitina-colesterol aciltransferase líquido cerebroespinhal [CSF] lactato desidrogenase lipoproteína de baixa densidade líquido extracelular [ECF] hormônio luteinizante líquido intracelular [ICF] leucemia mieloblástica aguda [AML] leucemia mieloide crônica [CML] lipoproteína lipase lipopolissacarídeo proteína relacionada ao receptor de LDL monoacilglicerol malonil-coenzima A manose manose-1-fosfato manose-6-fosfato monoamina oxidase proteína cinase ativada por mitógeno (uma superfamília de cinases transdutoras de sinal) mioglobina hemoglobina corpuscular média concentração de hemoglobina corpuscular média [CHCM] proteína 1 quimioatraente de monócito receptor do fator estimulante de colônia de macrófagos volume corpuscular médio [VCM] distrofia miotônica malato desidrogenase resistência múltipla às drogas matriz extracelular [ECM] cinase de proteína cinase ativada por mitógeno neoplasia endócrina múltipla tipo II 2-mercaptoetanol metionil-tRNA gamapatia monoclonal de significado indeterminado complexo maior de histocompatibilidade microRNAs mieloperoxidase ácido ribonucleico mensageiro proteína associada à resistência múltipla às drogas espectrometria de massa [EM] hormônio estimulador dos melanócitos doença da urina de xarope de bordo fator transportador específico da célula muscular transportador de sódio e potássio contragradiente, com gasto de ATP N-acetilbenzoquinoneimina N-acetilcisteína nicotinamida adenina dinucleotídeo (oxidado) nicotinamida adenina dinucleotídeo (reduzido) 12/13/2010 3:02:49 PM xxiv Abreviaturas NADP+ NADPH NANA ncRNA NEFA NF NF-II NGF NIDDM NLS NMDA NO NOS NPY 1,25(OH)2D3 NSAID NT NTX OAA OGTT 8-oxo-G 8-oxo-Gua OPG ORC OxS P1CP p38RK Pa PAF PAGE PAI-1 PAPS P-ATPase 3-PG PC PC PCP PCR PD PDE PDF PDGF PDGF-R PDH PDK PE PEP PEPCK PF3 PFGE PFK-1 (-2) PGG2 etc. PGI2 PGK PGM PHHI PHP pI Pi PI PI PI-3-K PICP PINP Baynes000.indd xxiv nicotinamida adenina dinucleotídeo fosfato (oxidado) nicotinamida adenina dinucleotídeo fosfato (reduzido) ácido N-acetilneuramínico (ácido siálico) RNA não codificador muito pequeno ácidos graxos não esterificados fator nuclear neurofibromatose tipo II fator de crescimento de nervo diabetes melito não insulino-dependente [DMNID] sinal de localização nuclear N-metil-D-aspartato óxido nítrico óxido nítrico sintase neuropeptídeo Y 1,25-di-hidroxivitamina D3 anti-inflamatório não esteroidal [AINES] nucleotídio (como medida de tamanho/ comprimento de um ácido nucleico) telopeptídeo amino-terminal do colágeno oxaloacetato teste de tolerância oral à glicose [TTOG] 8-oxo-2’-desoxiguanosina 8-oxodesoxiguanosina osteoprotegerina complexo de reconhecimento da origem estresse oxidante pró-peptídeo carboxi-terminal do pró-colágeno tipo 1 cinase de reativação p38 pascal fator de ativação de plaquetas eletroforese em gel de poliacrilamida inibidor do ativador de plasminogênio tipo 1 fosfoadenosina fosfossulfato ATPase do tipo fosforilação 3-fosfoglicerato fosfatidilcolina piruvato carboxilase fenilciclidina reação em cadeia da polimerase proteína desacopladora [UCP] fosfodiesterase produto de degradação de fibrina fator de crescimento derivado de plaquetas receptor de PDGF piruvato desidrogenase cinase dependente de trifosfato de fosfatidilionsitol fosfatidil etanolamina ácido fosfoenolpirúvico fosfoenolpirvato carboxicinase fator plaquetário 3 eletroforese em gel de campo pulsado fosfofrutocinase-1 (-2) prostaglandina G2 etc. prostaciclina I2 fosfogliceratocinase fosfoglicomutase hipoglicemia hiperinsulinêmica persistente da infância pseudo-hipoparatireoidismo ponto isoelétrico fosfato inorgânico fosfatidilinositol iodeto de propídio fosfatidilinositol-3-cinase peptídeo de extensão aminoterminal do prócolágeno pró-peptídeo aminoterminal do pró-colágeno tipo 1 PIP2/PIP3 PK PKA/PKC PKR PKU PL PLA/PLC PLP PLT PMA PNPO PNS PPAR PPi PRL PrP PRPP PS PT PTA PTGS PTH PTHrP PTK PTPase PWS PXSRN Py Py2CAPy5 qBH2 QS R RABP RAIDD RANK RANKL Rb RBC RDS RE RER RFLP RGD RIP RKK RM RMN RNA RNAi RNAPol II RNR RNS ROS RRX RS RSV RT-PCR S SACAIR SAM SAP1 SAPK SARA SCA I SCA III SCAP SCID bifosfato/trifosfato de fosfatidilinositol piruvato cinase proteína cinase A/C proteína cinase ativada por dsRNA fenilcetonúria fosfolipase A etc. fosfolipase A/C fosfato de piridoxal plaquetas ácido forbol mirístico pirodox(am)ina-5’-fosfato oxidase sistema nervoso periférico [SNP] receptor ativado por agentes que estimulam a proliferação de peroxissomos pirofosfato inorgânico prolactina (PL) proteína príon 5-fosforribosil-α-pirofosfato fosfatidilserina tempo de protrombina antecedente da tromboplastina plasmática silenciamento gênico pós-transcricional paratormônio proteína relacionada ao paratormônio proteína tirosina cinase fosfotirosina fosfatase síndrome de Prader-Willi sequência peptídica prolina-X-serina-argininaasparagina base pirimidina (numa sequência de nucleotídeo) Py-base pirimidínica; C-citidina; A-adenosina di-hidrobiopterina quinonoide sulfato de queratano (queratan sulfato) receptor (com qualificador, não isolado) proteína de ligação específica do ácido retinoico proteína acessória do “domínio da morte” ativador do receptor de NFκB ligante do RANK proteína do retinoblastoma hemácia [CVS] síndrome da disfunção respiratória retículo endoplasmático [ER] retículo endoplasmático rugoso polimorfismo de comprimento de fragmento de restrição sequência peptídica arginina-glicina-aspartato proteína acessória do “domínio da morte” homólogo p38RK de MEK ressonância magnética ressonância magnética nuclear ácido ribonucleico RNA de interferência RNA polimerase II ribonucleotídeo redutase espécies reativas do nitrogênio [ERN] espécies reativas do oxigênio [ERO] receptor X retinoico retículo sarcoplasmático vírus respiratório sincicial PCR em tempo real svedberg (unidade) 5-aminoimidazol-4-(N-succinilocarboxamida) ribonucleotídeo S-adenosilmetionina tipo de fator de transcrição proteína cinase ativada por estresse síndrome da insuficiência respiratória aguda [ARDS] ataxia espinocerebelar doença de Machado-Joseph proteína de ativação da clivagem de SREBP imunodeficiência combinada grave 12/13/2010 3:02:49 PM Abreviaturas SCIDS scuPA SD SDS SDS-PAGE SEK SER SER SERBP SERM ser-P SGLT SH SH2 SHBG SHP SIADH siRNA SNC snoRNA snoRNP SNP SNP snRNA SNRPN SOD SPCA SRBP Src SRE SRP SSBP SSCP SSRI STAT STR SUR T T3 T4 TAG TAP TAP TB TBG TBP 3TC TC TCA TCR tcuPA TdT TF TFPI Baynes000.indd xxv síndrome de imunodeficiência combinada grave ativador do plasminogênio do tipo urinário de cadeia única desvio padrão sódio dodecil sulfato eletroforese em gel de poliacrilamida com sódio dodecil sulfato homológo SAPK de MEK retículo endoplasmático liso elemento responsivo a esteroide proteína de ligação ao elemento de resposta a esteroide modulador seletivo dos receptores de estrogênio serina-fosfato transportador de glicose acoplado ao Na+ (simporte) hormônio esteroide (figuras somente) região-2 de homologia a Src globulina de ligação de hormônios sexuais fosfatase contendo o domínio SH2 síndrome da secreção inadequada do hormônio antidiurético pequeno RNA de interferência sistema nervoso central [CNS] pequeno RNA nucleolar ribonucleoproteína nucleolar pequena sistema nervoso periférico [PNS] polimorfismos de base única RNA nuclear pequeno proteína ribossomal nuclear pequena N superóxido dismutase acelerador sérico de conversão de protrombina proteína sérica de ligação ao retinal tipo de proteína tirosina cinase elemento de resposta a esteroide partícula de reconhecimento de sinal proteína que se liga ao DNA de fita simples polimorfismo conformacional de fita simples inibidor seletivo da recaptação de serotonina transdutor de sinal e ativador da transcrição pequena repetição in tandem receptor da sulfonilureia timina triiodotironina tiroxina triacilglicerol (triglicerídeo) tempo de atividade de protrombina transportador de peptídeo no RE associado à apresentação de antígeno tuberculose globulina transportadora de hormônio da tireoide proteína de ligação ao TATA 2’3’-didesoxi-3’-tiacitidina tomografia computadorizada ácido tricarboxílico receptor de antígeno de célula T urocinase (forma mais ativa de cadeia dupla) desoxinucleotidil transferase terminal fator de transcrição (com qualificador) [FT] inibidor da via do fator tecidual TG TGF(-β) TGI THF TIM TK Tm Tmax TMME TMMI Tn TNF TNF-R TOM tPA TRADD TRAF TRAFS TRH tRNA TSH TT TTF1 TTOG TTP Túbulo T TXA2 U UCP UDP UDP-Gal UDP-GalNAc UDP-Glc UDP-GlcNAc UDP-GlcUA UMP uPA UPRTase UV VCAM-1 VDCC VEGF VHS VIP VLDL VNTR VSV vWF WAF1 XIST XMP XO XP X-SCID YAC ZP3 xxv triacilglicerol (triglicerídeo) fator β da transformação do crescimento trato gastrointestinal [GIT] tetraidrofolato translocase na membrana mitocondrial interna [TMMI] timidina cinase temperatura de desnaturação do DNA velocidade máxima de transporte translocase na membrana mitocondrial externa [TOM] translocase na membrana mitocondrial interna [TIM] troponina fator de necrose tumoral receptor do fator de necrose tumoral translocase na membrana mitocondrial externa [TMME] ativador do plasminogênio do tipo tecidual proteína acessória com “domínio da morte” fator citoplasmático associado ao TNF-R proteína acessória com “domínio da morte” hormônio liberador da tireotropina RNA de transferência hormônio tireoestimulante (tireotropina) tempo de trombina fator de terminação de transcrito 1 teste de tolerância oral à glicose [OGTT] trifosfato de timidina túbulo transversal tromboxano A2 uridina proteína desacopladora [PD] difosfato de uridina UDP-galactose UDP-N-acetilgalactosamina UDP-glicose UDP-N-acetilglicosamina UDP ácido glicurônico monofosfato de uridina ativador do plasminogênio do tipo urinário uracilfosforribosiltransferase ultravioleta molécula 1 de adesão de células vasculares canais de cálcio voltagem-dependente (ou dependentes de voltagem) [CCVD] fator de crescimento endotelial vascular velocidade de hemossedimentação peptídeo intestinal vasoativo lipoproteína de muito baixa densidade repetição in tandem de número variável vírus da estomatite vesicular fator de von Willenbrand regulador do ciclo celular transcrito específico do X inativo monofosfato de xantina xantina oxidase xeroderma pigmentosum imunodeficiência combinada grave ligada ao X cromossomo artificial de levedura glicoproteína 3 da zona pelúcida 12/13/2010 3:02:49 PM xxvi REVISÃO CIENTÍFICA Aline Simões Fraga (Cap. 42) Professora Substituta Auxiliar do Departamento de Bioquímica do Instituto de Biologia Alcantara Gomes da Universidade do Estado do Rio de Janeiro (UERJ) Doutora em Biociências pela UERJ Mestre em Biociências Nucleares pela UERJ Marcia Cristina Paes (Caps. 9, 14 e 15) Professora Adjunta e Procientista do Departamento de Bioquímica do Instituto de Biologia da UERJ Pós-doutorado pela University of Bath, Reino Unido Doutora em Química Biológica pela UFRJ Mestre em Química Biológica pela UFRJ Amanda Chaves Pinho (Caps. 5 e 41) Mestre em Biologia pela UERJ Licenciatura e Bacharelado em Ciências Biológicas pela UERJ Docente Substituta Auxiliar (de 08/2007 a 02/2008) do Departamento de Bioquímica do Instituto de Biologia Roberto Alcantara Gomes da UERJ Marsen Garcia Pinto Coelho (Cap. 4) Professora Associada do Departamento de Bioquímica do Instituto de Biologia Roberto Alcantara Gomes da UERJ Coordenadora de pesquisa e de captação de recursos do Instituto de Biologia Roberto Alcantara Gomes da UERJ Doutora em 1988 pela UFRJ Mestre em 1979 pela UFRJ Ana Maria Rossini Teixeira (Caps. 2, 3, 12 e 13) Professora Adjunta do Departamento de Bioquímica do Instituto de Biologia Roberto Alcantara Gomes da UERJ Doutora em Ciências pela UERJ Artur Pedro do Carmo Moes (Cap. 28) Doutorando em Biologia pela Pós-graduação em Biociências da UERJ Mestre em Biologia pela Pós-graduação em Biociências Nucleares da UERJ Graduado em Ciências Biológicas pela Fundação Educacional da Região dos Lagos, RJ Cintia Fernandes de Souza (Caps. 36 e 40) Mestre em Biologia Parasitária pelo Instituto Oswaldo Cruz/ Fundação Oswaldo Cruz (Fiocruz), RJ Doutoranda do Programa de Pós-graduação em Biologia da UERJ Fabiana Siqueira Ribeiro (Caps. 34, 37 e Índice) Professora Docente I do Estado do Rio de Janeiro Doutora e Mestre em Biologia (Biociências Nucleares) pela UERJ Frederico Freire Bastos (Cap. 11) Professor Substituto do Departamento de Bioquímica do Instituto de Biologia da UERJ Doutor e Mestre em Ciências pelo Programa de Pós-graduação em Biologia da UERJ Jacyara Maria Brito Macedo (Caps. 7, 31, 32, 35 e 43) Professora Adjunta do Departamento de Bioquímica do Instituto de Biologia Roberto Alcantara Gomes da UERJ Pós-doutorado nas áreas de Virologia Molecular e Tecnologia Enzimática pela Universidade Federal do Rio de Janeiro (UFRJ) PhD em Genética pela Universidade de Leeds, Reino Unido Mestre em Tecnologia de Processos Químicos e Bioquímicos pela UFRJ Kátia Costa de Carvalho Sabino (Caps. 1, 16, 18 e 26) Professora Adjunta do Departamento de Bioquímica da UERJ Doutora em Biologia pela UERJ Baynes000.indd xxvi Monica Farah Pereira (Caps. 8, 10 e 33) Doutora e Mestre em Biologia pela UERJ Natalia Pereira de Almeida Nogueira (Caps. 22, 27, 44 e Apêndice) Professora Substituta do Departamento de Bioquímica da UERJ Mestre em Química Biológica pelo Instituto de Bioquímica Médica da UFRJ Rafael Ferreira Dantas (Cap. 25) Professor Substituto Auxiliar do Departamento de Bioquímica do Instituto de Biologia Roberto Alcantara Gomes da UERJ Doutor em Biociências pela UERJ Mestre em Biociências Nucleares pela UERJ Sergio R. Dalmau (Caps. 17, 20, 30, 38 e 39) Professor Adjunto do Departamento de Bioquímica do Instituto de Biologia da UERJ Coordenador do Curso de Bioquímica para Medicina (2000-10) da UERJ Visiting Research Fellow do Swiss Institute for Cancer Research 1983, Lausanne, Suíça Doutor em Biologia Celular e Molecular (1996) pelo Instituto Oswaldo Cruz/Fundação Oswaldo Cruz (Fiocruz), RJ Mestre em Bioquímica (1983) pelo Instituto de Química da UFRJ Tatiana de Almeida Simão (Caps. 19, 21, 23 e 24) Professor Adjunto do Departamento de Bioquímica do Instituto de Biologia Roberto Alcantara Gomes da UERJ Doutor e Mestre em Biologia (Biociências Nucleares) pela UERJ Vera Lúcia Freire da Cunha Bastos (Caps. 6 e 29) Professora Adjunta do Departamento de Bioquímica do Instituto de Biologia da UERJ Coordenadora de Graduação do Instituto de Biologia da UERJ Doutora em Ciências pelo Programa de Pós-graduação em Biologia da UERJ Mestre em Ciências pelo Curso de Pós-graduação do Departamento de Bioquímica do Instituto de Química da UFRJ Visiting Research Assistant da University of Alberta, Canadá 12/13/2010 3:02:49 PM 316 Homeostase da Água e de Eletrólitos à quantidade recuperada na urina (isto é, a concentração urinária, Uin, multiplicada pela taxa da formação de urina, V). Pin x TFG = Uin x V Dessa fórmula podemos calcular a TFG: TFG = Uin x V/ Pin cleadas e é produzido numa taxa constante. Devido a seu pequeno tamanho e seu ponto isoelétrico básico, a cistatina C é filtrada livremente através dos glomérulos. Não é secretada pelos túbulos, e, embora seja reabsorvida, é subsequentemente catabolizada, logo, não retorna para o sangue. Sua concentração é afetada pela idade. Outros fatores, independente da TFG, como a reação inflamatória, podem afetar a concentração de cistatina C. A TFG média é 120 mL/min para homens e 100 mL/min para mulheres. O clearance renal da inulina é igual à TFG. POTÁSSIO As dosagens de ureia e creatinina no soro são os primeiros testes realizados na pesquisa do diagnóstico de doença renal É fundamental monitorar a concentração de potássio em pessoas com alterações hidroeletrolíticas Administrar intravenosamente inulina sempre que se precisar avaliar a TFG é impraticável. Na prática clínica, se usa determinar o clearance da creatinina, um composto derivado da fosfocreatina presente nos músculos esqueléticos. O clearance da creatinina é semelhante ao da inulina. Embora alguma creatinina seja reabsorvida nos túbulos renais, isto é compensado por uma secreção tubular equivalente. Para calcular o clearance da creatinina, é necessário obter uma amostra de sangue e a urina coletada durante 24 horas. A concentração da creatinina no soro e na urina é medida. A taxa de excreção urinária é calculada dividindo-se o volume urinário total pelo tempo de coleta (V, anteriormente). O clearance da creatinina é então calculado segundo a fórmula: Clearance da creatinina = U[creatinina] x V P[creatinina] onde: P [creatinina] = concentração da creatinina no soro U[creatinina]= concentração da creatinina na urina V = taxa de excreção urinária (ml/min). A taxa de excreção urinária é calculada dividindo-se o volume urinário de 24 horas pelo tempo de coleta em minutos (no caso, 24h = 1.440 minutos). A concentração de creatinina no soro é de 20-80 mmol/L (0,28-0,90 mg/dL). Um aumento na concentração sérica de creatinina reflete uma diminuição da TFG: a concentração da creatinina sérica dobra quando a TFG diminui aproximadamente 50%. Outro teste usado para avaliar a função renal é a medida da ureia sérica. No entanto, como a ureia é um produto final do catabolismo proteico, sua quantidade plasmática também é dependente de fatores como a quantidade de proteína ingerida na dieta (Cap. 22) e a taxa de degradação tecidual. Na prática clínica, as determinações no soro de creatinina e ureia consistem em testes de primeira linha no diagnóstico da insuficiência renal (Fig. 23.14). A insuficiência renal leva a uma redução do volume urinário e do clearance da creatinina e aumento na concentração sérica de ureia e creatinina. Recentes avanços em testes laboratoriais incluem a padronização da dosagem de creatinina, criando-se um método, a ser usado em laboratório clínico, semelhante a um método de referência que utiliza espectrometria de massa com um isótopo diluído. TAXA DE FILTRAÇÃO GLOMERULAR ESTIMADA O clearance da creatinina muda com a idade, superfície corporal, sexo e raça. Além disso, a relação entre TFG e concentração de creatinina pode ser diferente entre pessoas sadias e pacientes com doença renal. Atualmente, os cálculos da TFG estão sendo aperfeiçoados incluindo-se na fórmula a concentração de creatinina no soro, assim como os fatores idade, sexo e peso. Não existem evidências, até o momento, que esta TFG estimada identifique melhor o risco de redução da função renal do que as dosagens séricas. Contudo, esta determinação pode ser útil para monitorar a doença renal uma vez que ela já tenha sido diagnosticada. Os valores de creatinina sérica precisam ser interpretados no contexto do histórico clínico, exame do paciente e resultados de outros testes laboratoriais. –O –O P Músculo O NH HN N H3C H N HN Pi H2O COO– O N H3C Creatinina Creatina fosfato Creatinina 500 plasmática (μmol/L) 400 300 50 Ureia Redução da função renal plasmática (mmol/L) 30 20 200 100 40 Faixa de referência 10 5 A concentração de cistatina C é outro marcador da taxa de filtração glomerular A cistatina C é uma proteína de 13 kDa, 122 aminoácidos, que pertence à família dos inibidores de cisteína proteinases. É um produto de gene constitutivo expresso em todas as células nu- Baynes023.indd Sec1:316 Fig. 23.14 As concentrações de ureia e creatinina no soro são importantes marcadores da função renal. O esquema superior mostra a conversão da fosfocreatina muscular em creatinina. A perda da função de 50% dos néfrons resulta aproximadamente na duplicação da concentração dos níveis séricos de creatinina. 12/13/2010 3:09:12 PM Sistema renina-angiotensina Osmolalidade A dosagem da concentração sérica de potássio é muito importante clinicamente (Fig. 23.15). A concentração normal do potássio no soro é 3,5-5 mmol/L. Como a concentração intracelular do potássio é muito maior do que no plasma, alterações relativamente pequenas na concentração de potássio entre o LEC e o LIC podem resultar em alterações importantes em sua concentração no soro. Tanto concentrações baixas quanto altas de potássio (hipocalemia e hipercalemia, respectivamente) podem colocar a vida em risco. Concentrações de potássio inferiores a 2,5 mmol/L ou acima de 6,0 mmol/L são perigosas. O monitoramento da concentração de potássio em pessoas com desordens hidroeletrolíticas é de fundamental importância. A causa mais comum de hipercalemia grave é a insuficiência renal: nesta condição, o potássio não pode ser adequadamente excretado na urina. Por sua vez, a concentração sérica de potássio baixa resulta de perdas excessivas ou na urina ou através do trato gastrointestinal. Os rins contribuem com mais de 90% da perda do potássio corporal. Alterações na concentração do potássio no soro também estão associadas a alterações acidobásicas (Cap. 24). SISTEMA RENINA-ANGIOTENSINA O sistema renina-angiotensina controla a pressão sanguínea e o tônus vascular Ingestão de potássio: Dieta LIC K+= 110 mmol/L LEC faixa de referência = 3,5-5,0 mmol/L Perda de potássio: Urina, líquidos intestinais (diarreia), drenagem cirúrgica no pós-operatório Concentração plasmática de potássio mmol/L mmol/L 6,0 Perigo! (hipercalemia) 5,0 4,0 Faixa de referência 3,0 2,0 Perigo! (hipocalemia) 1,0 317 A renina é produzida principalmente no aparelho justaglomerular do rim; é armazenada em grânulos secretores e liberada em resposta a uma redução na pressão de perfusão renal. A renina é uma protease que usa o angiotensinogênio como seu substrato. O angiotensinogênio é uma glicoproteína com mais de 400 aminoácidos, é sintetizado no fígado e seus diferentes derivados apresentam estrutura e peso molecular variáveis. A renina forma a angiotensina pela clivagem do angiotensinogênico. A angiotensina I é um peptídeo com 10 aminoácidos e consiste em um substrato para a peptidil-dipeptidase A (enzima conversora de angiotensina; ECA). A ECA remove dois aminoácidos da angiotensina I, produzindo angiotensina II. Esta reação também pode ser catalisada por enzimas como quimase e catepsina. Outra forma de angiotensina, angiotensina 1-9, é formada pela isoforma da ECA (ECA2) e é subsequentemente degradada a angiotensina 1-7. Esta última também pode ser formada da angiotensina II por endopeptidases. O sistema renina-angiotensina encontra-se ilustrado na Figura 23.16. Os receptores de angiotensina são importantes na patogênese da doença cardiovascular A angiotensina II induz constrição do músculo liso vascular, consequentemente aumentando a pressão sanguínea e reduzindo o fluxo sanguíneo renal e a taxa de filtração glomerular. Também estimula a liberação de aldosterona e a proliferação das células do músculo liso vascular pela ativação de receptores AT1, os quais sinalizam através de proteínas G e fosfolipase C (Fig. 23.17). Geralmente, a ativação do receptor AT1 tem efeitos que promovem a doença cardiovascular: estimulação da resposta inflamatória, deposição de matriz extracelular, geração de espécies reativas do oxigênio (ERO) e efeito pró-trombótico. Estas ações são antagonizadas pela ativação dos receptores AT2, que induzem vasodilatação por meio da estimulação da produção de óxido nítrico, promovem perda de sódio e inibe a proliferação das células musculares lisas vasculares. As ações da angiotensina (1-7), a qual age por meio do receptor denominado Mas (ela também pode se ligar a AT1 e AT2), também parecem ser cardioprotetoras. Drogas que inibem a ECA são atualmente muito usadas no tratamento da hipertensão e insuficiência cardíaca (Fig. 23.17 e quadro da pág. 66) Quantidades substanciais de angiotensina II são formadas no rim. As células justaglomerulares contêm ECA, angiotensina I e angiotensina II. A angiotensina II também é sintetizada nas células glomerulares e tubulares e é secretada no líquido tubular e no espaço intersticial. Os receptores da angiotensina II estão presentes nas células tubulares e células vasculares renais: assim, a angiotensina II produzida localmente talvez influencil a reabsorção tubular e o tônus vascular renal pelas ações autócrina e parácrina. 0 Aldosterona Fig. 23.15 Equilíbrio do potássio. A concentração plasmática do potássio é mantida dentro de limites estreitos. Tanto concentrações baixas (hipocalemia) como elevadas (hipercalemia) podem ser perigosas, porque o potássio afeta a contratilidade do músculo cardíaco. O painel superior mostra as principais vias de perda de potássio. Baynes023.indd 317 A aldosterona regula a homeostasia do sódio e do potássio A aldosterona é o principal hormônio mineralocorticosteroide no homem e é produzida no córtex adrenal. Ela regula o volume ex- 12/13/2010 3:09:12 PM 318 Homeostase da Água e de Eletrólitos Angiotensinogênio (1-255) Renina ECA 2 Angiotensina I (1-10) Inibidores da ECA – Angiotensina I (1-9) Endopeptidase ECA ECA Angiotensina II (1-8) ECA Angiotensina II (1-5) Angiotensina II (1-7) ECA 2 Endopeptidase Carboxipeptidase – Bloqueadores do receptor da angiotensina Receptores de angiotensina II tipo 1 (AT1) Suprarrenals da reabsorção renal de sódio da excreção urinária de potássio Receptores de angiotensina II tipo 2 (AT2) Rim TFG fluxo sanguíneo renal Receptor Mas Músculo liso vascular Contração Proliferação Miocárdio Contratilidade SNC Liberação de epinefrina Liberação de norepinefrina Também; da produção de ERO de deposição de matriz na camada íntima Fig. 23.16 O sistema renina-angiotensina. A renina converte o angiotensinogênio em angiotensina I. A angiotensina I é posteriormente convertida em angiotensina II pela enzima conversora de angiotensina (ECA). Ela também fornece outros peptídeos angiotensina. Ações celulares das angiotensinas são mediadas por receptores tipo 1 (AT1), tipo 2 (AT2) e receptores Mas, que se ligam à angiotensina (1-7). O sistema renina-angiotensina é um alvo para as duas principais classes de drogas anti-hipertensivas: inibidores da ECA (p. ex., ramipril, enalapril) e antagonistas do receptor AT1 (p. ex., losartan). Os inibidores da ECA são também largamente utilizados no tratamento da insuficiência cardíaca. CMLV, células musculares lisas vasculares; SNC, sistema nervoso central. *Receptor AT1 bloqueado pelo losartan. **Receptor AT2 bloqueado pela saralasina. ERO: espécie reativa de oxigênio. tracelular e tônus vascular, e controla o transporte renal de sódio e potássio. A aldosterona se liga ao receptor do mineralocorticoide citosólico nas células epiteliais, principalmente no ducto coletor renal. O receptor se move para o núcleo e se liga a domínios específicos em genes-alvo, alterando a expressão gênica. A aldosterona regula a Na+/K+-ATPase tanto pelo mecanismo de curta quanto pelo de longa duração e também regula transportadores como Na+/H+ tipo 3 no túbulo proximal, o cotransportador Na+/Cl- no túbulo distal e o canal de sódio na célula epitelial do ducto coletor. O resultado final é um aumento Baynes023.indd 318 na reabsorção de sódio e secreção aumentada de potássio e íon hidrogênio. O hiperaldosteronismo é um fator comum na hipertensão O aldosteronismo primário ocorre como resultado de uma atividade adrenal anormal e é raro. Pode resultar de um tumor adrenal isolado, um adenoma (síndrome de Conn). O hiperaldosteronismo secundário, mais frequente, é devido a uma secreção aumentada de renina. Os feocromocitomas são tumores secretores de catecolaminas que causam hipertensão em cerca 12/13/2010 3:09:12 PM Sistema renina-angiotensina Complexo do receptor de angiotensina II Membrana celular Canal de Ca2+ AT1R PLC Gp PIP2 Citosol DAG + IP3 Ca 2+ Ca2+ SR Relaxamento da CMLV MLCK inativa Fosforilação MLC MLC Contração da CMLV Defosforilação Fosfatase CMLV Fig. 23.17 Vasoconstrição induzida pela angiotensina II. O receptor de angiotensina (AT1R) está acoplado a proteínas G. A ligação de angiotensina II com o receptor leva à formação de inositol 1,4,5-trifosfato (IP3) e 1,2-diacilglicerol (DAG) mediada pela fosfolipase C. Isto mobiliza Ca2+ do retículo sarcoplasmático (SR) e estimula a entrada do Ca2+ extracelular através da ativação de canais de cálcio. O aumento do Ca2+ citosólico inicia a resposta contrátil das células musculares lisas vasculares. O Ca2+ subsequentemente se liga à calmodulina (Cal). O complexo Ca2+-calmodulina ativa a quinase de cadeia leve da miosina (MLKC), que fosforila as cadeias leves da miosina e provoca tensão muscular. Este efeito é terminado pela defosforilação da miosina (Cap. 20). Antagonistas dos receptores AT1, como a losartana, inibem os efeitos vasoconstritores da angiotensina II e são usados no tratamento da hipertensão. AT1R: Receptor de angiotensina AT1; DAG, 1,2,diacilglicerol; CMLU: célula muscular lisa vascular, MLCK: quinase de cadeia leve de miosina; Cal: calmodulina. de 0,1% dos pacientes hipertensos. É importante diagnosticar corretamente um feocromocitoma porque ele pode ser removido cirurgicamente (Cap. 43 e quadro da pág. 66). Peptídeos natriuréticos Os peptídeos natriuréticos são marcadores importantes da insuficiência cardíaca Uma família de peptídeos conhecida como peptídeos natriuréticos está envolvida na regulação do volume de líquidos do corpo. Os dois peptídeos principais são o peptídeo natriurético atrial (ANP) e o peptídeo natriurético cerebral (BNP). O ANP Baynes023.indd 319 UTILIDADE DIAGNÓSTICA DOS PRÓ-PEPTÍDEOS DO PEPTÍDEO NATRIURÉTICO CEREBRAL (BNP) Em vez de dosar as formas ativas dos peptídeos natriuréticos no plasma, é mais conveniente determinar os pró-peptídeos presentes no plasma em quantidades equimolares às espécies ativas. O pró-BNP (1-76) alcança níveis mais altos do que o BNP 32 na insuficiência cardíaca. De forma semelhante, o pró-ANP (1-98) possui meia-vida mais longa no plasma do que o ANP 1-28 biologicamente ativo, estando presente, portanto, em concentrações mais altas na circulação. Calmodulina Ca2+-Cal MLCK ativa 319 A INSUFICIÊNCIA RENAL AGUDA LEVA À REDUÇÃO ABRUPTA DO DÉBITO URINÁRIO E CONCENTRAÇÃO AUMENTADA DE UREIA E CREATININA NO SORO Um homem com 25 anos de idade foi admitido no hospital inconsciente após um acidente de motocicleta. Ele apresentava evidências de choque como hipotensão e taquicardia, fratura craniana e diversas lesões nos membros. Apesar do tratamento com coloide intravenoso e sangue ele apresentou oligúria persistente (5-10 mL/ hora; oligúria consiste em débito urinário inferior a 20 mL/hora). A oligúria devido à necrose tubular aguda pode ser diferenciada da uremia pré-renal pela medida da osmolalidade urinária (>500 mOsm/kg na uremia pré-renal e <350 mOsm/kg na insuficiência renal aguda), e pela concentração de sódio urinário (<20 mmol/L na azotemia pré-renal e >40 mmol/L na insuficiência renal aguda). No terceiro dia, sua concentração de creatinina sérica tinha subido para 300 µmol/L (3,9 mg/dL) e a concentração da ureia para 21,9 mmol/L (132 mg/dL). Os valores de referência são: ■ creatinina: 20-80 µmol/L (0,23-0,90 mg/dL) ■ ureia: 2,5-6,5 mmol/L (16,2-39 mg/dL) Comentário. Este jovem homem desenvolveu insuficiência renal aguda devido a uma necrose tubular aguda em consequência do choque hipovolêmico. Ele foi submetido à hemodiálise de emergência. A função renal começou a se recuperar depois de duas semanas com um aumento inicial do débito urinário, a chamada “fase diurética”. ■ ureia mg/dL ⫽ mmol/L ⫻ 6,02 ■ creatinina mg/ml = µmol/L x 0,0113 é sintetizado predominantemente no átrio cardíaco como um pró-peptídeo com 126 aminoácidos (pró-ANP). Ele é, então, clivado num pró-peptídeo menor com 98 aminoácidos e no ANP biologicamente ativo com 28 aminoácidos. O BNP é sintetizado nos ventrículos cardíacos como um pró-peptídeo de 108 aminoácidos, e é clivado num pró-peptídeo com 76 aminoácidos e no peptídeo biologicamente ativo BNP com 32 aminoácidos. O BNP 32 e outro peptídeo, CNP (com 23 aminoácidos), foram isolados do cérebro porcino, de onde vem esse nome. Todos os 12/13/2010 3:09:12 PM 320 Homeostase da Água e de Eletrólitos Complexo vasopressina-VR O SISTEMA RENINAANGIOTENSINA-ALDOSTERONA E A INSUFICIÊNCIA CARDÍACA Um homem de 65 anos de idade, com histórico de infarto do miocárdio, apresentou-se com fadiga crescente, dificuldade de respirar e edema de tornozelos. O exame físico revelou taquicardia leve e aumento da pressão venosa jugular. O ecocardiograma mostrou que a função do ventrículo esquerdo durante a sístole estava prejudicada. As dosagens séricas do paciente revelaram: sódio 140 mmol/L, potássio 3,5 mmol/L, proteínas 34 g/dL (normal 35-45 g/dL), creati- AQP2 Membrana luminal PKA ativa Curta duração + cAMP Longa duração ATP Ca2+ G AQP2 + Transcrição do gene AQP2 AQP2 Síntese de AQP2 Membrana basolateral Núcleo nina 80 µmol/L (0,90 mg/dL) e ureia 7,5 mmol/L (45 mg/dL). Comentário. Este homem se apresenta com sintomas e sinais de insuficiência cardíaca. A função cardíaca prejudicada leva a uma redução do fluxo sanguíneo pelos rins, ativação do sistema reninaangiotensina e estímulo da secreção de aldosterona. A aldosterona causa um aumento na reabsorção renal de sódio e retenção de água, aumentando assim o volume de líquido extracelular e causando edema. peptídeos natriuréticos possuem uma estrutura em forma de anel devido à presença de uma ponte dissulfeto. Os peptídeos natriuréticos promovem excreção renal de sódio e redução da pressão sanguínea. O ANP e o BNP são secretados em resposta à distensão atrial e à sobrecarga de volume no ventrículo. Eles se ligam a receptores ligados a proteínas G: os receptores tipo A estão localizados predominantemente nas células endoteliais e os receptores tipo B, no cérebro. Existe uma reatividade cruzada entre os diferentes receptores natriuréticos em relação a estes peptídeos. É importante notar que os níveis de ANP e de BNP estão aumentados na insuficiência cardíaca e consequentemente suas medidas são usadas como marcadores bioquímicos precoces desta condição. Estas medidas são particularmente úteis para excluir a presença de insuficiência cardíaca nos pacientes que se apresentam com sintomas inespecíficos tais como dificuldade respiratória. Vasopressina e aquaporinas A reabsorção de água nos ductos coletores renais é controlada pelo hormônio vasopressina, da pituitária posterior, que controla a atividade dos canais de água na membrana, aquaporinas. A vasopressina determina o volume final e a concentração da urina A vasopressina (também conhecida como hormônio antidiurético, ADH) controla a reabsorção de água nos ductos coletores renais (Fig. 23.18). A vasopressina é sintetizada nos núcleos supraóticos e paraventricular do hipotálamo e é transportada ao longo dos axônios para a pituitária posterior, onde é armazenada antes de ser processada e liberada. A vasopressina se liga ao seu receptor localizado nas membranas das células tubulares Baynes023.indd 320 Fig. 23.18 A vasopressina regula a reabsorção de água no ducto coletor. A vasopressina controla o canal de água aquaporina 2 (AQP2). A vasopressina se liga a seu receptor (VR) e, por meio da ativação de proteínas G (G), estimula a produção de cAMP que ativa a proteína quinase A (PKA). A PKA fosforila o AQP2 citoplasmático, e induz sua translocação para a membrana celular, aumentando a capacidade de transporte de água. A vasopressina também regula a expressão do gene AQP2. AC, adenilato ciclase. nos ductos coletores. O receptor é acoplado a proteínas G e ativa a proteína quinase A (PKA). A PKA fosforila a aquaporina 2 (AQP2), o que estimula sua translocação para a membrana celular, aumentando a reabsorção de água no ducto coletor. A secreção de vasopressina precisa ser inibida para permitir a formação de urina diluída. A impossibilidade de inibição total da vasopressina resulta em incapacidade de diluir a urina em níveis de osmolalidade menores do que a do plasma. Outros hormônios afetam a secreção de vasopressina. Os glicocorticoides estimulam, sobretudo por meio de seus efeitos hemodinâmicos que diminuem a pressão arterial. Incidentalmente, a AVP também é estimulada pela nicotina. Aquaporinas são proteínas que formam canais na membrana que transportam água O canal de água aquaporina está ilustrado na Figura 23.19. A aquaporina 1 (AQP1) encontra-se expressa nas membranas apicais e basolaterais do túbulo proximal e no ramo descendente da alça de Henle e não é regulada pela vasopressina. Encontra-se presente também em eritrócitos, células tubulares renais proximais e no endotélio capilar. As AQP2 e 3 estão presentes nos ductos coletores renais e são reguladas pela vasopressina. Defeitos na secreção de vasopressina e mutações nos genes que codificam as aquaporinas causam alterações clínicas A deficiência de vasopressina causa uma condição conhecida como diabetes insipidus, na qual grande quantidade de urina diluída é perdida. Por sua vez, a secreção excessiva de vasopressina pode ocorrer após um grande trauma ou cirurgia. Esta condição é conhecida como síndrome da secreção inapropriada de hormônio antidiurético (SIADH), e leva a retenção de água. Mutações no gene do receptor da vasopressina e também no gene da AQP2 levam a diferentes tipos da chamada diabetes insípida nefrogênica, uma condição associada à perda de grande 12/13/2010 3:09:12 PM Integração da homeostase da água e do sódio A H2O 321 Rim Glicano Glomérulo H2O Córtex Reabsorção iso-osmótica 300 H2O H2O H2O Receptores de vasopressina+ H2O B Membrana plasmática N P A N P A NH2 COOH H2O 600 Aquaporina Ramo ascendente impermeável à água Medula H2O H2O 1300 H2O Fig. 23.19 Canal de água aquaporina. A aquaporina 1 é um canal de água formado por várias subunidades com uma unidade glicana ligada a uma de suas subunidades (A). Cada um dos monômeros apresenta duas estruturas de repetição ao acaso, consistindo em três regiões transmembrana (B) e alças de ligação imersas na membrana. quantidade de urina e desidratação. A Figura 23.20 resume a regulação da água pelo rim. INTEGRAÇÃO DA HOMEOSTASE DA ÁGUA E DO SÓDIO Aldosterona e vasopressina juntas controlam o uso da água e do sódio Normalmente, apesar das variações na ingestão de líquido, a osmolalidade do plasma é mantida dentro de limites estreitos (280-295 mmol/kg H2O). A vasopressina contribui para o controle da osmolalidade plasmática regulando o metabolismo da água. Ela responde tanto aos sinais osmóticos como de volume. Por um lado, sua secreção e a sede são estimuladas por sinais dos osmorreceptores que respondem a aumentos bem pequenos (cerca de 1%) na osmolalidade plasmática. Por outro lado, a liberação da vasopressina é estimulada por uma redução (acima de 10%) no volume circulante. Água em excesso aumenta o volume do plasma, do fluxo sanguíneo renal e da TFG Na condição de excesso de água, a produção de renina é suprimida. A baixa concentração de aldosterona permite a perda de sódio na urina. Como o excesso de água dilui o plasma, a osmolalidade plasmática diminui. A redução na osmolalidade, detec- Baynes023.indd 321 Gradiente de osmolalidade Permeabilidade da parede tubular à água controlada pela vasopressina Fig. 23.20 Reabsorção e excreção renal de água. A permeabilidade das paredes dos túbulos à água difere ao longo do néfron. Cerca de 80% da água filtrada é reabsorvida no túbulo proximal por reabsorção iso-osmótica. O ramo ascendente da alça de Henle é impermeável à água. No ducto coletor, a vasopressina controla a reabsorção de água através dos canais de água aquaporina. OS DIURÉTICOS SÃO USADOS PARA O TRATAMENTO DE EDEMA, INSUFICIÊNCIA CARDÍACA E HIPERTENSÃO Os diuréticos são drogas que estimulam a excreção de água e sódio. Os diuréticos tiazídicos, por exemplo, bendrofluazida, reduzem a reabsorção de sódio nos túbulos distais bloqueando o cotransporte de sódio e cloreto. Os diuréticos de alça, tais como a furosemida, inibem a reabsorção de sódio na porção ascendente da alça de Henle. A espironolactona, um diurético poupador de potássio, é um inibidor competitivo da aldosterona: inibe a troca sódio-potássio nos túbulos distais e diminui a excreção de potássio. Uma diurese osmótica pode ser induzida pela administração de um açúcar álcool, o manitol. O efeito líquido do tratamento com diuréticos é o volume urinário aumentado e perda de água e sódio. Os diuréticos são importantes no tratamento do edema associado a problemas circulatórios, tais como insuficiência cardíaca, nos quais a função cardíaca deficiente leva à falta de ar grave causada por edema pulmonar. Eles também são essenciais no tratamento da hipertensão. 12/13/2010 3:09:12 PM 322 Homeostase da Água e de Eletrólitos INGESTÃO DEFICIENTE DE LÍQUIDOS LEVA À DESIDRATAÇÃO Um homem de 80 anos de idade foi admitido no hospital após ter permanecido por período prolongado no chão de sua casa, como resultado de um derrame agudo. Ele apresentou turgor tecidual deficiente, secura na boca, taquicardia e hipotensão. Dosagens no soro revelaram: sódio 150 mmol/L, potássio 5,2 mmol/L, bicarbonato 35 mmol/L, creatinina 110 µmol/L (1,13 mg/dL) e ureia 19 mmol/L (90,3 mg/dL). Os valores de referência são: ■ ■ ■ ■ ■ Sódio: 135-145 mmol/L Potássio: 3,5-5,0 mmol/L Bicarbonato: 20-25 mmol/L Creatinina: 20-80 µmol/L (0,28-0,90 mg/dL) Ureia: 2,5-6,5 mmol/L (16,2-39 mg/dL) Comentário. Este paciente se apresenta com desidratação, indicada pelos altos valores de sódio e ureia. Ele foi tratado com fluido intravenoso predominantemente na forma de glicose 5% para repor o déficit de água. A HIPERTENSÃO ARTERIAL É UMA DOENÇA COMUM A hipertensão consiste num aumento inadequado da pressão sanguínea arterial. É desejável que os níveis das pressões sanguíneas sistólica e diastólica sejam menores que 140 mmHg e 90 mmHg, respectivamente (valores ótimos são ainda menores, abaixo de 120/80 mmHg). Segundo a Organização Mundial da Saúde, cerca de 20% da população do mundo desenvolvido sofre desta condição. A hipertensão arterial pode ser classificada como “essencial” (primária) ou “secundária”. A causa da hipertensão essencial ainda não foi identificada, embora se saiba que envolve diversos fatores genéticos e ambientais, incluindo componentes neurais, endócrinos e metabólicos. Uma dieta rica em sódio é um fator reconhecido no desenvolvimento da hipertensão. A hipertensão está associada a um risco aumentado de derrame e infarto do miocárdio e é responsável por uma em cada oito mortes no mundo inteiro. Uma variedade de drogas é empregada no tratamento moderno da hipertensão. Entre estas se incluem diuréticos tais como a bendrofluazida, drogas que bloqueiam os adrenorreceptores, inibidores da enzima conversora da angiotensina e antagonistas dos receptores AT1 de angiotensina (quadro da pág. 323 e quadro da pág. 66; o feocromocitoma é descrito na pág. 588). tada pelos osmorreceptores hipotalâmicos, suprime a sede e a secreção de vasopressina. A supressão da vasopressina leva a perda de água pela urina. A resposta global ao excesso de água é a excreção aumentada de água e sódio. da osmolalidade do LEC do volume circulante do fluxo sanguíneo renal O déficit de água (desidratação) leva à redução no volume plasmático, no fluxo de sangue renal e na TFG Estimulação de osmorreceptores no sistema nervoso central Quando existe desidratação, a redução no fluxo sanguíneo renal estimula o sistema renina-angiotensina-aldosterona. A aldosterona inibe a excreção urinária de sódio. Além disso, devido à perda de água, a osmolalidade plasmática aumenta e estimula a secreção de vasopressina, com consequente redução no volume urinário. Desta maneira, a resposta ao déficit de água é a retenção de sódio e água (Fig. 23.21). A concentração de sódio no soro é um marcador de desordens do equilíbrio hidroeletrolítico Os distúrbios hidroeletrolíticos resultam de um desequilíbrio entre a ingestão de líquidos e eletrólitos e sua eliminação, e do movimento da água e eletrólitos entre os compartimentos do organismo. Uma redução na concentração de sódio (hiponatremia) geralmente indica que o líquido extracelular está sendo “diluído” (presença de excesso de água), enquanto uma concentração de sódio aumentada significa que o líquido extracelular está sendo “concentrado” (água está sendo perdida). A hiponatremia também pode resultar da perda de sódio, mas é raro. A avaliação da condição hídrica e eletrolítica do paciente é uma etapa importante na prática clínica A avaliação do equilíbrio hidroeletrolítico é uma parte importante do exame clínico. Além do exame físico e da história médica, as seguintes dosagens são necessárias: Baynes023.indd 322 Estimulação dos barorreceptores e detecção do Clno túbulo distal (aparelho justaglomerular) da renina Sede Liberação de vasopressina da angiotensina II de aldosterona da ingestão de água Reabsorção renal de água Retenção de sódio do volume circulante da osmolalidade do LEC* Fig. 23.21 Inter-relação entre o metabolismo da água e do sódio. Os metabolismos da água e do sódio estão intimamente ligados. Um aumento na osmolalidade do LEC estimula a secreção da vasopressina, levando ao aumento da reabsorção renal da água. Isto “dilui” o LEC e a osmolalidade diminui. Esta resposta é reforçada pelo estímulo da sede. Um decréscimo no volume plasmático também estimula a retenção de água por meio da estimulação de receptores sensíveis à pressão (barorreceptores) no aparelho justaglomerular. *A osmolalidade vai diminuir se o grau de retenção de água for relativamente maior do que a retenção de sódio. 12/13/2010 3:09:12 PM Leituras sugeridas ■ concentrações séricas dos eletrólitos: o perfil solicitado rotineiramente compreende sódio, potássio, cloreto e bicarbonato ■ concentrações séricas de creatinina e ureia ■ volume, osmolalidade e concentração de sódio na urina ■ osmolalidade sérica Os pacientes que possuem ou correm risco de desenvolver alterações hidroeletrolíticas necessitam de acompanhamento diário da ingestão e perda de líquidos (mapa de fluidos). 323 QUESTÕES DE APRENDIZADO Comente sobre o papel da bomba de Na+/K+-ATPase na manutenção dos gradientes iônicos através da membrana celular. 2. Explique o papel do sistema renina-angiotensina na manutenção da pressão do sangue. 3. Descreva o movimento da água entre o LEC e o LIC que ocorre na privação de água. 4. Por que uma baixa concentração de albumina no plasma leva ao edema? 1. Resumo ■ Tanto o déficit de água no organismo (desidratação) como o excesso (super-hidratação) causam problemas clínicos potencialmente graves. Portanto, a avaliação do equilíbrio hidroeletrolítico é uma parte importante do exame clínico. ■ O equilíbrio da água corporal está intimamente ligado com o equilíbrio dos íons dissolvidos (eletrólitos), dentre os quais, os mais importantes são o sódio e o potássio. ■ O movimento da água entre o LEC e o LIC é controlado pelo gradiente osmótico. ■ O movimento da água entre a luz de um vaso sanguíneo e o líquido intersticial é controlado pelo equilíbrio entre as pressões osmótica e hidrostática. ■ Os principais reguladores do equilíbrio hidroeletrolítico são a vasopressina (água) e a aldosterona (sódio e potássio). ■ O sistema renina-angiotensina é o principal regulador da pressão sanguínea e do tônus vascular. Baynes023.indd 323 ■ A dosagem dos peptídeos natriuréticos ajuda no diagnóstico da insuficiência cardíaca. ■ As concentrações séricas de ureia e creatinina são os principais testes realizados para avaliação da função renal. Leituras sugeridas Androgue HJ, Madias NE. Mechanisms of disease: sodium and potassium in the pathogenesis of hypertension. N Engl J Med 2007;356:1966–1978. Bekheirnia R, Schrier RW. Pathophysiology of water and sodium retention: edematous states with normal kidney function. Curr Opin Pharmacol 2006;6:202–207. Chobanian A, Bakris GL, Black HR et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. JAMA 2003;289:2560–2572. Li J, Gobe G. Protein kinase C activation and its role in kidney disease. Nephrology 2006;11:428–434. Moro C, Berlan M. Cardiovascular and metabolic effects of natriuretic peptides. Fund Clin Pharmacol 2006;20:41–49. Schrier RW. Body water homeostasis: clinical disorders of urinary dilution and concentration. J Am Soc Nephrol 2006;17:1820–1832. 12/13/2010 3:09:12 PM EM PORTUGUÊS MÉDICA BIOQUÍMICA MÉDICA John W. Baynes MS, PhD e Marek H. Dominiczak, MD, FRCPath 3ªEDIÇÃO • Oferece cobertura completa e atualizada dos mais recentes conceitos da área. Quadros de Conceitos Avançados • Utiliza quadros clínicos e integra tópicos de medicina clínica no texto para mostrar como a bioquímica é relevante para os problemas do dia a dia dos pacientes – ideal para cursos integrados baseados em problemas do cotidiano. Quadros de Exames Clínicos • Inclui quadros de conceitos avançados para cobertura em profundidade de tópicos importantes, incluindo pesquisas recentes em bioquímica. Ilustrações Coloridas • Incorpora formidáveis ilustrações coloridas, incluindo um sistema exclusivo de ícones que trazem a bioquímica à vida. Questões de Aprendizado • Ajuda os estudantes a guardar informações usando quadros de aprendizado ativo que testam o conhecimento no final de cada capítulo. O resultado é um pacote completo para o estudante de medicina. www.elsevier.com.br www.studentconsult.com.br A compra deste livro permite acesso gratuito ao www.studentconsult.com.br, que contém perguntas e respostas comentadas, links integrados, todos os quadros do livro impresso e banco de imagens. Além desses conteúdos em português, também permite o acesso gratuito ao conteúdo integral do livro em inglês no site www.studentconsult.com A aquisição desta obra habilita o acesso aos sites www.studentconsult.com e www.studentconsult.com.br. Os conteúdos publicados nestes sites permanecerão disponíveis até o lançamento da próxima edição em inglês e português respectivamente desta obra ou até que esta edição em inglês e português respectivamente não esteja mais disponível para venda pela Elsevier, o que ocorrer primeiro. John W. Baynes • Marek H. Dominiczak BIOQUÍMICA Quadros Clínicos • Explica conceitos difíceis usando casos clínicos para ajudar os estudantes a aplicar o conhecimento básico na medicina clínica. 3ªEDIÇÃO MÉDICA Este texto é ideal para apoiar o atual currículo de bioquímica, que mapeia o caminho para futuros médicos, apresentando a ciência básica e a prática médica de forma concisa e integrada. Organizado com características especiais, tais como Quadros Clínicos, Quadros de Conceitos Avançados, Quadros de Exames Clínicos, Ilustrações Coloridas e Questões de Aprendizado, mostra o conhecimento de forma clara e com grande estilo visual, perfeito para os estudantes de medicina de hoje. Este livro vem também com acesso ao site STUDENT CONSULT! Características especiais BIOQUÍMICA Baynes Dominiczak Classificação de Arquivo Recomendada BIOQUÍMICA TRADUÇÃO DA 3ª EDIÇÃO
Download