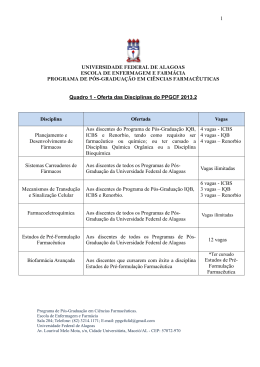
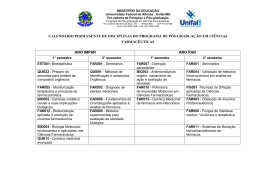
DISCIPLINA: PRÉ-FORMULAÇÃO (PCF 00025) No. de Créditos: Carga Horária: 4 60 horas RESPONSÁVEL: Maria Palmira Daflon Gremião DISTRIBUIÇÃO DIDÁTICA: Teórica: 45h Prática: 00h Outras Ativid: 15h Conteúdo programático • • • • • • Pré-formulação - importância, objetivos e estágios. Aspectos gerais considerados na pré-formulação: coeficiente de partilha O/A/absorção; posologia/metabolismo/toxicologia. Pré-formulação em formas farmacêuticas sólidas: características e propriedades das partículas e suas influências no processo tecnológico e na biodisponibilidade; relação fármaco/excipiente/biodisponibilidade; propriedades dos sistemas particulados sólidos e sua influência no processo tecnológico; estabilidade e estabilização; incompatibilidades. Pré-formulação em formas farmacêuticas líquidas - dispersões moleculares: solubilidade dos componentes e fatores influentes na solubilidade; relação fármaco/veículo/biodisponibilidade; estabilidade e estabilização; incompatibilidades. Pré-formulação em formas farmacêuticas líquidas - dispersões particuladas: propriedades e características da fase dispersa e suas influências na estabilização física do sistema e na biodisponibilidade; fatores que influem na estruturação do meio dispersor; incompatibilidades. -Pré-formulação em formas farmacêuticas semi-sólidas: características e propriedades físicas e físico-químicas do fármaco e suas influências no processo tecnológico e na biodisponibilidade; relação fármaco/excipiente/biodisponibilidade; estabilidade e estabilização; incompatibilidades. Ementa • Fatores de Pré-formulação • Pré-formulação das diferentes formas farmacêuticas Objetivos A disciplina estuda os fatores que devem ser considerados na pré-formulação de medicamentos: fatores gerais de pré-formulação e específicos na pré-formulação das diferentes formas farmacêuticas. Critérios de avaliação A avaliação do aprendizado será realizada através de seminários e trabalho escrito. Bibliografia 1-AMIDON, G.L., LENERMAS, H., SHAH, V.P., CRISON, J.R. A theoretical basis for a biopharmaceutics drug classification: the correlation of in vitor drug product dissolution and in vivo bioavailability. Pharmaceutical Research. 12: 413-420, 1995. 2- BANGA, A.K. Therapeutic Peptides and Proteins: Formulation, Processing, and Delivery Systems, 2a Edition, CRC Press 2005, 376. 3- BRITISH PHARMACOPEIA London, Her Majesty, 2001. 4-BUENO, J.H.F., CASTRO, A.D., EVANGELISTA, R.C., GREMIÃO, M.P.D. Alguns fatores físicos envolvidos na compressão e suas aplicações na formulação de comprimidos. Rev. Ciênc. Farm., v. 19, 1998. 5-BURGESS, D. J. Injectable Dispersed Systems: Formulation, Processing and Performance, 2005, 688p. 6-Carvalho, F C ; BRUSCHI, Marcos Luciano ; EVANGELISTA, Raul Cesar ; GREMIÃO, M. P. D. Mucoadhesive drug delivery systems. Brazilian Journal of Pharmaceutical Sciences v. 46, p. 1-20, 2010. 7-CASTRO, A.D., MOURÃO, S.C., BUENO, J.H., EVANGELISTA, R.C., GREMIÃO, M.P.D. Considerações sobre o processo de obtenção de dispersões moleculares. Infarma, v. 14, n° 11/12, 54-58, 2002. 8-GIBSON, M. Pharmaceutical preformulation and formulation,, CRC Press 2001, 596 p. 9-KANFER, I.; SHARGEL, L. Generic Drug Product Development: Solid Oral Dosage Forms CRC Press, 2005, 381 p. 10-KIM, J. Advanced pharmaceutics: Physicochemical principles. Boca Raton: CRC, 2004. 11-LACHMAN, L., LIEBERMAN, H.A., KANIG, J.L. Teoria e Prática na Indústria Farmacêutica, Fundação Caloustre Gulbenkian, vol. I e II, 2001, 1617p. 12-LEHR, C. M. Cell Culture Models of Biological Barriers: In vitro Test Systems for Drug Absorption and Delivery. CRC Press, 2002, 462p 13-LEVIN, M. Ed. Pharmaceutical process scale-up. 2. ed. New York: Taylor and Francis, 2005. 14-NASH, R. A.; WACHTER, A. H. Pharmaceutical Process Validation, Marcel Dekker, New York, 2003. 15-NIELLOUD, F., MARTI-MESTRES, G. Pharmaceutical Emulsions and Suspensions, 2000, 637p. 16-VERGNAUD, J. M.; ROSCA, I. D. Assessing bioavailability of drug delivery systems mathematical modelling. Boca Raton: Taylor and Francis, 2005. 17-YORK, P.; KOMPELLA, U. B.; SHEKUNOV, B. Y., Ed. Supercritical fluid technology for drug product development. New York: Marcel Dekker, 2004. 18- Mark, Gibson Pharmaceutical Preformulation and Formulation: A Practical Guide from Candidate Drug Selection to Commercial Dosage Form, 2a Ed., Informa, 2009, 234p. 19- PINNAMANENI, S. DAS, N.G., DAS, S.K. Formation approaches for orally administered poorly soluble drugs. Pharmazie, 57(5): 291-300, 2002. 20- SMITH, E.W.; MAIBACH, H.I. Percutaneous Penetration Enhancers, 2a ed, 2005, 448p. 21-VERGNAUD, J. M.; ROSCA, I. D. Assessing bioavailability of drug delivery systems – mathematical modelling. Boca Raton: Taylor and Francis, 2005. 22-YORK, P.; KOMPELLA, U. B.; SHEKUNOV, B. Y., Ed. Supercritical fluid technology for drug product development. New York: Marcel Dekker, 2004. Periódicos: Journal of Pharmaceutical Sciences. Journal of Pharmacy and Pharmacology Pharmaceutical Research. Drug Development and Industrial Pharmacy. Journal of Controlled Release Journal of Microencapsulation Journal of Nanosciences and Nanotechnology
Baixar