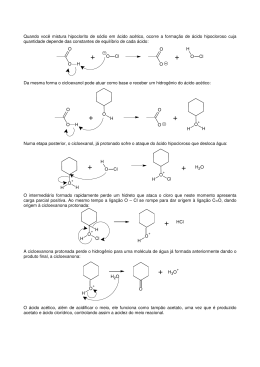
PAIES 2005-2008 3ª ETAPA Considere duas soluções aquosas contidas em frascos separados, mas que apresentam o mesmo valor de pH. Sabendo que uma delas contém ácido clorídrico, ácido forte (HCI), e a outra ácido acético, ácido fraco (H3C-COOH, cuja constante de ionização é 1,75 x 10-5), marque para as alternativas a seguir (V) verdadeira, (F) falsa ou (SO) sem opção. 1- ( ) 2- ( ) 3- ( ) 4- ( ) Para neutralizar um volume de solução aquosa diluída de hidróxido de sódio (NaOH), será necessário um mesmo volume de solução aquosa, seja ela do ácido clorídrico, seja do ácido acético. A adição de cristais do sal acetato de sódio (H3C–COO–Na+) a um certo volume da solução de ácido acético proporcionará uma elevação no valor de pH da solução, pois o grau de ionização do ácido se reduzirá. A adição de cristais do sal acetato de sódio (H3C-COO– Na+) a um certo volume da solução de ácido acético produzirá uma nova solução denominada Solução Tampão. Uma das características dessa solução é não sofrer variação significativa no valor de seu pH se a ela for adicionada uma pequena quantidade de solução diluída, como por exemplo, de um ácido forte. O pH da solução de ácido clorídrico é seguramente menor do que 7. Entretanto, se adicionarmos a essa solução, lentamente, uma solução diluída de hidróxido de sódio (NaOH), o valor do pH da solução resultante irá aumentando, gradativamente, enquanto que o valor de seu pOH irá diminuindo. Q U Í M I C A
Baixar