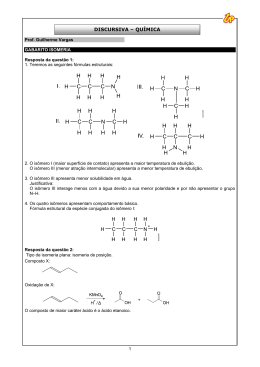
5. Parte Experimental 5. Parte Experimental 173 5. Parte Experimental Solventes e Reagentes Todos os solventes e reagentes eram de qualidade pró-análise e foram usados na forma em que foram adquiridos comercialmente, excepto quando expressamente indicado. Nestes casos os solventes foram secos e destilados de acordo com os métodos descritos.163 Análise Elementar C,H,N As análises de C,H,N foram realizadas pelo Sr. António Soares no Instituto Tecnológico e Nuclear (ITN), usando um analisador automático CE Instruments EA110. Espectroscopia de FTIR Os espectros de IV foram registados num espectrofotómetro Perkin-Elmer 577 ou num Bruker Tensor 27, sob a forma de pastilhas de KBr ou em nujol em células de CsI. Espectroscopia de RMN de 1H, 13C e 18F Os espectros de RMN de 1H, 13C e 18F foram obtidos num espectrómetro Varian Unity 300 MHz, utilizando-se o sinal residual do solvente como referência interna para o qual é conhecido o desvio químico relativamente ao tetrametilsilano (TMS). Espectrometria de Massa Os espectros de massa dos ligandos 3,5-Me2pzNN-Ant (L8), pzNN-Ant (L9) e Ant-3,5Me2pzNN (L10) apresentados no capítulo 3, foram efectuados num espectrómetro Extrel (Waters) FTMS 2001-DT (FT/ICR-MS), com ionização por impacto electrónico (IE) pelo Doutor Joaquim Marçalo (ITN). Os complexos de rénio, apresentados no capítulo 3, foram analisados por espectrometria com ionização por electrospray (ESIMS), no espectrómetro ThermoFinnigan LCQ no modo positivo (ITQB) pela Dr. Ana Coelho. 174 5. Parte Experimental Cromatografia em Camada Fina (TLC) As reacções de síntese química foram monotorizadas por TLC em tiras de sílica-gel 0.25 mm, Merck, em suporte de alumínio. Os cromatogramas foram revelados com radiação UV ou com iodo. Cromatografia em Coluna Foram efectuadas cromatografias em colunas de vidro de dimensões variadas, nas quais a fase sólida utilizada foi sempre gel de sílica 60, com granulometria 0.060 mesh (Merck). Cromatografia Líquida de Alta Pressão (HPLC) Para caracterizar as espécies radioactivas sintetizadas, bem como os complexos de rénio análogos, foi utilizado um sistema de HPLC (Shimadzu C-R4A) equipado com uma bomba Shimadzu LC-7a, Bio Liquid Chromatograph e dois detectores em série: detector UV (LKB) e um detector de radiação γ (Berthold – LB 505). Todos os solventes utilizados eram de qualidade HPLC. A água foi bidestilada em aparelho de quartz. Os solventes preparados foram filtrados por filtro milipore de 0.22 µm e desaerificados com hélio. Os cromatogramas foram obtidos por detecção da absorvância a 250 nm e por detecção da radiação γ, respectivamente para os compostos de Re e 99mTc. Para HPLC analítico foi utilizada uma coluna de fase reversa Macherey-Nagel C18 (Nucleosil EC 250/4, 100-10) e os eluentes foram gradientes de MeOH/0.1% TFA ou CH3CN/0.1% TFA com um fluxo de 1.0 ml/min. O método de gradiente de eluição foi o seguinte: t = 0-3 min: 0% MeOH ou CH3CN; 3-3.1 min: 0-25% MeOH ou CH3CN; 3.1-9 min: 25% MeOH ou CH3CN; 9-9.1 min: 25-34% MeOH ou CH3CN; 9.1-20 min: 34-100% MeOH ou CH3CN; 20-22 min: 100% MeOH ou CH3CN; 22-22.1 min: 100-0% MeOH ou CH3CN; 22.1-30 min: 0% MeOH ou CH3CN. Para purificar os compostos radioactivos foi utilizado um processo semi-preparativo. A coluna semi-preparativa Macherey-Nagel C18 (Nucleosil 100 EC 250/8) foi utilizada com uma pré-coluna Macherey-Nagel C18 (Nucleosil 100-7 EP 30/8). Os eluentes foram MeOH/0.1% TFA (gradiente) com um fluxo de 2 ml/min. O método de gradiente utilizado foi o seguinte: t = 0-3 min: 0% MeOH; 3-3.1 min: 0-25% MeOH; 3.1-9 min: 25% MeOH; 9-9.1 min: 25-34% MeOH; 9.1-20 min: 34-100% MeOH; 20-42 min: 100% MeOH; 42-42.1 min: 100-0% MeOH; 42.1-50 min: 0% MeOH. 175 5. Parte Experimental Após a purificação, o solvente das soluções radioactivas foi evaporado em corrente de azoto. De seguida, redissolveu-se o complexo radioactivo no mínimo de soro fisiolágico e procedeu-se ao controlo do produto por HPLC analítico. Uma vez verificado o grau de pureza da solução, o solvente foi novamente evaporado. Medição da Actividade das Soluções Radioactivas A actividade das soluções que continham compostos de 99mTc foi medida numa câmara de ionização Aloka, Curiemeter IGC-3, caso das soluções com mais actividade, ou num contador gama Berthold, LB2111. 176 5. Parte Experimental 5.1. Síntese e Caracterização de Ligandos N-Heterocíclicos e dos Respectivos Complexos de Re e 99mTc. 5.1.1. Síntese e Caracterização dos Ligandos Os ligandos N1-(2-(3,5-dimetil-1H-pirazol-1-il)etil)etano-1,2-diamina (L6)75 e N1-(2(1H-pirazol-1-il)etil)etano-1,2-diamina (L7)77 foram sintetizados conforme descrito na literatura. 5.1.1.1. N1-(2-aminoetil)-N2-(2-(3,5-dimetil-1H-pirazol-1-il)etil)etane-1,2-diamina (L1) Este ligando foi sintetizado por duas vias alternativas que a seguir se descrevem: i) Síntese por acoplamento directo da dietilenotriamina a) 2-(3,5-dimetil-1H-pirazol-1-il)etanol (a)108 N N OH A uma solução de 2,4-pentanodiona (50 g, 0.5 mol) em etanol absoluto (150 ml), mantida a uma temperatura abaixo dos 15ºC, foi adicionada, gota a gota, 2-hidroxietilhidrazina (38 g, 0.5 mol) dissolvida em etanol absoluto (50 ml). Após adição completa, a mistura reaccional ficou sob agitação à temperatura ambiente durante 1h. O solvente foi removido a pressão reduzida e o produto da reacção foi purificado por recristalização a -20 ºC de uma mistura de acetona / éter dietílico (20 ml/200 ml). Obteve-se 56 g (375 mmol, 75%) do composto a. 1 H-RMN (CDCl3): (ppm) 5.78 (s, pz-H, 1H); 4.02 (t, CH2, 2H); 2.93 (t, CH2, 2H); 2.20 (s, CH3, 3H); 2.17 (s, CH3, 3H). 177 5. Parte Experimental b) N-(2-p-toluenosulfoniletil)-3,5-dimetil-1H-pirazolo (b)108 O N N O S O Uma suspensão do composto a (42 g, 0.3 mol) com cloreto de p-toluenosulfonilo (57 g, 0.3 mol) em acetona (300 ml) e água destilada (300 ml) foi previamente colocada em banho de gelo, no qual a temperatura foi mantida abaixo dos 10 ºC. A esta suspensão foi adicionada, gota a gota, uma solução de NaOH (12 g, 0.3 mol). A mistura permaneceu sob agitação 1h à temperatura ambiente. O produto da reacção precipitou por evaporação da acetona e foi posteriormente filtrado e lavado com água destilada. Obtiveram-se 79 g (0.27 mol, 90%) de N(2-p-toluenosulfoniletil)-3,5-dimetil-1H-pirazolo (b). 1 H-RMN (CDCl3): (ppm) 7.61 (d, Ar-H, 2H); 7.26 (d, Ar-H, 2H); 5.73 (s, pz-H, 1H); 4.29 (t, CH2, 2H); 4.23 (t, CH2, 2H); 2.42 (s, CH3, 3H); 2.22 (s, CH3, 3H); 2.11 (s, CH3, 3H). c) N1-(2-aminoetil)-N2-(2-(3,5-dimetil-1H-pirazol-1-il)etil)etano-1,2-diamina (L1) N N H N H N NH2 3,5-Me2pzNNN Dissolveu-se dietilenotriamina (13 ml, 0.12 mol) e NaOH (250 mg, 6.25 mmol) em H2O (10 ml). A esta mistura adicionou-se, gota a gota com agitação, uma solução do composto b (1.75 g, 6 mmol) em THF (5 ml). Quando a adição terminou a solução refluxou durante 4 h. O produto da reacção foi extraído para CH2Cl2 e posteriormente purificado em cromatografia em coluna na qual o eluente foi CH2Cl2 → MeOH → MeOH:NH4. Obteve-se 634 mg de um óleo amarelo pálido correspondente a L1 (2.82 mmol, 48%). 178 5. Parte Experimental 1 H-RMN (CDCl3): (ppm) 5.72 (s, pz-H, 1H); 4.01 (t, CH2, 2H); 2.97 (t, CH2, 2H); 2.77 (t, CH2, 2H); 2.67 (m, 3(CH2), 6H); 2.18 (s, CH3, 3H); 2.14 (s, CH3, 3H). 1 H-RMN (CD3OD): (ppm) 5.83 (s, pz-H, 1H); 4.08 (t, CH2, 2H); 2.96 (t, CH2, 2H); 2.72 (m, 4(CH2), 8H); 2.25 (s, CH3, 3H); 2.15 (s, CH3, 3H). 13 C-RMN (CDCl3): 147.4 (C(3,5)pz); 139.1 (C(3,5)pz); 104.8 (C(4)pz); 51.64 (CH2); 49.10 (CH2); 48.80 (CH2); 48.10 (CH2; CH2); 41.33 (CH2); 13.40 (pz-CH3); 11.00 (pz-CH3) d) N1-(2-aminoetil)-N1-(2-(3,5-dimetil-1H-pirazol-1-il)etane-1,2-diamina (c). NH2 N N N NH2 Na reacção que conduz à formação de L1 forma-se também o produto c. Durante o processo de purificação de L1 por cromatografia em coluna o produto c foi isolado. 1 H-RMN (CDCl3): (ppm) 5.74 (s, pz-H, 1H); 3.99 (t, CH2, 2H); 2.81 (t, CH2, 2H); 2.67 (t, 2(CH2), 4H); 2.50 (t, 2(CH2), 4H); 2.22 (s, CH3, 3H); 2.16 (s, CH3, 3H). ii) Síntese a partir da dietilenotriamina protegida com BOC. a) N-(2-(2-aminoetilamino)etil)-2,2,2-trifluoroacetamida (d) (método adaptado da ref. 110) 2HN N H NH C(O)CF3 1.1 ml de dietilenotriamina (10.3 mmol) foi dissolvida em CH2Cl2 seco (8 ml). A solução foi mantida em banho de gelo para que a temperatura se mantivesse inferior a 0 ºC. A esta solução foi adicionada, gota a gota, uma solução de trifluoracetato de etilo (1.25 ml, 10.3 mmol) dissolvido em CH2Cl2 seco (12 ml). A solução permaneceu sob agitação, durante 2 h, a 179 5. Parte Experimental uma temperatura inferior a 0 ºC e mais 2 h à temperatura ambiente. Após evaporação do solvente a pressão reduzida obteve-se 1.66 g (10.3 mmol) de um óleo amarelo correspondente ao composto d. b) (BOC)NH(CH2)2NBOC(CH2)2NH(COCF3) (e) (Método adaptado da ref. 110) NH BOC N BOC NH COCF3 O composto d (1.66 g, 10.3 mmol) foi dissolvido em CH2Cl2. A esta solução foi adicionado, gota a gota, a -10ºC, 4.5 g (20.6 mmol) de di-tert-butil dicarbonato dissolvido em CH2Cl2. Esta solução foi mantida à temperatura ambiente, sob agitação, 24 h. Após esse tempo, o solvente foi removido a pressão reduzida obtendo-se o composto e que apresentava o aspecto de um óleo denso. 1 H-RMN (CDCl3): (ppm) 3.46 (s largo, (CH2)2, 4H); 3.26 (s largo, (CH2)2, 4H); 1.36 (m largo, BOC, 18H) 18 F-RMN (CDCl3): (ppm) -76.47 (s, CF, 1H); -76.09 (s, CF, 1H); -75.93 (s, CF, 1H) c) (BOC)NH(CH2)2N(BOC)(CH2)2NH2 (f) (Método adaptado da ref 111) NH BOC N NH2 BOC O composto e (10.3 mmol) foi dissolvido em MeOH (280 ml) e água destilada (12 ml). A esta solução adicionou-se 55.28 g (0.4 mol) de K2CO3 dissolvido em água destilada. A mistura refluxou 2 h após as quais a solução foi filtrada. A solução filtrada foi evaporada à secura e o resíduo redissolvido em água destilada. A esta solução foi adicionado NaOH (40%) até a solução atingir pH = 13. Posteriormente, extraiu-se o produto da reacção para CHCl3. Após 180 5. Parte Experimental evaporação do solvente a pressão reduzida obteve-se 2.05 g de um óleo amarelo correspondente ao composto e (7.6 mmol, 74%). 1 H-RMN (CDCl3): (ppm) 2.27 (s largo, CH2, 6H); 2.87 (s largo, CH2, 2H); 1.41 (m largo, BOC, 18H) d) 3,5-Me2pz(CH2)2NH(CH2)2N(BOC)(CH2)2NH(BOC) (g) BOC N N H N N BOC NH Dissolveu-se 162 mg do composto e (0.55 mmol) e 44 mg de NaOH (1.1 mmol) em água destilada. A esta solução adicionou-se gota a gota, sob agitação, 167 mg de N-(2-ptoluenosulfoniletil)-3,5-dimetil-1H-pirazolo (b) (0.55 mmol) dissolvido em THF. Após adição completa, a mistura refluxou 24 h. O composto foi extraído para CHCl3 e posteriormente purificado por cromatografia em coluna na qual o eluente foi CH2Cl2 → MeOH → MeOH:NH4 (98:2). Obteve-se 71 mg de um óleo amarelo claro correspondente ao composto g (0.171 mmol, 31%). 1 H-RMN (CDCl3): (ppm) 2.73 (s largo, CH2, 6H); 2.18 (s, CH3, 3H); 2.15 (s, CH3, 3H); 1.38 (m largo, BOC, 18H) e) N1-(2-aminoetil)-N2-(2-(3,5-dimetil-1H-pirazol-1-il)etil)etane-1,2-diamina (L1) N N H N H N NH2 3,5-Me2pzNNN 181 5. Parte Experimental Dissolveu-se 0.33 mmol (71 mg) do composto g em CH2Cl2 e adicionou-se 3.37 mmol (0.26 ml) de ácido trifluoracético. A solução permaneceu sob agitação, à temperatura ambiente durante 2 h. No final da reacção, o solvente foi evaporado e o resíduo redissolvido em H2O. Esta solução foi alcalinizada até pH = 11 por adição de NaOH (40%) e, de seguida, a H2O foi evaporada. A partir do resíduo seco, o produto da reacção, L1, foi extraído para MeOH. 5.1.1.2. 2-(2-(2-(2-(3,5-dimetil-1H-pirazol-1-il)etiltio)etiltio)etiltio)acetato de etilo (L2) a) 2-(2-(3,5-dimetil-1H-pirazol-1-il)etiltio)etanol (h)112 N N S OH HS(CH2)2OH (0.700 ml, 10 mmol) e NaOH (0.400 g, 10 mmol) foram colocados em 30 ml de água, com agitação. A solução refluxou 5min. A esta solução foi adicionada, gota a gota, uma solução de N-(2-p-toluenosulfoniletil)-3,5-dimetil-1H-pirazol (b) (2.78 g, 10 mmol) em THF. A solução refluxou durante 3 h após as quais o THF foi evaporado a pressão reduzida. O produto da reacção foi extraído para CHCl3. Obteve-se 1.618 g de um óleo amarelo claro correspondente ao composto h (8.1 mmol, 81%). 1 H-RMN (CDCl3): (ppm) 5.67 (s, pz-H, 1H); 4.39 (s, OH, 1H); 4.03 (t, CH2, 2H); 3.60 (t, CH2, 2H); 2.83 (t, CH2, 2H); 2.50 (t, CH2, 2H); 2.14 (s, CH3, 3H); 2.09 (s, CH3, 3H). b) 1-(2-(2-bromoetiltio)etil)-3,5-dimetil-1H-pirazolo (i) N N S Br PBr3 (190 l, 2 mmol) foi adicionado, gota a gota, com agitação, a uma solução do composto h (400 mg, 2 mmol) em CHCl3. A solução refluxou durante 24 h, sob azoto. Após 182 5. Parte Experimental esse tempo, a solução foi lavada com NaHCO3 (10%) e, posteriormente, com H2O. O CHCl3 foi evaporado a pressão reduzida obtendo-se 329 mg do composto i (1.25 mmol, 63%). 1 H-RMN (CDCl3): (ppm) 5.70 (s, pz-H, 1H); 4.03 (t, CH2, 2H); 2.25 (t, CH2, 2H); 2.89 (t, CH2, 2H); 2.59 (t, CH2, 2H); 2.16 (s, CH3, 3H); 2.11(s, CH3, 3H). c) 2-(2-mercaptoetiltio)acetate de etilo (j) HS S CO2Et Sulforeto de etilo (1.01 g, 16.6 mmol), 2-mercaptoacetato de etilo (1.824 ml, 16.6 mmol) e trietilamina (250 µl) foram misturadas em MeOH, sob azoto. A mistura permaneceu em agitação 24 h permitindo que a trietilamina catalisasse a abertura do anel sulfureto de etilo. Após esse tempo, o solvente foi evaporado obtendo-se 0.993 g de um óleo transparente correspondente ao composto j (5.517 mmol, 33%). 1 H-RMN (CDCl3): (ppm) 4.15 (q, O-CH2, 2H); 3.21 (t, CH2, 2H); 2.99 (t, CH2, 2H); 2.73 (t, CH2, 2H); 1.68 (t, SH, 1H); 1.24 (t, CH3, 3H) d) 2-(2-(2-(2-(3,5-dimetil-1H-pirazol-1-il)etiltio)etiltio)etiltio)acetato de etilo(L2) N N S S S CO2Et 3,5-Me2pzSSS-CH2CO2Et 41 mg de sódio metálico (1.25 mmol) foi colocado em etanol seco, sob azoto, com agitação, até completa conversão a etóxido de sódio. A esta solução foi adicionado, gota a gota, uma solução de etil-2-mercaptoacetato (225 mg, 1.25 mmol) em etanol e, posteriormente, uma solução do composto i (329 mg, 1.25 mmol) em etanol. A reacção ficou em agitação durante uma noite à temperatura ambiente. O solvente foi evaporado a pressão reduzida e o óleo 183 5. Parte Experimental resultante foi redissolvido em clorofórmio e lavado com água. Após evaporação do clorofórmio obteve-se um óleo amarelo claro correspondente a L2 (0.208 mmol, 17%). 1 H-RMN (CDCL3): (ppm) 5.71 (s, pz-H, 1H); 4.08 (m, CH2, O-CH2, 4H); 3.16 (s, SCH2CO, 2H); 2.89 (t, CH2, 2H); 2.75 (t, CH2, 2H); 2.66 (m, CH2, O-CH2, 4H); 2.59 (t, CH2, 2H); 2.48 (t, CH2, 2H); 2.19 (s, CH3, 3H); 2.13 (s, CH3, 3H); 1.20 (t, CH2-CH3, 3H). 1 H-RMN (CD3OD): (ppm) 5.83 (s, pz-H, 1H); 4.15 (m, CH2, O-CH2, 2H); 3.29 (s, SCH2CO, 2H); 2.93 (t, CH2, 2H); 2.83 – 2.52 (m, 4(CH2), 8H); 2.29 (s, CH3, 3H); 2.16 (s, CH3, 3H); 1.26 (t, CH2-CH3, 3H). 5.1.1.3. 1-(2-(2-(etiltio)etiltio)etil)-3,5-dimetil-1H-pirazolo (L3) N N S S 3,5-Me2pzSS-Et 105 mg de sódio metálico (4.56 mmol) foi colocado em etanol seco, sob azoto, com agitação, até completa conversão a etóxido de sódio. A esta solução foi adicionado, gota a gota, uma solução de etanotiol (0.50 ml, 4.56 mmol) em etanol e, posteriormente, uma solução de composto i (1.20 g, 4.56 mmol) em etanol. A reacção ficou em agitação durante uma noite à temperatura ambiente. O solvente foi evaporado a pressão reduzida e o óleo resultante foi redissolvido em clorofórmio e lavado com água. Após evaporação do clorofórmio obteve-se um óleo amarelo que, posteriormente foi purificado por cromatografia em coluna na qual o eluente foi AcOEt → MeOH. Obteve-se 737 mg de L3 (3.02 mmol, 66%) com o aspecto de óleo amarelo claro. Análise elementar calculada (experimental) para C11H20N2S2: C, 53.69 (54.14); H, 8.20 (8.70); N, 11.48 (12.04). 1 H-RMN (CDCl3): δ (ppm) 5.68 (s, pz-H, 1H); 4.03 (t, CH2, 2H); 2.85 (t, CH2, 2H); 2.53 (m, CH2, 2H); 2.45 (m, (CH2)2, 4H); 2.16 (s, CH3, 3H); 2.10 (s, CH3, 3H); 1.14 (t, CH3, 3H). 184 5. Parte Experimental 13 C-RMN (CDCl3): δ (ppm) 147.4 (C(3,5)pz); 138.9 (C(3,5)pz); 104.5 (C(4)pz); 48.28 (CH2); 31.73 (CH2); 31.71 (CH2); 31.15 (CH2); 25.50 (CH2); 14.35 (CH3); 13.05 (pz-CH3); 10.76 (pzCH3). 5.1.1.4. 2-(2-(2-(3,5-dimetil-1H-pirazol-1-il)etiltio)etiltio)acetato de etilo (L4) N N S S CO2Et 3,5-Me2pzSS-CH2CO2Et Sódio metálico (105 mg, 4.56 mmol) foi colocado em etanol seco, sob azoto, com agitação, até completa conversão a etóxido de sódio. A esta solução foi adicionado, gota a gota, uma solução de 2-mercaptoacetato (0.50 ml, 4.56 mmol) em etanol e, posteriormente, uma solução de composto i (1.20 g, 4.56 mmol) em etanol. A reacção ficou em agitação durante uma noite à temperatura ambiente. O solvente foi evaporado a pressão reduzida e o óleo resultante foi redissolvido em clorofórmio e lavado com água. Após evaporação do clorofórmio obteve-se um óleo amarelo que, posteriormente foi purificado por cromatografia em coluna na qual o eluente foi CH2Cl2 → AcOEt → MeOH. Obteve-se 1.00 g de L4 (3.3 mmol, 72%) que apresentava o aspecto de óleo amarelo claro. Análise elementar calculada (experimental) para C13H22N2O2S2: C, 51.46 (51.42); H, 7.26 (7.34); N, 9.24 (9.42). 1 H-RMN (CDCl3): δ (ppm) 5.82 (s, pz-H, 1H); 4.14 (m, CH2, CH2COO, 4H); 3.25 (s, CH2, 2H); 2.92 (t, CH2, 2H); 2.75 (t, CH2, 2H); 2.57 (t, CH2, 2H); 2.20 (s, CH3, 3H); 2.16 (s, CH3, 3H); 1.25 (t, CH3, 3H). 13 C-RMN (CDCl3): δ (ppm) 170.2 (C=O); 147.8 (C(3,5)pz); 139.2 (C(3,5)pz); 105.0 (C(4)pz); 61.37 (CH2OC=O); 48.57 (CH2C=O); 33.40 (CH2); 32.36 (CH2); 31.99 (CH2); 31.44 (CH2); 14.10 (CH3); 13.42 (pz-CH3); 11.10 (pz-CH3). IV (cm−1): (C=O) 1731. 185 5. Parte Experimental 5.1.1.5. ácido 2-(2-(3,5-dimetil-1H-pirazol-1-il)etiltio)etanotiol propiónico (L5) N N S S CO2H 3,5-Me2pzSS-CH2CO2H Dissolveu-se 117 mg de L3 (0.39 mmol) em THF e adicionou-se NaOH (77 mg, 1.93 mmol) dissolvido na quantidade mínima de água. Após refluxo durante uma noite e posterior arrefecimento à temperatura ambiente, a solução foi neutralizada com HCl 1N. Os solventes foram removidos por evaporação a baixa pressão e o resíduo seco foi lavado com água. Obtevese 66 mg de L5 (0.24 mmol, 62%) que apresentava o aspecto de um óleo branco. 1 H-RMN (CDCl3): δ (ppm) 5.75 (1H, s, pz-H), 4.14 (2H, t, CH2), 3.21 (2H, s, CH2), 2.86 (2H, t, CH2), 2.77 (2H, t, CH2), 2.65 (3H, t, CH3), 2.2 (3H, s, CH3), 2.16 (3H, s, CH3). 13 C-RMN (CDCl3): δ (ppm) 172.4 (C=O); 147.6 (C(3,5)pz); 139.6 (C(3,5)pz); 105.4 (C(4)pz); 47.8 (CH2C=O); 34.3 (CH2); 32.4 (CH2); 30.6 (CH2); 30.0 (CH2); 12.8 (CH3); 10.9 (pz-CH3). IV (cm-1): ν(C=O) 1703. 5.1.1.6. N1-(antracen-9-ilmetil)-N2-(2-(3,5-dimetil-1H-pirazol-1-il)etil)etano-1,2-diamina (L8) N N H N HN 3,5-Me2pzNN-Ant Adicionou-se 181 mg de 9-antracenoaldeido (0.879 mmol), dissolvido na mistura de solventes secos CH3OH:CH2Cl2 (1:3), ao ligando 3,5-Me2pzNN (L6) (160 mg, 0.879 mmol) dissolvido na mistura de solventes secos CH3OH: CH2Cl2 (1:3). A mistura reaccional ficou uma noite em agitação. Após esse tempo adicionou-se à solução NaBH4 (66 mg, 1.76 mol). Esta 186 5. Parte Experimental mistura ficou sob agitação mais uma noite. O solvente foi evaporado e o produto da reacção redissolvido em CH2Cl2. A fase orgânica foi lavada com K2CO3 (pH = 10). Obteve-se 743 mg (85%) de produto da reacção que foi posteriormente purificado por cromatografia em coluna (CH2Cl2 → MeOH). Obteve-se um sólido amarelo vivo que corresponde a L8. Análise elementar calculada (experimental) para C24H26N4: C, 77.2 (72.15); H, 7.77 (6.73); N, 15.00 (14.84). 1 H-RMN (CDCl3): δ (ppm) 8.37 (s, H-Ar, 1H); 8.29 (d, (H-Ar)2, 2H); 7.97 (d, (H-Ar)2, 2H); 7.48 (m, (H-Ar)4, 4H); 5.68 (s, pz-H, 1H); 4.69 (s, CH2-Ar, 2H); 3.95 (t, CH2, 2H); 2.92 (m, 2CH2, 4H); 2.75 (t, CH2, 2H); 2.14 (s, CH3, 3H); 2.10 (s, CH3, 3H). 13 C-RMN (CDCl3): δ (ppm) 146.97 (C(3,5)pz); 138.63 (C(3,5)pz); 131.10 (Ar-H); 129.86 (Ar- H); 128.72 (Ar-H); 126.71 (Ar-H); 125.62 (Ar-H); 124.94 (Ar-H); 124.49 (Ar-H); 123.78 (ArH); 104.44 (C(4)pz); 49.16 (CH2); 48.82 (CH2); 48.63 (CH2); 47.95 (CH2); 45.15 (CH2-Ar); 13.13 (pz-CH3); 10.61 (pz-CH3). FT/ICR-MS (+) (m/z): 373.2 [M+H]+ (20%); 276.2 [M-3,5-Me2pz]+ (100%); 233.1 [AntCH2NHCHCH2]+ (33%); 207.1 [AntCH2NH2]+ (96%); FT/ICR-MS (-) (m/z): 372.2 [M](100%). 5.1.1.7. N1-(2-(1H-pirazol-1-il)etil)-N2-(antracen-9-ilmetil)etano-1,2-diamina (L9) N N H N HN pzNN-Ant 0.193 g de pzNN (L7) (1.253 mmol) e trietilamina seca (0.253g, 2.5 mmol) foram dissolvidas na mistura de solventes secos MeOH:CH2Cl2 (1:3). A esta solução foi adicionado 86 mg de 9-antracenoaldeido (0.417 mmol) e a solução permaneceu uma noite à temperatura ambiente, com agitação. No dia seguinte foi adicionado à solução NaBH4 (0.032g, 0.834 mmol). Esta solução permaneceu mais uma noite sob agitação e posteriormente foi lavada com K2CO3. Na fase orgânica encontrava-se o produto da reacção que foi obtido por evaporação do solvente 187 5. Parte Experimental e purificado por cromatografia em coluna (CH2Cl2 → MeOH → MeOH:NH4 (8:2)). Obteve-se 0.054g (0.16 mmol, 38%) de óleo cor de laranja escuro correspondente a L9. 1 H-RMN (CDCl3): δ (ppm) 8.37 (s, H-Ar, 1H); 8.30 (d, (H-Ar)2, 2H); 7.98 (d, (H-Ar)2, 2H); 7.48 (m, (H-Ar)4, (pz-H), 5H); 7.29 (t, pz-H, 1H); 6.13 (t, pz-H, 1H); 4.68 (s, CH2-Ar, 2H); 4.12 (t, CH2, 2H); 2.93 (m, 2CH2, 4H); 2.73 (t, CH2, 2H). 13 C-RMN (CDCl3): δ (ppm) 139.38 (pz); 131.36 (pz); 130.13 (Ar-H); 129.47 (Ar-H); 129.01 (Ar-H); 127.08 (Ar-H); 125.96 (Ar-H); 124.80 (Ar-H); 124.00 (Ar-H); 105.16 (pz); 51.79 (CH2); 49.20 (CH2); 49.02 (CH2); 48.65 (CH2); 45.35 (CH2-Ar). FT/ICR-MS (+) (m/z): 345.2 [M+H]+ (100%); 276.2 [M-HPz]+ (14%); 207.1 [AntCH2NH2]+ (12%); FT/ICR-MS (-) (m/z): 344.2 [M]- (100%). 5.1.1.8. N1-(2-(4-(antracen-9-ilmetil)-3,5-dimetil-1H-pirazol-1-il)etil)etane-1,2-diamina (L10) a) 9-bromometilantraceno (k)134 Br A uma solução de trifenilfosfina (3.5 g; 13.5 mmol) em CH3CN seco, adicionou-se lentamente bromo líquido (5 mmol) até que a solução apresentasse uma cor ligeiramente alaranjada. De seguida, adicionou-se 2.59 g de 9-hidroximetilantraceno (12.44 mmol) lentamente na forma de sólido. A solução ficou amarela observando-se a formação de um precipitado amarelo. A mistura reaccional foi arrefecida a 0 ºC e o sólido amarelo filtrado e recristalizado de clorofórmio. O produto k foi obtido com um rendimento de 68 %. 1 H-RMN (CDCl3): δ (ppm) 8.47 (s,H-Ar, 1H); 8.29 (d, (H-Ar)2, 2H); 8.02 (d, (H-Ar)2, 2H); 7.63 (t, (H-Ar)2 2H); 7.49 (t, (H-Ar)4, 2H); 5.52 (s, CH2-Ar, 2H) 188 5. Parte Experimental b) 3-(antraceno-9-ilmetil)pentano-2,4-diona (l) O O A uma suspensão de hidreto de sódio (62 mg, 2.58 mmol), em THF seco a 0ºC, adicionou-se 0.242 ml de acetilacetona (2.34 mmol). Esta mistura ficou sob agitação 2 horas à temperatura ambiente. A 0 ºC adicionou-se 634 mg (2.34 mmol) de 9-bromometilantraceno e a mistura permaneceu a esta temperatura 40 min. A solução ficou uma noite sob agitação à temperatura ambiente ao fim da qual se adicionou 60 ml de HCl 1M, a 0ºC. Por extracção para éter obteve-se o composto l (1.8 mmol) com um rendimento de 78%. 1 H-RMN (CDCl3): δ (ppm) 8.34 (s, H-Ar, 1H); 8.14 (d, (H-Ar)2, 2H); 7.98 (d, (H-Ar)2, 2H); 7.49 (m, (H-Ar)4, 4H); 4.23 (t, CH-(COCH3)2, 1H); 4.14 (d, CH2-Ar, 2H); 1.93 (s, (CH3)2, 6H) c) 2-(4-(antraceno-9-ilmetil)-3,5-dimetil-1H-pirazol-1-il)etanol (m) (método adaptado da ref. 107) N N OH Uma solução de 2-hidroxietilhidrazina (50 l, 0,721 mmol) em etanol absoluto foi adicionada, gota a gota, com agitação, a uma solução do composto l (209 mg, 0,721 mmol) em CHCl3:EtOH (1:1) a 0ºC. A adição foi efectuada mantendo o meio reaccional em gelo. Após 1 h. à temperatura ambiente e sob agitação, os solventes foram evaporados à secura. O produto da reacção foi purificado por cromatografia em coluna na qual o eluente foi CH2Cl2 → MeOH. Obteve-se o composto m (127 mg) com um rendimento de 62%. 189 5. Parte Experimental 1 H-RMN (CDCl3): δ (ppm) 8.40 (s, H-Ar, 1H); 8.12 (d, (H-Ar)2, 2H); 8.02 (d, (H-Ar)2, 2H); 7.36 (m, (H-Ar)4, 4H); 4.69 (s, CH2-Ar, 2H); 3.94 (m, 2CH2, 4H); 1.89 (s, CH3, 3H); 1.60 (s, CH3, 3H). d) 4-(antraceno-9-ilmetil)-1-(2-bromoetil)-3,5-dimetil-1H-pirazolo (n) N N Br A uma solução do composto m (127 mg, 0.35 mmol) em tolueno, sob azoto, adicionouse 66 µl de PBr3 (0,7 mmol). A solução ficou em refluxo durante uma noite após a qual a solução foi lavada com uma solução saturada de NaHCO3 (10%) e posteriormente com H2O. A fase orgânica foi evaporada à secura obtendo-se 105 mg do composto n limpo, o que corresponde a um rendimento de 71%. 1 H-RMN (CDCl3): δ (ppm) 8.39 (s, H-Ar, 1H); 8.12 (d, (H-Ar)2, 2H); 7.99 (d, (H-Ar)2, 2H); 7.44 (m, (H-Ar)4, 4H); 4.65 (s, CH2-Ar, 2H); 4.24 (t, CH2-Br, 2H); 3,59 (t, CH2-pz, 2H); 1.87 (s, CH3-pz, 3H); 1.65 (s, CH3-pz, 3H). e) N1-(2-(4-(antraceno-9-ilmetil)-3,5-dimetil-1H-pirazol-1-il)etil)etane-1,2-diamina (L10) N N H N NH2 Ant-3,5-Me2pzNN 190 5. Parte Experimental Adicionou-se lentamente 105 mg do composto n (0.24 mmol) a uma solução de etilenodiamina seca (321 l, 4.8 mmol) em MeOH seco. A solução refluxou durante uma noite. Após esse tempo a solução foi levada à secura. O produto reaccional foi redissolvido em CHCl3 e lavado com H2O. O ligando L10 limpo é um óleo cor de laranja e foi obtido após purificação por cromatografia em coluna (MeOH → MeOH:NH4 (8:2)) com um rendimento de 50%. 1 H-RMN (CDCl3): δ (ppm) 8.39 (s, H-Ar, 1H); 8.15 (m, (H-Ar)2, 2H); 8.00 (m, (H-Ar)2, 2H); 7.42 (m, (H-Ar)4, 4H); 4.65 (Ar-CH2, 2H); 3.94 (t, CH2, 2H); 2.88 (t, CH2, 2H); 2.66 (m, CH2, 2H); 2.57 (m, CH2, 2H) 1.89 (s, CH3, 3H); 1.75 (s, br, N-H, 1H); 1.57 (s, CH3, 3H). 13 C-RMN (CDCl3): δ (ppm) 145.97 (C(3,5)pz); 136.02 (C(3,5)pz); 131.69 (Ar-H); 131.44 (Ar- H); 130.48 (Ar-H); 129.19 (Ar-H); 126.40 (Ar-H); 125.68 (Ar-H); 124.89 (Ar-H); 124.73 (ArH); 114.37 (C(4)pz); 52.04 (CH2); 49.11 (CH2); 48.34 (CH2); 41.52 (CH2); 23.47 (CH2-Ar); 12.52 (pz-CH3); 9.52 (pz-CH3). FT/ICR-MS (+) (m/z): 373.2 [M+H]+ (6%); 355.2 [M-H3N]+ (12%); 342.2 [M-CH4N]+ (45%); 286.1 [M-C4H10N2]+ (100%); FT/ICR-MS (-) (m/z): 372.2 [M]- (100%). 5.1.1.9. N1-(2-(4-(antraceno-9-ilmetil)-1H-pirazol-1-il)etil)etano-1,2-diamina (L11) a) 2-(antraceno-9-ilmetil)malonato de etilo (o)164 OEt EtO O O EtOH seco foi adicionado a 122 mg de sódio metálico (5.3 mmol), sob azoto. A solução ficou com agitação até completa conversão a etóxido de sódio e foi, posteriormente, adicionada à solução de malonato dietílico (844 mg, 5.3 mmol). Após 1 h, adicionou-se 1.3 g de 9bromometilantraceno (k) (4.8 mmol) e a solução permaneceu uma noite, sob agitação, à temperatura ambiente. O EtOH foi removido por evaporação a pressão reduzida e o produto reaccional foi, posteriormente, lavado com H2O. Obteve-se o composto o (1.44g) com um rendimento de 85%. 191 5. Parte Experimental 1 H-RMN (CDCl3): δ (ppm) 8.38 (s, H-Ar, 1H); 8.26 (d, (H-Ar)2, 2H); 7.85 (d, (H-Ar)2, 2H); 7.38 (m, (H-Ar)4, 4H); 4.28 (d, Ar-CH2, 2H); 4.02 (m, (O-CH2)2, 4H); 3.85 (t, CH-(CO2)2, 1H); 1.03 (t, OCH2CH3, 6H) b) 2-(antraceno-9-ilmetil)propano-1,3-diol (p)164 OH OH 1.27 g de composto o (3.624 mmol) foi dissolvido em éter seco. A esta solução foi adicionado LiAlH4 (4.35 ml, 4.35 mmol) lentamente, sob agitação e mantendo a solução a 0ºC. A mistura reaccional ficou sob agitação, à temperatura ambiente, uma noite, após a qual se adicionou H2O e posteriormente, NaOH 1M. Evaporando à secura a fracção etérica obteve-se o composto p (880 mg) com um rendimento de 91%. 1 H-RMN (CDCl3): δ (ppm) 8.35 (s, H-Ar, 1H); 8.29 (d, (H-Ar)2, 2H); 7.99 (d, (H-Ar)2, 2H); 7.49 (m, (H-Ar)4, 4H); 3.82 (m, CH2-OH, 4H); 3.94 (d, Ar-CH2, 2H); 2.32 (m, CH-CH2OH, 1H). c) 2-(antracen-9-ilmetil)malonaldeido (q) (método adaptado da ref. 135) H H O OH A uma solução de composto p (880 mg, 3.3 mmol), DMSO seco (3.6 ml, 3.3 mmol) e Et3N seca (4.53 ml, 32.74 mmol) em CH2Cl2 seco (13.5 ml) a 0ºC, foi adicionado lentamente Py SO3 (2.57g, 16.16 mmol). Após 1 noite sob agitação, a mistura reaccional foi lavada com 192 5. Parte Experimental éter. A mistura reaccional foi diluída com CHCl3 e a fase orgânica lavada com água destilada. O composto q (468 mg) é um óleo amarelo obtido por evaporação da fase orgânica, com um rendimento de 54%. 1 H-RMN (CDCl3): δ (ppm) 13.60 (s, br, OH, 1H); 8.43 (s, H-Ar, 1H); 8.14 (m, (H-Ar)2, (OCH)2 4H); 8.02 (d, (H-Ar)2, 2H); 7.50 (m, (H-Ar)4, 4H); 4.53 (s, Ar-CH2, 2H); c) 2-(4-(antracen-9-ilmetil)-1H-pirazol-1-il)etanol (r) (método adaptado da ref. 107) N N OH Uma solução de 2-hidroxietilhidrazina (120 l, 1.786 mmol) em etanol absoluto foi adicionada, gota a gota, com agitação, a uma solução de composto q (468 mg, 1.786 mmol) em CHCl3:EtOH (1:1), a 0ºC. Após 1 h à temperatura ambiente e sob agitação, os solventes foram evaporados á secura. O produto r (318 mg) é obtido puro por cromatográfica em coluna (na qual o eluente foi CH2Cl2 → CH2Cl2:MeOH (8:2)) com um rendimento de 48%. 1 H-RMN (CDCl3): δ (ppm) 8.46 (s, H-Ar, 1H); 8.31 (d, (H-Ar)2, 2H); 8.09 (d, (H-Ar)2, 2H); 7.51 (m, (H-Ar)4, 4H); 7.54 (s, H-pz, 1H); 6.97 (s, H-pz, 1H); 4.80 (s, Ar-CH2, 2H); 3.99 (t, CH2, 2H); 3.81 (t, CH2, 2H) d) 4-(antracen-9-ilmetil)-1-(2-bromoetil)-1H-pirazolo (s) N N Br 193 5. Parte Experimental A uma solução de composto r (539 mg, 1.786 mmol) em tolueno adicionou-se PBr3 (336 l, 3.572 mmol), sob azoto. A solução ficou em refluxo durante uma noite. Após esse tempo, a solução foi lavada com uma solução saturada de NaHCO3 e posteriormente com H2O. A fase orgânica foi evaporada á secura obtendo-se 553 mg do composto s (85 %) com a aparência de óleo cor de laranja. 1 H-RMN (CDCl3): δ (ppm) 8.39 (s, H-Ar, 1H); 8.22 (d, (H-Ar)2, 2H); 8.01 (d, (H-Ar)2, 2H); 7.46 (m, (H-Ar)4, 4H); 7.43 (s, H-pz, 1H); 6.92 (s, H-pz, 1H); 4.76 (s, Ar-CH2, 2H); 4.24 (t, CH2, 2H); 3.56 (t, CH2, 2H) 13 C-RMN (CDCl3): δ (ppm) 139.39 (CH2-pz); 132.21 (H-pz); 131.64 (Ar-H); 129.70 (Ar-H); 129.14 (Ar-H); 128.80 (Ar-H); 126.38 (Ar-H); 125.88 (Ar-H); 124.95 (Ar-H); 124.50 (Ar-H); 120.77 (H-pz); 53.22 (CH2); 30.04 (CH2); 22.98 (CH2-Ar) e) N1-(2-(4-(antracen-9-ilmetil)-1H-pirazol-1-il)etil)etano-1,2-diamina (L11) N N H N NH2 Ant-pzNN Adicionou-se lentamente o composto s (553 mg, 1.5 mmol) a uma solução de etilenodiamina seca (2 ml, 30 mmol) em MeOH seco. A solução refluxou durante uma noite. Após esse tempo, a solução foi levada á secura. O produto da reacção foi redissolvido em CHCl3, lavado com H2O abundante e filtrado. Obteve-se 342 mg de produto da reacção cujo rendimento foi de 66.3%. L11 é um óleo, obtido após purificação por cromatografia em coluna (CH2Cl2:MeOH (95:5) → CH2Cl2:MeOH:NH4 (60:40:4)), com um rendimento de 39%. 194 5. Parte Experimental 1 H-RMN (CDCl3): δ (ppm) 8.35 (s, H-Ar, 1H); 8.22 (d, (H-Ar)2, 2H); 7.98 (d, (H-Ar)2, 2H); 7.44 (m, (H-Ar)4, 4H) 7.38 (s, (H-pz), 1H); 6.84 (s, (H-pz), 1H); 4.72 (Ar-CH2, 2H); 3.94 (t, CH2, 2H); 2.84 (t, CH2, 2H); 2.58 (t, CH2, 2H); 2.47 (t, br, CH2, N-H, 3H). 13 C-RMN (CDCl3): δ (ppm) 138.66 ((3,5(C)pz-H); 132.22 ((3,5(C)pz-H); 131.57 (Ar-H); 129.60 (Ar-H); 129.06 (Ar-H); 128.47 (Ar-H); 126.21 (Ar-H); 125.74 (Ar-H); 124.86 (Ar-H); 124.46 (Ar-H); 120.50 (C(4)pz-H); 51.78 (CH2); 51.58 (CH2); 48.95 (CH2); 41.28 (CH2); 22.93 (CH2-Ar) FT/ICR-MS (+) (m/z): 345.2 [M+H]+ (100%). 5.1.1.10. N1-[2-(antrapirazolo)etil]etano-1,2-diamina (L12) a) 2-(antrapirazolo)etanol (t) O N N OH 2 g de 1-cloroantraquinona (8.242 mmol) foi colocado a reagir com 2hidroxietilhidrazina (2.8 ml, 41.21 mmol), em DMSO seco, durante uma noite, a 150ºC. À solução foi adicionado CH2Cl2 que posteriormente foi lavada com H2O. O produto obtido foi purificado por coluna cromatografica por um processo isocrático com AcOEt. Obteve-se 698 mg do composto t (2.644 mmol, 32%). 1 H-RMN (CDCl3): δ (ppm) 8.28 (1H, d, Ar-H), 8.03 (1H, d, Ar-H), 7.99 (1H, d, Ar-H), 7.62 (2H, m, Ar-H), 7.48 (2H, m, Ar-H), 4.59 (2H, t, CH2), 4.23 (2H, t, CH2). 195 5. Parte Experimental b) 1-(2-bromoetil)-antrapirazolo (u) O N N Br PBr3 (200 l, 2.132 mmol) foi adicionado, gota a gota, com agitação e sob azoto, a uma solução de 2-hidroxietilantrapirazolo (205 mg, 0.7765 mmol) em tolueno. A solução refluxou durante uma noite. Após esse tempo, a solução foi lavada com NaHCO3 e, posteriormente, com H2O. Após evaporação do solvente a pressão reduzida obteve-se 127 mg do composto u (0.3884 mmol, 50%). 1 H-RMN (CDCl3): δ (ppm) 8.44 (1H, d, Ar-H), 8.19 (1H, d, Ar-H), 8.04 (1H, d, Ar-H), 7.71 (4H, m, Ar-H), 4.89 (2H, t, CH2), 3.90 (4H, m, 2x CH2). c) N1-[2-(antrapirazolo)etil]etano-1,2-diamina (L12) O N N H N NH2 AntrapzNN 520 l de etilenodiamina seca (7.77 mmol) foi adicionada, gota a gota e com agitação, a uma solução de composto u (125 mg, 0.388 mmol) em MeOH seco. A solução permaneceu sob refluxo uma noite. Após esse tempo, o solvente foi evaporado e o produto reaccional redissolvido em CH2Cl2. Esta solução foi lavada com H2O e posteriormente evaporada à secura. O produto da reacção foi purificado por cromatografia em coluna (MeOH → MeOH:NH4 (100:3)). Obteve-se 52 mg de pó amarelo correspondente ao ligando L12 (0.171 mmol, 44%). 196 5. Parte Experimental Análise Elementar Calculada para C18N4OH18: C, 70.57; N, 18.29; H, 5.92. Encontrada experimentalmente: C, 67.03; N, 16.91; H, 5.91. 1 H-RMN (CD3OD): δ (ppm) 8.29 (1H, d, Ar-H), 8.13 (1H, d, Ar-H), 7.92 (2H, t, Ar-H), 7.71 (2H, m, Ar-H), 7.53 (1H, t, Ar-H), 4.66 (2H, t, CH2), 3.22 (4H, t, 2(CH2)), 2.72 (4H, m, 2(CH2)). 13 C-RMN (CD3OD): δ (ppm) 187.94 (C=O); 143.79 (Ar); 142.75 (Ar); 137.59 (Ar); 137.21 (Ar); 135.97 (Ar); 132.81 (Ar); 132.67 (Ar); 132.40 (Ar); 130.04 (Ar); 127.24 (Ar); 126.61 (Ar); 124.73 (Ar); 120.10 (Ar); 54.86 (CH2); 53.26 (CH2); 52.86 (CH2); 44.54 (CH2). IV (KBr, cm−1): (C=O) 1656, 1637, 1610, 1594. 5.1.1.11. 1-(2-(2-(etiltio)etiltio)etil)-antrapirazolo (L13) a) 1-(2-(2-etanoltio)etil)-antrapirazolo (v) O N N S OH 0.230 ml de HS(CH2)2OH (3.24 mmol) e 0.130 g de NaOH (3.24 mmol) foram colocados em água, com agitação. A solução refluxou 15min. A esta solução foi adicionado, gota a gota, uma solução do composto u (0.212g, 0.648 mmol) em THF. A solução refluxou durante uma noite e, após esse tempo, o THF foi evaporado a pressão reduzida. O produto da reacção foi extraído para CHCl3. Obteve-se 0.193g do composto v (0.596 mmol, 92%). 1 H-RMN (CDCl3): δ (ppm) 8.44 (1H, d, Ar-H), 8.20 (1H, d, Ar-H), 8.05 (1H, d, Ar-H), 7.71 (3H, m, Ar-H), 7.53 (1H, m, Ar-H), 4.73 (2H, t, CH2), 3.72 (2H, m, CH2), 3.18 (2H, m, CH2), 2.67 (2H, m, CH2). 197 5. Parte Experimental b) 1-(2-(2-bromoetiltio)etil)-antrapirazolo (w) O N N S Br Adicionou-se, gota a gota e com agitação, 140 l de PBr3 (1.49 mmol) a uma solução do composto v (193 mg, 0.596 mmol) em tolueno:CH2Cl2 (1:1). A solução refluxou durante uma noite após a qual foi lavada com NaHCO3 (10%) e, posteriormente, com H2O. O solvente foi evaporado a pressão reduzida obtendo-se 230 mg do composto w (0.590 mmol, 99 %). 1 H-RMN (CDCl3): δ (ppm) 8.45 (1H, d, Ar-H), 8.21 (1H, d, Ar-H), 8.04 (1H, d, Ar-H), 7.69 (3H, m, Ar-H), 7.53 (1H, m, Ar-H), 4.69 (2H, t, CH2), 3.40 (2H, m, CH2), 3.21 (2H, m, CH2), 2.85 (2H, m, CH2). c) 1-(2-(2-(etiltio)etiltio)etil)-antrapirazolo (L13) O N N S S AntrapzSS-Et 219 l de HSCH2CH3 (2.96 mmol) e 0.118 g de NaOH (2.956 mmol) foram colocados em água, com agitação. A solução refluxou 5min. A esta solução foi adicionado, gota a gota, uma solução de composto w (0.230g, 0.590 mmol) em THF. A solução refluxou durante uma noite após a qual, o THF foi evaporado a pressão reduzida. O produto da reacção foi extraído para CHCl3 e posteriormente purificado por cromatografia em coluna usando como solvente CH2Cl2. Obteve-se 87 mg de um óleo cor de laranja escuro correspondente a L13 (0.236 mmol, 40%). 198 5. Parte Experimental Análise Elementar Calculada para C20N2S2OH20: C, 65.20; N, 7.61; S, 17.37; H, 5.48. encontrada experimentalmente: C, 64.51; N, 7.40; S, 16.63; H, 4.70. 1 H-RMN (CDCl3): δ (ppm) 8.38 (1H, d, Ar-H), 8.12 (1H, d, Ar-H), 7.96 (1H, d, Ar-H), 7.65 (2H, m, Ar-H), 7.59 (1H, m, Ar-H), 7.50 (1H, m, Ar-H), 4.64 (2H, t, CH2), 3.14 (2H, t, CH2), 2.57 (4H, m, (CH2)2), 2.41 (2H, q, CH2), 1.13 (3H, t, CH3). 13 C-RMN (CDCl3): δ (ppm) 183.48 (C=O); 139.25 (Ar); 139.19 (Ar); 133.16 (Ar); 131.50 (Ar); 129.07 (Ar); 128.40 (Ar); 128.36 (Ar); 126.23 (Ar); 123.31 (Ar); 122.60 (Ar); 120.76 (Ar); 114.82 (Ar); 77.21 (Ar); 50.00 (CH2); 32.34 (CH2); 32.31 (CH2); 31.47 (CH2); 25.89 (CH2); 14.63 (CH3). IV (KBr, ν/cm−1): (C=O) 1651, 1637, 1610, 1593. 199 5. Parte Experimental 5.1.2 - Síntese e Caracterização de Complexos de Re Os complexos de rénio foram sintetizados a partir de diferentes compostos de partida cuja síntese se encontra descrita na literatura. Estes compostos de partida foram: ReOCl3(PPh3)2 (1)113 e [ReO2(py)4]Cl (2)113b para os complexos de Re(V) e [Re(CO)5Br] (4)165 e (NEt4)2[ReBr3(CO)3] (5)126 para os complexos de Re(I). O complexo fac-[Re(CO)3(3,5-Me2pzNN)]Br foi sintetizado de acordo com o descrito na literatura.75 5.1.2.1 - [ReO(OMe)(3,5-Me2pzNNN)]BPh4 (3) 85 mg do ligando 3,5-Me2pzNNN (L1) (0.343 mmol) foi dissolvido em MeOH e adicionado a uma solução de [ReO2(py)4]Cl (97.5 mg, 0.171 mmol) em MeOH. A solução foi mantida a 60ºC, com agitação, durante 4 horas. O produto da reacção foi colocado a recristalizar em MeOH com NaB(Ph4). Várias semanas depois obtiveram-se de cristais verdes escuros, de faces definidas, que foram analisados por difracção de raios-X. + BPh4O NH2 Re NH OMe N N N 5.1.2.2 – Reacção de 3,5-Me2pzSSS-CH2CO2Et com [ReO2(py)4]Cl Foram dissolvidas 42 mg de 3,5-Me2pzSSS-CH2CO2Et (L2) (0.124 mmol) em MeOH. Esta solução foi adicionada à solução de [ReO2(py)4]Cl (60 mg, 0.104 mmol) em MeOH. A mistura reaccional foi mantida em refluxo, com agitação, durante cerca de 3h. O solvente foi removido por evaporação a pressão reduzida e o precipitado recristalizado em CH2Cl2/éter. A evaporação lenta dos solventes conduziu à formação de cristais verde esmeralda de faces bem 200 5. Parte Experimental definidas. A análise por difracção de raio X mostrou estar em presença do dímero [ReOCl2(py)2]2( -O) descrito na literatura.125 5.1.2.3. fac-[Re(CO)3(3,5-Me2pzSS-Et)]Br (6) N N OC S S Re CO CO Uma solução de [Re(CO)5Br] (100 mg, 0.24 mmol) e de 3,5-Me2pzSS-Et (L3) (65 mg, 0.27 mmol) em MeOH seco refluxou durante uma noite, sob azoto. Após esse tempo, o MeOH foi evaporado a pressão reduzida e o resíduo seco foi lavado com THF. O sólido resultante foi extraído para a H2O. A suspensão foi centrifugada e o sólido precipitado foi seco. Obteve-se 69 mg de sólido branco microcristalino que corresponde ao complexo fac-[Re(CO)3(3,5-Me2pzSSEt)]Br (42%). Análise elementar calculada (experimental) para C16H22N2O5S2ReBr: C, 28.3 (28.01); H, 3.37 (3.31); N, 4.7 (4.65); S, 10.8 (9.44). 1 H-RMN (CD3OD): δ (ppm) 6.23 (s, pz-H, 1H); 4.73 (m, CH2, 1H); 3.96 (m, CH2, 1H); 3.78 (m, CH2, 1H); 3.38 (m, (CH2)2, 2H); 3.23 (m, CH2, 1H); 3.05 (m, CH2, 2H); 2.61 (m, CH2, 1H); 2.57 (s, CH3, 3H); 2.35 (s, CH3, 3H); 2.01 (m, CH3, 1H); 1.43 (t, CH3, 3H). Neste complexo há protão que está por baixo do Metanol deuterado. 13 C-RMN (CDCl3): δ (ppm) 160.03 (C O); 156.17 (C(3,5)pz); 146.57 (C(3,5)pz); 110.30 (C(4)pz); 37.26 (CH2); 34.37 (CH2); 33.96 (CH2); 32.41 (CH2); 17.08 (CH2-CH3); 13.64 (pzCH3); 12.10 (pz-CH3). IV (KBr, cm−1): ν (C O) 2039, 1919. HPLC tr = 18.4 min (Nucleosil 100-10 C18; 1 ml/min; MeOH / 0.1% TFA) 201 5. Parte Experimental 5.1.2.4. fac-[Re(CO)3(3,5-Me2pzSS-CH2CO2Et)]Br (7) N N OC S S CO2Et Re CO CO Uma solução de (NEt4)2[Re(CO)3Br3] (100 mg, 0.13 mmol) e 3,5-Me2pzSS-CH2CO2Et (L4) (40 mg, 0.13 mmol) em MeOH seco refluxou durante uma noite, sob azoto. Após evaporação do MeOH, o resíduo é redissolvido em H2O, da qual precipita 45 mg de um sólido branco microcristalino correspondente ao complexo 7 (0.07 mmol, 53%). Análise elementar calculada (experimental) para C16H22N2O5S2ReBr: C, 29.4 (29.57); H, 3.37 (3.91); N, 4.3 (4.27). 1 H-RMN (CD3OD): δ (ppm) 6.25 (s, pz-H, 1H); 4.73 (m, CH2, 1H); 4.33 (m, CH2, 2H); 3.94 (m, CH2, 1H); 3.77 (m, CH2, 1H); 3.47 (m, CH2, 2H); 3.00 (m, CH2, 2H); 2.62 (s, CH3, 3H); 2.52 (m, CH2, 2H); 2.35 (s, CH3, 3H); 2.02 (m, CH2, 1H,); 1.32 (t, CH3, 3H). 13 C-RMN (CD3OD): δ (ppm) 191.59 (C O); 168.38 (O-C=O); 156.36 (C(3,5)pz); 146.69 (C(3,5)pz); 110.37 (C(4)pz); 63.78 (CH2); 49.16 (CH2); 41.04 (CH2); 37.52 (CH2); 35.03 (CH2); 32.39 (CH2); 17.02 (CH2-CH3); 14.40 (pz-CH3); 12.10 (pz-CH3). IV (KBr, cm−1): (C O) 2036, 1947; (C=O) 1721. HPLC tr = 17.5 min (Nucleosil 100-10 C18; 1 ml/min; MeOH / 0.1% TFA) 202 5. Parte Experimental 5.1.2.5. fac-[Re(CO)3(3,5-Me2pzSS-CH2CO2H)]Br (8) N N OC S S CO2H Re CO CO Uma solução de [Re(CO)5Br] (93 mg, 0.23 mmol) e de 3,5-Me2pzSS-CH2CO2H (L5) (66 mg, 0.24 mmol) em MeOH seco refluxou durante uma noite, sob azoto. Após esse tempo, o MeOH foi evaporado a pressão reduzida e o resíduo seco foi lavado com H2O. O sólido resultante foi recristalizado em THF/Hexano obtendo-se 65 mg de fac-[Re(CO)3(3,5-Me2pzSSCH2CO2H)]Br (0.1 mmol, 43%). Análise Elementar Calculada para C14H18N2O5S2ReBr: C, 26.9; H, 2.88; N, 4.49. Encontrada experimentalmente: C, 27.2; H, 3.02; N, 4.52. 1 H-RMN (CD3OD): δ (ppm) 6.25 (s, pz-H, 1H); 4.73 (m, CH2, 1H); 4.37 – 4.23 (m, CH2, 1H); 3.99 – 3.89 (m, CH2, 1H); 3.80 – 3.74 (m, CH2, 2H); 3.54 - 3.39 (m, CH2, 2H); 3.06 – 2.95 (m, CH2, 1H); 2.62 (m, CH, CH3, 4H); 2.36 (s, CH3, 3H); 2.08 – 1.88 (m, CH2, 1H). 13 C-RMN (CD3OD): δ (ppm) 190.306 (C O); 169.66 (O-C=O); 156.40 (C(3,5)pz); 146.61 (C(3,5)pz); 110.34 (C(4)pz); 49.17 (O-CH2); 41.25 (CH2); 37.64 (CH2); 34.87 (CH2); 32.40 (CH2); 17.01 (pz-CH3); 12.17 (pz-CH3). IV (KBr, cm−1): ν (C O) 2036, 1944; ν (C=O) 1702. HPLC tr = 15.0 min (Nucleosil 100-10 C18; 1 ml/min; MeOH / 0.1% TFA) 203 5. Parte Experimental 5.1.2.6. fac-[Re(CO)3(3,5-Me2pzNN-Ant)]Br (9) + Br N NH N OC - HN Re CO CO Dissolveu-se 121 mg de 3,5-Me2pzNN-Ant (L8) (0.327 mmol) em MeOH seco. A esta solução adicionou-se 132 mg de [Re(CO)5Br] (0.327 mmol). A mistura reaccional ficou em refluxo, sob agitação, uma noite. Após evaporação do solvente obteve-se o produto da reacção quase limpo. A purificação por recristalização em THF/n-Hexano seguida de lavagem com THF conduziu à formação de 67 mg de um pó amarelo pálido correspondente ao complexo fac[Re(CO)3(3,5-Me2pzNN-Ant)]Br (29%). Análise elementar calculada (experimental) para C27H26N4O3ReBr: C, 44.88 (43.24); H, 3.60 (3.39); N, 7.75 (7.8). 1 H-RMN (CD3OD) δ (ppm): 8.67 (s, H-Ar, 1H); 8.41 (d, (H-Ar)2, 2H); 8.15 (d, (H-Ar)2, 2H); 7.70 (d, (H-Ar)4, 2H); 7.57 (d, (H-Ar)2, 2H);7.18 (s, br, N-H, 1H); 6.09 (s, H-C(4)pz, 1H); 5.55 (m, Ar-CH2, 1H); 5.37 (m, Ar-CH2, 1H); 4.50 (m, CH2, 1H); 4.36 (s, br, N-H, 1H); 4.02 (m, CH2, 1H); 3.52(m, CH2, 2H); 2.81 (m, CH2, 1H); 2.62 (m, CH2, 2H); 2.39 (m, CH2, 1H); 2.28 (s, CH3, 3H); 2.25 (s, CH3, 3H). 13 C-RMN (CDCl3): δ (ppm) 152.50 (C(3,5)pz); 144.13 (C(3,5)pz); 131.36 (Ar-H); 130.50 (Ar- H); 130.06 (Ar-H); 129.93 (Ar-H); 128.23 (Ar-H); 126.31 (Ar-H); 125.61 (Ar-H); 122.17 (ArH); 108.24 (C(4)pz); 53.23 (CH2); 48.99 (CH2); 48.62 (CH2); 48.14 (CH2); 15.36 (pz-CH3); 12.22 (pz-CH3). 13 C-RMN (DMSO): δ (ppm) 153.38 (C(3,5)pz); 143.98 (C(3,5)pz); 131.08 (Ar-H); 130.59 (Ar- H); 129.46 (Ar-H); 129.15 (Ar-H); 127.82 (Ar-H); 127.06 (Ar-H); 125.45 (Ar-H); 123.92 (ArH); 107.62 (C(4)pz); 67.05 (CH2-Ar). IV (KBr, cm−1): ν (C O) 2024, 1900. ESI-MS (m/z): 643.0 [M]+ HPLC tr = 23.9 min (Nucleosil 100-10 C18; 1 ml/min; MeOH / 0.1% TFA) 204 5. Parte Experimental 5.1.2.7. fac-[Re(CO)3(Ant-3,5-Me2pzNN)]Br (10) + Br N N OC NH Re H2N CO CO A reacção de 100 mg de Ant-3,5-Me2pzNN (L10) (0.269 mmol) com 109 mg [Re(CO)5Br] (0.269 mmol) foi conduzida em MeOH, sob refluxo, durante uma noite. O solvente foi removido sob vácuo e o produto reaccional foi lavado com n-hexano. Obteve-se 192 mg de um pó amarelo acastanhado correspondente a fac-[Re(CO)3(Ant-3,5-Me2pzNN)]Br (0.262 mmol, 98%). Análise elementar calculada (experimental) para C27H26N4O3ReBr: C, 44.88 (42.40); H, 3.60 (3.74); N, 7.75 (7.09). 1 H-RMN (CD3OD) δ (ppm): 8.49 (s, H-Ar, 1H); 8.16 (d, (H-Ar)2, 2H); 8.05 (d, (H-Ar)2, 2H); 7.49 (m, (H-Ar)4, 4H); 6.90 (s, br, N-H, 1H); 5.38 (s, br, N-H, 1H); 4.83 (s, Ar-CH2, 2H); 4.38 (m, CH2, 1H); 4.02 (m, CH2, 1H); 3.82 (s, br, N-H, 1H); 3.41 (m, CH2, 1H); 2.84 (m, CH2, 2H); 2.44 (m, (CH2), 3H); 2.22 (s, CH3, 3H); 1.66 (s, CH3, 3H). 13 C-RMN (CD3OD): δ (ppm) 194.506 (C O); 152.65 (C(3,5)pz); 142.30 (C(3,5)pz); 133.03 (Ar-H); 131.87 (Ar-H); 131.19 (Ar-H); 130.49 (Ar-H); 128.18 (Ar-H); 127.33 (Ar-H); 126.17 (Ar-H); 125.38 (Ar-H); 118.38 (C(4)pz); 55.65 (CH2); 43.13 (CH2); 30.69 (CH2); 24.13 (CH2); 14.86 (pz-CH3); 9.98 (pz-CH3). IV (KBr, cm−1): ν (C O) 2025, 1889. ESI-MS (m/z): 643.0 [M]+. HPLC tr = 23.1 min (Nucleosil 100-10 C18; 1 ml/min; MeOH / 0.1% TFA) 205 5. Parte Experimental 5.1.2.8. fac-[Re(CO)3(Ant-pzNN)]Br (11) + Br N N OC NH Re H2N CO CO A uma solução de 45 mg de Ant-pzNN (L11) (0.131 mmol) em MeOH, adicionou-se 53 mg de [Re(CO)5Br] (0.131 mmol) sob azoto. A solução ficou uma noite a 60ºC, sob agitação. Após evaporação do solvente, o produto da reacção foi lavado com CHCl3. Obteve-se 50 mg de um pó amarelo torrado correspondente ao complexo fac-[Re(CO)3(Ant-pzNN)]Br (55%). 1 H-RMN (CD3OD) δ (ppm) 8.49 (s, H-Ar, 1H); 8.32 (d, (H-Ar)2, 2H); 8.08 (d, (H-Ar)2, 2H); 7.89 (s, (H-pz), 1H); 7.47 (m, (H-Ar)4, 4H); 7.38 (s, H-pz,, 1H); 6.93 (s, br, N-H, 1H); 5.26 (s, br, N-H); 4.44 (m, CH2, 1H); 4.31 (m, CH2, 1H); 4.10 (m, CH2, 2H); 3.41(s, br, N-H); 2.72 (m, CH2, 2H); 2.42 (m, (CH2), 4H); 1.97 (m, CH2, 1H). 13 C-RMN (DMSO): δ (ppm) 194.32 (C O); 143.99 (C(4)pz); 132.98 (Ar-H); 131.64 (Ar-H); 131.33 (Ar-H); 129.34 (Ar-H); 129.17 (Ar-H); 126.54 (Ar-H); 126.37 (Ar-H); 125.30 (Ar-H); 124.55 (C(3,5)pz); 121.89 (C(3,5)pz); 79.22 (pz-CH2); 54.66 (CH2); 51.69 (CH2); 47.78 (CH2); 21.91 (CH2). IV (KBr, cm−1): ν (C O) 2026, 1896. ESI-MS (m/z): 614.9 [M]+. HPLC tr = 23.1 min (Nucleosil 100-10 C18; 1 ml/min; MeOH / 0.1% TFA) 206 5. Parte Experimental 5.1.2.9. Reacção de AntrapzNN (L12) com [Re(CO)5Br] Uma solução de [Re(CO)5Br] (116 mg, 0.286 mmol) e AntrapzNN (L12) (92 mg, 0.300 mmol) em MeOH seco refluxou durante uma noite, sob azoto. Após evaporação do MeOH obteve-se 0.046 g de um pó amarelo analisado por RMN de 1H a diferentes temperaturas, IV e espectrometria de massa, tal como discutido na secção 3.3.2. A caracterização do(s) produto(s) reaccional(is) não foi conclusiva. 1 H-RMN (CDCl3, 20ºC) δ (ppm): 8.43 (d, H-Ar); 8.34 (d, H-Ar); 8.17 (d, H-Ar); 8.06 (d, H- Ar); 7.75-7.67 (m, H-Ar); 7.59-7.51 (m, H-Ar); 4.79-4.65 (m, CH2); 4.13-2.65 (m, CH2). IV (KBr, cm−1): ν (C O) 2020, 1870; (C=O) 1653, 1593 5.1.2.10. Reacção de AntrapzSS-Et (L13) com [Re(CO)5Br] Uma solução de [Re(CO)5Br] (34 mg, 0.084 mmol) e AntrapzSS-Et (L13) (31 mg, 0.084 mmol) em MeOH seco refluxou durante uma noite, sob azoto. Durante a reacção observou-se a precipitação de um pó amarelo que foi isolado por centrifugação. A caracterização deste pó por RMN de 1H a diferentes temperaturas, IV e espectrometria de massa não foi conclusiva, tal como discutido na secção 3.3.2. Análise elementar calculada (experimental) para C23N2S2O4ReBrH20: C, 38.33 (38.44); H, 2.81 (3.40); N, 3.90 (3.73). 1 H-RMN (CDCl3, 60ºC) δ (ppm): 8.44 (d, H-Ar, 1H); 8.19 (d, H-Ar, 1H); 8.06 (d, H-Ar, 1H); 7.85 (d, H-Ar, 1H); 7.70 (m, 2(H-Ar), 2H); 7.55 (t, H-Ar, 1H); 4.90-4.78 (m, CH2); 4.08 (s, largo, CH2); 3.55-3.51 (m, CH2); 3.09-2.81 (m, CH2); 2.60-2.58 (m, CH2); 1.37 (t, CH3, 3H). IV (KBr, ν/cm−1): ν (C O) 2033, 1955, 1908; (C=O) 1651, 1595. 207 5. Parte Experimental 5.1.3. Síntese e Caracterização dos Complexos de 99mTc(I) As manipulações químicas que envolveram substâncias radioactivas foram efectuadas atrás de uma parede de chumbo com um visor de vidro impregnado de sais de chumbo numa “hote” com extracção. Os frascos que continham produtos radioactivos foram colocados dentro de contentores de chumbo, de espessura adequada. O controlo da dose de radiação absorvida pelo manipulador foi efectuado por leitura de dosímetros (detecção de radiação) individuais. 5.1.3.1 Síntese e Purificação dos Complexos com 99mTc(I) – procedimento geral O pertecnetato de sódio (Na[99mTcO4]) foi obtido por eluição de um gerador de 99 Mo/99mTc com NaCl 0.9% (Amersham ou MDS Nordion S.A., Belgica). A actividade do eluído foi medida numa câmara de ionização Aloka, Curiemeter IGC-3, Tóquio, Japão). O pertecnetato de sódio obtido permitiu a síntese do produto de partida [99mTc(CO)3(H2O)3]+ (5a) tal como se encontra descrito.62 O complexo fac-[99mTc(CO)3(3,5-Me2pzNN)]Br foi sintetisado de acordo com o descrito na literatura.77 Preparou-se previamente uma solução de ligando com uma concentração que variou entre 10-2 e 10-5M. Quando o ligando é hidrossoluvel, a solução foi preparada em água destilada. No caso dos ligandos insolúveis em água, a solução foi preparada em EtOH. Num frasco de vidro selado, foi introduzido, em atmosfera de azoto, 100 l de solução de ligando. A este frasco, adicionou-se também 900 l de uma solução de [99mTc(CO)3(H2O)3]+ (1-2 mCi) em tampão fosfato (0.1 M, pH 7.4). A mistura foi incubada a uma temperatura (60100ºC) e durante um período de tempo (30 a 60 min) que variou com o ligando envolvido na reacção. Após arrefecimento, a solução foi analisada por HPLC caracterizando-se desta forma a espécie radioquímica formada, por comparação do seu tempo de retenção (detecção δ) com o do complexo de rénio congénere (detecção UV). 208 5. Parte Experimental 5.1.3.2. fac-[99mTc(CO)3(3,5-Me2pzSS-Et)]+ (6a) A mistura do ligando 3,5-Me2pzSS-Et, L3 (cuja concentração final foi 10-3M) com [99mTc(CO)3(H2O)3]+ foi incubado 60 min a 100 ºC obtendo-se o complexo 6a. HPLC (CH3CN / 0.1% TFA (gradiente)): tr (6a) = 18.7 min 5.1.3.3. fac-[99mTc(CO)3(3,5-Me2pzSS-CH2CO2Et]+ (7a) e fac-[99mTc(CO)3(3,5-Me2pzSS-CH2CO2H)]+ (8a) A mistura do ligando 3,5-Me2pzSS-CH2CO2Et, L4 (cuja concentração final foi 10-3M) com [99mTc(CO)3(H2O)3]+ foi incubado 60 min a 37 ºC obtendo-se os complexos 7a e 8a. HPLC (CH3CN / 0.1% TFA (gradiente)): tr (7a) = 17.7 min tr (8a) = 15.2 min 5.1.3.4. fac-[99mTc(CO)3(3,5-Me2pzNN-Ant)]+ (9a) A mistura do ligando 3,5-Me2pzNN-Ant, L8 (cuja concentração final foi 5 x 10-4M) com [99mTc(CO)3(H2O)3]+ foi incubado 30 min a 100 ºC obtendo-se o complexo 9a. HPLC (MeOH / 0.1% TFA (gradiente)): tr (9a) = 24.7 min 5.1.3.5. fac-[99mTc(CO)3(Ant-3,5-Me2pzNN)]+ (10a) A mistura do ligando Ant-3,5-Me2pzNN, L10 (cuja concentração final foi 104M) com [99mTc(CO)3(H2O)3]+ foi incubado 30 min a 80 ºC ontendo-se o complexo 10a. HPLC (MeOH / 0.1% TFA (gradiente)): tr (10a) = 23.6 min 209 5. Parte Experimental 5.1.3.6. fac-[99mTc(CO)3(Ant-pzNN)]+ (11a) A mistura do ligando Ant-pzNN, L11 (cuja concentração final foi 5 x 10-4M) com [99mTc(CO)3(H2O)3]+ foi incubado 30 min a 80 ºC obtendo-se o complexo 11a. HPLC (MeOH / 0.1% TFA (gradiente)): tr (11a) = 23.7 min. 5.1.3.7. Síntese de “[99mTc(CO3)( AntrapzNN)]” (12a) A mistura do ligando AntrapzNN, L12 (cuja concentração final foi 10-4M) com [99mTc(CO)3(H2O)3]+ foi incubado 60 min a 60 ºC obtendo-se 12a. HPLC (MeOH / 0.1% TFA (gradiente)): tr (12a) = 22.8 min 5.1.3.8. Estabilidade na Presença de Cisteína e Histidina Alíquotas de 100 l das preparações dos complexos de 99mTc (nas quais a concentração de ligando é 10-4 M) foram adicionadas a 900 l de solução 10-3 M de cisteina. Alíquotas de 100 l das mesmas preparações radioactivas foram adicionadas a 900 l de solução 10-3 M de histidina. As soluções dos aminoácidos são em PBS a pH 7.4. As misturas foram incubadas a 37 ºC e analisadas por HPLC ao fim de 1, 2, 4 e 6 h.72 5.1.3.10. Lipofilia A lipofilia dos complexos foi avaliada por determinação do coeficiente de partição (PO/W) no sistema bifásico n-octanol / PBS (0.1 M, pH 7.4), segundo o seguinte procedimento: A três tubos de centrifuga adicionou-se 1 ml de n-octanol e 1 ml de soro fisiológico. A mistura foi agitada em vórtex durante 1 min, sendo, de seguida, adicionado a cada tubo 25 l da solução de complexo de 210 99m Tc em estudo. Agitou-se novamente em vortex durante 1 min e 5. Parte Experimental centrifugou-se a 3 000 rpm durante 5 min, de modo a obter uma separação eficiente entre a fase orgânica e a fase aquosa. Seguidamente, retiraram-se três aliquotas de 100 l de cada uma das fases e a respectiva actividade foi medida num contador de radiação gama. O coeficiente de partição (PO/W) foi calculado aplicando a expressão: PO/W=C1/C2, em que C1 representa a actividade na fase orgânica (cpm) e C2 a actividade na fase aquosa (cpm). A lipofilia do complexo é avaliada pelo valor do log PO/W. 211 5. Parte Experimental 5.2. Estudo Espectroscópico da Interacção com o DNA dos Ligandos e Complexos de Re acoplados a um Fragmento Intercalador. Procedimento geral Por espectroscopia de UV-Visivel, fluorescência e dicroismo circula, acompanhou-se titulações nas quais se adicionava, progressivamente, à solução da molécula em análise, volumes mínimos de uma solução de DNA. O DNA utilizado é um sal de sódio de DNA de timo de vitela (calf thymus) da Sigma e foi utilizado sem qualquer purificação. O sal de DNA foi dissolvido numa quantidade mínima de tampão Tris (0.01M, NaCl 0.05M, pH 7.4) agitando a solução durante 24h a 4ºC. A concentração de DNA, expressa por nucleótido, foi determinada por espectrometria de UVVisivel usando ε260nm = 6600 M-1cm-1. A pureza da solução de DNA foi testada medindo a razão Abs260nm/Abs280nm. Todas as medidas foram efectuadas a 28ºC em tampão Tris (0.01M, NaCl 0.05M, pH 7.4) com 5 a 20% de DMSO para permitir a dissolução dos compostos a testar na concentração requerida ao ensaio.129 Utilizando dicroismo linear acompanhou-se uma titulação na qual se adiciona progressivamente à solução de DNA solução da molécula em análise. As soluções foram dissolvidas em tampão fosfato (10mM, pH = 7.2) com 2 a 4% de DMSO.166, 167 Os estudos espectroscópicos de UV-Visivel, fluorescência e dicroismo circular foram realizados no Centro de Química Estrutural do Instituto Superior Técnico, com a colaboração do professor João C. Pessoa e da Doutora Isabel Correia. As análises por dicroismo linear foram efectuadas pelo investigador G. Viola no Departamento de Ciências Farmacêuticas da Universidade de Padova (Italia). Espectroscopia de UV/Visível Os espectros foram traçados num espectrofotómetro de UV-Visivel V-560 da Jasco em células de vidro com um percurso óptico de 1cm. 212 5. Parte Experimental Para eliminar a influência da absorvância do DNA, foram adicionadas quantidades iguais de solução de DNA à célula onde se encontra a amostra a testar e à célula de referência. Espectroscopia de Fluorescência Os espectros foram traçados num espectrofluorimetro Luminescence Spectrometer LS50B da Perkin Elmer em cuvetes de quartz de 1 cm de percurso óptico. As soluções de 3,5-Me2pzNNAnt (L8), pzNNAnt (L9), antrapzNN (L12) e fac[Re(CO)3(3,5-Me2pzNN-Ant)]+ (9) foram excitadas a λ=340 nm e as de Ant-3,5-Me2pzNN (L10), Ant-pzNN (L11) e fac-[Re(CO)3(Ant-3,5-Me2pzNN)]+ (10) a λ=345 nm. Os splits de emissão e excitação foram seleccionados para cada uma das soluções de modo a maximizar a intensidade de fluorescência das mesmas. Foi obtido o espectro de emissão entre λ=360-600 nm, com uma velocidade de varrimento de 100 nm/min. Dicroismo Circular Os espectros foram obtidos num espectropolarimetro Jasco J -720 que possui um polarimetro com um fotomultimetro UV-Visivel (200–700 nm). Formam usadas cuvettes de 1 ou 2 cm de percurso óptico. O espectro do solvente, no qual se encontravam solubilizados os compostos, foi subtraído aos espectros das amostras. Os espectros foram traçados entre 500 e 250 nm, com sensibilidade de 10 mdeg, resolução de 0.2 nm, velocidade de varrimento de 50 nm/min, resposta de 4 seg., largura de banda de 0,5 nm e acumulação 1. Dicroismo Linear Foi utilizada uma “flow cell” num espectropolarimetro Jasco J500 A equipado com uma interface Jasco J e um PC IBM. Os espectros foram obtidos com a sensibilidade de 10 mdeg, a resolução de 0.2 nm, a resposta de 4 seg. e a velocidade de varrimento de 50 nm/min. A preparação das amostras foi efectuada com um dispositivo descrito na literatura para o estudo de soluções de polímeros.168 213 5. Parte Experimental 5.3. Ensaios in vitro de Ligandos e Complexos de Re e de 99m Tc em Células Tumorais (B16-F1) e Não Tumorais (V79) Nos ensaios in vitro utilizaram-se sempre em paralelo duas linhas celulares: B16-F1 de melanoma de ratinho e V79 de fibroblastos de pulmão de hamster chinês. Para a cultura destas duas linhas celulares utilizou-se o mesmo procedimento que a seguir se descreve. As células foram descongeladas rapidamente em banho maria a 37ºC e colocadas no meio de cultura à mesma temperatura. O meio de cultura utilizado foi o DMEM (contendo Glutamax-I, Gibco ref. 61965) com 10% de soro fetálico de bovino (Gibco, ref. 10270) e 1% de solução de antibióticos (100 UI/ml de penicilina e 100 µg/ml de estreptomicina, Gibco ref. 15140). As células foram incubadas numa estufa a 37ºC numa atmosfera com 5% de CO2. Assim que as células aderiram, mudou-se o meio de cultura dos frascos para remover o DMSO presente na alíquota de congelação e nocivo para as células. Sempre que as células em cultura atingiram uma confluência (preenchimento do fundo do frasco) entre 70 e 80% procedeu-se à passagem (P) das células. Para tal, o meio de cultura foi aspirado, as células foram lavadas com PBS e aplicou-se uma solução de tripsina - 0.5% EDTA (Gibco ref. 25300). Após cerca de 2 min a 37ºC as células soltaram-se do fundo do frasco e a tripsina foi inactivada por adição de meio de cultura (4 vezes o volume da solução de tripsina). As células foram homogeneizadas e distribuídas ou diluídas para novo(s) frasco(s) de cultura. A cultura prosseguiu com mudança de meio de 2 em 2 dias. Nas experiências realizadas foram utilizadas células nas passagens entre P2 e P11. As células foram armazenadas em azoto líquido ou a -80ºC em aliquotas de 1 ml preparadas em meio de congelação (meio de cultura suplementado com 10% de soro fetálico e 10% de DMSO). Os ensaios em culturas de células foram efectuados com a colaboração das Doutoras Fernanda Marques e Paula Raposinho (investigadoras do grupo onde este trabalho se insere) e dos Doutores José Rueff e Sebastião Rodrigues (investigadores do Departamento de Genética da Faculdade de Ciências Médicas da Universidade Nova de Lisboa). A avaliação da captação celular por microscopia de fluorescência foi efectuada pelos Doutores Fernanda Marques e Gabriel G. Martins no Instituto Gulbenkian da Ciência. 214 5. Parte Experimental 5.3.1. Viabilidade Celular A citotoxicidade foi analisada por um teste designado por MTT 151 que avalia a viabilidade celular após contacto com a molécula a testar. As células que se mantêm viáveis reduzem o MTT (brometo de 3-(4,5-dimetiltiazol-2-1l)-2,5-difeniltetrazólio) a formazan, durante a respiração celular, nos mitocôndrios. A detecção de formazan é portanto uma forte indicação da integridade dos mitocôndrios e, indirectamente, da viabilidade celular. Os testes foram efectuados em placas de 96 poços. 5.3.1.1. Citotoxicidade de ligandos e complexos de rénio As células foram aplicadas em placas (cerca de 9000 células / 200 l / poço) 6 horas antes da adição das soluções dos compostos a testar para garantir a adesão das células aos poços. As soluções dos compostos foram preparadas em meio de cultura por diluições sucessivas de uma solução mãe contendo 1% DMSO. Utilizou-se 8 poços para cada concentração avaliada. As soluções ficaram a incubar durante 12 horas a 37ºC e após esse tempo as células foram lavadas com PBS e posteriormente incubadas com MTT durante 3 a 4 horas a 37ºC. Após lavagem com PBS, adicionou-se 200 l de DMSO, para dissolver os cristais de formazan formados. Leu-se a absorvância a 595 nm num espectrofotómetro de placas (Power Wave Xs, Bio-Tek). O valor da viabilidade máxima das células foi determinado em cada placa (controlo) incubando as células apenas com meio de cultura (concentração zero de composto). A citotoxidade das moléculas foi avaliada por determinação dos valores do IC50. Este parâmetro corresponde à concentração necessária para reduzir a 50% o valor da absorvância obtido nos poços controlo da mesma placa, ou seja a concentração que reduz para metade a viabilidade celular. 215 5. Parte Experimental 5.3.1.2. Radiotoxicidade As células foram aplicadas em placas (cerca de 7000 células / 200 l / poço) 6 horas antes da adição do composto a testar para garantir a adesão das células aos poços. Os complexos de 99m Tc, purificados por HPLC semipreparativo, foram redissolvido em meio de cultura preparando-se soluções com diferentes actividades radioactivas, por diluições sucessivas. Estas soluções ficaram a incubar com as células 36 horas a 37ºC, após as quais, as células foram lavadas com PBS. Testaram-se 8 poços com cada actividade. As células foram incubadas com MTT durante 3 a 4 horas e posteriormente foram lavadas com PBS. Para dissolver os cristais de formazan formados adicionou-se 200 l de DMSO a cada poço. Leu-se a absorvância a 595 nm num espectrofotometro de placas (Power Wave Xs, Bio-Tek). 5.3.2. Captação Celular e Internalização no Núcleo (adaptado da ref. 169) Nos estudos de captação celular e internalização as células foram aplicadas em placas de 24 poços (cerca de 105 células / 500 l / poço) 16 horas antes da aplicação do composto radioactivo a testar para garantir a adesão das células. Os complexos de 99mTc foram purificados por HPLC semi-preparativo e redissolvidos em meio de cultura. Estas soluções (200 000 cpm / 500 l / poço) foram postas a incubar com células (30 min, 1, 2, 3 e 4 horas) a 37ºC numa atmosfera com 5% CO2. As células foram então lavadas com uma solução de PBS com 0,2 % de BSA e tratadas com tripsina (100 l / poço). A inactivação da tripsina fez-se com 250 l de meio de cultura. As células, então em suspensão (em eppendorf) foram centrifugadas e lavadas 2 vezes com solução fria de PBS com 0.2% de BSA. A destruição da membrana celular da célula foi conseguida pela adição de 500 l de tampão de lise (Tris 10mM, MgCl2 1.5 mM, NaCl 140 mM, pH 8.0-8.3) e 1 l de Nonidet P-40 a 10 % (Roche) durante 15 min em gelo. Centrifugou-se a 1300 g e a 4ºC durante 2 min. Após centrifugação obteve-se o precipitado (que continha o núcleo das células) e o sobrenadante (com os restantes conteúdos celulares). A actividade medida no precipitado corresponde à internalização nuclear e a captação celular é o somatório da actividade medida no precipitado e no sobrenadante. 216 5. Parte Experimental Testaram-se 4 poços a cada tempo. Durante o ensaio verificou-se que as células sujeitas aos compostos testados durante 4 horas mantiveram-se viáveis (controlo da viabilidade celular). Com efeito, foram seleccionados 3 poços em cada placa e nestes as células foram tripsinisadas e colocadas em contacto com solução de trypan blue. As células viáveis, por serem impermeáveis a este reagente, não adquirem a cor azul. 5.3.3 Avaliação da Captação Celular por Microscopia de Fluorescência Para efectuar os estudos por microscopia de flourescência foram aplicadas cerca de 5 x 104 células por poço em placas de 6 poços. As células ficaram uma noite a incubar. No dia seguinte o meio foi aspirado e as células foram incubadas com novo meio no qual estava dissolvida a molécula a analisar (80 µM). As células ficaram incubadas com aos complexos de 99m Tc a testar durante 3 h após as quais foram lavadas com PBS e fixadas com uma solução de 3% paraformaldeido em PBS, durante 20 min à t.a. Após 3 lavagens com PBS, as células foram incubadas com 5 µM de DRAQ5 (corante de DNA) durante 20 min à t.a. A seguir as placas foram lavadas 3 vezes com PBS e montadas em slides standard do microscópio em glicerol com 3% N-propilgalato para melhorar as condições de visualização e prevenir o aparecimento de manchas. As amostras foram observadas num microscópio Leica DMRA2, utilizando uma objectiva de 100 x 1.4 NA e um filtro Chroma + A4 UV para avaliar a fluorescência do antraceno ( ( ex ex max = 350 nm, max = 647 nm, em em max = 410 nm) e um filtro vermelho Y5 Cy5 para o DRAQ5 max = 670 nm). As imagens foram obtidas e tratadas com uma máquina fotográfica CoolSNAP HQ 1.3 Mpixel cooled CCD e com o software MetaMorph. 217 5. Parte Experimental 5.4. Cristalografia de Raios-X de Cristal Único Os cristais foram montados em capilares de vidro. No caso do complexo 7 o cristal foi montado embebido em Nujol de modo a minimizar a perda de cristalinidade. Os dados de difracção de raio-X foram obtidos à temperatura ambiente num difractómetro Enraf-Nonius CAD-4 com radiação monocromática de molibdénio (λ=0,71069Å). As estruturas foram resolvidas utilizando métodos de Patterson usando o programa SHELXS-97 e refinadas usando o programa SHELXL-97.170, programa ORTEP-3. 172 171 A representação gráfica das estruturas foi efectuada com o A resolução e o refinamento das estruturas foram efectuados com a ajuda da Doutora Ângela Domingos e da Doutora Isabel Cordeiro dos Santos (ITN). 5.4.1. [ReO(OMe)(3,5-Me2pzNNN)]BPh4 (3) C8 N5 O1 C6 C1 1 C12 C13 C9 N1 Re C1 C5 O2 N4 C7 C4 218 N2 N3 C3 C2 5. Parte Experimental Tabela 5.1 – Dados cristalograficos para o complexo [ReO(OMe)(3,5-Me2pzNNN)]BPH4 (3). Formula empírica; Massa molecular Com36H45BN5O2Re; 776.78 gmol-1 Sistema Cristalográfico Monoclínico Grupo Espacial P21/n Dimensões da Célula Unitária a = 12.101(2) Å = 90º b = 14.3993(15) Å = 96.285(13)º c = 19.975(2) Å = 90º 3 Volume (V) 3459.6(9) Å Z 4 Densidade (calculada) 1.491 mg m-3 (Mo-K ) 3.55 mm-1 Reflexões totais 7102 Reflexões únicas 6767 [R(int) = 0.0551] Parâmetros refinados 406 ( ) Max e min 2 0.9996 e 0.7721 S on F 1.048 Ajuste final [I>2sigma(I)] R1 = 0.0667, wR2 = 0.0916 Ajuste final (todos os dados) R1 = 0.1476, wR2 = 0.1132 a R = | | F | - | FC| | / | F |, wR2 = [ (w(F 2 - FC2)2)]1/2; [F > 4 (F )]. 219 5. Parte Experimental 5.4.2 - [Re(CO)3(3,5-Me2pzSS-CH2CO2Et)]Br (7) O5 O4 C3 C9 C2 C1 S2 Re N1 N2 S1 Tabela 5.2– Dados cristalográficos para o complexo [Re(CO)3(3,5-Me2pzSS-CH2CO2Et)]Br (7) Fórmula empírica; Massa molécular C16H26BrN2O7S2Re; 688.62 g mol-1 Sistema Cristalográfico Triclínico Grupo Espacial P Dimensões da Célula Unitária a = 9.8592(10) Å = 66.412(12)º b = 11.0784(17) Å = 76.308(11)º c = 11.8537(18) Å = 85.189(11)º Volume (V) 1152.7(3) Å3 Z 2 Densidade (calculada) 1.984 mg m-3 (Mo-K ) 7.233 mm-1 Reflexões totais 4616 Reflexões únicas 4383 [R(int) = 0.0182] R1 b 0.0368 wR2 a 0.0841 R = | | F | - | FC| | / | F |, wR2 = [ (w(F 2 - FC2)2)]1/2; [F > 4 (F )] b 220 Os valores foram calculados para dados com I > 2 (I)
Download