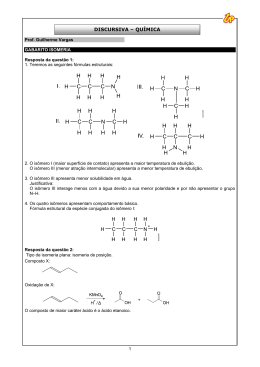
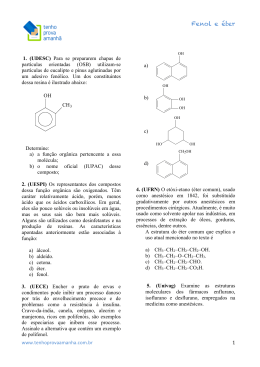
QUÍMICA — 1 GRUPO CV — 10/2009 RESOLUÇÕES E RESPOSTAS QUESTÃO 1: a) I = cetona; II = álcool; III = hidrocarboneto; IV = aldeído e cetona. b) H3 C O H2 C C OH C CH2 H3C — CH2 — MgI H2 O H2C CH2 H2C H3 C H2SO4 CH2 H2C I H2 C CH2 H2 C C II CH H2 C CH2 H2 C III O3 Zn ácido 7 oxonon-2-enóico H3 C O — — O H2 C — — O H3C — CH2 — C — CH2 — CH2 — CH2 — CH — — CH — C — OH C VII H O C H2 C H3 O+ CH2 H2 C IV O — — Ph3P — — CHCO2CH3 VI CH3 aO N Ph3P — —O — — — O H3C — CH2 — C — CH2 — CH2 — CH2 — CH — — CH — C — ONa — H O + O— —C — — — O V QUESTÃO 2: a) NH2 — O— fórmula estrutural — C— NH2 +4 número de oxidação do carbono — — H3C — CH2 — C — CH2 — CH2 — CH2 — C — —C H H 2 — ANGLO VESTIBULARES H — b) + O— — H H → O— —C— —O + 2 H — N—H H 144444424444443 energia fornecida N— — H H — N—H — O— — C— 1444442444443 energia liberada 1C— — O = 800 2 C — N = 610 + 4 N — H = 1560 2 O — H = 920 3890 kJ A reação é exotérmica e o ∆H = –50 kJ. 2C— — O = 1600 + 6 N — H = 2340 3940 kJ QUESTÃO 3: a) Se a reação ocorresse numa única etapa a equação da velocidade seria: v = k[ICl]2[H2]1 ordem da reação = 2 + 1 = 3 (3a ordem) b) Equação da velocidade: v = k[ICl]x[H2]y Nos experimentos 1 e 2 a [H2] não varia, portanto a variação da velocidade da reação foi devida a variação das concentrações do [ICl]. 123 [ICl]1 = 0,5 mol ⋅ L–1 [ICl]2 = 0,1mol ⋅ L–1 [ICl]1 = 5 ⋅ [ICl]2 123 v1 = 0,1mol ⋅ L–1 ⋅ s–1 v2 = 0,02 mol ⋅ L–1 ⋅ s–1 v1 = 5 ⋅ v2 Conclusão: v é proporcional à [ICl] ∴ v = k[ICl]1[H2]y Nos experimentos 3 e 4 a [ICl] permanece constante, portanto, a velocidade da reação é devida à variação de [H2] 123 [H2]3 = 0,2 mol ⋅ L–1 [H2]4 = 0,5 mol ⋅ L–1 [H2]4 = 2,5 ⋅ [H2]3 123 v3 = 0,016 mol ⋅ L–1 ⋅ s–1 v4 = 0,04 mol ⋅ L–1 ⋅ s–1 v4 = 2,5 ⋅ v3 Conclusão: v é proporcional à [H2] ∴ v = k[ICl]1[H2]1 Equação da velocidade: v = k[ICl]1[H2]1 ordem do ICl = 1 ∴ 1a ordem ordem do H2 = 1 ∴ 1a ordem ordem da reação = 1 + 1 = 2 (2a ordem) QUESTÃO 4: a) 3 (NH4)HCO3(s) + H3PO4(aq) → (NH4)3PO4(aq) + 3 CO2(g) + 3 H2O(l) ou 3 HCO3–(aq) + 3 H+(aq) → 3 CO2(g) + 3 H2O(l) ∆ b) (NH4)HCO3(s) → NH3(g) + H2O(g) + CO2(g) A liberação de gases é responsável pelo crescimento da massa dos pães e bolos. QUÍMICA — 3 GRUPO CV — 10/2009 — — QUESTÃO 5: a) Cl Cl H2C — CH — CH2 — CH3 + Zn → ZnCl2 + H2C — — CH — CH2 — CH3 but-1-eno Cl — Cl — b) — — H2C — CH2 — CH2 — CH2 + Zn → ZnCl2 + H2C — CH2 H2C — CH2 ciclobutano QUESTÃO 6: a) HClO + NaOH → ác. hidróxido hipocloroso de sódio NaClO + H2O b) 0,149 g NaClO –––––––– 1L x –––––––– 4000 L x = 596 g NaClO 596 g = 74,5 g ⋅ mol–1 ⋅ 40000 L 2,0 ⋅ 10–4 mol/L NaClO 2,0 ⋅ 10–4 mol/L ClO– 123 m = QUÍMICA — 1 GRUPO RV-RVS — 10/2009 RESOLUÇÕES E RESPOSTAS QUESTÃO 1: a) I = cetona; II = álcool; III = hidrocarboneto; IV = aldeído e cetona. b) H3 C O H2 C C OH C CH2 H3C — CH2 — MgI H2 O H2C CH2 H2C H3 C H2SO4 CH2 H2C I H2 C CH2 H2 C C II CH H2 C CH2 H2 C III O3 Zn ácido 7 oxonon-2-enóico H3 C O — — O H2 C — — O H3C — CH2 — C — CH2 — CH2 — CH2 — CH — — CH — C — OH C VII H O C H2 C H3 O+ CH2 H2 C IV O — — Ph3P — — CHCO2CH3 VI CH3 aO N Ph3P — —O — — — O H3C — CH2 — C — CH2 — CH2 — CH2 — CH — — CH — C — ONa — H O + O— —C — — — O V QUESTÃO 2: a) NH2 — O— fórmula estrutural — C— NH2 +4 número de oxidação do carbono — — H3C — CH2 — C — CH2 — CH2 — CH2 — C — —C H H 2 — SISTEMA ANGLO DE ENSINO H — b) + O— — H H → O— —C— —O + 2 H — N—H H 144444424444443 energia fornecida N— — H H — N—H — O— — C— 1444442444443 energia liberada 1C— — O = 800 2 C — N = 610 + 4 N — H = 1560 2 O — H = 920 3890 kJ A reação é exotérmica e o ∆H = –50 kJ. 2C— — O = 1600 + 6 N — H = 2340 3940 kJ QUESTÃO 3: a) Se a reação ocorresse numa única etapa a equação da velocidade seria: v = k[ICl]2[H2]1 ordem da reação = 2 + 1 = 3 (3a ordem) b) Equação da velocidade: v = k[ICl]x[H2]y Nos experimentos 1 e 2 a [H2] não varia, portanto a variação da velocidade da reação foi devida a variação das concentrações do [ICl]. 123 [ICl]1 = 0,5 mol ⋅ L–1 [ICl]2 = 0,1mol ⋅ L–1 [ICl]1 = 5 ⋅ [ICl]2 123 v1 = 0,1mol ⋅ L–1 ⋅ s–1 v2 = 0,02 mol ⋅ L–1 ⋅ s–1 v1 = 5 ⋅ v2 Conclusão: v é proporcional à [ICl] ∴ v = k[ICl]1[H2]y Nos experimentos 3 e 4 a [ICl] permanece constante, portanto, a velocidade da reação é devida à variação de [H2] 123 [H2]3 = 0,2 mol ⋅ L–1 [H2]4 = 0,5 mol ⋅ L–1 [H2]4 = 2,5 ⋅ [H2]3 123 v3 = 0,016 mol ⋅ L–1 ⋅ s–1 v4 = 0,04 mol ⋅ L–1 ⋅ s–1 v4 = 2,5 ⋅ v3 Conclusão: v é proporcional à [H2] ∴ v = k[ICl]1[H2]1 Equação da velocidade: v = k[ICl]1[H2]1 ordem do ICl = 1 ∴ 1a ordem ordem do H2 = 1 ∴ 1a ordem ordem da reação = 1 + 1 = 2 (2a ordem) QUESTÃO 4: a) 3 (NH4)HCO3(s) + H3PO4(aq) → (NH4)3PO4(aq) + 3 CO2(g) + 3 H2O(l) ou 3 HCO3–(aq) + 3 H+(aq) → 3 CO2(g) + 3 H2O(l) ∆ b) (NH4)HCO3(s) → NH3(g) + H2O(g) + CO2(g) A liberação de gases é responsável pelo crescimento da massa dos pães e bolos. QUÍMICA — 3 GRUPO RV-RVS — 10/2009 — — QUESTÃO 5: a) Cl Cl H2C — CH — CH2 — CH3 + Zn → ZnCl2 + H2C — — CH — CH2 — CH3 but-1-eno Cl — Cl — b) — — H2C — CH2 — CH2 — CH2 + Zn → ZnCl2 + H2C — CH2 H2C — CH2 ciclobutano QUESTÃO 6: a) HClO + NaOH → ác. hidróxido hipocloroso de sódio NaClO + H2O b) 0,149 g NaClO –––––––– 1L x –––––––– 4000 L x = 596 g NaClO 596 g = 74,5 g ⋅ mol–1 ⋅ 40000 L 2,0 ⋅ 10–4 mol/L NaClO 2,0 ⋅ 10–4 mol/L ClO– 123 m =
Download