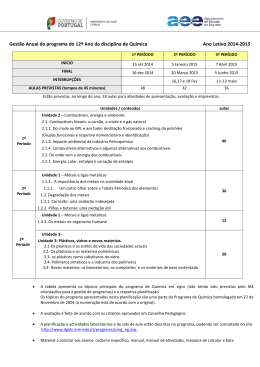
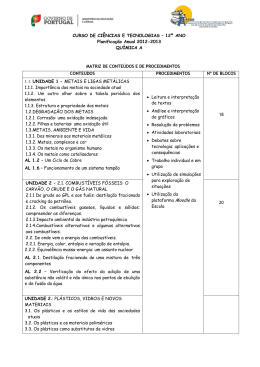
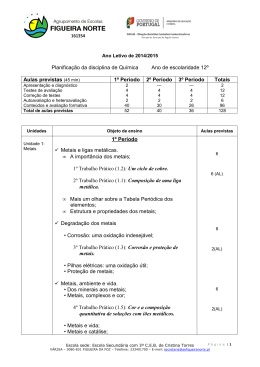
ESCOLA SECUNDÁRIA DE ALMEIDA GARRETT INFORMAÇÃO – PROVA DE EQUIVALÊNCIA À FREQUÊNCIA – Ensino Secundário 12º Ano DISCIPLINA: QUÍMICA Modalidade da Prova: Escrita + prática CÓDIGO: 342 Ano Letivo: 2014/2015 1.ª e 2.ª FASES Objeto de Avaliação A prova tem por referência o Programa de Química do 12º ano. 1.Metais e ligas metálicas Tabela Periódica dos Elementos Os elementos metálicos na Tabela Periódica (blocos s, p, d, f). Os Metais de Transição: a especificidade das orbitais d. Estrutura e propriedades dos metais A ligação metálica Propriedades características dos metais como substâncias ou materiais: brilho, maleabilidade, ductilidade, condutibilidade térmica e eléctrica. Degradação dos metais e corrosão: pilhas e baterias Reações de oxidação - redução. As pilhas como fonte de energia. A reatividade dos metais e o Potencial Padrão de elétrodo. A espontaneidade das reações redox. Metais, complexos e cor Complexos e compostos de coordenação com EDTA. Estabilidade de complexos: constantes de formação. Os metais no organismo humano Metais essenciais e metais tóxicos. A hemoglobina e o transporte de gases no sangue. O caso do CO2 indispensável: efeito tampão. Funcionamento de um sistema tampão. Características e estrutura da prova A prova é constituída por duas componentes: uma prova escrita e uma componente prática. Prova escrita Cotação (Total: 200 pontos) Prova escrita: 70% Componente prática: 30% Prova escrita (200 pontos) A prova está organizada por grupos de itens. Os itens podem ter como suporte um ou mais documentos, como, por exemplo, textos, tabelas de dados, gráficos e esquemas. 1.Metais e ligas metálicas: Tipologia de itens . Itens de seleção – escolha múltipla, verdadeiro/falso . Itens de construção: - Resposta curta; - Resposta restrita. 2. Combustíveis, energia e ambiente: 80 a 100 pontos As respostas aos itens de resposta curta podem envolver, por exemplo, a apresentação de uma palavra, de uma expressão, de uma frase, de um número, de uma equação ou de uma fórmula. As respostas aos itens de resposta restrita podem envolver a produção de um texto com apresentação de uma explicação, de uma previsão, de uma justificação ou de uma conclusão; ou podem envolver a realização de cálculos e a apresentação de justificações ou de conclusões. 70 a 90 pontos 3. Plásticos, Vidros e Novos Materiais: 20 a 30 pontos Página 1 de 3 2. Combustíveis, energia e ambiente Prova Prática Do crude ao GPL e aos fuéis: destilação fracionada e cracking do petróleo Cicloalcanos e alcenos: nomenclatura e isomeria. O benzeno e outros hidrocarbonetos aromáticos. Eletronegatividade e a polaridade de ligações e de moléculas. Isomeria de cadeia e de posição nos alcanos e nos álcoois. Isomeria de grupo funcional entre álcoois e éteres. Isomeria geométrica em alcenos. 1 - Realização de uma Atividade Laboratorial (AL), de entre as onze referidas como obrigatórias no Programa da disciplina. Os combustíveis gasosos, líquidos e sólidos: compreender as diferenças A equação dos gases ideais. Tipo de forças intermoleculares em diferentes interações "moleculares". As forças intermoleculares e os estados físicos das substâncias. Como variam as propriedades físicas dos alcanos em função da cadeia carbonada. 2 - Elaboração de um relatório, onde deve constar: Prova Prática (200 pontos) Execução Laboratorial: 80 pontos - registo das medições efetuadas na forma de tabela; - elaboração de gráfico(s), se necessário; Elaboração do relatório: 120 pontos - apresentação de cálculos para resposta ao problema; - fundamentação de procedimentos; - registo de conclusões. Combustíveis alternativos e algumas alternativas aos combustíveis Combustíveis alternativos: hidrogénio, álcool, bioálcool, biodiesel e biogás. A reciclagem de materiais orgânicos como fonte de obtenção de combustíveis. Vantagens e inconvenientes da utilização de combustíveis alternativos. As células de combustível, células fotovoltaicas e aerogeradores. A energia nuclear. Energia, calor, entalpia e variação de entalpia • Entalpia e variação de entalpia de uma reação. • Variações de entalpia associadas a diferentes tipos de reações: Entalpia padrão de combustão e entalpia-padrão de formação. • Cálculo da entalpia de uma reação a partir das entalpias de formação: Lei de Hess: ou da aditividade das entalpias-padrão de reação. 3. Plásticos, Vidros e Novos Materiais Polímeros sintéticos e a indústria dos polímeros. • Obtenção de polímeros sintéticos: monómeros e reações de polimerização. • Homopolímeros e co-polímeros. • Monómeros e grupos funcionais: álcoois, ácidos carboxílicos, cloretos de ácido, aminas, amidas, éteres, ésteres, aldeídos e cetonas. • Polímeros de condensação: poliésteres, poliamidas e poliálcoois. • Reações de polimerização de condensação e de adição. Grau de polimerização e massa molecular relativa média. Página 2 de 3 Critérios Gerais de Classificação: A classificação a atribuir a cada resposta resulta da aplicação dos critérios gerais e dos critérios específicos de classificação. Nos itens de escolha múltipla, a cotação do item só é atribuída às respostas que apresentem de forma inequívoca a opção correta. Todas as outras respostas são classificadas com zero pontos. Nos itens de resposta curta, a cotação do item só é atribuída às respostas totalmente corretas. Poderão ser atribuídas pontuações às respostas parcialmente corretas, de acordo com os critérios específicos de classificação. Nos itens de resposta restrita, os critérios de classificação apresentam-se organizados por níveis de desempenho ou por etapas. A cada nível de desempenho ou a cada etapa corresponde uma dada pontuação. Nos itens que envolvam a produção de um texto, a classificação das respostas tem em conta a organização dos conteúdos e a utilização de linguagem científica adequada. Os critérios de classificação das respostas aos itens de cálculo apresentam-se organizados por etapas. A classificação da resposta a estes itens resulta da soma das pontuações atribuídas às etapas apresentadas, à qual podem ser subtraídos pontos em função dos erros cometidos. Consideram-se dois tipos de erros: Erros de tipo 1 – erros de cálculo numérico, transcrição incorreta de dados, conversão incorreta de unidades, desde que coerentes com a grandeza calculada, ou apresentação de unidades incorretas no resultado final, também desde que coerentes com a grandeza calculada. Erros de tipo 2 – erros de cálculo analítico, ausência de conversão de unidades (qualquer que seja o número de conversões não efetuadas, contabiliza-se apenas como um erro de tipo 2), ausência de unidades no resultado final, apresentação de unidades incorretas no resultado final não coerentes com a grandeza calculada e outros erros que não possam ser considerados de tipo 1. À soma das pontuações atribuídas às etapas apresentadas deve(m) ser subtraído(s): . 1 ponto, se forem cometidos apenas erros de tipo 1, qualquer que seja o seu número. . 2 pontos, se for cometido apenas um erro de tipo 2, qualquer que seja o número de erros de tipo 1 cometidos. . 4 pontos, se forem cometidos mais do que um erro de tipo 2, qualquer que seja o número de erros de tipo 1 cometidos. Os erros cometidos só são contabilizados nas etapas que não sejam pontuadas com zero pontos. Duração da prova: a prova escrita tem a duração de 90 minutos; a prova prática tem a duração de 90 minutos mais 30 min de tolerância. Material a utilizar: O examinando apenas pode usar na prova, como material de escrita, caneta ou esferográfica de tinta azul ou preta. O examinando deve ainda ser portador de máquina calculadora gráfica, que cumpra os requisitos das máquinas de calcular autorizadas nos exames nacionais, e de uma pequena régua. Não é permitido o uso de lápis, nem de corretor. Para a realização da prova prática é obrigatório usar bata. Indicações específicas: A prova inclui uma tabela periódica. NOTA: A classificação da prova é expressa pela média ponderada e arredondada às unidades das classificações obtidas nas duas componentes: escrita 70%, prática 30% (Despacho Normativo nº 6-A/2015, de 5 março, alínea b), do ponto 2, do artigo 25º). Página 3 de 3
Baixar