Ano Letivo 2014/2015
INFORMAÇÃO - PROVA DE EQUIVALÊNCIA
À FREQUÊNCIA
12º Ano de Escolaridade
QUÍMICA
Prova 342
2015
(Dec.-Lei n.º 74/2004, de 26 de Março)
1. OBJETIVOS GERAIS
O Programa de Química do 12.º ano de escolaridade norteia-se por uma orientação CTS
(Ciência, Tecnologia e Sociedade) visando, numa perspectiva de continuidade, o alargamento
do leque de competências desenvolvidas na disciplina de Física e Química A.
Neste contexto, a avaliação nesta disciplina incide sobre os objetivos gerais orientados
para a integração das perspetivas científica, tecnológica e social.
As competências a avaliar, enquadradas nas dimensões dos saberes, das acções e dos
valores, são as que se operacionalizam nos objetivos integrados nas três unidades temáticas:
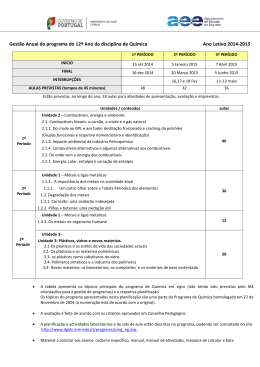
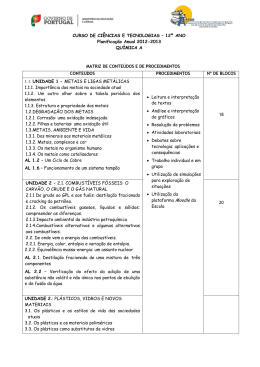
– Unidade 1: Metais e Ligas Metálicas
– Unidade 2: Combustíveis, Energia e Ambiente
– Unidade 3: Plásticos, Vidros e Novos Materiais,
que configuram o Programa de Química do 12.º ano de escolaridade, centrado na
temática geral «Materiais, sua estrutura, aplicações e implicações da sua produção e
utilização», unidades que constituem os objetos de ensino desta disciplina.
2. CONTEÚDOS
Os conteúdos das provas escrita e prática serão os constantes no programa da disciplina:
- Unidade 1:
1.1. Metais e ligas metálicas
1.1.1. A importância dos metais na sociedade atual
1.1.2. Um outro olhar sobre a Tabela Periódica dos Elementos
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 1 de 11
1.1.3. Estrutura e propriedades dos metais
1.2. Degradação dos Metais
1.2.1. Corrosão: uma oxidação indesejada
1.2.2. Pilhas e baterias: uma oxidação útil
1.2.3. Proteção dos metais
1.3. Metais, Ambiente e Vida
1.3.1. Dos minerais aos materiais metálicos
1.3.2. Metais, complexos e cor
1.3.3. Os metais no organismo humano
1.3.4. Os metais como catalisadores
- Unidade 2:
2.1. Combustíveis fósseis: o carvão, o crude e o gás natural
2.1.1. Do crude ao GPL e aos fúeis: destilação fracionada e cracking do petróleo
2.1.2. Os combustíveis gasosos, líquidos e sólidos: compreender as diferenças
2.1.3. Impacte ambiental da indústria petroquímica
2.1.4. Combustíveis alternativos e alguns alternativas aos combustíveis
2.2. De onde vem a energia dos combustíveis
2.2.1. Energia, calor, entalpia e variação de entalpia
2.2.2. Equivalência massa-energia: um assunto nuclear
- Unidade 3:
3.1. Os plásticos e os estilos de vida das sociedades actuais
3.2. Os plásticos e os materiais poliméricos
3.3. Os plásticos como substituintes do vidro
3.4. Polímeros sintéticos e a indústria dos polímeros
3.5. Novos materiais: os biomateriais, os compósitos e os materiais de base sustentada
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 2 de 11
3. CARACTERIZAÇÃO E ESTRUTURA DA PROVA DE EXAME
O exame é constituído por duas provas: uma escrita e outra prática.
A cotação de cada prova é expressa numa escala de 0 a 200 pontos, à qual corresponde
um valor máximo de 20 valores. A cotação final é calculada de acordo com o Despacho
Normativo 18/2008 de 19 de Março:
- 70% da componente escrita + 30% da componente prática.
PROVA ESCRITA
A prova escrita integra itens de tipologia diversificada, que pretendem avaliar
competências nos diferentes domínios, de acordo com os objetivos de aprendizagem
estabelecidos no Programa da disciplina.
Os itens da prova escrita estruturam-se em torno de informações que podem ser
fornecidas sob a forma de pequenos textos (descrição de situações / experiências em
contextos reais, extratos de artigos de revistas científicas, de jornais, ou de outras fontes),
figuras, gráficos ou tabelas.
A prova escrita pode incluir itens de resposta fechada (escolha múltipla, associação ou
correspondência, verdadeiro / falso, resposta curta e completamento) e itens de resposta
aberta (composição curta ou resposta restrita e composição extensa orientada).
Os itens de resposta fechada pretendem avaliar o conhecimento e a compreensão de
conceitos, bem como relações entre eles, e podem contemplar todos os conteúdos
programáticos e envolver cálculos simples.
Os itens de resposta aberta pretendem avaliar competências de nível cognitivo mais
elevado, como a aplicação do conhecimento de conceitos e de relações entre eles, a
compreensão de relações entre conceitos em contextos reais e, ainda, a produção e
comunicação de raciocínios aplicados a situações do quotidiano. Estes itens poderão envolver
uma abordagem multitemática, destinada a avaliar a capacidade de visão integrada de vários
conteúdos, e envolver a mobilização de conceitos nucleares do domínio da Química.
Nos itens de resposta aberta que envolvam a resolução de exercícios numéricos, o
examinando deve explicitar, na sua resposta, todos os raciocínios e cálculos que tiver de
efectuar.
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 3 de 11
Valorização das unidades programáticas na prova escrita
Unidades
Pontuação
Unidade 1: Metais e Ligas Metálicas
80 a 100
Unidade 2: Combustíveis, Energia e Ambiente
80 a 100
Unidade 3: Plásticos, Vidros e Novos Materiais
15 a 25
PROVA PRÁTICA
A prova prática inclui a execução de uma das onze actividades laboratoriais (AL)
referidas como obrigatórias no Programa da disciplina de Química.
Em relação à AL executada, o examinando deverá recolher, analisar e relacionar dados
de variáveis de diferentes modos (graficamente, matematicamente, …).
Poderá ser solicitada a elaboração de um relatório ou a resposta a itens de tipologia
diversificada relativos da AL executada.
Pretende-se, deste modo, avaliar as competências processuais (capacidade de observar,
executar com segurança, analisar criticamente situações particulares, gerar e testar hipóteses)
e comunicativas (capacidade de usar e compreender linguagem científica, registar, ler e
argumentar usando informação científica).
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 4 de 11
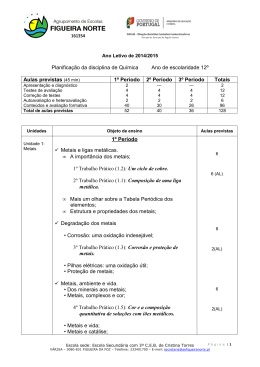
Actividades Laboratoriais obrigatórias
Unidades
Pontuação
Unidade 1:
AL1.2 – Um ciclo do cobre
AL1.4 – Funcionamento de um sistema tampão
AL1.6 – A cor e a composição quantitativa de soluções com iões metálicos
Unidade 2:
AL2.1 – Destilação fracionada de uma mistura de três componentes
AL2.2. – Verificação do efeito da adição de uma substância não volátil e
não iónica nos pontos de fusão e de ebulição da água
AL2.3 – Determinação da entalpia de neutralização da reacção NaOH (aq)
200
+ HCl (aq)
AL2.4 – Determinação da entalpia de combustão de diferentes
combustíveis líquidos
AL2.5 – Determinação da entalpia de combustão de diferentes álcoois
Unidade 3:
AL3.1 – Identificação de plásticos por testes físico-químicos
AL3.3. – Cristais e vidros
AL3.6. – Sintetizar polímeros
4. CRITÉRIOS GERAIS DE CLASSIFICAÇÃO
PROVAS ESCRITA E PRÁTICA
• Nos itens de escolha múltipla, é atribuída a cotação total à resposta correcta. As
respostas incorretas são classificadas com zero pontos.
Também deve ser atribuída a classificação de zero pontos aos itens em que o
examinando apresente:
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 5 de 11
– mais do que uma opção (ainda que incluindo a opção correcta);
– o número do item e/ou a letra da alternativa escolhida ilegíveis.
• Nos itens de ordenamento, só é atribuída classificação se a sequência apresentada
estiver integralmente correta.
• Nos itens de verdadeiro / falso, de associação e de correspondência, a classificação a
atribuir tem em conta o nível de desempenho revelado na resposta.
• Nos itens de resposta curta, caso a resposta contenha elementos que excedam o
solicitado, só são considerados para efeito de classificação os elementos que satisfaçam o que
é pedido, segundo a ordem pela qual são apresentados na resposta. Porém, se os elementos
referidos revelarem contradição entre si, a classificação a atribuir é de zero pontos.
• Nos itens de resposta aberta em que é solicitada a escrita de um texto, os critérios de
classificação estão organizados por níveis de desempenho, a que correspondem cotações fixas.
O enquadramento das respostas num determinado nível de desempenho contempla
aspectos relativos aos conteúdos, à organização lógico–temática e à utilização de terminologia
científica, cuja valorização deve ser feita de acordo com os descritores apresentados no
quadro I.
QUADRO I
Nível 3
Composição coerente no plano lógico-temático (encadeamento lógico do discurso, de acordo
com o solicitado no item).
Utilização de terminologia científica adequada e correta.
Nível 2
Composição coerente no plano lógico-temático (encadeamento lógico do discurso, de acordo
com o solicitado no item).
Utilização, ocasional, de terminologia científica não adequada e/ou com incorreções.
Nível 1
Composição com falhas no plano lógico-temático, ainda que com correta utilização de
terminologia científica.
• Nos itens de resposta aberta que envolvam a resolução de exercícios numéricos, os
critérios de classificação estão organizados por níveis de desempenho, a que correspondem
cotações fixas.
O enquadramento das respostas num determinado nível de desempenho contempla aspetos
relativos à metodologia de resolução, à tipologia de erros cometidos e ao resultado final, cuja
valorização deve ser feita de acordo com os descritores apresentados no quadro II.
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 6 de 11
QUADRO II
Nível 5
Metodologia de resolução correta.
Resultado final correto.
Ausência de erros.
Nível 4
Metodologia de resolução correta.
Resultado final incorreto, resultante apenas de erros de tipo 1, qualquer que seja o seu
número.
Nível 3
Metodologia de resolução correta.
Resultado final incorreto, resultante de um único erro de tipo 2, qualquer que seja o número
de erros de tipo 1.
Nível 2
Metodologia de resolução correta.
Resultado final incorreto, resultante de mais do que um erro de tipo 2, qualquer que seja o
número de erros de tipo 1.
Nível 1
Metodologia de resolução incompleta, isto é, apresentação de apenas uma das etapas de
resolução consideradas como mínimas, qualquer que seja o número de erros de tipo 1.
Erros de tipo 1 – erros de cálculo numérico, transcrição incorreta dos dados, conversão
incorreta de unidades ou ausência de unidades / unidades incorretas no resultado final.
Erros de tipo 2 – erros de cálculo analítico, erros na utilização de fórmulas, ausência de
conversão de unidades (*), e outros erros que não possam ser incluídos no tipo 1.
(*) qualquer que seja o número de conversões de unidades não efectuadas, contabilizar
apenas como um erro de tipo 2.
Deve ser atribuída a classificação de zero pontos se a resposta apresentar:
• metodologia de resolução incorreta – resultado incorreto;
• metodologia de resolução incorreta – resultado correto;
• metodologia de resolução ausente com apresentação de resultado final, mesmo que
correto.
• Se a resolução de um item que envolva cálculos apresentar erro exclusivamente
imputável à resolução numérica ocorrida num item anterior, não deve ser objeto de
penalização.
• Nos itens em que é solicitada a escrita de uma equação química, deve ser atribuída a
classificação de zero pontos se alguma das espécies químicas intervenientes estiver
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 7 de 11
incorretamente escrita, se estiver incorreta em função da reacção química em causa ou se a
equação não estiver estequiométrica e eletricamente acertada.
• Os cenários de metodologia de resposta apresentados para alguns dos itens abertos
podem não esgotar todas as possíveis hipóteses de resposta. Deve ser atribuído um nível de
desempenho equivalente se, em alternativa, o examinando apresentar uma outra metodologia
de resolução igualmente correta.
• As classificações a atribuir às respostas dos examinandos são expressas
obrigatoriamente em números inteiros.
PROVA PRÁTICA
• Na prova prática exige-se a execução correta de todas as técnicas necessárias à
realização da AL, assim como a selecção do material adequado para a realização das mesmas.
• Será obrigatório que o examinando utilize material e tome as precauções necessárias
para a execução da AL dentro de parâmetros rígidos de segurança. A prova poderá ser
interrompida se não se observarem os condicionalismos anteriores.
5. MATERIAL A USAR E MATERIAL NÃO AUTORIZADO
Nas provas escrita e prática:
-o examinando apenas pode utilizar como material de escrita, caneta ou esferográfica
de tinta azul ou preta;
- o examinando deve ser portador de máquina de calcular gráfica de acordo com a
listagem emitida pelo GAVE para os exames nacionais de Física e Química –A;
- é permitido o uso de régua e esquadro graduados;
- não é permitido o uso de tinta ou fita correctora.
6. DURAÇÃO DA PROVA DE EXAME
PROVA ESCRITA: 100 minutos
PROVA PRÁTICA: 100 minutos + 30 minutos (tolerância)
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 8 de 11
7. INDICAÇÕES ESPECÍFICAS
A prova inclui um formulário e ainda uma Tabela Periódica, anexos a este documento.
Outros dados imprescindíveis à resolução de um dado item, para além dos indicados nos
textos, nos gráficos, nas figuras ou nas tabelas que lhes estão anexados(as), são indicados no
final do enunciado.
CONSTANTES
Constante de Avogadro
NA = 6,02x1023 mol-1
Constante de Planck
h = 6,63x10-34 J s
R = 0,082 atm dm3 mol-1 K-1
R = 8,31 J mol-1 K-1
c = 3,00x108 m s-1
Constante dos gases
Velocidade de propagação da luz no vácuo
FORMULÁRIO
m
M
• Quantidade de substância………………………………………………………………………………………… n =
m – massa
M – massa molar
• Número de partículas…………………………………………………………………………………………….
n – quantidade de substância
NA – constante de Avogadro
N = nNA
m
V
• Massa volúmica……………………………………………………………………………………………………….. ρ =
m – massa
V – volume
• Concentração de solução…………………………………………………………………………………………. c =
n
V
n – quantidade de substância (soluto)
V – volume
• Grau de ionização/dissociação………………………………………………………………………………… α =
n
n0
n – quantidade de substância ionizada/dissociada
n0 – quantidade de substância dissolvida
• Frequência de uma radiação electromagnética………………………………………………………… ν =
c
λ
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 9 de 11
c – velocidade de propagação das ondas electromagnéticas no vácuo
λ – comprimento de onda no vácuo
• Energia de uma radiação electromagnética (por fotão)………………………………………….. E = hν
h – constante de Planck
ν – frequência
• Equivalência massa-energia…………………………………………………………………………………… E = mc 2
E – energia
m – massa
c – velocidade de propagação da luz no vácuo
ur
• Momento dipolar (módulo)………………………………………………………………………………….. µ = δ r
|δ| – módulo da carga parcial do dipolo
r – distância entre as cargas eléctricas
• Absorvência de solução…………………………………………………………………………………………. A = ε c l
ε – absortividade
l – percurso óptico da radiação na amostra de solução
c – concentração de solução
• Energia transferida sob a forma de calor…………………………………………………………… Q = mc ∆T
c – capacidade térmica mássica
m – massa
∆T – variação de temperatura
• Entalpia…………………………………………………………………………………………………………….. H = U + PV
U – energia interna
P – pressão
V – volume
• Equação de estado dos gases ideais…………………………………………………………………… PV = nRT
P – pressão
V – volume
n – quantidade de substância (gás)
R – constante dos gases
T – temperatura absoluta
• Conversão de temperatura (de graus Celsius para Kelvin)……………… T / K = θ / °C + 273,15
T – temperatura absoluta
θ – temperatura Celsius
{
+
−3
• Relação entre pH e a concentração de H3O+…………………… pH = −log H3O /moldm
}
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 10 de 11
Matriz da Prova de Exame 342 (Provas Escrita e Prática) / Química / Página 11 de 11
Baixar