INSTITUTO SUPERIOR DE ENGENHARIA DE LISBOA
Departamento de Engenharia Química
Licenciatura em Engenharia Química (1ºciclo)
SECÇÃO DE PROCESSOS QUÍMICOS E REACTORES
REACTORES QUÍMICOS I
Ana Maria Maia Sêco
1
Reactores Químicos I
Bibliografia
3
REACTORES QUÍMICOS
4
Introdução
4
1- REVISÃO DE NOÇÕES FUNDAMENTAIS
1.1 - Definição de Grandezas associadas à Estequiometria
5
5
1.1.1 - Coeficientes Estequiométricos
5
1.1.2 - Grau de Avanço da Reacção
7
1.1.3 - Definição de Grau de Conversão
9
1.2 - Termodinâmica Química
9
1.2.1.- Balanço energético da transformação química.
10
1.2.1.1.- Variação de entalpia associada a uma reacção química
11
1.2.1.2.- Casos de sistemas complexos R relações estequeométricas
13
1.2.2 - Equilíbrio químico
14
1.2.2.1 - Variação de entalpia livre de uma reacção química
14
1.2.2.2 - Constante de equilíbrio
15
1.2.2.4 - Efeito da Temperatura sobre a Constante de Equilíbrio
17
1.3 - A Cinética Química
18
1.3.1 - Introdução
18
1.3.2 - Cinética Química Formal
21
1.3.2.1 - Definição da Velocidade de reacção
21
1.3.2.2 - Equação da Velocidade da reacção
23
1.3.2.3 - Influência da temperatura
25
1.3.3 - Colecta e Análise de dados Cinéticos
26
Problemas
32
2 - CLASSIFICAÇÃO DOS REACTORES
41
2.1 - Principais Características de um Reactor
42
2.2 - Princípios do Projecto de Reactores Balanços Mássicos e Entálpicos
50
3 - REACTORES DESCONTÍNUOS MONOFÁSICOS
52
3.1 - Balanços mássicos e energéticos
53
3.2 - Diversas tecnologias utilizáveis
56
3.3 Optimização da produção:
57
1
Reactores Químicos I
Problemas
58
4 - REACTORES CONTÍNUOS TUBULARES
62
4.1 - Balanços Mássicos e Energéticos
63
4.2 - Exemplos de Soluções em Casos Simples
65
4.3 - Diversas Tecnologias Utilizáveis
68
4.4 - PFR com Recirculação
70
Problemas
72
5 - REACTORES CONTÍNUOS PERFEITAMENTE AGITADOS 77
5.1- Balanços Mássicos e Energéticos
77
5.2 - Associação em Série de Reactores Contínuos
82
5.3 - Diversas Tecnologias Utilizáveis
83
5.3.1 - Tanque Agitado Mecanicamente
83
5.3.2 - Tanque Munido de Agitação Exterior
84
5.4 - Exemplos de aplicação
85
Problemas
87
6 – COMPARAÇÃO DOS DIFERENTES TIPOS DE REACTORES91
Problemas
94
7 - ANEXO
98
2
Reactores Químicos I
Bibliografia
1 - F. Lemos, J. M. Lopes, F. Ramôa Ribeiro, Reactores Químicos- Colecção Ensino
da Ciência e Tecnologia, IST, 2002;
2 - Charles G. Hill, Jr., An Introduction to Chemical Engineering Kinetics & Reactor
Design - John Wiley & Sons; 1977;
3- O. Levenspiel, Chemical Reaction Engineering - John Wiley & Sons 3ª edição
(1999);
O. Levenspiel, Volume 1- Cinética Química Aplicada;
Volume 2- Cálculo de
Reactores - ed. Edgard Blucher, Ltda (1976);
4- H. Scott Fogler,
Elements of Chemical Reaction Engineering - Prentice Hall
International Editions, New Jersey 3ª edição (1999);
5- E. Bruce Nauman, Chemical Reactor Design, Optimization and Scaleup - Mc GrawHill, 2001;
6- J. Villermaux , Génie de la Reaction Chimique" - Conception et Fonctionnement des
reacteurs, Tec & Doc (1993);
7- J. M. Coulson, J. F. Richardson, Tecnologia Química – vol. III, Fundação Calouste
Gulbenkian (1982);
8 - A. M. Nunes dos Santos,
Reactores Químicos, vol I - Fundação Calouste
Gulbenkian (1990);
9- J. M. Smith , Chemical Engineering Kinetics - Mc Graw- Hill 3ª edição, 1981;
10- R. Aris, Elementary Chemical Reactor Analysis- Prentice Hall, New Jersey, 1969;
11- A. R. Cooper, G. V. Jeffreys, Chemical Kinetics and Reactor Design - Oliver and
Boyd, Edinburg (1979);
12 - G. F. Froment, K. B. Bischoff, Chemical Reactor Analysis and Design - John
Wiley, New York, 2ª edição 1990;
13- P. Trambouze, H. Van Landeghem, J. P. Wauquier, Les Reacteurs Chimiques Editions Technip (1984);
3
Reactores Químicos I
Reactores Químicos
Introdução
Os processos considerados em Engenharia Química fazem intervir, separada ou
simultaneamente, transformações físicas e químicas. Uma transformação química reacção química - é definida como sendo uma transformação em que tem lugar uma
redistribuição electrónica nos elementos que nela intervêm. Esta definição engloba os
diferentes tipos de reacções químicas, essencialmente reacções de decomposiição,
isomerização e combinação (mais comum). Há ruptura e formação de ligações
covalentes, por ex.
H 2 + I 2 → 2 HI
ou aquelas que envolvem a transferência de protões, por ex.
H + + OH - → H 2 O
ou ainda aquelas que envolvem transferência de electrões, por ex.
Zn + Cu + + → Zn + + + Cu
O reactor químico é o “coração” de um processo químico, onde ocorrem as
transformações químicas que podem ser muito variadas.
Na preparação dos reagentes, antes da entrada no reactor, assim como na
preparação dos produtos na saída do reactor, ocorrem apenas transformações físicas,
(operações unitárias) que podem ser numerosas.
No projecto de um reactor químico, o engenheiro dever escolher o tipo de reactor, o
modo e condições operacionais, funcionamento e o dimensionamento, de maneira a
obter a uma escala comercial o máximo de "lucro" dentro das restrições impostas pela
natureza das matérias primas, pelos custos dos produtos, do capital e da mão de obra,
das necessidades de segurança, de controle de poluição, de economia de energia,
etc.
4
Reactores Químicos I
Há várias escalas de estudo dos reactores:
Escala laboratorial
Escala piloto: avaliação em condições "reais" para assegurar o scale-up. Preparação
de produtos para testes comerciais. Optimização do processo.
Escala industrial: Nesta escala a experimentação é muito difícil, pois seria muito
dispendiosa e não se deve perturbar a produção. Quando o reactor não é ideal, deve
fazer-se as correcções necessárias considerando-se e calculando-se como se fosse
ideal.
1- Revisão de Noções Fundamentais
1.1 - Definição de Grandezas associadas à Estequiometria
1.1.1 - Coeficientes Estequiométricos
Para um sistema químico, envolvido numa reacção, o princípio de conservação de
massa é implicitamente enunciado quando se escrevem as relações estequiométricas
que definem a transformação química.
Assim, quando se escreve:
A + HCl → C + H 2 O
escreve-se de facto um balanço que respeita a conservação da massa. De notar que
se o número de moléculas pode variar num sistema em evolução, pois na realidade há
destruição de determinados agregados moleculares para se construirem outros, o
número de átomos fica invariável.
Por conseguinte, deve efectuar-se um balanço de massa para cada categoria de
átomos. A equação química escreve-se:
N2
+ 3 H2
(2)
(3)
→
2 NH 3
(1)
o que evidencia que uma molécula de nitrogénio reagindo com 3 moleculas
de
hidrogénio origina, caso a reacção esteja completa, 2 moléculas de amoníaco.
Então, por cada “pacote básico” contendo NA= 6,02 x 1023 (numero de Avogadro), temse que a massa de 1 mole de nitrogénio reagindo com a massa de 3 moles de
hidrogénio produz a massa de 2 moles de amoníaco, no caso de a reacção ser
completa.
5
Reactores Químicos I
Aos coeficientes que multiplicam as fórmulas moleculares de cada um dos reagentes
ou de cada um dos produtos de reacção que figuram na equação química dá-se o
nome de coeficientes estequiométricos; convencionaremos escrever as equações
químicas de tal modo que os coeficientes estequiométricos sejam números inteiros e
primos entre si, como sucedeu nesta equação. Por exemplo, a reacção do monóxido
de carbono com o oxigénio pode ser traduzida pela equação química:
CO + 1 O 2
2
→ CO 2
A qual está de acordo com a Lei de Lavoisier, mas não está conforme a convenção
estabelecida; de acordo com essa convenção, a equação química deve ser escrita sob
a forma:
2 CO + O 2 → 2 CO 2
Por outro lado, a equação poderia ser descrita sob a forma equivalente:
4 CO + 2 O 2 → 4 CO 2
de acordo com a Lei de Lavoisier mas não deve ser escrita sob esta forma pois os
coeficientes estequiométricos não são primos entre si.
Numa reacção química, dá-se o nome de sistema à mistura constituída não só pelos
reagentes e produtos de reacção mas também pelos inertes presentes na reacção, por
exemplo, numa combustão em que se use como comburente o ar atmosférico, o
nitrogénio não figura na equação química, pois não participa da reacção, mas faz parte
do sistema. Dá-se o nome de constituintes do sistema a cada um dos reagentes,
produtos de reacção ou inertes que figuram nessa reacção química e representa-se,
como anteriormente pelo símbolo genérico Ai (Ai= A1,2 3…AS), sendo AS o número
total de constituintes. Torna-se, então, cómodo atribuir um número de referência a
cada um dos constituintes do sistema o que, para aqueles que participam na reacção
química, se pode fazer figurar directamente na escrita da equação química;
Não esquecer, os números de referência, para os inertes existentes no sistema. Por
convenção, os coeficientes estequiométricos são quantidades positivas para os
produtos da reacção e quantidades negativas para os reagentes
Duma maneira geral, escreve-se uma relação estequiométrica sob a forma:
s
∑ν A
i
i
=0
i =1, S
i =1
Ai: espécie i ;
6
(1.1)
Reactores Químicos I
S : número total de espécies que participam efectivamente na reacção;
i : nº de referência da espécie Ai.
ν i : coeficiente estequiométrico do componente Ai na reacção.
ν = soma algébrica dos coeficientes estequiométricos de uma reacção química.
Assim em relação à equação:
2 CO + O 2
(2)
→
2 CO 2
(3)
(1)
o número de referência e os coeficientes estequiométricos atribuídos aos constituintes
activos (participantes na reacção) são respectivamente :
CO2 ------- 1
ν1 =+2 ;
CO ---------2
ν2 = −2 ;
O2 ----------3
ν3 = −1
ν = + 2 − 2 −1 = −1
Os coeficientes das espécies que não são produzidas nem consumidas na reacção
são nulos; p. ex. o caso dos inertes ou catalisadores, (constituinte A4).
Se um sistema durante uma transformação química for descrito por um conjunto de R
reacções simultâneas, teremos R relações:
∑ ν ij A i = 0
i =1, S;
j =1, R;
(1.2)
ν ij = coeficiente estequiométrico do componente Ai na reacção j.
1.1.2 - Grau de Avanço da Reacção
Num sistema fechado, em que ocorre uma reacção simples, o grau de extensão ou de
avanço da reacção é um parâmetro introduzido por De Donder que é definido por:
ni −nio
νi
ζ=
ζ
: grau de avanço da reacção em relação a um instante intermediário t;
nio : número inicial de moles da espécie Ai; no : número total de moles iniciais;
7
(1.3)
Reactores Químicos I
ni : número de moles da espécie Ai no instante t;
n : número total de moles no instante t;
υ
: coeficiente estequiométrico da espécie Ai.
Por definição, o valor de
ζ (ksi) é independente da espécie Ai
considerada. Diz-se
que uma reacção química avança de 1 dedonder, quando as moles de um constituinte
activo qualquer varia de uma quantidade igual ao seu coeficiente estequiométrico.
Para um sistema químico em que tem lugar a reacção
s
∑ν
i
Ai = 0
i =1, S
i =1
o valor máximo de
ζ
é consequentemente :
ζ = − nν
io
i
Num sistema caracterizado pelo desenvolvimento simultâneo de R reacções, pode
exprimir-se num balanço molar para cada espécie Ai por:
ni = nio + ∑ν ijζ j
i =1, S;
j =1, R
(1.4)
sendo cada reacção j caracterizada por um avanço ζ j .Note-se que o avanço é uma
variável extensiva, que é medida em moles.
Resumo:
Início
nio
Equilíbrio ni
n1 = n10 +ν1 ζ
n10
n20
n2 = n20 +ν2 ζ
n30
n3 = n30 + ν3 ζ
inerte=n40
n4 = n40
n = n1 + n 2 + n 3 + n 4
n0 = n10 + n20 + n30 + n40
νtotal=ν1+ν2+ ν3
n = n0 + νtotal ζ
n = moles totais ( instante ζ)
n0 = moles totais iniciais
8
Reactores Químicos I
1.1.3 - Definição de Grau de Conversão
Define-se grau de conversão de um reagente Ai ( reagente limitante) pela relação:
αi =
nio − ni
nio
(1.5)
para um sistema fechado. Exprime-se frequentemente em %:
α i (%) = 100α i
Tendo em conta a definição de avanço
αi =
(1.6)
ζ j vem:
− ∑ν ijζ j
nio
(1.7)
Notemos que a noção de conversão só faz sentido para o reagente limitante e engloba
o conjunto das reacções do sistema.
1.2 - Termodinâmica Química
A termodinâmica fornece dados importantes no projecto do reactor, nomeadamente a
energia libertada ou absorvida durante a reacção e o rendimento máximo que se
poderá obter da mesma. Assim como já tivemos oportunidade de rever os conceitos
termodinâmicos que estudam
essencialmente os fenómenos térmicos são
considerados um dos ramo da ciência de evolução mais tortuosa e complicada. A
edificação científica só foi realizada neste século (1950).
dτ p = − pdV
dQ = TdS − Adξ
Actualmente os sistemas são considerados com n+2 graus de liberdade.
As transformações reais são sempre irreversíveis, em que:
-
Os estados intermediários não são de equilíbrio;
-
Os diagramas termodinâmicos não são representáveis;
-
A equação de estado não é aplicável;
-
A produção de entropia é sempre positiva;
9
(1.8)
Reactores Químicos I
As transformações reversíveis são sempre conceptuais, não são reais.
-
Os estados intermediários são sempre de equilíbrio;
-
Os diagramas e as equações de estado são aplicáveis,
-
A produção de entropia é nula.
1.2.1.- Balanço energético da transformação química.
Primeiro Princípio da Termodinâmica em dispositivos termodinâmicos fechados (DTF)
Todos os sistemas possuem uma propriedade denominada Energia Interna U em que
U = U (V , T , ξ ) em qualquer transformação que ocorra num dispositivo termodinâmico
fechado tem-se:
∆ U = ∑ Pe
(1.9)
ou seja, a variação da energia interna é igual ao somatório das interacções entre o
sistema e o exterior através da fronteira do sistema.
∆ U = τ e + Qe + φ em
H = U+pV = U-Lp
dU=CVdθ + (l-p)dV + rTV dζ
e
(1.10)
(1.11)
dH=Cpdθ + (h-v)dp + rTp dζ
Primeiro Princípio da Termodinâmica em dispositivos termodinâmicos abertos (DTA)
∆Vg +∆Ec +∆U +∆(pV) =τnc +τap +Qe +φem
sendo:
∆U + ∆ ( pV ) = ∆H
(1.12)
(1.13)
A variação de energia dum sistema químico num estado 1 para um estado 2 é a soma
de diferentes termos de importância variável:
- a energia interna;
- a energia potencial;
- a energia cinética;
- a energia de superfície.
Durante a sua evolução para um estado 2, o sistema troca com o exterior diferentes
formas de trabalho ou interacção com o exterior:
- trabalho devido a forças não conservativas;
10
Reactores Químicos I
- trabalho devido a aparelhos de transporte (turbinas, bombas, compressores);
- quantidade de calor;
- força electromagnética.
Quando o sistema atinge o estado 2, a lei da conservação de energia escreve-se:
Energia 2 = Energia 1+ Energia fornecida ao sistema pelo exterior - Energia fornecida pelo sistema ao exterior
Na prática é mais importante e frequente considerar a variação do conteúdo
energético dum sistema em vez do seu valor absoluto, o qual necessita a escolha
duma base de referência, para a sua definição.
A variação do conteúdo energético pode resultar quer duma modificação das variáveis
intensivas (pressão, temperatura, entalpia parcial molar) ou das extensivas (volume,
entropia, número de moles).
Dum modo geral, para seguir a evolução dum sistema reaccional há a considerar dois
casos:
a) O caso em que durante a transformação há troca de calor a pressão constante ou
variação de entalpia;
b) O caso em que há troca de calor a volume constante ou variação de energia
interna.
O aumento de temperatura de um sistema pode ser obtido de diferentes maneiras:
Radiação térmica, passagem de corrente eléctrica, interacção trabalho, interacção
calor.
1.2.1.1.- Variação de entalpia associada a uma reacção química
Num sistema reaccional descrito por uma relação estequiométrica:
∑ ν i Ai = 0
(1.1)
a variação de entalpia associada a esta relação e correspondente à transformação
completa dos reagentes (νi < 0) em produtos (νi> 0) é igual a:
( ∆ HR )T = ∑ ν iH Y ( A i )
11
(1.14)
Reactores Químicos I
(∆ΗR)T é a variação de entalpia associada à reacção ocorrendo à temperatura T,
expressa, p. ex. em Joule.
Geralmente esta variação de entalpia é referida a um mole de um composto Ai. Este
calor de reacção tem assim o valor numérico:
∆H R
(1.15)
νi
HT(Ai) designa a entalpia de um mole do componente Ai à temperatura T pode ser
definida em função de (1.16) :
HT(Ai) = (∆Ηof)To(Ai) + ((∆ΗoT(Ai) - ∆ΗoTo(Ai)) + Λ ΗoT(Ai) + HTP(Ai) + ΗMT(Ai)
Onde:
(∆Ηof)To (Ai) que designa a entalpia padrão de formação da espécie Ai à temperatura
T0.
Note-se que por definição a entalpia padrão de formação dos elementos é nula a
qualquer temperatura.
∆Ηo
(Ai) - ∆Ηo
T
To
(Ai) é a variação de entalpia padrão entre a temperatura T0 e a
temperatura T, sem mudança de estado;
Λ Ηo
T
(Ai) é variação de entalpia padrão de mudança de estado (entalpia de fusão,
de sublimação, de vaporização );
Η T P (Ai) é o termo correctivo de entalpia a ter em conta, se a pressão for diferente
de 1 atm. ;
ΗM
T
(Ai) é o termo de entalpia a ter em conta, devido à contribuição da espécie Ai no
calor de mistura. É geralmente um termo de fraca importância e difícil de estimar,
sendo frequentemente omitido.
Esta forma de determinar a entalpia molar da espécie Ai‚ puramente convencional;
qualquer outro caminho termodinâmico que conduza ao mesmo estado final pode ser
considerado.
A variação de entalpia molar entre duas temperaturas T1 e T2, sem mudança de
estado, para o componente Ai, calcula-se através da variação :
12
Reactores Químicos I
]
∆H ( Ai ) TT2
1
T2
= ∫ C p ( Ai )dT
(1.17)
T1
sendo Cp(Ai) o calor específico molar do composto Ai.
A entalpia molar padrão de um composto Ai à temperatura de referência T0 é igual à
sua entalpia padrão de formação a essa temperatura.
[
]
H 0T0 ( Ai ) = ∆H 0f ( Ai ) T
(1.18)
0
e a entalpia padrão da reacção à temperatura T0 será :
(∆H )
0
R T
0
[
]
= ∑ν i H 0T0 ( Ai ) = ∑ν i ∆H 0 f ( Ai ) T
(1.19)
0
A variação de entalpia padrão com a temperatura pode ser obtida a partir de:
(
( ∆H o R )T = ∆H 0 R
)
T0
(
)
+ ∫ ∑ν i c 0 pi dT
(1.20)
com CPi calor específico da espécie i à pressão de 1 atm.
1.2.1.2.- Casos de sistemas complexos definidos por R relações estequeométricas
Consideremos um conjunto de R relações estequiométricas; cada relação j deve ser
caracterizada como anteriormente por uma entalpia de reacção:
(∆H ) = ∑ν
j T
ij H T
( Ai )
1=1,S
2= 1,R
(1.21)
Os R valores de ∆ Ηj podem ser calculados independentemente.
A Variação de entalpia correspondente à reacção j cujo estado de avanço é ξ j será :
(∆Hζ j )T = ζ j (∆H j )T = ζ j (∑νij HT ( Ai ))
e a variação global de entalpia do sistema para os avanços respectivos
ξ R,
(1.22)
ξ1, ξ2,ξ3,
das diferentes reacções será :
(∆H )T
=
∑ (∆Hζ ) = ∑ ζ
j T
j ( ∆H J )T
13
(1.23)
Reactores Químicos I
Para o caso geral da determinação da variação de entalpia entre dois estados 1 e 2 da
transformação química, pode descrever-se um ciclo termodinâmico compreendendo a
variação global de entalpia, e far-se-à
∆H
2
1
=
∑ζ
j ( ∆H j )T0
+ ∆H 10 + ∆H
2
0
(1.24)
n11,...,ns1 : número de moles da espécie A1,… ,As no estado 1
n12,...,ns2 : número de moles da espécie A1,… ,As no estado 2
nI : número de moles de inertes.
1.2.2 - Equilíbrio químico
1.2.2.1 - Variação de entalpia livre de uma reacção química
A escrita das relações estequiométricas para uma reacção nada nos diz sobre a sua
possibilidade de realização.
Para saber, se uma reacção descrita por uma relação estequiométrica é possível, é
necessário recorrer à termodinâmica, particularmente aos dados de entalpia livre G.
Uma reacção é tanto mais favorecida quanto maior é a diminuição de entalpia livre que
a acompanha.
Para um sistema químico em que tem lugar a reacção traduzida pela relação
estequiométrica:
∑ν
i
Ai = 0
(1. 1)
exprime-se a variação de entalpia livre padrão da reacção à temperatura T (entalpia
livre Padrão dos produtos - entalpia livre padrão dos reagentes) pela expressão:
( ∆ G R ) To =
o
∑ν [(∆G
i
o
f
)( Ai )
]T
(1.25)
o
para νi moles de Ai,
[
o
sendo (∆G f )( Ai )
]T é
a variação de entalpia livre padrão de formação do composto
Ai à temperatura T.
[
Nas tabelas, é pouco frequente encontrar directamente: ( ∆ G
14
o
f
)( A i )
]
Reactores Químicos I
Pelo contrário ‚ mais fácil conhecer ou estimar:
[(∆G
o
f
)( Ai )
]T o ,
[(∆H
o
f
)( Ai )
]T
(1.26)
o
e os valores de Cp0 (Ai) em função da temperatura.
A temperatura T0 de referência mais utilizada é 298 K.
Para o cálculo de ( ∆G R ) T pode então utilizar-se (1.27):
o
o
T
0
T
o
o
(∆GR )T =(∆HR )298−T(∆S0R)298+ ∫ ∑νiC (Ai)dT−T ∫ ∑νiCp (Ai)dT T
298
298
P
que pode muitas vezes simplificar-se em:
(∆GR ) T = (∆H R ) 298 − T (∆S 0 R ) 298
o
desde que
∑ν C
i
o
p
0
(1.28)
( Ai ) seja pequeno.
1.2.2.2 - Constante de equilíbrio
A equação básica para o cálculo da composição de uma mistura no equilíbrio é:
( ∆ G R o ) T = − R T ln K a
(1.29)
em que Ka é o produto das actividades de cada composto Ai, no equilíbrio, elevadas
ao respectivo coeficiente estequiométrico:
K a = π ( a ie ) ν i
(1.30)
A actividade ai é definida como:
ai =
fi
(1.31)
fi o
sendo fi a fugacidade da espécie Ai na mistura de fi
o
a fugacidade da espécie Ai no
estado de referência.
Nas expressões cinéticas que utilizaremos adiante, teremos de utilizar a constante de
equilíbrio expressa quer em termos de pressões parciais, quer de concentrações ou
de fracções molares, pelo que teremos de efectuar a transformação de Ka em Kp, Kc
ou Kx, de acordo com as necessidades.
15
Reactores Químicos I
Consideremos por exemplo o cálculo da constante de equilíbrio expressa em termos
de pressões parciais Pi.
- A pressão parcial é definida por:
Pi = P yi
sendo P a pressão total e yi a fracção molar do composto i.
- Para o gás:
ai =
fi
fi o
(1.31)
fi - fugacidade da espécie Ai na mistura gasosa (em atm.);
fio - fugacidade da espécie Ai no estado de referência;
(para um gás real o estado de referência é definido como aquele em que a fugacidade
é igual a 1 e no qual o comportamento do gás seria ideal).
- Define-se o coeficiente de fugacidade
γ
pela relação:
fi
f
= i
Pi Py i
(1.32)
- Do conjunto das definições anteriores vem:
ai=fi=
γ ipi
onde
γ
é adimensional
(1.33)
Definindo o operador K relativo a um conjunto de S valores de m por:
K (m) = π (m) νi
i =1,S
(1.34)
Pode escrever-se:
Ka = K( γ ) K(y) . PΣνi
(1.35)
Para o caso em que o comportamento dos gases é o ideal, os coeficientes de
fugacidade são iguais a 1, e o termo Kp é igual a Ka. A pressões muito elevadas o
comportamento dos gases afasta-se muito da idealidade e o termo K( γ
)
difere
substancialmente da unidade e tem um efeito significativo na composição de equilíbrio.
Os valores dos coeficientes de fugacidade têm então de ser determinados ( a partir de
gráficos ) e o termo K( γ )já poderá ser calculado.
Num sistema contendo ni moles de um gás inerte e a fracção molar de um
componente Ai é dada por yi, pelo que Ka se pode escrever na forma:
16
Reactores Químicos I
⎡
⎤
P
K a = K (γ ) (π ni ) ⎢
⎥
⎣ (n1 + n2 + n3 + ...ni + n I ) ⎦
νi
∑ν i
(1.36)
Esta equação é muito fácil para o cálculo da composição de equilíbrio de uma mistura
reaccional.
O número de moles das várias espécies no equilíbrio pode ser relacionado com os
seus valores no instante zero usando o grau de avanço da reacção. Estes valores uma
vez substituídos na equação acima conduzem a uma equação com uma só incógnita o grau de avanço da reacção.
1.2.2.3 - Caso de sistemas complexos definidos por R relações
Para cada reacção escrita isoladamente e de acordo com a sua estequiometria pode
determinar-se:
[
(∆G o j )T = ∑ν ij (∆G f )( Ai )
o
]T
(1.37)
Assim cada reacção j pode ser associada a uma variação de entalpia livre e portanto a
uma constante de equilíbrio.
Mas, quando se deseja conhecer o estado de equilíbrio do sistema tomado como um
todo, temos de resolver um sistema compreendendo simultaneamente:
- S relações lineares de balanço da forma:
nie = nio + ∑ν ijζ je
j=1,R i=1,S
(1.2)
- R relações não lineares da forma:
ν ij
K yj = π ( yie )
j=1,R i=1,S
(1.38)
com:
Yi =
ni
e
nT
nT= Σ ni + ninertes
A resolução deste sistema fornece os
(1.39)
γ je e os n e.
No entanto, o problema é bastante complexo e em muitas situações é preferível utilizar
um método de minimização de energia livre.
1.2.2.4 - Efeito da Temperatura sobre a Constante de Equilíbrio
A pressão constante:
17
Reactores Químicos I
∆Go
)
d(
( ∆ H o )T
T
)
= −(
T2
dT
(1.40)
Tendo em conta que:
( ∆G o ) T = − RT ln K a
(1.41)
Vem:
d ln K a ( ∆H o ) T
=
dT
RT 2
e
d (ln K a )
(∆H o ) T
= −
1
R
d( )
T
(1.42)
(∆Ηο)Τ é a Variação de entalpia Padrão associada à reacção correspondente à
estequiometria ΣνIAi, à temperatura T.
Representando graficamente ln Ka em ordenadas e 1/T em abcissas obtém-se uma
curva, que é normalmente assimilável a uma recta, cujo coeficiente angular
representa:
−∆H
R
em que ∆Η
ο
o
(1.43)
é a Variação média da entalpia da reacção no intervalo de temperaturas
considerado.
ο
Para reacções exotérmicas (∆Η é negativo) a constante de equilibro diminui com o
aumento da temperatura, enquanto que para reacções endotérmicas a constante de
equilíbrio aumenta com o aumento da temperatura.
1.3 - A Cinética Química
1.3.1 - Introdução
A cinética química, de um modo geral, procura caracterizar e analisar os factores que
influenciam a velocidade de uma reacção química. As leis de velocidade da
transformação constituem a cinética química. Na cinética química estudam-se as
18
Reactores Químicos I
velocidades das reacções químicas e os factores de que dependem. Entre esses
factores destacam-se a concentração, a temperatura, a pressão e as naturezas do
solvente e do substrato. Fazendo estudos sistemáticos sobre os efeitos daqueles
factores nas velocidades, é possível tirar conclusões à escala molecular, conducentes
a propor mecanismos simultaneamente simples e prováveis, capazes de permitir uma
interpretação das reacções químicas em jogo. Numa investigação cinética medem-se,
directa ou indirectamente, concentrações ao longo do tempo. Em seguida, procura-se
estabelecer uma lei que exprima a variação da velocidade com as concentrações dos
reagentes,
produtos
ou
outras
substâncias,
como
sejam
os
catalisadores,
determinando-se a ou as velocidades específicas, consoante se trate de reacções de
ordem global ou de reacções complexas.
Na engenharia química, é necessário projectar adequadamente o equipamento em
que se vão efectuar essas reacções em escala industrial. Se a reacção for
suficientemente rápida, a ponto de ser considerada em equilíbrio, o projecto ficará
mais simplificado. Só neste caso, as informações cinéticas não serão necessárias,
apenas interessa os dados termodinâmicos. Vimos nos parágrafos anteriores a forma
de expressar os balanços de massa (a estequiometria) e os balanços térmicos (ou
entálpicos), correspondentes a avanços duma transformação química envolvendo uma
ou várias reacções. Vimos também, como para uma transformação reversível, é
possível fixar o limite do avanço em função de critérios termodinâmicos. Resta-nos
estudar e definir as leis destes avanços em função do tempo de permanência dos
reagentes no reactor.
A introdução do parâmetro tempo é fundamental quando se pretende definir o volume
reacccional necessário à realização duma transformação química até um avanço
fixado previamente, ou quando se pretende definir o grau de transformação dum
conjunto de reagentes num volume reaccional determinado ao fim dum certo tempo de
contacto.
Convém estabelecer uma distinção entre a cinética química, considerada como
objecto de investigação com vista a descobrir os mecanismos íntimos da
transformação química e a cinética química, considerada como conjunto de leis de
velocidade de transformação, expressas em função de parâmetros observáveis,
mensuráveis, quantificáveis e ordenados em formas matemáticas susceptíveis de ser
introduzidas num cálculo do reactor químico. Compreender-se-à imediatamente que é
nesta segunda acepção que utilizaremos o termo.
19
Reactores Químicos I
Isto não significa obviamente um desinteresse pelo conhecimento intimo dos
fenómenos, mas permite situar a responsabilidade do investigador (do laboratório), e
do projectista do reactor (do desenvolvimento e de engenharia).
De qualquer forma é importante que possamos conhecer pelo menos as principais
características da reacção, que passamos a enumerar:
1) A natureza das fases reaccionárias e a sua localização
Num meio reaccional envolvendo várias fases, observa-se frequentemente que a
transformação química se realiza quer no seio duma delas, quer na interface entre
duas fases, quer numa delas mas na vizinhança da interface. Uma vez conhecida a
localização da reacção química, temos de criar o espaço reaccional, quer se trate dum
espaço a três dimensões (caso das reacções que se desenvolvem no seio duma fase)
ou dum espaço a duas dimensões (caso das reacções de superfície ou das reacções
que se desenvolvem no seio duma fase mas na proximidade imediata da interface).
O conhecimento prévio da localização da reacção é fundamental, sobretudo quando
tem de se extrapolar um reactor a partir dos dados do laboratório.
2) O modo de activação
Para que uma reacção se possa iniciar é necessário que o sistema reaccional seja
activado. De entre os diversos tipos de activação que podem ser utilizados os mais
importantes são a elevação da temperatura, a utilização de catalisadores, de
iniciadores, e a utilização de fontes de energia exterior (radiação UV, arco eléctrico,
ultra-sons, etc.).
O modo de activação resulta dos vários processos utilizados separadamente ou
conjuntamente:
a- Aumento da energia interna das moléculas (fornecimento de energia química,
eléctrica ou de radiação);
b- Abaixamento da barreira energética (papel dos catalisadores);
c- Utilização de espécies estranhas ao processo, actuando por arrastamento (papel
dos iniciadores).
3) As formas intermediárias activas
Os modos de activação citados atrás originam espécies fugazes: iões, radicais,
moléculas activadas, complexos, etc, a maior parte das vezes muito reactivos, que
raramente se revelam directamente, mas que desempenham um papel essencial no
20
Reactores Químicos I
reagrupamento das ligações que acompanham a passagem dos reagentes aos
produtos.
1.3.2 - Cinética Química Formal
A cinética química formal é constituída pelo conjunto das expressões matemáticas que
descrevem a velocidade dum processo de transformação química.
Estas expressões constituem a base de partida para o cálculo dos reactores químicos.
1.3.2.1 - Definição da Velocidade de reacção
Vamos começar por tratar o caso duma reacção simples tendo lugar num sistema
fechado.
Consideremos a introdução no sistema fechado de n moles de cada uma das S
espécies Ai que reagem entre si através duma reacção descrita estequiometricamente
por:
∑
ν i Ai = 0
Ao fim dum tempo de reacção t analisa-se a mistura, o que permite calcular o avanço
através da expressão:
ni = nio + νi ξ
(1.44)
Se recomeçarmos a mesma operação parando desta vez a reacção ao fim do tempo
t + ∆ t observaremos:
ni +∆ ni = nio + νi (ξ + ∆ ξ)
(1.45)
donde:
∆ ni = νi ∆ ξ
(1.46)
Fazendo tender t para zero, obtém-se sob a forma diferencial:
dni
dζ
=νi(
)
dt
dt
(1.47)
é a velocidade de aparecimento (ou de desaparecimento) da espécie Ai em função do
tempo, no sistema descontínuo e fechado que estamos a examinar; dξ/dt é uma
medida de R denominada velocidade extensiva da reacção (o termo extensivo indica
que R é referido à totalidade do volume do recinto reaccional).
21
Reactores Químicos I
No caso de reacções em fase homogénea é usual referir a velocidade de variação do
número de moles à unidade de volume da fase reaccional, obtendo-se assim:
1 dni
1 dζ
(
) =ν i (
) =ν i r
V dt
V dt
(1.48)
sendo r denominada a velocidade da reacção referida à unidade de volume de fase
reaccional, sendo frequentemente designada por velocidade intensiva ou velocidade
intrínseca da reacção. As definições de velocidade de reacção podem ser definidas
não só em relação ao volume do reactor e estão relacionadas da seguinte forma:
R=r.volumedo fluido=r´.massado sólido= r´´.superfíciesólido=r´´´volumesólido =r´´´.volume reactor
Nos sistemas homogêneos, o volume do fluido é sempre igual ao volume do reactor.
Teremos então:
dni
= ν i rV
dt
(1.49)
Notemos que o volume V ocupado pelo conjunto das moléculas que formam o meio
reaccional homogéneo pode variar durante a reacção o que tem de ser tido em conta.
Assim se definirmos a concentração molar como:
C
i
=
n
V
i
(1.50)
teremos:
I dni dC i
d (ln V )
=
+ Ci
dt
dt
V dt
(1.51)
que se simplifica em:
I dni dCi
=
V dt
dt
(1.52)
se o volume reaccional for constante.
Num sistema reaccional mais complexo, onde tenham lugar simultaneamente R
reacções independentes e caracterizadas cada uma por uma velocidade rj teremos do
mesmo modo:
dni
= ∑ ν ij ( r j V )
dt
22
(1.53)
Reactores Químicos I
Será assim possível descrever a evolução dum sistema reaccional se puder ter
acesso às diferentes expressões das velocidades rj, as quais farão intervir
eventualmente as concentrações das diferentes espécies e a temperatura, como
veremos a seguir.
1.3.2.2 - Equação da Velocidade da reacção
Duma maneira geral, para as reacções em fase homogénea a velocidade da reacção
pode escrever-se como uma função da temperatura e da composição, entre outros:
rj =
função (temperatura, composição,...)
(1.54)
ou seja:
rj
= K (T), φ (Ci)
(1.55)
onde K é a chamada constante de velocidade da reacção. Este parâmetro apresenta
um valor constante, para uma dada temperatura.
A expressão mais correntemente encontrada para a velocidade de reacção, para
sistemas homogéneos, é:
→
→S
r = Kπ (Ci )
βi
i=1
←
←S
− Kπ (Ci )
βi
i=1
(1.56)
ou:
→
→S
r = Kπ ( pi )
i=1
βi
←S
− Kπ ( pi )
←
βi
i=1
(1.57)
π designa um produto de factores
β é um expoente que afecta a concentração ou a pressão parcial e é denominado
ordem parcial em relação à espécie Ai: Este coeficiente não deve ser confundido com
o coeficiente estequiométrico;
K é a constante de velocidade já referida acima.
A soma dos coeficientes βi designa-se por ordem global da reacção:
M=
Σ βi
(1.58)
23
Reactores Químicos I
As setas sobre βi e k referem-se respectivamente à reacção no sentido directo e à
reacção no sentido inverso. Frequentemente só aparece a parte correspondente ao
sentido directo, sendo a seta omitida:
r = K (C i) β i
(1.59)
Isto significa simplesmente que, dado o valor de (∆G0 j)T ,a posição do equilíbrio está
fortemente deslocado no sentido directo e que, por conseguinte, a reacção no sentido
inverso pode ser desprezada.
No caso geral, a escrita da equação de velocidade com dois termos deve respeitar a
condição de equilíbrio termodinâmico.
O índice e suplementar indica que as concentrações Ci são as correspondentes ao
equilíbrio entre as diferentes espécies Ai. Esta condição pode exprimir-se da maneira
seguinte: se o equilíbrio for atingido, a velocidade da reacção no sentido directo
equilibrará a velocidade no sentido inverso, de tal modo que a velocidade útil da
transformação será nula (r = 0), donde:
→
→S
Kπ (Cie )
βi
i=1
←
←S
= Kπ (Cie )
βi
(1.60)
i=1
Este equilíbrio pode, por sua vez, como vimos anteriormente, será definido através da
constante de equilíbrio Kc tal que:
Kc =
S
π
i=1
( C ie ) ν i
(1.61)
então deverá necessariamente ter-se:
→
K
←
= Kc
K
e:
→
βi
−
←
β i =υ i
(1.62)
Por vezes poder ser vantajoso escrever a velocidade da reacção r da maneira
seguinte:
→
⎡
βi
−1
π
(
C
)
i
r = K⎢
→
⎢
β +ν i
⎣⎢ K cπ (C i )
→
24
⎤
⎥
⎥
⎦⎥
(1.63)
Reactores Químicos I
1.3.2.3 - Influência da temperatura
As constantes de velocidade cujas unidades dependem das ordens da reacção,
variam em primeira aproximação com a temperatura segundo a lei de Arrhenius:
→
→
K = K o exp(
−E
)
RT
(1.64)
ou:
→
→
d (ln K ) − E
=
1
R
d( )
T
(1.65)
expressão conhecida da termodinâmica com o nome de equação de ClapeyronClasius.
→
E : energia de activação da reacção considerada no sentido directo;
R: constante dos gases perfeitos;
T: temperatura absoluta;
→
k0: factor de frequência (com as dimensões de K ).
Para a reacção inversa poderia escrever-se uma relação idêntica:
Daí resulta que:
→
K
KC = ←
⎡ ← →⎤
K exp ⎢( E − E ⎥
⎣
⎦
RT
(1.66)
ou:
←
→
d (ln K C ( E − E )
=
R
⎛1⎞
d⎜ ⎟
⎝T ⎠
(1.67)
donde se conclui que:
→
←
∆H R = E − E
25
(1.68)
Reactores Químicos I
Muitas vezes é preferível utilizar a relação de Arrhenius numa forma diferente,
escolhendo uma temperatura de referência T0:
⎡
⎤
⎢
⎥
E
⎢
⎥
K T = K To exp
⎢ R( 1 − 1 ) ⎥
⎢ T T ⎥
o
⎣
⎦
(1.69)
T0 é a temperatura da reacção em estudo, ou a temperatura de entrada no reactor, ou
no início da reacção, ou ainda a temperatura média do fluído de arrefecimento, etc.
1.3.3 - Colecta e Análise de dados Cinéticos
- O método integral testa uma equação de velocidade específica, integrando e
comparando os valores teóricos e experimentais. A equação da velocidade é sempre
sugerido por um mecanismo hipotético. Este método não é adequado para investigar a
equação empírica que melhor se ajusta aos dados experimentais A relação entre a
derivada em relação ao tempo da concentração de um reagente e as concentrações
das espécies presentes pode ser expressa sob a forma:
−
d[C A ]
α
β
γ
= k[C A ] [C B ] [C C ]
dt
(1.70)
k - Constante de velocidade
α − Ordem parcial em relação a A
β- Ordem parcial em relação a B
γ− Ordem parcial em relação a C
É o método mais usual para a determinação da ordem da reacção é o da integração
da equação, arbitrando-se uma ordem determinada para a reacção, obtendo-se assim
uma expressão das concentrações em função do tempo, este processo repete-se até
se obter uma expressão integrada que se ajuste aos dados experimentais é o Método
de Tentativas. Para uma reacção de ordem n r = kC A , usando a forma integrada,
n
obtém-se:
1− n
CA
− C Ao
n −1
1− n
= −ν A Kt
(1.71)
- O tempo de meia vida é o tempo necessário para que a concentração inicial de um
reagente se reduza a metade, este método requer uma série de experiências, cada
26
Reactores Químicos I
uma com diferentes concentrações iniciais. Para uma reacção de ordem n
r = kCA
n
usando a forma integrada, obtém-se um tempo de meia vida t1/2
t1 / 2
−n
(2n −1 − 1)C1AO
=
k (n − 1)
(1.72)
Utilizando o logaritmo para ambos os membros da equação:
⎡ 2n−1 −1 ⎤
lnt1/ 2 = ln⎢
⎥ + (1− n) lnCAO
⎣ k(n −1) ⎦
(1.73)
declive = 1 -n
ln t1/2
ordem <1
ordem > 1
ordem = 1
ln Cao
Fig.1. Variação do tempo de meia vida com a concentração inicial para diferentes
ordens da reacção (n)
−
Ο Método diferencial, o método das concentrações em excesso e o método das
velocidades iniciais, também são utilzados para determinação de ordens da reacção.
27
Reactores Químicos I
Equação
Equação da Condições
Forma integrada
Química
velocidade
iniciais
ν AA → P
r=K (zero)
CAo
C A = C Ao + ν A K ⋅ t
(1)
ν AA → P
r=KCA (um)
CAo
C A = C Ao ⋅ eν a ⋅K ⋅t
(2)
ν AA → P
r=KCAn
CAo
1
CA
ν A A + ν B B → P r=KCACB
ν AC AO ≠ ν BCBO
A + B + D → P r=KCACBCD
CAO ≠ CBO = CDO
n −1
−
1
C AO
n −1
= −ν a ⋅ (n − 1) ⋅ K ⋅ t
(3)
1
C (C + ν Bξ )
ln AO BO
= Kt
ν BC AO − ν ACBO CBO (C AO + ν Aξ )
K ×t =
CAO − ξ
C −ξ
C −ξ ⎤
1⎡
+ (COo − CAo) ln BO
+ (CAO − CBO) ln Do ⎥
⎢(CBO − CDO) ln
CAO
CBO
Ω ⎣⎢
CDO ⎦⎥
Ω = (C AO − C BO )(C AO − C DO )(C Do − C AO )
A + B + D → P r=KCACBCD
CAO =CBO =CDO
1
1
−
= −ν a ⋅ 2 ⋅ K ⋅ t
2
2
CA
C AO
ν A A ↔ν BB
r=K1CA –K2CB
CAo, CBO
⎡ ( K C − K 2C BO ) + (ν a K1 + ν b K 2 )ξ ⎤
ln ⎢ 1 AO
⎥ = (ν a K1 + ν B K 2 ) ⋅ t
( K1C AO − K 2C BO )
⎣
⎦
A+ B↔ D+ E
r=K1CACB
- K2CD CE
- CAo,
CBO,
CDo, CEO
⎡
⎤
⎢ 2ϕ ⋅ ξ ⎥ + 1
1 ⎥
⎢
1
⎢⎣ ( β − q 2 ⎥⎦
ln
= q2 ⋅t
⎡
⎤
⎢ 2ϕ ⋅ ξ ⎥ + 1
1 ⎥
⎢
⎢⎣ β + q 2 ⎥⎦
α = K1 C AO − C BO −
n=3
q = β 2 − 4α ⋅ ϕ
K=
K1
K2
1
C DO C EO
K
β = − K1 (C AO + C BO ) +
1
(C DO + C EO )
K
Tab 1.2. Forma integrada de algumas velocidade da reacção a volume constante.
28
(3)
ϕ = K1 (1 −
1
)
K
Reactores Químicos I
1.3.4 - Princípios gerais
A configuração de um reactor para uma certa reacção química é de extrema
importância e pode ser projectado num reactor de leito fixo, leito fluidizado, leito móvel,
perfeitamente agitado ou reactor de transporte pneumático.
O reactor assim como outro aparelho da indústria química deve ser formulado
correctamente:
1 - Equações de conservação (massa, energia, quantidade de movimento).
2 - Leis cinéticas de transporte e de reacção química
3 - Condições iniciais e aos limites
4 - Leis de equilíbrio estático
5 - Princípio de optimização a partir de considerações várias: energéticas, de
produção, etc.
1) Princípios de conservação das extensidades:
Exprimem a conservação da massa, energia, quantidade de movimento e carga
eléctrica. Deve-se a Damkohler o trabalho pioneiro de formulação matemática dum
reactor químico;
A_____> Produtos
No caso simples duma reacção
e dum fluido newtoniano, as equações de conservação escrevem-se:
→
→
Massa:
− r = div ( u c A − D
Energia:
r ∆ H = div ( →
cA) +
grad
→
u ρ c p T − gradT
)+
∂C A
∂t
(1.70)
(1.71)
∂ (ρ c p T )
∂t
Quantidade de movimento:
→
gradp − η ( ∇
→
→
∂
1
→
u + graddivu ) + ρ ∂ut + ρ (u grad ) u = 0
3
→
2
→
(1.72)
Para estabelecer a equação de conservação duma extensidade, consideremos um
elemento de volume de dimensões dx, dy, dz; sendo γx dy dz o débito de extensidade que
29
Reactores Químicos I
entra através da face de área dy dz situada à abcissa x e estendendo o raciocínio a
todas as faces do elemento resulta (1.73) que:
(γx-γx+dx)dydz+(γy-γy+dy)dxdz+(γz -γz+dz)dx dy = r dx dy dz +
∂g
dxdydz
∂t
onde g é a densidade volúmica de extensidade e r é a velocidade de desaparição por
reacção química.
2) Leis de equilíbrio estático:
São expressões do 1º Princípio da Termodinâmica; no caso do equilíbrio físicoquímico, traduzem a igualdade dos potenciais químicos de cada constituinte em cada
uma das fases em presença Impõem em todo o caso os “limites” das transformações
químicas.
3) Leis cinéticas de transporte e leis capacitivas:
Estas leis exprimem o sentido e a velocidade de evolução dum sistema; é o caso da
velocidade duma reacção química, das velocidades de transporte de extensidades,
etc. São bem conhecidas as leis lineares de transporte de extrensidade em meios
imóveis e tranquilos, relativas aos processos de transporte de massa por difusão
molecular (lei de Fick), transferência de calor (lei de Fourier) e transporte de carga
eléctrica (lei de Ohm).
Lei de Fick:
ϕM = −D
Lei de Fourier
ϕ q = −λ
i=
Lei de Ohm :
∂c
∂x
∂T
∂x
− I ∂V
R ∂x
(1.74)
(1.75)
(1.76)
Como exemplos de leis lineares de transporte citamos ainda a lei de Newton para o
transporte de quantidade de movimento :
λ = −η
e a lei de Darcy
∂u
y
∂x
ρu = − B
(1.77)
∂P
∂x
(1.78)
que rege o escoamento dum fluido em regime laminar, através de um meio poroso.
30
Reactores Químicos I
Podemos, pois, escrever que as expressões das leis lineares de transporte é, na forma
→
ϕ
geral:
= −λ
→
g ra d V
(1.79)
Na equação anterior, γ é o fluxo de extensidade (mole/cm2 ) , λ é a condutibilidade do
meio (coeficiente de difusão, condutibilidde térmica, etc) e V o potencial
(concentração, temperatura,..). Por outro lado, a concentração ou densidade volúmica
de extensidade pode, em primeira aproximação, relacionar-se com o valor local de
potencial por meio duma lei linear:
g = c.V
(1.80)
Esta é a expressão geral da lei capacitiva linear, onde c é a capacidade do meio. Um
exemplo de relação capacitiva é a equação de estado dum fluido.
Combinando as duas equações anteriores e pondo
D=
λ
c
(difusividade do meio com dimensões L2 T-1) obtém-se
→
ϕ = − D grad g
(1.81)
31
Reactores Químicos I
Problemas
Revisão de Noções Fundamentais
1- Sabendo que entram num ractor descontínuo, 150 mol de N2 e 240 mol de H2
N2 + 3H2
_________
> 2NH3
a- Qual o reagente limitante e o reagente em excesso?
b- A composição molar, volumétrica e ponderal da mistura reaccional na saída do
reactor, para um grau de avanço de 130 mol.
c- Qual o valor máximo do grau de avanço da reacção?
2- Numa mistura de N2, H2 e gases inertes, a relação inicial entre as fracções molares
de N2 e H2‚ de 1:3α e a fracção molar dos gases inertes é δ. Em virtude da reacção do
N2 com o H2 há formação de amoníaco. Mostrar que quando a fracção molar de
amoniaco for z, as fracções molares de N2 e H2 são respectivamente:
x n2 = X
0
n2
( 1 − b 1 Z ) x H2 = X
b1 =
0
H2
(1 − b2 Z )
3α − 1 + 2 δ
2 (1 − δ )
3- Um reactor é alimentado com 12% de SO2 e o restante ar estando à pressão de
1485 kPa e à temperatura de 227ºC
2SO2+ O2
_________
> 2SO3
a- Quais são os valores das concentrações dos reagentes?
b-
% molares da mistura reaccional para 80% de conversão.
c- Represente, gráficamente a variação da concentração dos constituintes
SO2 e SO3 em função do grau de avanço da reacção.
d- Qual o valor máximo do grau de avanço da reacção?
32
Reactores Químicos I
4 - Considere as seguintes reacções simultâneas:
N2 + 3H2
_________
> 2NH3
H2 + CO2_________> CO + H2O
(a)
(b)
No reactor são alimentados 550 mol, contendo inicialmente 67,4 % H2, 21,3 % N2 e o
restante CO2. A mistura na saída tem 16 % NH3 e 5 % H2O (percentagens molares).
a- Calcule os grau de avanço das reacções (a) e (b), .
b- Densidade (PTN ) da mistura na saída do reactor.
5 – O reactor é alimentado continuamente com uma mistura de 200 mol/h de metano e
50 mol/h de etano, o ar entra com 4500 mol/h, sabendo que os graus de avanço das
reacções são respectivamente 100 e 20 mol/h, calcule as massas volúmicas na saída
do reactor em g/dm3 (condições standard e PTN ).
6 - Para descrever cinéticamente a formação do HBr a partir de Br2 e H2 foi proposto o
seguinte sistema de equações simultâneas:
2 Br __________> Br2
Br + H2
__________
> HBr + H
H + Br2 __________> HBr + Br
H + HBr __________> H2 + Br
Br2 __________> 2 Br
determine das cinco equações apresentadas, quantas são combinações lineares das
primeiras.
7 - Determine a entalpia da reacção no estado padrão, sabendo que entram 30 mol de
metano por cada 120 mol de água e o grau de conversão é de 85%:
CH4 (g) + H2O (g) ___________> CO (g) + 3 H2 (g)
8 - O óxido de etileno é produzido por oxidação directa com ar usando um catalisador
(prata sobre um suporte conveniente). Suponha que a alimentação entra num reactor
33
Reactores Químicos I
tubular a 200 ºC e que contém 10 % de etileno e 90 % de ar (%s molares). Se a
temperatura à saída não exceder 260 ºC, é possível converter 60 % do etileno a óxido,
embora 40 % seja também completamente queimado a dióxido de carbono. Que
quantidade de energia deve ser removida do reactor, por mol de alimentação do
etileno, de forma a não exceder a temperatura limite? (∆Ho f)oxido = -12,58 Kcal/mol
Cp oxido = 17,95+ 3,43.10-2T + 3,51.10-4T2 -4,78.10-7T3 + 1,9.10-10T4
(J/(mol.K)
9-Calcule a composição de equilíbrio de uma mistura com as seguintes espécies
químicas:
espécie
N2
H2O
C2H4
% molar
15,0
60,0
25,0
A reacção é a seguinte:
H2O (g) + C2H4 (g) _________> C2H5OH (g)
Utilize os calores de entalpia padrão e energia livre padrão a 298 K. A mistura é
mantida à temperatura constante de 527 K e a uma pressão de 264,2 atm. Admita
desprezável a variação de entalpia padrão com a temperatura.
10 –Num reactor ocorre a seguinte reacção em fase gasosa à temperatura de 600K e
pressão de 1 atm, sendo a alimentação em quantidades equimolares.
H2 + CO2_________> CO + H2O
Sabendo que a constante de equilíbrio Kp a 600 K é igual a 3,4.10-2 . Calcule o grau de
conversão e determine a composição da mistura à saída do reactor .
11 - Para a reacção
2A__________> B + C
a constante de equilíbrio Kp a 560 K e a 1 atm, é igual a 9,9.10-2 atm.
Determine a conversão e o grau de avanço sabendo que a alimentação é de 150 mol,
a- no caso de o reagente ser puro;
b- de estar presente vapor de água como inerte na razão de 10 /1.
12 - O butadieno pode ser produzido pela desidrogenação do buteno, segundo o
esquema reaccional:
C4H8__________> H2 + C4H6
34
Reactores Químicos I
Para moderar os efeitos térmicos associados com a reacção são geralmente
introduzidas grandes quantidades de vapor de água com a alimentação. Se se atingir
o equilíbrio termodinâmico, calcule a composição da corrente efluente (que deixa o
reactor)..A temperatura do efluente é 800 K, pressão do efluente é de 1 atm,
a
composição da corrente 54 % vapor de água e o restante buteno
T=800K
∆Go KJ/mol)
∆Ho KJ/mol)
Água
-203,66
-246,53
Buteno
207,04
-21,56
Butadieno
228,10
97,34
tabela da energia livre padrão e entalpia livre padrão das espécies a 800 K.
13 - Calcule a composição de equilíbrio de uma mistura com as seguintes espécies
químicas:
N2 15,0% ;H2O 50,0%; C2H4 35,0%
(% molar)
A mistura é mantida à temperatura constante de 527 K e a uma pressão de 264,2 atm.
Admita desprezável a variação de entalpia padrão com a temperatura. A reacção é a
seguinte:
H2O (g) + C2H4 (g) _________> C2H5OH (g)
Utilize os calores de entalpia padrão e energia livre padrão a 298 K.
∆Go
∆Ho
TC
PC
Kcal/mol
Kcal/mol
(K)
(atm)
água
-54,64
-57,8
647
218,3
eteno
16,28
12,5
283,1
50,5
alcool
-40,13
-56,0
516,3
63
T=298K
14 - O metanol é preparado cataliticamente a partir de uma mistura de monóxido de
carbono e hidrogénio (gás de síntese):
CO + 2H2__________> CH3OH
À entrada do reactor dispõe-se de uma mistura estequiométrica de CO e H2 a 200 atm
e 275ºC. Determinar a composição da mistura à saída do reactor, se for atingido o
equilibrio.
35
Reactores Químicos I
Dados: CO
∆Ηf 298 K
= -26,4157 Kcal.mol-1
Tc= 133 K Pc= 34,5 atm
∆Gf 298 K = -32,81 Kcal.mol-1
CH3OH ∆Ηf 298 K = -48,05 Kcal.mol-1
Tc= 513,2 K Pc= 78,5 atm
∆Gf 298 = -38,31 Kcal.mol-1
H2
∆Ηf 298 K = 0
Kcal.mol-1
Tc= 33,3 K Pc= 12,8 atm
15 - Considere um sistema inicialmente constituído por 150 mol de CO e 35 mol de H2
a 1020 K. A pressão do sistema é 25 atm. As seguintes reacções podem ser
consideradas:
2 CO + 2 H2 _________> CH4 + CO2
CO + 3 H2
_________
CO2 + H2
_________
> CH4 + H2O
> H2O + CO
(a)
(b)
(c)
As constantes de equilíbrio em termos das pressões parciais para as reacções a e b
são respectivamente:
Kp,a = 0,046 atm -2
Kp, b = 0,034 atm -2
Calcule os graus de avanço e determine a composição de equilíbrio da mistura
reaccional.
16- Considere a reacção irreversível:
ν A A ________>ν P P
realizada a volume e temperatura constantes, sendo CAO a concentração inicial de A, e
o respectivo coeficiente estequimétricoν A=-1. Verifique a evolução da concentração,
CA, da espécie A em função do tempo t:
a - reacção ordem zero
b - reacção ordem um
CA = CA0 – K t
CA = CA0 e-kt ou ln
C Ao
= Kt
CA
c –Calcule os tempos de meia vida, para ambas as ordens da reacção.
36
Reactores Químicos I
N2O5 ________> N2O4 + 1/2 O2
17 – Considere para a reacção:
os seguintes valores da constante de velocidade é K, em função da temperatura:
T (K)
288
298
K (s-1) 1,04.10-5
313
3,38.10-5
323
2,47.10-4
328
7,59.10-4
4,87.10-3
Se a constante de velocidade seguir a Lei de Arrhenius, determine os valores de Ko
em s-1 (factor pré-exponencial e de E (energia de activação).
18 – Num reactor descontínuo, a decomposição térmica do dimetiléter foi estudada
pelo método estático a 305ºC, acompanhando a variação da pressão total, tendo-se
obtido os seguintes resultados:
Tempo s
0
390
777
1195
3155
>105
P mmHg
312
408
488
562
779
931
Admitindo que inicialmente estava apenas presente o éter na mistura reagente, e
sabendo que a equação é traduzida por:
(CH3)2 O__________> CH4 + H2 + CO
Verificar se a reacção é de 1ª ordem, e determinar a constante cinética da reacção
utilizando o método das tentativas.
19 – Num reactor descontínuo, 500 ml de 2M de óxido de etileno (A) forma misturados
com 500 ml de água
(B) contendo 0,9% de ácido sulfúrico (utilizado como
catalisador). O produto da reacção é etileno glicol (P):
Tempo
0
0,5
1,0
0
0,145 0,27
A+B_________> P
1,5
2,0
3,0
4,0
6,0
10,0
0,376
0,447
0,610
0,715
0,848
0,957
(min)
CP M
Verifique se a reacção é de 1ª ordem, a constante cinética é igual a 0,31min1.
Represente gráficamente a evolução do grau de avanço com o tempo.
20 - Os dois tipos principais de reacções irreversíveis de segunda ordem são:
Tipo I : ν AA +ν
B
Tipo II : ν AA +ν
B ________>ν
B
P
B ________>ν
P
P
37
P
r = KCA2
se A limitante
r = KCACB
Reactores Químicos I
Calcule os tempos de meia vida e verifique que as variações de CA em relação ao
tempo para sistemas de volume e temperaturas constantes, serão:
1
1
−
= −ν A Kt
C A C A0
a- Tipo I
⎡ (CB C Ao ) ⎤
ln⎢
⎥ = (C A oν B − CBo ν A ) Kt
C
C
⎢⎣ A Bo ⎥⎦
b- Tipo II
21 – Num reactor descontínuo, não se conhece a cinética da seguinte reacção:
A __________> P,
mas foram obtidos os seguintes resultados:
Tempo s
o
20
40
60
120
180
300
Concentração M
10
8
6
5
3
2
1
a- Com base no método integral, justifique se a ordem n é diferente de zero, um e
dois.
b- Com base no método diferencial, verifique se a ordem da reacção n é igual a
1,43 e calcule K.
22 - A reacção entre o dibromoetileno e o iodeto de potássio em em metanol a 99% :
C2H4Br2 + 3 KI __________> C2H4 + 2 KBr + KI3
foi investigada cinéticamente a 59,7ºC tendo se obtido os seguintes resultados:
concentração inicial de KI
= 0,1531 Kmol.m-3
concentração inicial de C2H4Br2 = 0,0286 Kmol.m-3
Tempo
Ks
Conversão C2H4Br2
29,7
40,5
47,7
55,8
62,1
0,2863
0,363
0,4099
0,4572
0,489
72,9
83,7
0,5396 0,5795
Demonstre que a equação é de 2ª ordem e determine a constante cinética da reacção.
23 –Foi estudada, a decomposição do óxido nitroso em fase gasosa à temperatura de
1030 K num reactor (volume constante).Os dados experimentais são:
38
Reactores Químicos I
P0 mmHg
82,5
139
290
360
t 1/2
860
470
255
212
Consistente com estes resultados, verifique se a equação da velocidade n=1,934 e o
valor numérico da constante cinética igual a 0,596.
24 - A reacção A
⇔
B é de primeira ordem reversível e a constante de equilíbrio
apresenta os valores de Keq = 12,6 e 11,9 para as temperaturas de 591 e 615 K,
respectivamente.
Experiências laboratoriais realizadas a 574 K , A
puro originaram os seguintes
resultados:
tempo (s)
conversão
1008
1140
3624
1800
1542
1896
0,226
0,241 0,598
0,36
0,307
0,371
a) Verifique que estes resultados se ajustam à lei de velocidade proposta.
b) Calcule o valor das constantes de velocidade da reacção directa e inversa.
25 – Confirme e interprete os resultados da tabela abaixo, sabendo que a reacção de
1ª ordem reversível e ocorre num reactor tubular adiabático:
nC4H10
⇔ iCH
4
10
A temperatura de alimentação é de 330 e K1 é a constante cinética no sentido directo.
∆ΗR= -6900 J/mol E= 65,7 KJ/mol. Keq= 3,03 a T2=333K CA0=9,3 M Ko=31,1 h-1
X
T (K)
K1 (h-1)
Keq
Xeq
r mol/dm3.h
0
330
4,22
3,1
0,76
39,2
0,2
338,7
7,76
2,9
0,74
52,8
0,4
347,3
13,93
2,73
0,73
58,6
0,6
356,0
24,27
2,57
0,72
37,7
0,65
358,1
27,74
2,54 0,715
24,5
0,7
360,3
31,67
2,5
4,1
39
0,71
Reactores Químicos I
K eq = 3,03 × e
−6900
1 1
×(
− )
8, 31 333 T
e
K1 = 31,1 × e
−65700
1 1
×(
− )
8, 31
360 T
26 - Faça o estudo matemático que permite obter a equação cinética para o sistema:
A + B __________> C
(1)
A + D __________> E
(2)
Verifique que no caso das reacções serem de primeira ordem em relação aos
componentes B e D e de ordem zero em relação ao reagente A se obtém:
ln(
CB
K
C
) = 1 ln( D )
C Bo
K2
C Do
27- A cloração de um álcool A e de um álcool B em fase líquida apresenta a seguinte
estequiometria:
A + HCl__________> C + H2O
(1)
B + HCl__________> D + H2O
(2)
Em que C e D são os produtos clorados. As expressões das velocidades de
desaparecimento de A, (-RA) e de B (-RB) são:
(-RA) = K1 CA CHCl
K1 = 1,6.10-3 (dm3/(mol.min)
(-RB) = K2 CB CHCl
K2 = 1,9.10-3 (dm3/(mol.min)
Sabendo que a alimentação é constituída por uma mistura com concentração de HCl
de 44 M e a correspondente à concentração de A e de B é de 32 M e as
concentrações de C e D são nulas .
a- Demonstre que
ln(
CB
K
C
) = 2 ln( A )
C B0
K1
C A0
b- calcule as concentrações das espécies C e D no instante em que 45% de A foi
consumido por a reacção. Despreze a variação de volume do sistema.
40
Reactores Químicos I
2 - Classificação dos Reactores
O reactor químico é um equipamento onde ocorre uma reacção química, quer dizer,
onde determinadas espécies moleculares são transformadas noutras espécies
moleculares. No reactor, o fluido reaccional pode ser aquecido ou arrefecido e pode
também permutar massa e/ou calor com uma fase estagnante.
O reactor químico constitui assim o "coração das unidades de fabricação de produtos
químicos, encontrando-se quer em refinarias, complexos metalúrgicos ou nas mais
variadas fábricas de produtos químicos. Nestas unidades industriais, o reactor está
geralmente rodeado doutros equipamentos colocados a montante e a jusante,
destinados a tratamentos físicos das matérias primas e dos produtos da reacção. Os
reactores fazem também parte do equipamento utilizado na luta contra a poluição para
tratar por via química ou biológica um certo número de efluentes.
Os equipamentos utilizados para a realização das transformações químicas
apresentam uma grande diversidade de formas e dimensões. De facto, encontram-se
nas unidades industriais fornos, caldeiras, tanques, colunas, balões, misturadores, ou
simples tubos. Deste modo, poder-se-ia ser levado a pôr de parte qualquer tentativa
de classificação dos reactores químicos, pensando que cada aparelho encontrado na
prática constituía um caso particular.
Todos estes aparelhos têm contudo em comum o facto da sua função ser a de realizar
uma transformação química. No projecto de qualquer reactor químico, há a considerar
os dois aspectos complementares de ciência e de arte. A intervenção de forma
crescente do aspecto “ciência” permite não só esclarecer erros desnecessários como
também abrir perspectivas para atingir os objectivos com menos dinheiro e tempo.
41
Reactores Químicos I
Portanto, referindo-nos às características principais duma reacção química devemos
ser capazes de definir um certo número de critérios que sirvam de base a uma
classificação.
No projecto do reactor é necessário:
- Recolha de dados químicos e físico-químicos para a caracterização da reacção, ou
seja, dados termodinâmicos e cinéticos das reacções desejadas e das reacções
secundárias obtidas quer teórica ou experimentalmente;
-
Influência do tipo de escoamento, mistura, transferência de calor;
-
Mecanismo controlador do sistema reaccional (cinético, transferência de massa ou
de calor)
-
Tipo de reactor;
-
Condições operatórias (grau de selecção, selectividade e rendimento), controlo da
reacção e estabilidade dos produtos finais obtidos;
-
Selecção dos materiais;
-
Projecto mecânico;
-
Aspectos económicos (custo de capital, custo de produção).
2.1 - Principais Características de um Reactor
Dentro das diversas características duma transformação química, tomemos, para
servir de base à nossa classificação, a mais evidente à escala macroscópica, i.e., a
natureza das fases em presença.
Deste modo uma primeira distinção entre os diversos casos será:
- Sistemas monofásicos ou homogéneos
O meio reaccional é constituído por uma única fase, gasosa ou uma fase líquida.
Neste caso os reactores são ditos do tipo homogéneo.
- Sistemas polifásicos ou heterogéneos
Podem ser considerados inúmeras combinações:
Gás + líquido; Líquido + líquido; Gás + sólido; Líquido + sólido; Gás + líquido + sólido
ou duma forma mais geral:
Fluidos + sólidos,
42
Reactores Químicos I
Exige assim a presença de, pelo menos, duas fases para ocorrer numa certa
velocidade. Não importa se a reacção ocorre na interface, se os reagentes e produtos
se distribuem entre as fases ou se estão contidas numa única fase. De uma forma ou
outra, serão necessários duas fases para que se dê a reacção.
A tab. 1 mostra a classificação das reacções químicas, de acordo com o critério visto e
com alguns exemplos de reacções típicas para cada caso.
Não catalíticas
Homogêneas
Catalíticas
Grande parte das reacções Grande parte das reacções fase
fase gasosa
líquida
Reacções rápidas queima
Reacções sistemas coloidais
Queima coque
Reacções
e
microbianas
Ustulação minérios
Heterogêneas
enzimáticas
Ataque de sólidos por ácidos
Absorção gás-líquido reacção
Redução minério de ferro
Síntese do NH3
Oxidação NH3 produção HNO3
Craqueamento do crude
Oxidação SO2 a SO3
Tabela1 - Classificação das reacções químicas em projecto de reactores
As reacções podem ser simples ou múltiplas, sendo que estas últimas podem ser
realizadas em reacções em série ou em reacções em paralelo. A chave para o
estabelecimento do projecto óptimo está na operação de contacto dos reagentes e no
sistema de escoamento dos fluidos no interior do reactor. Esses aspectos podem ser
determinados pela estequiometria,
pela cinética da reacção, forma de contacto e
temperaturara, concentração, para se obter alto rendimento do produto desejado.
A forma de estabelecer contacto entre os reagentes poderá ser escolhida pelo uso de
diferentes tipos de unidades, com entrada ráida ou lenta das diversas alimentações.
Assim, um segundo critério de classificação diz respeito ao modo de exploração do
processo químico.
Quanto a este critério os reactores podem ser basicamente de três tipos:
- reactor descontinuo ou por partidas
- reactor contínuo
- reactor semi-descontínuo ou semi-contínuo
43
Reactores Químicos I
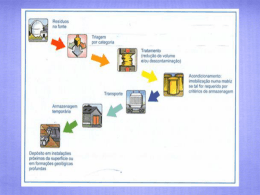
Trabalhar em descontínuo ou intermitente (batch reactor) (fig.2.1.), é uma operação
em estado não estacionário, cuja composição varia com o tempo, todavia, num
instante qualquer, a composição ao longo do reactor é constante. Descontínuo,
significa alimentar os reagentes no reactor e deixar a transformação química
desenvolver-se em função do tempo. Classificam-se por vezes estes aparelhos de
sistemas fechados, porque durante o tempo em que decorre a transformação não há
entrada ou saída de matéria do sistema.
Reagentes
produtos da Reacção
carga dos reagentes
descarga dos produtos
Figura 2.1. Operação descontínua - esquema das diversas fases
No reactor descontínuo, os reagentes entram no reactor, são misturados e aí
permanecem durante um certo período, no qual ocorre a reacção. A mistura resultante
é então descarregada.
44
Reactores Químicos I
Figura 2.2 - Variação da concentração do reagente de uma reacção simples num
reactor descontínuo.
Nos reactores há diferentes tipos de agitação podendo ser do tipo hélice, turbina,
âncora e de borbulhamento.
No reactor ideal a agitação é perfeita, e a concentração à entrada é diferente da
concentração no reactor.
Os reactores tanques descontínuos são usados na indústria química para a produção
de quantidades limitadas de material principalmente nos casos em que os custos de
mão de obra representam uma fracção mínima do custo final. São assim produtos
caros como os utilizados na indústria farmacêutica, cosmética, etc.
As hipótese básicas do chamado modelo ideal do reactor tanque descontínuo são:
1. o grau de agitação no reactor é
tal que a massa reaccional pode, em cada
instante, ser considerada como uniforme - as propriedades do sistema não
dependem da posição. Nestas condições a equação da continuidade integrada em
45
Reactores Químicos I
relação ao volume da massa reaccional conduz a que a massa da mistura
reaccional seja constante, o que exprime o facto que o reactor trabalha sem trocar
massa com o exterior (descontínuo). Normalmente, é feita a hipótese adicional de
que o reactor é isotérmico, isto é, a temperatura da massa reaccional é constante
no tempo. Por sua vez o volume da mistura reaccional pode variar com a
progressão da reacção. Uma variante do sistema descontínuo é realizada quando
parte dos reagentes é introduzida ao longo do processo, enquanto que a descarga
dos produtos se faz apenas quando terminada a reacção. Este modo de operação
é classificado por semi-contínuo.
Encontram-se também casos em que os reagentes são carregados no início da
operação havendo uma purga contínua de um ou mais produtos da reacção. (fig.2.3).
alimentação
reacção com possibilidade de
saída dos produtos
entrada de outro reagente
Figura 2.3. Operação semi-contínua - esquema das diversas fases
Por sua vez, os sistemas contínuos, classificados de sistemas abertos, são providos
duma ou várias entradas para introduzir os reagentes e duma ou várias saídas para
evacuação dos produtos da transformação.
Duma maneira geral, pode caracterizar-se os dois modos de operação definidos atràs,
pelo facto do sistema descontínuo operar duma forma não estacionária (transiente),
46
Reactores Químicos I
enquanto que o sistema contínuo é geralmente concebido para trabalhar em regime
estacionário (“steady-state”)
Numa operação contínua, há a considerar no interior do reactor um percurso para as
diversas fases desde os seus pontos de entrada até aos pontos de saída. Este
escoamento interno pode revestir várias formas dependendo da estrutura do
equipamento. Dois tipos de escoamento para modelos ideais são considerados em
teoria:
- o escoamento tipo pistão ou reactor tubular (plug flow), tal como o que é
realizado quando se faz circular a grande velocidade um fluido pouco viscoso num
tubo; sem retorno e sem mistura (unmixed flow reactor):
- o escoamento através dum recipiente perfeitamente agitado ou reactor de
mistura (CSTR-constant flow stirred tank reactor), todo o contéudo é agitado
mantendo-se constante a composição ao longo do reactor.
Escoamento do tipo pistão
Reactor tubular ideal.
Escoamento através dum reactor
perfeitamente agitado.
Figura 2.4 - Operação contínua - os dois modelos ideais do escoamento de fluxo
contínuo
O escoamento do tipo pistão, ocorre no reactor tubular ideal. Neste, há um
escoamento da massa reagente numa dada direcção espacial, não existindo gradiente
de concentração radial, ou seja a velocidade em qualquer ponto da secção do tubo é
constante e todas as propriedades também são constantes, caracteriza-se por
apresentar um escoamento ordenado dos elementos fluidos. Estabelece-se, sim, um
47
Reactores Químicos I
perfil contínuo e decrescente de concentração do reagente entre a entrada e a saída
do reactor é‚ denominado reactor com gradiente de concentração onde não há mistura
de fluidos ao longo do seu precurso, o tempo de permanência é constante para
qualquer elemento do fluido, é como se os reagentes caminhassem ao longo do
reactor numa única fila ordenada.
No caso do escoamento através do reactor perfeitamente agitado, o reagente que
entra no reactor encontra-se bruscamente mergulhado num meio (meio reaccional)
que tem uma composição igual ao do fluxo que sai do reactor. Ao nível da entrada do
reactor, há uma descontinuidade de concentrações, enquanto que no meio reaccional
contido no reactor as concentrações das diferentes espécies químicas são uniformes.
Os equipamentos que se encontram, na prática, não terão todas as características
destes modelos ideais, mas desde que se aproximem suficientemente dum deles farse-à a sua análise a partir do modelo ideal introduzindo termos correctivos, se
necessário.
Falar-se-à então de reactor do tipo tubular ou do tipo perfeitamente agitado, consoante
o modelo ideal a considerar em primeira aproximação.
Os reactores tubulares são usados na indústria para a produção em larga escala.
Neles podem ter lugar reacções homogéneas ou heterogéneas (catalíticas).Um
exemplo é a reacção de polimerização do etileno e o craqueamento catalítico do
gasóleo em hidrocarbonetos leves.
Figura 2.5 - Comportamento do reagente A num reactor tubular ideal
48
Reactores Químicos I
Figura 2.6 - Comportamento do reagente A num reactor CSTR
Os reagentes colocam-se
no início e os produtos
retiram-se depois de um
tempo de residência
Reactor
Batch
ou Intermitente
Classificação
de Reactores
Homogéneos
Uniforme
Reactor
Semicontinuo
Reactor
Tubular
Reactor
Contínuo
Os reagentes e
os produtos
entram e saem
continuamente
do sistema
Reactor
CSTR
Uniforme
Uma outra característica da reacção que tem muitas vezes uma influência decisiva
sobre a estrutura do reactor e sobre o seu aspecto exterior diz respeito ao efeito
térmico, inevitavelmente ligado a qualquer transformação química. Grande número de
reacções praticadas industrialmente têm calores de reacção consideráveis, quer se
trate de reacções exotérmicas ou endotérmicas. Para estes casos, o reactor dever ser
munido de superfícies de permuta térmica, capazes de transferir o calor
correspondente no sentido conveniente.
49
Reactores Químicos I
Distinguem-se os dois casos seguintes ideais (que no decorrer deste curso trataremos
mais em pormenor):
-reactor isotérmico;
-reactor adiabático.
As equações indicadas abaixo relativas ao projecto dos três reactores indicados, em
muitos casos, aproximam-se dos reactores reais. Os desvios podem ser calculados
pela introdução de um factor de correcção nas equações.
2.2 - Princípios do Projecto de Reactores – Formulação Geral dos
Balanços Mássicos e Entálpicos
As equações básicas de projecto de reactores são essencialmente os balanços
materiais e energéticos e a equação cinética.
Vamos começar por considerar em primeiro lugar os sistemas monofásicos.
Seja um elemento de volume V de fase reaccional, suposta homogénea quer em
composição, quer em temperatura.
Figura 2.7 - Elemento de volume V de fase reaccional contendo ni moles da espécie
Ai
a- Balanço mássico de um componente para o elemento de volume V, por
unidade de tempo.
Para qualquer reactor o princípio de conservação de massa requer que a massa da
espécie i num elemento de volume V, obedeça à seguinte condição:
50
Reactores Químicos I
(velocidade de acumulação
elemento de volume)
de i
dentro
do elemento de volume)
= (caudal
de i
que entra
para o
- ( caudal de i que sai do elemento de volume) + ( velocidade de transformação
de
i no elemento de volume)
Para qualquer espécie Ai contida neste elemento de volume V é possível escrever
um balanço molar sob a forma geral seguinte:
dni
= Fie − Fis + Ri ∆V
dt
(i=1,S)
(2.1)
onde:
dni
dt
é a velocidade de acumulação de Ai no volume ∆V
(2.2)
Fie e Fis são respectivamente os caudais molares que entram ou saiem
Ri é a velocidade de transformação da espécie Ai por unidade de volume
(Ri=Σνi,j rj ; para um inerte Ri=0)
b- Balanço Energético para o elemento de volume V, na unidade de tempo t
Tal como para o balanço mássico, a conservação de massa, a conservação de
energia nos reactores pode escrever-se da seguinte forma:
(velocidade de acumulação de entalpia dentro do elemento de volume)=
(caudal entálpico que entra
elemento de volume)
no elemento de volume)
- (caudal entálpico que sai
do
+ (velocidade de transferência de entalpia do exterior para o elemento
de volume)
Desta forma pode escrever-se:
−
−
−
d (n h )
∑ dti i = ∑ Fie h ie − ∑ Fis h is + q∆V
(i=1,S)
onde:
−
dn h
∑ dti
é a velocidade de acumulação de entalpia no volume
51
∆V:
(2.3)
Reactores Químicos I
−
−
∑ Fie h ie ; ∑ Fis h is
são respectivamente os caudais entálpicos que entram e
saem do elemento de volume;
q é a velocidade de transferência de entalpia vinda do exterior do volume V.
3 - Reactores Descontínuos Monofásicos
Trata-se do equipamento mais simples que pode ser encarado para realizar uma
transformação química. Consiste, como já referimos atràs, num recipiente no qual os
reagentes são introduzidos no início da operação: atingidas as condições de
temperatura e pressão, a reacção desenvolve-se até ao grau de conversão desejado.
Um esquema dum reactor descontínuo encontra-se na figura 3.1.
Motor
Entrada da
Alimentação
Ligação a fluidos de
aquecimento ou de
arrefecimento
Agitador
Figura 3.1 - Representação esquemática de um reactor descontínuo
Os elementos principais do reactor descontínuo são:
52
Reactores Químicos I
- um recipiente capaz de conter um elemento V de fluido reaccional;
- uma superfície para a permuta térmica;
- um sistema de agitação para misturar se necessário os reagentes no início da
operação e facilitar a transferência térmica através da superfície de permuta.
Assim, descrito, este aparelho aparece bem adaptado para realizar uma reacção em
fase líquida, mas dificilmente aplicável ao caso duma reacção em fase gasosa. Desta
forma, no tratamento que vamos fazer a seguir suporemos implicitamente que
tratamos o caso duma fase líquida homogénea, pelo que a variável pressão não será
tida em consideração.
3.1 - Balanços mássicos e energéticos
Para um tal reactor admite-se que a temperatura e composição são idênticas em todos
os pontos da fase reaccional. As expressões escritas atrás para um elemento de
volume podem aplicar-se ao conjunto do volume V de fase reaccional. Por outro lado,
os termos correspondentes aos caudais desaparecem por não haver chegada nem
saída de massa no sistema.
Assim teremos:
-balanço de massa
dni
= RiV = V (∑ν ij r j )
dt
(i = 1,S )
(2.4)
-balanço entálpico
−
d (∑ ni h i )
= qV
dt
(2.5)
O primeiro termo desta equação pode explicitar-se da seguinte forma:
−
d ( ∑ ni hi )
dt
−
dn −
d hi
= ∑ i h i + ∑ ni
dt
dt
(2.6)
e
−
−
d hi d hi dT
=
dT dt
dt
53
(2.7)
Reactores Químicos I
−
sendo
d hi
dT
a capacidade calorífica molar Cpi
Por sua vez,
dξ j
dni
= Σν ij
dt
dt
(2.8)
donde:
− dξ
dξ j
dni −
h
h
ν
=
(
i
∑ dt
∑ ∑ ij i dt ) = ∑ (∆H j dt )
(2.9)
Nestas condições a equação de balanço entálpico toma a forma:
∑ ( ∆H j
dξ j
dt
) + (∑ ni C pi )
dT
= qV
dt
(i=1,S) (j=1,R)
(2.10)
Note-se que
dξ j
dt
= r jV
(j=1,R)
(2.11)
A equação de balanço entálpico compreende um termo ligado ao calor produzido ou
consumido pela reacção e um segundo termo traduzindo a acumulação de energia
calorífica na fase reaccional.
O termo q V é a energia trocada com o exterior por unidade de tempo, sendo positivo
se for fornecida energia ao meio reaccional.
De uma forma clássica o termo q V conterá duas parcelas de importância diferente:
qV= calor trocadocom o exterior(q1V)+energia mecânica dissipadapelo agitador(q2V)
Para uma dada superfície de permuta (parede, serpentina, ...), o termo q1 V tem a
forma:
q V = U A (Tmf – T)
(2.12)
sendo U o coeficiente global de transferência de calor, A a área através da qual se dá
a transferência e Tmf a temperatura média do fluido de permuta.
A equação de balanço entálpico e as equações cinéticas constituem o sistema
diferencial que por integração permite descrever o funcionamento de um reactor
54
Reactores Químicos I
descontínuo. Esta integração far-se-à numericamente ou analiticamente com as
condições aos limites:
- para t = 0
ni = nio
T = T0
sendo
V = V0
Para permitir uma integração mais simples, a maior parte das vezes analítica, podem
admitir-se certas hipóteses, tais como: V = constante (aceitável para uma fase líquida,
sobretudo se contiver um solvente):
No estudo o termo V, chamado volume do reactor, na verdade se refere ao volume da
mistura reagente. Quando este difere do volume interno do reactor, entao Vr designa o
volume interno enquanto V é o volume da mistura. Pôr exemplo, em reacções
catalisadas por sólidos com porosidade ε, temos V= Vr ε. Para sistemas homogêneos
usamos apenas o termo V. Cada uma destas duas últimas hipóteses corresponde a
um caso limite constituindo na maior parte das vezes uma representação aproximada
de um caso real:
-SISTEMA ISOTÉRMICO
dT
= 0;
dt
(2.13)
O sistema diferencial reduz-se às equações cinéticas, que podem ser integradas a
partir do conhecimento das equações de velocidade, rj.
-SISTEMA ADIABÁTICO
q=0
(2.14)
Para um sistema reaccional simples ΣνiAi = 0, a equação de balanço entálpico reduzse a:
∆H R
dξ
dT
+ (∑ ni C pi )
=0
dt
dt
(2.16
que se pode escrever:
dT − ∆H R
=
dξ ∑ ni C pi
(2.17)
Se se considerar o segundo membro constante vem:
T = To −
∆H R
ξ
n
C
∑ i pi
(2.18)
55
Reactores Químicos I
3.2 - Diversas tecnologias utilizáveis
Alguns dos sistemas mais correntemente utilizados na prática apresentam-se nas
figuras seguintes:
Agitador rotativo
Agitador rotativo
Fluido para troca
térmica
Fluido para troca
térmica
Fluido de
aquecimento e
arrefecimento
Duplo envelope
Serpentina
Alimentação
Figura 3.2.a - Reactor descontinuo
um com um duplo envelope
Alimentação
Figura 3.2.b -Reactor descontinuo com
duplo
Entrada
da envelope e uma serpentina interna.
alimentação
Fluido troca
térmica
Permutador
calor tubular
Bomba de
circulação
Válvula
56
Reactores Químicos I
Figura 3.2.c - Reactor descontinuo com um permutador externo para circulação do
produto do reactor.
Vapor
Fluido troca
térmica
Condensador
Líquido
Duplo envelope
Fluido troca
térmica
Figura 3.2.d - Reactor descontínuo com arrefecimento para condensação da fase
vapor.
3.3 Optimização da produção:
- Velocidade de produção: Veloc
prod
=
mol Pr oduto
tempo . de .operação
A conversão óptima e o tempo de operação óptimo correspondem ^`a velocidade de
produção máxima.
- Condição de máximo:
dVeloc prod
dt
=0
57
Reactores Químicos I
Problemas
Projecto de Reactores
Reactores Descontínuos
1- Num reactor descontínuo A__________> B
Tempos de reacção
1ª ordem K s-1
2ª ordem KcA0 s-1
Horas
10-4
10-3
Minutos
10-2
10-1
Segundos
1
10
milisegundos
1000
10000
Verifique a ordem de grandeza dos tempos de reação, para 90% de conversão?
2- - Pretende-se produzir 4500Kg, por dia de 8 horas de trabalho, de um produto B,
através da seguinte reacção em fase líquida:
A__________> 2B + C
Carrega-se um reactor descontínuo a 70ºC, com uma solução de A contendo: 15 M e
pretende-se atingir a conversão de 75%. A reacção é de 1ª ordem e a constante de
velocidade é de 1,3 h-1. O peso molecular de B é 70 e o tempo de carga e descarga
do reactor é de 23 minutos e o de lavagem é de 12 minutos. Dimensione o reactor
capaz de realizar a referida produção, trabalhando isotermicamente.
3 - Produz-se acetato de butilo num reactor descontínuo à temperatura de 100ºC. A
alimentação é constituída por 5 mol de butanol por mol de ácido acético. Sabe-se que
a reacção é de segunda ordem em relação ao ácido acético quando o butanol se
encontra em excesso e que o valor da constante de velocidade é de 16 ml / (mol.min).
a) Calcule o tempo necessário para obter um grau de avanço de 0,7 mol.
b) Dimensione um reactor capaz de produzir 1500 kg / dia de acetato de butilo.
Considere que o intervalo de tempo de descarga, limpeza e arranque entre cada duas
operações é de 30 minutos .
58
Reactores Químicos I
4 - Numa instalação piloto, pretende-se produzir um dado produto P, utilizando um
reactor descontínuo, em fase liquída e em funcionamento isotérmico, podendo ser
2A ________> P
resumida pela seguinte expressão:
Sabendo que a concentração inicial de A é 1,3 M, a de inerte 1,7 M e o grau de
avanço da reacção final é de 0,87 M. O tempo de carga é de 11 minutos, de lavagem
de 12 minutos e o tempo de descarga do reactor é de 15 minutos. Dimensione o
reactor capaz de realizar a produção mensal de 150 Kg de P, trabalhando
isotermicamente e 8 horas dia.
Dados adicionais: K= 0,12 M-1.min-1; MMP=112
5 - Num reactor descontínuo à temperatura de 98ºC, dá-se a reacção:
3 A + 4 B________> 2P
A alimentação é constituída por 23 mol de A, 20 mol de B e 2 mol inerte. Sabe-se que
a reacção é de segunda ordem em relação ao reagente limitante e que o valor da
constante de velocidade é de 15,43 ml / (mol.min).
a- Calcule o tempo necessário para obter uma conversão de 78%.
b- Dimensione um reactor capaz de produzir 7600 kg / dia de produto. Considere que
o intervalo de tempo de descarga, limpeza e arranque entre cada duas operações é de
65 minutos . A densidade do produto pode ser considerado de 0,865, e dos reagentes
de 0,965.
6 – Num reactor descontínuo, dá-se a seguinte decomposição:
N 2O
4
↔
2 NO
2
A temperatura e a pressão são constantes no reactor, respectivamente de 340K e 2
atm. Sabendo que K de equilibrio é de 0,1 M.
a- calcule o valor do grau de conversão no equilibrio.
b- Supondo que K sentido directo é de 10 s-1 , calcular o tempo da reacção.
Sabendo que o tempo de carga e descarga é de 15 mn e de lavagem é de 12 mn.
MB=102.
7 - Num reactor descontínuo à temperatura de 95ºC, dá-se a seguinte reacção:
59
Reactores Químicos I
2 A + B <__________> 2C
A alimentação é constituída por 1,3 M de A e 1,5 mol de B.
Sabe-se que a reacção é de segunda ordem em relação ao reagente limitante (tipo
I) e que o valor da constante de velocidade é de 25,43 ml / (mol.min) e a constante de
equilibrio é igual a 3.
a- Calcule o tempo necessário para obter um grau de avanço de 80% do de equilibrio.
b- Dimensione um reactor capaz de produzir 5600 kg / dia de produto.
•
•
intervalo de tempo de descarga, limpeza e arranque entre cada duas operações é
de 1,5 h .
massas moleculares: A=135, B=29, C= 220.
8 - O metanol é preparado cataliticamente a partir de uma mistura de monóxido de
carbono e hidrogénio ( gás de síntese):
CO + 2 H2 ___________> CH3OH
Na entrada do reactor descontínuo a temperatura é de 275ºC e a pressão de 200 atm,
dispõe-se de 5 Kmol de CO e 12 Kmol de H2 e 2 Kmol/h de inerte. Dimensionar o
reactor para uma produção diária de 3500 Kg de produto. Sabe-se que os tempos
necessários para encher e esvaziar o reactor são de 6 e 9 minutos respectivamente,
lavagem de 9 minutos, que a reacção é desprezável durante os 5 primeiros minutos
(aquecimento) e que o produto final é introduzido no tanque de arrefecimento depois
de ser atingido um grau de avanço da reacção de 4 Kmol.
9- Um dado reagente A isomeriza-se segundo o esquema reaccional
A_________>B
Determine os volumes de reactores necessários para produzir 4,5.106 Kg de B em
9500 horas de operação:
a) Se o reactor operar isotermicamente à temperatura de 165 ºC;
b) Se o reactor operar adiabaticamente.
Energia de activação: E=29,2 Kcal/mol
K (a 165 ºC) = 0,85 h-1
Entalpia de reacção = - 96 cal/g
Cp (A, B)= 0,63 cal/(g .º C)
massa especifica (A,B) = 0,84 g/cm3
60
massa molecular de (A, B) =210
Reactores Químicos I
Sabe-se que os tempos necessários para encher e esvaziar o reactor são de 12 e 18
minutos respectivamente, que a reacção é desprezável durante os 10 primeiros
minutos (aquecimento) e que o produto final é introduzido no tanque de arrefecimento
depois de ser atingido o grau de conversão é de 88%.
10 - Numa unidade de investigação, dá-se a hidrólise do anidrido acético (A), a ácido
acético (B), num reactor descontínuo.
(CH3CO)2O + H2O
___________
> 2 CH3COOH
Calcule o tempo de operação, para uma conversão de 75%, sabendo que o tempo de
carga e descarga é de 5 mn e de lavagem é de 8 mn:
a) num reactor isotérmico a 15ºC.
b) num reactor adiabático.
c) num reactor politrópo.
A alimentação é constituída por 3.10-4 mol.dm-3, contendo 60% molar de A e o restante
água.
(_∆HR )=55 Kcal.mol-1
calor específico médio= 0,9 Btu.lbmol-1.ºF-1
densidade= 1,06
T (ºC)
10
15
25
40
K (min-1)
0,05672
0,08063
0,15804
0,38015
11 Numa unidade piloto, num reactor descontínuo com um volume de 0,5 m3, ocorre a
dissociação de A, segundo a reacção:
A__________>B + C
Realiza-se a 400kPa e a temperatura na alimentação é de 330K.
Compare o tempo de operação necessário em condições isotérmicas e em condições
adiabáticas para uma conversão de 90% , sabendo que o tempo de carga, descarga e
lavagem é de 20 minutos.
Temperatura K
330
340
350
360
370
380
(kseg-1)
0,330
0,462
0,641
0,902
1,27
1,98
K
(_∆HR )330K= -11,63 kJ / mol, os calores específicos de A é de 160 J/mol.K, B e C são
idênticos e de valor numérico de 120 J /mol.K.
61
Reactores Químicos I
4 - Reactores Contínuos Tubulares
O reactor tubular é constituído, na sua forma elementar, por um tubo no interior do
qual circula o meio reaccional numa dada direcção e em que não existe agitação ou
mistura da massa reaccional. A permuta de calor, necessária quer para fornecer
calorias ao sistema, ou para as eliminar, faz-se geralmente através da parede do tubo.
Um tal equipamento pode ser representado esquematicamente na figura 4.1.
4.1 - Esquema dum reactor contínuo tubular
A hipótese mais simples de análise deste tipo de reactor consiste em admitir que a
mistura se escoa no interior do tubo ou tubos como um êmbolo se desloca no interior
dum cilindro, a concentração do reagente limitante diminui continuamente ao longo do
comprimento do reactor. Assim, neste caso, o reactor designa-se por reactor tubular
ideal ou do tipo êmbolo ("plug flow reactor") e considera-se que a velocidade de
escoamento é constante numa dada secção transversal e consequentemente a
concentração e a conversão são constantes nessa secção recta. O balanço molar é
realizado numa fatia elementar do reactor l - l+dl.
62
Reactores Químicos I
Escoamento
tipo pistão
Escoamento
laminar
Escoamento
turbulento
Fig. 4.2 Representação esquemática do escoamento pistão, laminar e turbulento
Conclusão: O regime turbulento é o que se assemelha mais ao modelo ideal de
escoamento - o tipo êmbolo.
Isto é tanto mais verdade quanto mais turbulento for o escoamento do fluido; de facto,
o perfil das velocidades tende para o modelo ideal quando o número de Reynolds
aumenta.
4.1 - Balanços Mássicos e Energéticos
Suponhamos então que uma dada transformação química, simbolizada por:
∑ν
ij
Ai = 0 se desenvolve no fluido que circula no reactor tubular esquematizado na
figura anterior. A posição dum elemento de volume de fluido reaccional no interior do
tubo pode ser referenciada por meio da distância l que o separa da entrada do tubo.
Consideremos um elemento de fluido de volume
V, delimitado por duas secções
rectas do tubo, respectivamente às distâncias l e l+∆l em relação à entrada do tubo
63
Reactores Químicos I
(l=0). Podem efectuar-se balanços molares e energéticos à volta deste elemento de
volume elementar, supondo o regime estacionário atingido.
Balanço molar para um componente Ai:
( Fi ) l − ( Fi ) l + ∆l + Ri ∆V = 0
(i=1,S)
(4.1)
Balanço energético global:
∑ (F
−
i
−
h i ) l − ∑ ( Fi h i ) l + ∆l + q∆V = 0
(i=1,S)
(4.2)
∆V = S∆l, sendo S a secção recta do tubo.
Dividindo todos os termos das equações (5.1) e (5.2) por ∆l e fazendo tender l para
zero, vem:
dFi
− Ri S = 0
dl
∑(
(4.3)
dFi hi
) − qS = 0
dl
(4.4)
sendo q.s. o calor transferido por unidade de tempo e unidade de comprimento do
tubo.
Para um sistema contínuo vimos que se pode definir o avanço das diversas reacções j
através de:
Fi = Fio + ∑ν ij ξ ′′ j
(j=1,R)
(4.5)
e que:
Ri = ∑νijrj
(j=1,R)
A equação (5.3) pode então escrever-se:
dξ ′′j
dl
= rj S
(j=1,R)
(4.6)
A equação (5.4) por sua vez pode escrever-se doutra forma, desenvolvendo-se o 1º
termo:
−
−
d ( Fi h i ) dFi −
d hi
=
hi + Fi
dl
dl
dl
64
(4.7)
Reactores Químicos I
dFi
dξ ′′ j
= ∑ ν ij
dl
dl
−
−
d hi d h i dT
dT
=
= Cpi
dl
dT dl
dl
(4.8)
Finalmente obtêm-se:
dξ ′′ j
dT
∑i (Fi C pi dl ) + ∑j (∆H j dl ) − qS = 0
(4.9)
As R equações (5.6) e as equações (5.7) poderão então ser integradas
simultaneamente, tendo em conta as condições aos limites para l=0;
Fi=Fio ;
ζ´j=0
(j=1,R)
e
T=T0
A integração da equação (5.7) necessitará do conhecimento do termo de transferência
de calor q.
Chama-se novamente a atenção para o facto de que a escrita das equações (5.1) e
(5.2) implica a hipótese importante seguinte: as grandezas Ri e hi só dependem de l
não variando numa mesma secção recta do tubo, qualquer que seja a posição radial
considerada. Esta hipótese corresponde ao modelo ideal, que referimos por
escoamento tipo êmbolo. Utilizando um tal modelo de escoamento supõe-se, com
efeito, que todos os elementos de fluido têm a mesma velocidade linear quando
atravessam uma mesma secção recta.
4.2 - Exemplos de Soluções em Casos Simples
Reportando-nos à equação (5.7) podem imediatamente obter-se as simplificações de
certas situações particulares:
- Reactor Isotérmico
dT
=0
dt
Neste caso, as equações de balanço mássico (5.6) podem ser integradas
independentemente, para uma dada temperatura.
- Reactor adiabático
q=0
Neste caso, as variáveis T e ζ´ estão agora ligadas de forma biunívoca.
65
Reactores Químicos I
Consideremos agora o caso duma transformação simples
∑ν
i
Ai = 0 , realizada num
reactor tubular de forma isotérmica.
A equação (5.6) escrever-se-à:
dζ ′
= rS
dl
(4.10)
O termo de velocidade r poder ser substituído pela sua expressão em função das
concentrações dos componentes Ai.
Suponhamos que a reacção é de primeira ordem:
r = k C1
F1 F10 + ν 1ζ ′′
C1 =
=
Q
Q
(4.11)
então a equação (5.11) pode tomar a forma:
dζ ′′
Sdl
K
=
Q
F10 + ν 1ζ ′′
(4.12)
No caso dum sistema para o qual as variações de volume possam ser desprezadas, a
integração de (5.12) pode fazer-se facilmente e
ζ′ =
F10 ⎡
ν KS
⎤
exp( 1 ) − 1⎥
⎢
ν1 ⎣
Q
⎦
(4.13)
S 1 é o volume do reactor necessário para obter um avanço molar ζ´
Sl
é o tempo de permanência, θ , do meio reaccional no reactor até 1.
Q
A equação (5.13) permite expressar os caudais molares dos diversos componentes Ai
à saída do reactor em função apenas do tempo de permanência .
No caso da reacção A1________>A2, a expressão (5.13) conduz a:
F1
= exp(− Kθ )
F10
(4.14)
sendo o reactor tubular bem adaptado à realização de reacções em fase gasosa, a
hipótese de não haver variações de volume do meio reaccional nem sempre é
66
Reactores Químicos I
aceitável. Neste caso dever ser considerada uma equação de estado aplicável à
mistura gasosa para complemento dos balanços molares.
A título de exemplo, retomemos o caso simples considerado atràs: reacção de ordem
1, caracterizada pela relação estequiométrica
∑ν
i
Ai = 0
com
∑ν
−
i
=ν = 0.
Admitamos que para a mistura gasosa pode ser utilizada a lei dos gases perfeitos.
A equação (5.12) é ainda válida, mas sendo Q variável deverá ser expresso em
função de ζ´ .
O caudal volumétrico Q corresponde aos caudais molares Ai, sendo os inertes
também incluídos.
Pode escrever-se:
Q = (∑ Fi )
RT
P
(4.15)
Por outro lado:
−
∑ Fi = ∑ Fio + ∑ ν i ξ ′ ′ = Fo + ν ξ ′ ′
A equação (5.12) vem então:
−
( Fo + ν ξ ′ ′ )
KSP
dξ ′ ′ =
dl
( F10 + ν 1ξ ′ ′ )
RT
(4.16)
Se se supõe que a evolução do sistema se faz de forma isotérmica e que as variações
de pressão ao longo do tubo são desprezáveis, a integração de (5.16) é imediata,
obtendo-se:
−
−
F + ν 1ξ ′ ′
ν
ν
KSP
( F0 −
F10 ) ln( 10
)+
ξ′ ′ =
l
ν1
ν1
ν1
F10
RT
1
(4.17)
No caso geral, a equação (5.16) deverá ser integrada ao mesmo tempo que a
equação do balanço entálpico, obtida da equação (5.7), isto é:
⎛
∑ ⎜⎝ F C
i
pi
dξ ′ ′
dT ⎞
) − qS = 0
⎟ + ( ∆H R
dl ⎠
dl
(4.18)
e que uma equação que traduza a perda de carga devida ao escoamento do fluido,
tendo a forma seguinte:
67
Reactores Químicos I
−
u2ρ
dP
= −f
dl
di
(4.19)
sendo:
f o factor de atrito dependendo do número de Reynolds e da rugosidade relativa;
−
- u=
Q
a velocidade média
s
-
ρ a densidade média do fluido
-
di o diâmetro interior do tubo.
4.3 - Diversas Tecnologias Utilizáveis
Como referimos, este reactor é constituído por um tubo, no interior do qual circula o
meio reaccional. A troca de calor necessária, seja para fornecer energia ao sistema,
seja para as retirar, far-se-à através da parede do tubo.
De acordo com a temperatura a que se processa a reacção, as tecnologias a usar são
bastante diferentes:
1) a temperatura moderada (<500 ºC), sistema de tubos concêntricos com
circulação entre os tubos de um fluido térmico ( água, vapor, fluido orgânico,
sal fundido), tal como representado na figura 5.2.
Figura 4.3 - Tubos concêntricos, exemplo a polimerização do etileno (T<500 ºC)
Condições operatórias: - pressão - 2000 a 3000 bar temperatura - 180 a 300ºC
68
Reactores Químicos I
O controle da temperatura é realizado por um efeito conjugado da transferência
térmica através da parede e injecção do iniciador da polimerização misturado com
uma parte do monómero frio. O arrefecimento do meio reaccional faz-se com
circulação de água sob pressão, p. ex. num duplo envelope.
2) A temperatura elevada (>500ºC), o tubo é colocado num forno, aquecido por meio
de queimadores a gás ou a fuel. Neste caso, o tubo é colocado na zona de convecção
e/ou radiação (figura 4.4).
Figura 4.4 - Forno Tubular, exemplo steam cracker da nafta (T>500 ºC)
Podem citar-se assim como vimos, exemplos típicos destas duas tecnologias,
respectivamente a polimerização do etileno e o steam cracker de determinadas
fracções de petróleo para a obtenção do etileno.
O funcionamento adiabático do reactor consegue-se isolando exteriormente os tubos.
O volume do reactor será obtido como vimos a partir dos balanços molares e do
balanço energético. Para calcular o diâmetro e o comprimento dever procurar-se
validar a hipótese de escoamento pistão, através da utilização das seguintes
restrições:
Re (nº de Reynolds >104)
L - comprimento do tubo ;
L/D >102
D - diâmetro interior do tubo
A título indicativo, refira-se que num forno de “steam cracker”, em que o tubo tem um
diâmetro de cerca de 8 cm, o nº de Reynolds é superior a 106, enquanto que o tempo
de permanência é inferior ao segundo.
O reactor tubular está especialmente adaptado para realizar as reacções rápidas
especialmente em fase gasosa.
69
Reactores Químicos I
Sob o ponto de vista da realização prática, quando os volumes reaccionais
necessários são muito elevados, põe-se o problema das dimensões dos tubos a
utilizar. Por exemplo, se se tiver, necessidade dum volume de 50 m3, isso necessitaria
de um tubo com um comprimento mínimo de 86 m. Este comprimento poderia afigurarse demasiado pequeno, após o cálculo do nº de Reynolds correspondente. Neste
caso, poderá , por exemplo, ser interessante utilizar um tubo de maior diâmetro mas
enchendo-o com um enchimento de forma a manter um escoamento do tipo pistão.
Aquando da concepção de um reactor tubular, para além da noção de tempo de
permanência ligado à velocidade da reacção e à conversão desejada, deverá
considerar-se a transferência térmica pela parede do tubo, o que será responsável
pelo perfil de temperatura ao longo do tubo.
Os coeficientes de transferência entre o fluido em escoamento no interior do tubo e a
parede calcular-se-à pelo processo clássico. No exterior do tubo, deverá ser tida em
conta a forma como se faz a troca de calor:
- transferência por convecção forçada no caso dos tubos concêntricos;
- transferência por radiação, no caso do forno, podendo assim obter-se fluxos de calor
consideráveis (3 a 8.104 W /m2 em média, no caso dum forno de steam cracker).
4.4 - PFR com Recirculação
Alimentação
Produtos
Reciclo
Reciclo = R =
caudal ⋅ que ⋅ retorna
caudal ⋅ que ⋅ sai
αf
dα
α1 r
VR = FAo(1+ R) ∫
α1 =
70
R
αf
R +1
Reactores Químicos I
71
Reactores Químicos I
Problemas
Reactores tubulares
1 - Num reactor contínuo, tubular tipo pistão, em condições isotérmicas, ocorre a
reacção gasosa do dibromo etilo (A) e o iodeto de potássio (B):
C2H4Br2 + 3 KI _______> C2H4 + 2 KBr+ KI3
As concentrações iniciais são CAo=0, 864 M e CB0=1,531 M
A reacção é de 2ª ordem tipo II, a constante cinética K =0,0052 M-1.min-1.
Sabendo que os caudais molares de C2H4Br2 e de KI são respectivamente de 20 mol/h
e 40 mol/h , o grau de avanço da reacção final é de 12 mol/ h. Determine o volume
do reactor necessário.
2 - Calcule o volume do reactor tubular ideal isotérmico necessário para se obter 37%
de decomposição do acetaldeído a 520 ºC e à pressão de 1 atm, de acordo com a
reacção:
CH3CHO________> CH4 + CO
A alimentação do reactor é de 0,12 kg / s, a reacção é de 2º ordem irreversível e a
constante de velocidade é de 0,43 dm3 / (mol.s) a 520 ºC.
3- A decomposição da fosfina em fase gasosa
4 PH3 ____________> P4 + 6 H2
ocorre a 1200 ºF e 4,6 atm segundo uma reacção de 1ª ordem em que k = 10 h-1.
Quais as dimensões de um reactor tubular tipo êmbolo, isotérmico, que produza 80%
de conversão da fosfina, sendo a alimentação de 40 lb mol / h de fosfina?
4 - Um reactor tubular isotérmico existente numa unidade fabril opera a 215ºC e à
pressão de 5 atm, em fase gasosa:
A_____________>3B
Sabendo que a equação cinética é dada por: -rA = 10-2 CA1/2 CAO=6,25 mol/dm
Determinar o tempo espacial necessário para uma conversão de 68%
A alimentação tem 20% em volume de inertes.
72
3
Reactores Químicos I
5 - Deseja-se aumentar em 20% o caudal molar que atravessa o reactor tubular tipo
êmbolo onde se processa a reacção de 1ª ordem irreversível
A__________> B
(em fase gasosa)
mas de forma a manter a mesma conversão, à saída. Se a temperatura for
inicialmente de 150 ºC, propõe-se que a temperatura de operação passe a ser mais
elevada de 171,5ºC, Justifique.
Dados: Ea = 4 Kcal / mol de A.
6 - Numa unidade industrial, no reactor tubular, operando adiabaticamente em fase
gasosa à pressão de 1,5 atm e temperatura de 600 K, dá-se a reacção do eteno com
o bromo , segundo a seguinte reacção reversível:
C2H4 + Br2 <__________>C2H4Br2
A composição molar da alimentação é de 32% de eteno, 60% de bromo e o restante
inertes e o caudal na entrada do reactor é de 600 m3/h.
Calcular para se obter um grau de avanço igual a 65% do grau de avanço máximo
possível .
a- o volume do reactor
b - tempo espacial e o tempo de permanência.
A equação cinética é a seguinte: r= 500C C2H42 – 0,032 C C2H4Br2
7 - Pretende-se realizar a reacção
A+B
↔ 2C
reversível e de 2ª ordem em ambos os sentidos, num reactor tubular, alimentando-o
com uma mistura gasosa contendo 50% de A, 40% de B e 10% de inertes, a 2700K e
a 20 atm.
Determine o volume do reactor necessário para se obter 80% do grau de avanço de
equilíbrio. Suponha o reactor ideal e isotérmico. O caudal de alimentação é de 5000
dm3/s, constante de equilibro
Keq = 1,42 e a constante cinética da reacção directa
K1= 8.103 dm3/ (mol.s)
8 - A decomposição gasosa do ácido fórmico puro é estudada num reactor tubular tipo
pistão isotérmico, segundo a reacção:
HCOOH _______> H2O + CO
O reactor opera a 150ºC e 1 atm. O caudal na entrada do reactor é de 600 m3/h.
73
Reactores Químicos I
Sabendo que a equação cinética é de 1ª ordem com K= 2,46 min-1
Calcular para se obter um grau de conversão final de 70%:
bcd-
o volume do reactor
tempo espacial e o tempo de permanência.
balanço entálpico
A__________> B
9 - A reacção em fase líquida
É realizada num reactor tubular à pressão de 202,6 kPa.
A alimentação é de 600 mole / s de A puro
temperatura de 200 ºC. O volume
específico de A puro é de 0,056 dm3 / mol, o calor de reacção a 200 ºC de -15 kJ / mol,
os calores específicos de A e de B são idênticos e de valor numérico de 42 J /mol k e
a constante de velocidade na gama de temperatura de operação é dada pela relação:
K = 0,11 + 8.10-4 ( T -200)
em que a temperatura em graus Celsius e k tem unidades de s-1. A operação inicial do
reactor é adiabática até se atingir a temperatura de 400 ºC, temperatura máxima
permissível acima da qual se formam produtos secundários indesejáveis, pelo que a
operação é isotérmica acima dessa temperatura até ao final da operação.
Calcule o volume do reactor necessário para se obter um grau de conversão de A de
80%. Qual deve ser então a velocidade de transferência de calor na secção de
arrefecimento do reactor?
2A__________> 3B
10 - A reacção em fase gasosa
é efectuada num reactor tubular ideal operado adiabaticamente. A alimentação é
constituída por 250 mol /min de alimentação e de igual caudal de inertes a 27 ºC e a
1,1 atm.
Calcule o volume do reactor necessário, para se obter um grau de avanço da reacção
de 110 mol/min. Qual é o valor da temperatura na saída do reactor?
∆H o R = - 1100 cal / mol A CpA = 16,2 cal / (mol.ºC) CpB
Cpin. = 13,9 cal / (mol.ºC)
K
=
= 12,1 cal / (mol.ºC)
0,4.104 exp ( -2750/ T ) min-1
74
T em K
Reactores Químicos I
11 - A decomposição da seguinte reacção em fase gasosa:
SO2Cl2__________> SO2 + Cl2
é efectuada num reactor contínuo tubular ideal operando adiabaticamente.
A alimentação é constituída por 600 mol /min de SO2Cl2 e 350 mol /min de inertes à
temperatura de 20 ºC e à pressão de 0,95 atm.
Calcule o volume do reactor necessário, para se obter um grau de avanço da reacção
de 510 mol / min e calcule a temperatura de saída da mistura reaccional.
∆H o R = - 10450 cal / mol K0 = 6,4.1015 s-1
Cp SO2Cl2 = 12 cal / (mol.ºC) Cpinerte =
Cp SO2
=
15 cal / (mol.ºC) Cp Cl2
=
E = 51,3 Kcal.mol-1
25 cal / (mol.ºC)
13 cal / (mol.ºC)
12 - Num reactor tubular tipo pistão, é realizada a seguinte reacção em fase gasosa:
2A__________>2B + 3C
A alimentação é de 3560 mol/s de A puro, à temperatura de 210 ºC e a pressão no
reactor é constante e de 1,25 atm.
A operação inicial do reactor é adiabática até se atingir a temperatura de 270ºC,
temperatura máxima permissível acima da qual se formam produtos secundários
indesejáveis, pelo que a operação é isotérmica acima dessa temperatura até ao final
da operação.
Calcule o volume do reactor necessário, para se obter um grau de conversão final de
A de 83%.
∆H o R = -19,1 KJ/mole; U= 670 J / (s.dm2.K).
CpA=40 J /mol k CpB=30 J /mol k CpC=21 J /mol k
T (ºC)
210ºC
260ºC
310ºC
360ªC
410ºC
K (min-1)
0,48
0,95
1,87
3,65
7,02
13 - Num reactor tubular ideal operando adiabaticamente, realiza-se a seguinte
reacção em fase gasosa:
CO + 2H2__________> CH3OH
75
Reactores Químicos I
A alimentação é constituída por 350mol /min de CO, 400mol/min de H2 e 100 mol/min
de inertes a 35 ºC e a 1,1 atm.
Calcule o volume do reactor necessário, para se obter um grau de avanço da reacção
de 160 mol /min.
∆H o R = - 1600 cal / mol
Cp CO
= 13 cal / (mol.ºC)
Cp CH3OH = 15 cal / (mol.ºC)
K
Cp H2
= 11 cal / (mol.ºC)
Cpin.
= 25 cal / (mol.ºC)
= 0,37.104 exp ( -2560/ T ) min-1
T em K
14 - Numa indústria petroquímica, é realizada num reactor tubular tipo pistão, a
seguinte reacção elementar em fase gasosa do butadieno (B) com o eteno (E) :
B + E____> C
A reacção é irreversível e de 2ª ordem tipo II.
A alimentação é constítuida por 154 Kmol /s de B, 123 Kmol /s e 69 Kmol /s de inerte à
temperatura de 450 ºC e prssão de 1,05 atm.
O grau de avanço da reacção final é de 70 Kmol /s
∆H o R = - 35 Kcal / mol (450ªC) ;
U= 620 J / (s.dm2.K).
K = 10 7,55 exp(-13840/T) temperatura é em graus K (K tem unidades de M-1s-1).
CpB= 37 cal.mol-1.K-1;cpE= 20 cal.mol-1.K-1;cpC= 59cal.mol-1.K-1;cpI= 25cal.mol-1.K-1
Comparar o tempo espacial no reactor em regime isotérmico e adiabático.
15- Apresente algumas vantagens da utilização de um PFR com correntes laterais
76
Reactores Químicos I
5 - Reactores Contínuos Perfeitamente Agitados
Como já indicámos atrás o funcionamento dum reactor monofásico perfeitamente
agitado é simples. Admite-se que em qualquer ponto do reactor as variáveis
intensivas, tais como concentrações ou temperatura, têm o mesmo valor. A
alimentação e saída da mistura reaccional é contínua.
Na Figura 4.1 seguinte apresenta-se esquematicamente este tipo de reactores.
Compreendem essencialmente um tanque munido de agitação, uma tubuladura de
alimentação e uma tubuladura de descarga.
Mistura
reaccional
Produtos da
reacção
Alimentação
Sistema de
agitação
Figura 5.1 - Esquema de princípio dum reactor perfeitamente agitado monofásico.
5.1- Balanços Mássicos e Energéticos
Para uma transformação química representada por:
∑ν ij Ai
=0
77
(5.1)
Reactores Químicos I
desenvolvendo-se no fluido contido no reactor atrás esquematizado, as equações
gerais de balanço de massa e entálpico são as seguintes:
dni
= Fie − Fis + Ri ∆V
dt
(i=1,S)
(5.2)
−
_
−
d (ni hi )
=
−
F
h
F
h
ie
∑ dt
∑ ie
∑ is is + q∆V
(5.3)
tomam a forma:
Fie − FiS + Ri ∆V = 0
−
(i=1,S)
(5.4)
−
∑ Fie h ie − ∑ Fis h is + q∆V = 0 (i=1,S)
(5.5)
o termo cinético Ri ser expresso para as condições no conjunto do volume do fluido
reaccional contido no reactor e que são as que se encontram ao nível da saída face à
hipótese da mistura perfeita.
Definindo o grau de avanço ξ ′ ′ para um sistema aberto por:
ξ ′′ =
Fis − Fie
(Σ iAi =0)
νi
Fis = Fie + ∑ν ijξ ′′ j
Σ
(
i jAi
=0)
(5.6)
(5.7)
e:
Ri = ∑ν ijξ ′′ j
(5.8)
sendo:
i=(1,S) , j= (1,R)
(5.9)
vem:
∑νijξ′′j =∑νijrjV
(5.10)
ou
ξ′′=rjV
78
(5.11)
Reactores Químicos I
e:
⎡
− ⎤
⎢
F
h
−
h
∑ ie ⎢ ie is ⎥⎥ − ∑j
⎦
⎣
−
∑ ν ij ξ ′ ′ ( his ) = ∑ ∆H j ξ ′ ′ j
i
(5.12)
j
Note-se que nestas equações os avanços molares são tomados à saída do reactor.
Por outro lado:
∑ ∑ν
j
−
ij
ξ ′ ′ j ( his ) = ∑ ∆H j ξ ′ ′ j
i
(5.13)
j
sendo as entalpias da reacção, calculadas para as condições reinantes no interior do
reactor que são idênticas às correspondentes à saída do fluido.
A equação anterior pode tomar a forma:
−
∑ Fio (∆ hi )− ∑ ∆H j ξ ′ j ′ +qV = 0
(5.14)
−
onde o termo ∆ hi traduz a diferença das entalpias molares das espécies i entre a
entrada e a saída do reactor.
Esta equação compreende três termos:
1º termo - variação de entalpia do fluido;
2º termo - efeito térmico devido à transformação química;
3º termo - troca de energia com o exterior.
Na medida em que a variação de entalpia molar é essencialmente devida às variações
de temperatura, o primeiro termo pode escrever-se:
∑
Te
F ie
∫ Cp
i
(5.15)
dt
Ts
ou:
∑F
−
ie C pi (Te − Ts )
(5.16)
−
sendo C pi o valor médio de Cpi entre Te e Ts.
Quanto ao terceiro termo, pode exprimir-se como para os reactores descontínuos
através de:
79
Reactores Químicos I
qV=UA(Tmf −TS ) :
(5.17)
A solução simultânea das equações, de balanço mássico e entálpico permite calcular
os valores de ζ´ e de Ts. Para efectuar esta resolução é preciso conhecer todas as
características do sistema reaccional (rj, Hj, Cpi, νij), bem como as do reactor (V, A, U,
Tmf). As condições operatórias são definidas por Fie e Te.
As equações anteriores podem ser simplificadas para os casos particulares:
- Sistema isotérmico
Te=Ts
- Sistema adiabático
qV=0
Logo:
∑F
io
−
( ∆ hi ) = ∑ ∆H j ξ ′ ′ j
ou para as condições de poder ser considerado um calor específico médio:
−
∑ Fie C pi (Te − Ts ) = ∑ ∆H j ξ ′ ′ j
(5.18)
donde pode ser calculada a temperatura de funcionamento adiabático:
Te − Ts =
∑ ∆H
∑F
ie
j
ξ′ ′
j
(5.19)
−
C pi
Na resolução das equações de balanço de massa o termo rj será expresso em função
das concentrações Ci das diversas espécies químicas no interior do reactor. Se
chamarmos Qs ao caudal volumétrico à saída, ter-se-à:
C is =
Fis
Qs
(5.20)
Fie
Qe
(5.21)
e identicamente para a entrada:
Cie =
Em muitos casos pode tomar-se: Qs=Qe=Q
80
Reactores Químicos I
Uma forma conveniente e usual de expressar a relação entre a velocidade de
alimentação FAO e o volume do reactor V num sistema contínuo é através dos termos
“tempo espacial” e “velocidade espacial”, definidos da seguinte forma:
O tempo espacial (tempo espacial = τ = 1/s = [tempo] (“space time”). é o tempo
necessário para processar um volume de reactor de alimentação, medido em
condições específicas.
Assim, um tempo espacial de 4 minutos significa que, a cada quatro minutos, um
volume do reactor de alimentação, em condições específicas, é processado no
reactor.
A velocidade espacial pode ser definido como sendo o volume de reactor de
alimentação processada em condições específicas na unidade de tempo.
Velocidade espacial = s = [tempo-1] (“space velocity”). Assim, uma velocidade espacial
de
8h-1 significa que oito volumes do reactor de alimentação, em condições
específicas, estão a alimentar o reactor por hora.
Caudal molar = F = mol / tempo
Os valores do tempo espacial e velocidade espacial dependem das condições
escolhidas. Ao seleccionar as condições de temperatura, pressão e estado físico (gás,
líquido ou sólido), nas quais efectuaremos a medida do volume de material que entra
no reactor.
λ=
1 C Ao V
=
=
s FAo Qo
(5.22)
sendo Q0 o caudal volumétrico da alimentação.
Nos reactores descontínuos utiliza-se tempo da reacção, enquanto nos contínuos há
que distinguir o tempo de permanência e tempo espacial. Embora os diferentes
parâmetros de funcionamento de um reactor contínuo em estado estacionário, sejam
independentes do tempo, a extensão da reacção, grau de conversão ou grau de
avanço da reacção depende do tempo que uma dada partícula da alimentação vai
permanecer dentro do reactor. Este tempo espacial será tanto maior quanto maior for
o volume do reactor ou quanto menor for o caudal volumétrico da alimentação.
81
Reactores Químicos I
5.2 - Associação em Série de Reactores Contínuos
Na prática industrial é frequente a associação de reactores contínuos perfeitamente
agitados (CSTR) em série de forma a diminuir o tempo de residência e
consequentemente o volume do reactor.
Cada andar da cascata de reactores será tratada como um reactor perfeitamente
agitado. Todos os cálculos apresentados atrás são aplicáveis, sendo as grandezas de
saída de um andar (m-1) tomadas como as grandezas de entrada do andar m.
Figura 5.1 - Comportamento do reagente A numa bateria de
reactores CSTR em série
Os balanços molares e entálpicos relativos a um andar genérico m têm a forma:
( FA ) m −1 − ( FA ) m + ( Ri ) m Vm = 0
(5.22)
(∑ FA hA ) m−1 − (∑ FA hA ) m + q mVm = 0
(5.23)
82
Reactores Químicos I
A é o reagente limitante, o índice i varia de 1a S (nº total de equações independentes)
e o índice m de 1 a N (nº total de andares).
Muitas vezes por razões de economia de construção, os volumes dos andares são
iguais, Vm=V.
5.3 - Diversas Tecnologias Utilizáveis
O
reactor
perfeitamente
agitado
assemelha-se
aos
reactores
descontínuos.
Especificadas as tubuladuras para entrada da alimentação e saída dos produtos,
podem usar-se as mesmas tecnologias de construção que para os reactores
descontínuos.
Encontram-se, assim, tanques agitados, quer por meio dum agitador rotativo, quer por
meio de circulação exterior.
5.3.1 - Tanque Agitado Mecanicamente
Na Figura 5.2 esquematiza-se este tipo de aparelho. o tanque cilíndrico tem fundo
geralmente elíptico e é munido dum agitador rotativo. Este tanque pode igualmente ser
dotado de superfícies de permuta térmica; duplo envelope, serpentina, etc.
Motor redutor
Produtos
Alimentação
Bafles
Figura 5.2 - Esquema de reactor contínuo perfeitamente agitado, tipo tanque com
agitação mecânica.
A realização de sistemas em série poderá fazer-se colocando vários módulos de
agitação
sobre
uma
mesma
árvore
montada
83
no
centro
de
uma
coluna
Reactores Químicos I
compartimentada. poderão assim conseguir-se facilmente até umas dezenas de
andares em série.
Motor
Agitador
Produtos
Baffle
Alimentação
Figura 5.3 - Esquema de reactor de vários andares com agitação mecânica
(6 andares)
5.3.2 - Tanque Munido de Agitação Exterior
Tal como nos reactores descontínuos, a mistura dos reagentes e do meio reaccional
pode ser conseguida por meio de uma circulação externa realizada com o auxílio de
uma bomba (figura 5.4). A troca de calor será realizada, se necessário, inserindo na
linha de circulação um permutador de calor. A introdução dos reagentes far-se-á antes
ou depois do permutador de forma a melhor aproveitar a superfície de permuta.
84
Reactores Químicos I
R+Q
A3
Distribuidor
S3
Fluido térmico
Fluido térmico
Permutador
de calor
A2
Dispositivo
anti-vortex
S2
Bomba
S1
A1
Figura 5.4 - Esquema de reactor contínuo perfeitamente agitado com circulação
A1, A2, A3 - possibilidades de alimentação do reagente
S1, S2, S3 - possibilidades de saída do meio reaccional
Q
- caudal de alimentação
5.4 - Exemplos de aplicação
Grande
número
de
reacções
realizadas
industrialmente
utilizam
sistemas
perfeitamente agitados num ou em vários andares.
É o caso de algumas polimerizações. Dada a elevada viscosidade do meio reaccional,
os equipamentos utilizados são quase sempre do tipo tanque agitado mecanicamente.
Os reactores perfeitamente agitados estão bem indicados para a realização de
reacções em fase líquida. Actualmente aparecem grande número de aplicações de
catálise homogénea em fase líquida, que podem ser realizadas em equipamentos
como os atràs apresentados. Podem citar-se a fabricação de hexenos, heptenos e
octenos por dimerização de propilenos e de butenos. Na prática utilizam-se um ou
vários reactores do tipo de recirculação externa. No caso da produção de hexenos a
partir do propileno é suficiente um só reactor para obter uma conversão de 90%
(tempo médio de permanência da ordem de 2 horas). Se se deseja aumentar a
conversão podem usar-se dois reactores em série - processo dimersol do IFP. No
85
Reactores Químicos I
caso da reacção de dimerização dos butenos, a reacção é mais lenta, podendo ser
necessários quatro reactores em série.
Ao nível da realização prática e da fiabilidade de funcionamento, o sistema com
circulação externa apresenta um certo número de vantagens que tornam esta
tecnologia preferível sobretudo para unidades com elevada capacidade. De facto uma
bomba é mais fácil de instalar que uma agitação mecânica e principalmente tem a
vantagem de que numa unidade poderem ser instaladas duas bombas em paralelo,
como indicado atràs, para fluidos reaccionais muito viscosos o reactor com agitação
mecânica poderá ser vantajoso.
86
Reactores Químicos I
Problemas
Projecto de Reactores
Reactores Contínuos CSTR
1 – Num reactor CSTR operando isotermicamente, pretende-se produzir 2.108 lb/ano
de etileno glicol (P), a partir de 1M óxido de etileno (A) e 1M água (B), com caudais
volumétricos iguais.
A + B__________>P
Calcule :
a- O volume de projecto do reactor em m3 ( diâmetro e dobro de altura), para uma
conversão final de 80%.
b– tempo espacial em min, dois reactores em paralelo, a conversão 81%, se o
volume de cada reactor 3m3 .
c - tempo espacial em min. dois reactores em série a conversão global seria de 90%,
volume de cada reactor 3m3 .
A reacção é de 1ª ordem, K=0,311min-1. MMP=62.
2 - - Determinada instalação fabril dispõe dum reactor CSTR com dois andares de 200
litros de volume cada, onde se deseja realizar isotermicamente a reacção:
A + B ____________>C
que é uma reacção irreversível de 2ª ordem, sendo K=0,15 l / (mol. min).
Para introduzir-se no 1º andar um caudal de 10 l / min de uma solução com 2 mol / l
de A e em ambos os andares um caudal de 5 l / min de uma solução com 1 mol / l de
B. Determine a concentração final de B.
3 - A reacção em fase líquida
A + B ⇔ C+D
é uma reacção de 2ª ordem reversível em que
K1 = 7,3 dm3/ ( mol min ) ( constante de equilibrio no sentido directo)
K2 = 4,4 dm3 / ( mol min ) (constante de equilibrio no sentido inverso)
87
Reactores Químicos I
que é efectuada num reactor CSTR com um volume de 250 litros.
Alimenta-se este tanque com dois caudais de igual valor, um contendo 9 M de A e
outro com 6 M de B. Desejando-se obter 75% do grau de avanço de equilibrio, qual
deverá ser o valor dos caudais de alimentação?
4 - A reacção de Diels-Alder entre a benzoquinonina (B) e o ciclopentadieno (C):
B + C__________>P
ocorre à temperatura de 25ºC em fase líquida. O caudal de B é de 0,173 m3/Kseg e a
concentração é de 0,15 Kmol/m3 e o caudal de C é de 0,126 m3/Kseg e a
concentração é de 0,11 Kmol/m3 .
A reacção é de 2ª ordem tipo II, K= 9,92 m3/Kmol.Kseg
Calcule para uma conversão global de 87%:
a- o volume do reactor CSTR
b- o volume se forem 2 reactores iguais CSTR em série.
5 - Determinada instalação fabril dispõe dum reactor CSTR com dois andares em série
de 300 dm3 de volume cada, onde se deseja realizar isotermicamente a reacção:
A +2 B ____________>C
reacção irreversível de 2ª ordem tipo II, sendo K=0,15 dm3/ (mol. min).
Para introduzir-se no 1º andar um caudal de 10 dm3 / min de uma solução com 2 M de
A e em ambos os andares um caudal de 5 dm3/ min de uma solução com 1 M de B.
a- Determine os graus de avanço e as conversões de cada reactor.
b- Apresente as diferenças processuais, caso os reactores CSTR estivessem em
paralelo, é possível confirmar que nesta situação a conversão global é menor?
6 - Numa unidade industrial, deseja-se realizar isotermicamente a reacção reversível
em fase líquida:
2A <____________> B + C
Com K1=1,25 dm3 /(mol. min) (sentido directo) e Keq=18 (contante de equilibrio).
88
Reactores Químicos I
A alimentação é realizada através de duas correntes, uma contendo um caudal de
1950 dm3 /mn de A com uma concentração de 21M e a outra de inerte com um caudal
de 1200 dm3 /mn e uma concentração de 5 M. Pretende-se:
a- dimensionar um reactor CSTR de um andar com um grau de avanço da reacção
igual a 90% do equilíbrio;
b- determinar o nº de andares necessários em série para se obter a mesma
conversão final, no caso de cada reactor ter 1/5 do volume do reactor
dimensionado na alínea a.
7 - Propõe-se para a reacção A + B
___
> C em fase líquida a utilização de dois
reactores CSTR em série. Dado que a espécie B é valiosa, escolheu-se trabalhar com
um excesso do reagente A, de tal modo que a expressão de velocidade reaccional é
de pseudo - primeira ordem em relação ao reagente B; A reacção é exotérmica e o
controlo da temperatura em ambos os reactores é efectuado por um permutador de
calor onde circula vapor de água a 1 atm e a 100 ºC. O fluido reaccional no primeiro
reactor encontra-se a 106 ºC e no segundo a 117 ºC.
Sabe-se que o volume de cada reactor é de 0,86 m3, o caudal volumétrico de
alimentação é 1,1
dm3 / s. Mais ainda, o calor específico da mistura reaccional (que
não é grandemente afectado pela reacção) é de 3,47 J / (cm3. K) e a alimentação entra
a 70ºC e tem uma composição inicial de 5,6 mol / dm3 de B.
Determine a área de transferência necessária para cada reactor e calcule a conversão
e o grau de avanço global Nota F0Cpo=QoCpó
K= 0,9.10-3 a 106 ºC s-1
∆ΗR = - 73 KJ / mol
K= 2,8.10-3 a 117 ºC s-1
U= 670 J / (s.dm2.K) para cada reactor.
8 - Optou-se numa unidade industrial pela utilização de um reactor contínuo
perfeitamente agitado CSTR de forma cilíndrica, com o diâmetro de 0,5 m e a altura de
1 metro. A reacção é realizada em fase líquida:
2A + B ________> 2 C
Sabe-se que a reacção é irreversível de 1ª ordem em ambos os reactores.
A alimentação é constituida por duas correntes, A com um caudal de 15 dm3 / min de
contendo 55 mol / min de A, o constituinte B com um caudal de 12dm3/ min de uma
solução com 29 mol/ min de B.
89
Reactores Químicos I
Se o reactor operar isotermicamente, em estado estacionário, qual será a conversão,
grau de avanço, a temperatura no reactor e a energia transferida ao permutador de
calor.
Temperatura média de entrada = 354 K.
Temperatura média do fluido de aquecimento =100ºC
K0= 1,2.106 min-1
EA= 12 Kcal/mol
∆Hr = - 22 Kcal / mol
Cpmédio= 0,81 cal / mol. K
U = 330 cal / h. dm2.K
A=20dm2
9 - Num reactor contínuo, perfeitamente agitado em estado estacionário, isotérmico,
com um volume de 1 m3, ocorre a seguinte reacção em fase líquida entre a acetona
(A) e HCN (B) numa solução aquosa, segundo a reacção química:
CH3COCH3 + HCN ↔ (CH3)2 C (CN)(OH)
As concentrações iniciais são CAo=0,1164 M CB0=0,0758 M e inerte CI=0,7 M.
A constante de equilibrio Keq= 13,87 M-1 e K1=7,6.10-3 M-1s-1
A alimentação é constituída por três correntes, de iguais caudais volumétricos.
a - Calcular o caudal volumétrico de cada constituinte, para que a conversão obtida
seja 90% da conversão de equilibrio.
b- calcular o nº de reactores em série se o volume de 1 m3, fosse reduzido a
¼,
para
se obter a mesma conversão final.
10 - Um reactor contínuo de volume de 500 litros, é alimentado com um reagente
gasoso A puro com uma concentração de 100mmol/dm3.
No reactor tem lugar a seguinte reacção em fase gasosa:
2 A1________>A2
Para diferentes valores de caudais de alimentação, obtiveram-se os seguintes
resultados:
Caudal Litros/h
30
9
3,6
1,5
Conc.mmol/dm3
85,7
66,7
50,0
33,3
Verificar se a equação é de 2ª ordem, admitindo que não há variações de pressão e
temperatura.
90
Reactores Químicos I
6 – Comparação dos diferentes tipos de reactores
Tipo
Características
Vantagens
Desvantagens
Utilização
Descontínuo,
Batch ou
Intermitente
Sistema fechado
Estado não
estacionário
Colocam-se os
reagentes no
início e retiram-se
os produtos no
final
Elevada conversão Alto custo
Baixo custo inicial
operacional
O recipiente é
Operação e
facilmente aquecido qualidade do
ou arrefecido
produto mais
Flexibilidade de
variável do que
operação
em operação
Fácil manutenção
contínua
Reacções em
fase líquida
Estudos de
laboratório
Tempos de
residência altos
Produtos de alta
pureza
Usos indústrias
cosmética e de
fermentação
Semi-batch ou
Semi-contínuo
Um dos reagentes
é colocado no
início e o outro
reagente em
contínuo
(pequena
concentração)
Ou um dos
produtos pode ser
removido
continuamente
para evitar
reações paralelas
Boa selectividade
Flexibilidade
operacional
Pode-se manter
baixa a
concentração de
um reagente
Pode ser usado um
condensador de
refluxo
Bom controlo de
temperatura
Reacções em
fase liquida
Reacções
altamente
exotéricas
Retirar produtos
gasosos
Baixa
concentração de
um reagente
Indústria
farmacêutica e
biológica
Química fina
CSTR ou reactor
com agitação
perfeita ou ideal
Sistema aberto
Operação
contínua
Estado
estacionário
Agitação perfeita
Produção em
Baixa conversão Reacções em
grande escala
por unidade de
fase liquida
Fácil controlo da
volume
Gás-líquido e
temperatura
No caso de má
sólido-líquido
Simples construção
agitação,
Adaptação fácil a
possibilidade de
reacções com duas
curtos-circuitos.
fases.
Sistema aberto
Operação
contínua
Estado
estacionário
Temperatura e
conversão são
função do
comprimento
Numa secção
transversal a
concentração é
constante
Elevada conversão
por unidade de
volume
Baixo custo
operacional
Boa transferência
térmica
Contínuo
PFR ou Tubular
Tipo pistão
Contínuo
91
Baixa produção
Alto custo
operacional
Qualidade do
produtos
variável
Gradientes
térmicos e de
concentrações
radiais
Controlo de
temperatura
deficiente
Para cada fluxo,
há tempos de
residência
diferentes
Paragem e
limpeza muito
onerosas
Fase gasosa
Alta produção
Temperaturas
elevadas
Reacções rápidas
Reactores
homogéneos ou
heterogéneos
catalíticos
Reactores Químicos I
Tipo
PBR ou Reactor
de enchimento
Contínuo
Reactor em Leito
Fluidizado
Características
Vantagens
Desvantagens
Utilização
Reactor tubular
Alta conversão por
cujo interior tem
unidade de massa
particulas de
de catalisador
catalisador
Contínuo
Estado
Baixo custo
estacionário
operacional
Reagentes e
produtos entram e
saem
continuamente
.efeitos difusionais
Gradientes
térmicos
indesejáveis
Controlo de
temperatura
deficiente
Podem ocorrer
caminhos
preferenciais
Dificil
manutenção
Fase gasosa com
catalisador sólido
Gás-sólido
Reacções
heterogéneas e
reacções em fase
gasosa com
catalisador
estudos
difusionais
Agitação perfeita
como o CSTR
Reacções
heterógeneas
Transporte dos
fluidos do leito
não é bem
conhecida
Uma forte
agitação pode
causar a
destruição do
catalisador e
formação de
produtos
indesejáveis
Incerteza no
scale-up
Reacções
heterogéneas e
reacções em fase
gasosa com
catalisador
Fase gasosa com
catalisador sólido
Gás-sólido
Contínuo
Boa mistura
Temperatura
uniforme
O catalisador pode
ser continuamente
regenerado com o
auxílio de um
controlo auxiliar
Tabela 6.1 - Vantagens, desvantagens e uso dos vários tipos de reactores ideais
A escolha do reactor a utilizar está condicionada por questões técnicas de aplicação a
uma reacção específica. O reactor descontínuo é utilizado apenas quando se pretende
produções reduzidas ou quando não se conhece o controlo completo do processo. É
um reactor muito versátil , pode ser utilizado para efectuar reacções com diferentes
selectividades, permitindo um controlo bastante preciso da extensão da reacção. Os
custos de instalação são semelhantes ao reator CSTR, mas os custos de operação
são mais elevados, dada a necessidade de operações por ciclo de carga, descarga e
lavagem do reactor. Os reactores CSTR são utilizados em sistemas reaccionais em
que existam reacções paralelas de forma a melhorar a selectividade do processo.
Dos reactores contínuos, o CSTR é o que apresenta menores custos por unidade de
volume. Porém, para se obter um determinado grau de avanço da reacção, o volume
do reactor CSTR é muito superior ao do reactor tubular.
O reactor tubular terá sempre um grau de avanço maior por unidade de volume do que
o reactor CSTR para as reacções com um comportamento cinético tradicional.Os
reactores tubulares são sempre mais convenientes em reacções em fase gasosa, por
motivos que têm a ver com a
sua construção e selagem, nomeadamente nos
empanques dos agitadores.
92
Reactores Químicos I
Produto
Reacção Tipo
Fase do Reactor
Aplicação
Hidrogenação óleos
Descontínuo
Líquida
Óleos vegetais
Ácidoacetilsalicilico
Semicontínuo
Líquido
Aspirina
Alquilato
CSTR
Líquido
Componentes
gasolina
Butadieno
CSTR
Líquido
Borracha
Monómero/polímero
Caprolacto
CSTR
Líquido
Plásticos ou fibras
Nafta
PFR
Gasoso
Etileno
Etileno
PFR
Gasoso
Polietileno
Polietileno
PFR
Líquido
Plásticos
Nylon-6
PFR
Líquido
Fibras ópticas
Acetato de Etilo
PFR
Líquido
Sabões e detergentes
Resíduos petróleo
Fluidizado
Gasoso/Sólido
Produtos aromáticos
Catalisador
saturado
Fluidizado
Gasoso/Sólido
Catalisador
regenerado
Tab. 6.2 Resumo de algumas aplicações industriais
Regime isotérmico (permutador de calor)
Regime adiabático
Sintese amoníaco
Oxidação SO2 a SO3
Sintese por oxidação: anidrido ftálico,
Conversão de CO:
maleico, acroleina, óxido de etileno
CO + H2O__>CO2+H2
formol.
Sintese fischer-tropsch
Desidrogenação do buteno
Reforma a vapor do metano ou nafta
Hidrogenação selectiva acetileno a etileno
Tab. 6.3
Resumo de algumas aplicações industriais em regime isotérmico e
adiabático (em fase homogénea).
93
Reactores Químicos I
Problemas
1 - Comente a seguinte afirmação, com base no gráfico abaixo:
” Aumentando o número de reactores CSTR associados em série, o volume total
necessário a uma da conversão, dado pela soma das áreas dos rectângulos,
aproxima-se do volume correspondente de um reactor tubular PFR (área por debaixo
da curva):
º+
Reactores CSTR em Série
2 - Quais as conclusões primordiais a retirar das figuras 6.1 e 6.2 .
94
Reactores Químicos I
Fig.6.1 Para uma reacção de 1ª ordem (A__________> Produtos),
A relação dos volumes de N reactores CSTR em série/ tubular é...
95
Reactores Químicos I
Fig.6.2 Para uma reacção de 2ª ordem (A__________> Produtos),
A relação dos volumes de N reactores CSTR em série/ tubular é...
3 - Numa unidade industrial, dá-se a decomposição em fase gasosa até 80%:
SO2Cl2___________> SO2+ Cl2
96
Reactores Químicos I
a 405ºC e 1,1 atm, sabendo que:
Ko= 6,5.1015s-1 E=53,2 Kcal.mole-1
Calcular o tempo espacial e comparar com o tempo no reactor CSTR .
4 - Para a reacção A + 2 B → 3C , sabe-se que K=0,01s-1 e a conversão é de 99% em
relação a A. O tempo espacial no reactor tubular é de 461s e o mesmo resultado se
obteria para o tempo de reacção no reactor descontínuo.
Em contrapartida, no reactor CSTR o tempo de permanência seria de 9900s, para o
mesmo processo.
Explique estes resultados.
5 – Na figura abaixo trata-se de uma associação em série PFR – CSTR
Balanço ao PFR-reactor tubular:
X1
dx
0 r
V1 = FAO ∫
Balanço ao CSTR:
V2 = FAO
X 2 − X1
r2
Compare com 2 reactores CSTR em série.
97
Reactores Químicos I
7 - Anexo
Tabela 1 - Constante dos Gases Perfeitos R
8,314
Pa m3 mol-1 K-1
8,314
J mol-1 K-1
1,987
cal mol-1 K-1
1,987
-1
-1
btu (mol-lb) ºR
82,06
atm cm3 mol-1 K-1
0,08206
atm dm3 mol-1 K-1
1,314
atm ft3 (mol-lb)-1 K-1
0,7302
3
-1
-1
atm ft (mol-lb) ºR
62,36
mmHg dm3 mol-1 K-1
998,9
3
-1 -1
mmHg ft (mol-lb) K
555,0
mmHg ft3 (mol-lb)-1 ºR-1
21,9
inHg ft3 (mol-lb)-1 ºR-1
847,81
kgf m-2 m3 mol-1 K-1
0,08478
kgf cm-2 dm3 mol-1 K-1
10,73
psia ft3 (mol-lb)-1 ºR-1
1545
lbf ft-2 ft3 (mol-lb)-1 ºR-1
7,805 × 10-4
hp h (mol-lb)-1 ºR-1
5,819 × 10-4
kW h (mol-lb)-1 ºR-1
8,317 × 107
erg mol-1 K-1
Massa volúmica de gases
Equação dos gases
w
P× M
ρ=
R ×T
PQ = ZFRT
Tab2. Simbologia
Grandezas
Nome
definição
F
Caudal molar
mol
tempo
Q
Caudal volumétrico
volume
tempo
τ
Tempo espacial
volume mol
=
Q
F
ξ
Grau de avanço
ξ*x V= ξ`` x τ
98
Reactores Químicos I
Tab.2 Coeficiente de fugacidade
Pr= pressão reduzida=
99
P
Pc
φ
Tabela 3 - Equações da Capacidade Calorífica para Compostos Orgânicos e Inorgânicos (a baixas pressões)
Reactores Químicos I
100
(continuação)
Tabela 3 - Equações da Capacidade Calorífica para Compostos Orgânicos e Inorgânicos (a baixas pressões)
Reactores Químicos I
101
Tabela 4 - Capacidades Caloríficas Molares Médias de Gases entre 25 ºC e t (ºC) (p = 0)
Reactores Químicos I
102
Reactores Químicos I
Tabela 5 -
Calores de Formação e Calores de Combustão de Vários Compostos a 25 ºC.
Os estados padrão dos produtos para ∆Ĥ co são CO2(g), H2O(l), N2(g), SO2(g), e HCl(aq).
Para converter a Btu/lb-mol, multiplique por 430.6.
Composto
Acetic acid
Fórmula
CH3COOH
∆Ĥ of
Massa
Molecular
Estado
kJ/mol
∆Ĥ co
kJ/mol
60.05
l
-486.2
-871.69
g
-919.73
Acetaldehyde
CH3CHO
40.052
g
-166.4
Acetone
C3H6O
58.08
aq, 200
-410.03
g
-216.69
-1821.38
-1299.61
Acetylene
C2H2
26.04
g
226.75
Ammonia
NH3
17.032
l
-67.20
g
-46.191
Ammonium carbonate
(NH4)2CO3
96.09
-1192.36
-382.58
c
aq
-941.86
Ammonium chloride
NH4Cl
53.50
c
-315.4
Ammonium hydroxide
NH4OH
35.05
aq
-366.5
Ammonium nitrate
NH4NO3
80.05
c
-366.1
aq
-339.4
c
-1179.3
aq
-1173.1
l
-88.83
g
-40.0
l
48.66
-3267.6
g
82.927
-3301.5
c
-1263
l
-1245.2
l
0
g
30.7
l
-147.6
-2855.6
g
-124.73
-2878.52
l
-158.5
-2849.0
g
-134.5
-2868.8
Ammonium su1fate
Benzaldehyde
Benzene
Boron oxide
Bromine
n-Butane
Isobutane
(NH4)SO4
C6H5CHO
C6H6
B2 O 3
Br2
C4H10
C4H10
132.15
106.12
78.11
69.64
159.832
58.12
58.12
103
Reactores Químicos I
1-Butene
C4H8
56.104
g
1.172
Calcium arsenate
Ca3(AsO4)2
398.06
c
-3330.5
Calcium carbide
CaC2
64.10
c
-62.7
Calcium carbonate
CaCO3
100.09
c
-1206.9
Calcium chloride
CaCl2
110.99
c
-794.9
Calcium cyanamide
CaCN2
80.11
c
-352
Calcium hydroxide
Ca(OH)2
74.10
c
-986.56
Calcium oxide
CaO
56.08
c
-635.6
Calcium phosphate
Ca3(PO4)2
310.19
c
-4137.6
Calcium silicate
CaSiO3
116.17
c
-1584
Calcium sulfate
CaSO4
136.15
c
-1432.7
aq
-1450.5
c
-2021.1
Calcium sulfate (gypsum)
CaSO4.2H2O
172.18
Carbon
C
12.01
-2718.58
c
0
-393.51
Graphite (β)
Carbon dioxide
Carbon disulfide
CO2
CS2
44.01
76.14
g
-393.51
l
-412.92
l
87.86
-1075.2
g
115.3
-1102.6
Carbon monoxide
CO
28.01
g
-110.52
-282.99
Carbon tetrachloride
CCl4
153.838
l
-139.5
-352.2
g
-106.69
-384.9
g
-105.0
-1421.1
l
-41.20
-5215.44
g
3.93
-5260.59
c
-769.86
aq
-843.12
c
-751.4
Chloroethane
Cumene
(isopropylbenzene)
Cupric sulfate
C2H5C1
C6H5CH(CH3)2
CuSO4
64.52
120.19
159.61
Cyclohexane
C6H12
84.16
g
-123.1
-3953.0
Cyclopentane
C5H10
70.130
l
-105.8
-3290.9
g
-77.23
-3319.5
104
Reactores Químicos I
Tabela 5 -
Calores de Formação e Calores de Combustão de Vários Compostos a 25 ºC.
(continuação)
Composto
Fórmula
∆Ĥ of
Massa
Molecular
Estado
kJ/mol
∆Ĥ co
kJ/mol
Ethane
C2H6
30.07
g
-84.667
-1559.9
Ethyl acetate
CH3CO2C2H5
88.10
l
-42.92
-2274.48
Ethyl alcohol
C2H5OH
46.068
l
-277.63
-1366.91
g
-235.31
-1409.25
l
-12.46
-4564.87
g
29.79
-4607.13
Ethyl benzene
C6H5.C2H5
106.16
Ethyl chloride
C2H5Cl
64.52
g
-105
Ethylene
C2H4
28.052
g
52.283
-1410.99
Ethylene chloride
C2H3C1
62.50
g
31.38
-1271.5
3-Ethyl hexane
C8H18
114.22
l
-250.5
-5470.12
g
-210.9
-5509.78
c
-403.34
c
-822.156
Ferric chloride
FeCl3
Ferric oxide
Fe2O3
Ferric sulfide
FeS2
Ferrosoferric oxide
Fe3O4
Ferrous chloride
FeCl2
Ferrous oxide
FeO
Ferrous sulfide
159.70
See lron sulfide
c
-1116.7
c
-349.67
71.85
c
-267
FeS
87.92
c
-95.06
Formaldehyde
CH2O
30.026
g
-115.89
-563.46
n-Heptane
C7H16
100.20
l
-224.4
-4816.91
g
-187.8
-4853.48
l
-198.8
-4163.1
g
-167.2
-4194.753
-285.84
n-Hexane
C6H14
231.55
See lron sulfide
86.17
Hydrogen
H2
2.016
g
0
Hydrogen bromide
HBr
80.924
g
-36.23
Hydrogen chloride
HCl
36.465
g
-92.311
Hydrogen cyanide
HCN
27.026
g
130.54
105
-303.76
Reactores Químicos I
Hydrogen sulfide
H2S
34.082
g
-20.15
-562.589
Iron sulfide
FeS2
119.98
c
-177.9
Lead oxide
PbO
223.21
c
-219.2
Magnesium chloride
MgCl2
95.23
c
-641.83
Magnesiurn hydroxide
Mg(OH)2
58.34
c
-924.66
Magnesium oxide
MgO
40.32
c
-601.83
Methane
CH4
16.041
g
-74.84
-890.4
Methyl alcohol
CH3OH
32.042
l
-238.64
-726.55
g
-201.25
-763.96
Methyl chloride
CH3C1
50.49
g
-81.923
-766.63¥
Methyl cyclohexane
C7H14
98.182
l
-190.2
-4565.29
g
-154.8
-4600.68
l
-138.4
-3937.7
g
-106.7
-3969.4
l
-173.23
aq
-206.57
Methyl cyclopentane
Nitric acid
C6H12
HNO3
84.156
63.02
Nitric oxide
NO
30.01
g
90.374
Nitrogen dioxide
NO2
46.01
g
33.85
Nitrous oxide
N2O
44.02
g
81.55
n-Pentane
C5H12
72.15
l
-173.1
-3509.5
g
-146.4
-3536.15
c
-1281
aq (1H2O)
-1278
Phosphoric acid
H3PO4
98.00
Phosphorus
P4
123.90
c
0
Phosphorus pentoxide
P2 O 5
141.95
c
-1506
Propane
C3H8
44.09
l
-119.84
-2204.0
g
-103.85
-2220.0
Propene
C3H6
42.078
g
20.41
-2058.47
n-Propyl alcohol
C3H8O
60.09
g
-255
-2068.6
¥
Estado Padrão HCl(g).
106
Reactores Químicos I
Tabela 5 -
Calores de Formação e Calores de Combustão de Vários Compostos a 25 ºC.
(continuação)
Composto
n-Propyl benzene
Fórmula
C6H5. CH2.C2H5
Massa
Molecular
120.19
∆Ĥ of
∆Ĥ co
Estado
kJ/mol
kJ/mol
l
-38.40
-5218.2
g
7.824
-5264.5
Silicon dioxide
SiO2
60.09
c
-851.0
Sodium cyanide
NaCN
49.01
c
-89.79
Sodium sulfate
Na2SO4
149.05
c
-1384.5
Sodium sulfide
Na2S
78.05
c
-373
Sodium sulfite
Na2SO3
126.05
c
-1090
Sodium thiosulfate
Na2S2O3
158.11
c
-1117
32.07
c
0
Sulfur
Sulfur chloride
S2C12
135.05
l
-60.3
Sulfur dioxide
SO2
64.066
g
-296.90
Sulfur trioxide
SO3
80.066
g
-395.18
Sulfuric acid
H2SO4
98.08
l
-811.32
aq
-907.51
l
11.99
-3909.9
g
50.000
-3947.9
l
-285.840
g
-241.826
l
-25.42
-4551.86
g
17.24
-4594.53
l
-24.44
-4552.86
g
19.00
-4596.29
l
-24.43
-4552.86
g
17.95
-4595.25
c
-978.55
aq
-1059.93
Toluene
Water
m-Xylene
o-Xylene
p-Xylene
Zinc sulfate
C6H5CH3
H2O
C6H4(CH3)2
C6H4(CH3)2
C6H4(CH3)2
ZnSO4
92.13
18.016
106.16
106.16
106.16
161.45
Fonte: Himmelblau, David M., Basic Principles and Calculations in Chemical Engineering, 6th Edition,
Prentice Hall, 19
107
Reactores Químicos I
108
Reactores Químicos I
Tabela 6 – Massa Volúmica de Líquidos
(continuação)
109
Reactores Químicos I
Tabela 6 – Massa Volúmica de Líquidos
(continuação)
Fonte: Raznjevicc, Kuzman, Handbook of Thermodynamic Tables, 2nd Edited and
Revised Edition, Begell House, inc., publishers, 1995.
110
Download