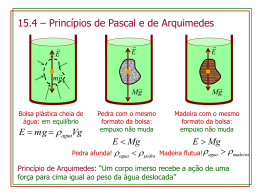
Densidade Tatiana Dillenburg Saint’Pierre Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons. http://creativecommons.org.br http://creativecommons.org/licenses/by-sa/3.0/br/legalcode Sala de Leitura Densidade Densidade Você já parou para pensar por que algumas substâncias são mais pesadas do que outras? Por que um copo de vidro é mais pesado do que um copo de plástico (Figura 1)? Será que é devido ao material do qual ele é feito? Certos materiais têm algumas propriedades que os tornam mais pesados ou mais leves. Figura 1: Materiais diferentes têm densidades diferentes. Vamos fazer um experimento: Pegue vários pedaços de um mesmo metal, mas de tamanhos diferentes. Pode ser qualquer metal disponível no laboratório, como chumbo (Pb) ou zinco (Zn), por exemplo; ou você ainda pode pegar pedaços de lata de refrigerante - que é feita de alumínio (Al), ou pedaços de fio de cobre (Cu). Agora, mergulhe cada pedaço em uma proveta com água para saber o volume do pedaço de cada metal. Você perceberá que o volume do metal corresponde à variação do volume de água na proveta (Figura 2). Atenção! Antes de iniciar o experimento, não se esqueça de verificar o volume inicial da água na proveta. Observe, também, eventuais bolhas de ar no interior da proveta, que podem causar erros ao experimento. Observação: toda vez que você esvaziar a proveta para tirar o metal, use um béquer para colocar a água retirada. Assim, evitará o desperdício de água. Faça isso, mesmo que seja para uma quantidade pequena de água. Depois de realizar o experimento, construa uma tabela (Tabela 1) com os resultados obtidos, colocando: de um lado, os valores das massas dos pedaços de metal; e de outro, os volumes correspondentes. . 1 . Sala de Leitura Densidade Tabela 1: Resultados das massas e volumes medidos. Massa Volume Relação Observe que tem uma coluna a mais nessa tabela, além das colunas de massa e de volume. Isso foi feito de propósito. A última coluna é a da relação, em que você poderá propor uma equação matemática que relacione massa e volume. Veja se existe alguma relação entre as massas e os volumes medidos que se repete em todas as linhas da tabela 1. Figura 2: Relação de massa medida e volume de água deslocado. . 2 . Sala de Leitura Densidade A partir da Figura 2 você pôde perceber que existe uma relação constante entre a massa e o volume de um mesmo material. Por ser uma constante, essa relação é uma propriedade característica da matéria. Essa propriedade é chamada de densidade. Densidade A densidade é uma propriedade da matéria que relaciona massa e volume. Em outras palavras, ela define a quantidade de massa de uma substância contida por unidade de volume. Densidade = massa / volume O conceito de densidade pode ser facilmente entendido na prática comparando objetos feitos a partir de diferentes substâncias, mas de mesmo volume. Portanto, sólidos com o mesmo volume - porém feitos de diferentes materiais - terão massas distintas, ou seja, materiais diferentes têm densidades diferentes. Imagine vários cubos, todos com o mesmo tamanho - com as dimensões de cubos de gelo, por exemplo - porém feitos de materiais diferentes, como: metal, plástico e o próprio gelo. Logicamente, os cubos terão massas diferentes. O cubo de metal será o mais pesado de todos e o de plástico o mais leve. Entretanto, nem sempre essa comparação será tão óbvia, pois dependerá dos materiais utilizados. Se compararmos cubos com 1 cm³ feitos de diferentes metais, perceberemos que cubos de alguns metais terão massas bem diferentes e outros, nem tanto. Isso ocorre porque entre os metais as densidades variam em um intervalo bastante grande, como mostra a Figura 3. Esta figura também evidencia que um cubo de alumínio (Al) é mais leve do que um cubo de mesmo tamanho feito de ferro (Fe), e este é mais leve do que um cubo feito de cobre (Cu) ou de chumbo (Pb). Figura 3: Densidades, em kg m-3, e massas, em g, de cubos de 1 cm3 de diferentes materiais. . 3 . Sala de Leitura Densidade Agora você já deve ser capaz de colocar diferentes materiais em ordem de densidade, basta sentir a massa de cada material com as mãos ou simplesmente compará-los usando uma balança. Por exemplo, qual dos dois metais você imagina que é mais denso, prata ou ouro? Veja na Figura 4 se você acertou a resposta. Figura 4: Comparação das massas de um cubo de prata (Ag) e um cubo de ouro (Au), ambos com o mesmo volume. Então, concluímos que a relação entre massa e volume de uma substância é a sua densidade. Quando se refere a uma substância pura, maciça e homogênea, como elementos ou compostos químicos, a densidade é chamada de densidade absoluta ou massa específica. Caso contrário, é chamada somente densidade e representa a densidade média de um corpo ou de uma substância não homogênea. A tabela periódica esquematizada abaixo (Figura 5) mostra como as densidades dos elementos químicos variam nos grupos e nos períodos. Figura 5: Variação das densidades dos elementos químicos dentro da tabela periódica. . 4 . Sala de Leitura Densidade De acordo com o Sistema Internacional (SI), a densidade é expressa em kg m-3, mas muitas vezes é encontrada expressa em g mL-1. As Figuras 6 e 7 mostram uma comparação de diferentes medidas de volume, expressas em diferentes unidades. Na Figura 6, observamos que o volume de 1 L, medido com um balão volumétrico ou com uma proveta, corresponde ao volume de um cubo de 1 dm3, ou seja, um cubo de 10 cm de lado. Na Figura 7, observamos a correspondência entre 1 cm3 (medido em uma cubeta) e 1 mL (medido com proveta ou com pipeta). Nessas figuras, foi utilizada uma solução diluída de permanganato de potássio (KMnO4) para facilitar a visualização dos volumes medidos. Figura 6: O volume de 1 L é igual ao volume de um cubo de 1 dm3 . . 5 . Sala de Leitura Densidade Figura 7: O volume de 1 mL é igual ao volume contido em 1 cm3. Densidade relativa A relação entre as densidades de diferentes substâncias com a densidade da água é denominada densidade relativa. A densidade da água é expressa em 1000 kg m-3, de acordo com o Sistema Internacional e conforme a recomendação da IUPAC. Portanto, 1 m3 corresponde a 1000 L, o que significa que 1000 kg de água ocupam um volume de 1000 L, ou seja, a densidade da água pode ser expressa como 1 kg L-1, que equivale a 1 g mL-1. Esta unidade é mais comumente utilizada, pois facilita a compreensão. No que se refere à densidade, deve-se ter em mente que os volumes variam com a temperatura e essa aproximação pode não ser válida em qualquer temperatura. Na verdade, 1 g mL-1 é a densidade da água na temperatura de 4 oC, temperatura na qual a água ocupa o maior volume, ou seja, é a temperatura de maior expansão da água. Esse comportamento diferente da água ocorre por causa das ligações existentes entre suas moléculas, mas isso é assunto para outra aula. Pode-se avaliar se a densidade de um determinado material é maior ou menor do que 1 g mL-1, simplesmente mergulhando em água um objeto feito do material em estudo. Assim, se o objeto tiver densidade maior do que a da água, ele afunda. Por outro lado, se a densidade for menor do que a da água, ele boia. Nesse caso, a densidade é relativa à densidade da água e é adimensional, pois é a razão entre duas densidades com mesmas unidades. . 6 . Sala de Leitura Densidade Então, se 1 mL de água pesa 1 g, 1 mL de outro líquido qualquer ou outra substância não terá necessariamente esta mesma massa. Veja o exemplo a seguir (Figura 8), que mostra um sistema composto por várias substâncias imiscíveis, com diferentes densidades. Figura 8: Comparação entre as densidades de várias substâncias. Você também pode fazer um experimento mergulhando em um recipiente com água diversos objetos feitos de materiais distintos. Antes de mergulhá-los, sinta o peso de cada um, tentando prever se o material é mais ou menos denso do que a água, ou seja, tente adivinhar se os objetos afundam ou boiam. Utilize objetos do seu próprio material escolar, como: lápis (madeira), borracha, régua de plástico - ou outros materiais, como: isopor, cortiça e metais. O que acontece ao tentar mergulhar uma bola de borracha, dessas de frescobol, na água? Ao contrário da borracha de apagar, que afunda, a bola de borracha boia. A que você atribui esse comportamento? Alguém poderia supor que os dois objetos sejam feitos de borrachas diferentes, com densidades diferentes. Entretanto, essa não é a justificativa correta. Nesse caso, a borracha é mais densa do que a água; porém a bola de borracha boia porque é oca e tem ar dentro! O conceito de densidade relativa foi empregado intuitivamente por Arquimedes, um filósofo e cientista, para resolver um problema do rei na época da Grécia Antiga, conforme você lerá a seguir. . 7 . Sala de Leitura Densidade Um pouco de História Arquimedes foi um filósofo, inventor e matemático grego que viveu por volta do ano 250 a.C. (287 a.C. – 212 a.C.), em uma cidade chamada Siracusa, na Grécia Antiga. Naquela época, o rei Hieron havia mandado fazer uma coroa de ouro, porém ele desconfiou que o ourives o tivesse enganado, misturando algum outro metal - menos nobre - com o ouro. O rei, então, ordenou a Arquimedes que solucionasse o problema, porém o rei não queria que a coroa fosse desmanchada. O prazo que o rei havia dado a Arquimedes estava se esgotando e, segundo a história, ele acabou encontrando a solução deste problema por acaso, durante o banho. Naquela época, não se tinha água encanada em abundância - como atualmente, e os banhos eram mais raros, tomados em banheiras em casas de banho! Ao entrar na banheira, Arquimedes percebeu que o seu corpo deslocava certo volume de água, fazendo a água transbordar, e deduziu que o volume da água deslocada deveria ser igual ao volume do seu corpo. Assim, ele imaginou que o volume de água, deslocado pela coroa, se essa fosse feita de ouro puro, deveria ser diferente do volume deslocado pela mesma coroa feita com uma mistura de ouro e outro metal. Isso pode ser traduzido como: uma determinada massa de ouro terá volume menor do que a mesma massa de outro metal, como a prata. Arquimedes ficou tão empolgado com a descoberta que saiu da banheira correndo para casa, sem roupa, gritando: Eureka! Eureka!, que significa encontrei, em grego. Figura 9: A história conta que Arquimedes empregou o conceito de densidade a partir da observação do volume de água que transbordava da banheira quando ele mergulhava. Da mesma maneira, concluiu que poderia usar a relação massa – volume para descobrir se o material da coroa era ouro puro. Na verdade, Arquimedes descobriu - a partir das densidades da coroa e do ouro - que a coroa não era de ouro puro, mas sim misturada com prata ou outro metal. Arquimedes percebeu que massas iguais . 8 . Sala de Leitura Densidade de diferentes metais deslocavam diferentes volumes de água. Para tanto, comparou a quantidade de água deslocada pela coroa com a quantidade de água deslocada pela mesma massa de ouro e de prata. A coroa deslocava maior quantidade de água do que a mesma massa em ouro, porém menor do que a mesma massa de prata. Isso mostra que a coroa não era feita somente de ouro. Ela tinha alguma quantidade de prata em sua composição. Essa descoberta confirmou a fraude! Densidade de substâncias compostas A densidade de uma substância composta ou de uma mistura é a média ponderada das densidades dos seus componentes, calculada a partir das porcentagens em massa de cada componente, como você pôde observar na história de Arquimedes. Assim, a bola de borracha boia porque a sua densidade é a média da densidade da borracha e da densidade do ar que está dentro dela, considerando suas quantidades. Retome a história da coroa que pertencia ao rei Hieron. Se a coroa fosse feita misturando-se partes iguais de ouro e prata, a densidade da liga metálica obtida seria a média direta entre as densidades dos dois metais, como mostra a Figura 10. Similarmente, se quantidades diferentes dos componentes fossem misturadas, a densidade do material resultante seria uma média ponderada das densidades de cada componente. Figura 10: A mistura de quantidades iguais de duas substâncias com densidades diferentes resulta em uma substância cuja densidade é a média das densidades dos seus componentes. . 9 . Sala de Leitura Densidade Se a coroa fosse feita somente de ouro, teria uma massa maior do que outra coroa, com o mesmo volume, feita somente de prata. Isso ocorre porque a densidade do ouro é de 19,30 g cm-3, enquanto a densidade da prata é de 10,49 g cm-3, ou seja, um cubo de 1 cm3 de ouro tem 19,30 g. Já um cubo de prata com as mesmas medidas, 1 cm3, possui massa bem menor, ou seja, 10,49 g - pouco mais do que a metade da massa do cubo de ouro. Em outro exemplo, se uma coroa de 1 kg fosse feita somente de ouro, ao ser mergulhada em água, deslocaria um volume de 51,8 cm3 ou 51,8 mL, enquanto que uma coroa de prata pesando 1 kg deslocaria 95,3 cm3 ou 95,3 mL de água. Isso equivale dizer que, se fossem feitas duas coroas exatamente iguais em tamanho e forma - uma delas feita de prata e outra de ouro - a de prata teria uma massa bem menor do que a de ouro. Por outro lado, se utilizassem as mesmas quantidades de prata e de ouro para fazer duas coroas, a de prata seria bem maior do que a de ouro. A Figura 11 representa os volumes ocupados por 1kg de prata e por 1 kg de ouro - nesse caso os metais foram representados na forma de pó para poderem ser "colocados" dentro de provetas de vidro. Figura 11: Volumes ocupados por 1 kg de prata (Ag) e por 1 kg de ouro (Au) na forma de pó. Determinação da composição de uma substância através das densidades dos seus componentes Por meio da densidade de um objeto ou de uma substância composta e das densidades dos seus componentes, pode-se determinar a porcentagem de cada componente na substância. Já a densidade de um material pode ser calculada a partir da composição do material e das densidades dos seus componentes. Como já mencionado, a densidade de uma substância composta é a média ponderada das densidades dos seus componentes, calculada a partir das porcentagens em massa de cada componente. Qual seria, então, a porcentagem de cada metal na coroa que pertencia ao rei Hieron, se a densidade dela fosse 17,5 g cm-3, e tendo o ourives misturado prata ao ouro? . 10 . Sala de Leitura Densidade dAu = 19,3 g cm-3 e dAg = 10,5 g cm-3 Temos um sistema de 2 equações e 2 incógnitas: dmistura = xAu . dAu + xAg . dAg xAu + xAg = 1 Substituindo: 17,1 = 19,3 xAu + 10,5 xAg xAu = 1 – xAg 17,1 = 19,3 (1 – xAg) + 10,5 xAg 8,8 xAg = 2,2 xAg = 0,25 e xAu = 0,75 Resposta: A composição da coroa é 75% de ouro e 25% de prata. Empuxo Quando um objeto é mergulhado em água, ao ser submerso, desloca um volume de água igual ao seu próprio volume, já que dois corpos não podem ocupar o mesmo lugar. O objeto sofre uma força contrária, devido ao deslocamento da massa de água que tem o mesmo volume do objeto. A força atuante de baixo para cima é denominada empuxo e ela é uma resultante da pressão hidrostática exercida pelo líquido, como mostra a Figura 12. Entende-se por pressão hidrostática - a força exercida pela água sobre a superfície de um objeto mergulhado. Essa pressão aumenta com a profundidade, portanto, a resultante é uma força de baixo para cima. É a mesma força sentida ao se tentar mergulhar a bola de borracha na água. . 11 . Sala de Leitura Densidade Figura 12: O empuxo é a força resultante da pressão exercida por um líquido sobre toda a superfície de um objeto mergulhado. O efeito do empuxo também faz com que o objeto mergulhado na água pareça pesar menos do que fora dela. Esse “menor peso” é chamado de peso aparente, definido como o peso do objeto menos o empuxo, ou seja, menos o peso do mesmo volume em água. Considerando que o empuxo é a resultante das pressões exercidas pelo líquido e que a pressão aumenta com a profundidade, a resultante será uma força de baixo para cima, devido ao deslocamento da massa de água de volume ser igual ao do objeto mergulhado. O empuxo também ocorre na atmosfera, porém numa extensão bem menor do que na água ou em outro líquido, já que a pressão exercida pelo ar é bem menor do que a pressão da água. Assim, o peso do objeto mergulhado pode ser calculado multiplicando a massa pela gravidade, menos o empuxo, como pode ser verificado na Figura 13. Por isso, um objeto mergulhado em um líquido apresenta um peso aparentemente menor do que se ele tivesse “mergulhado” no ar. Figura 13: O peso de um objeto mergulhado em um líquido é chamado de peso aparente, pois é o peso do objeto menos o empuxo exercido pelo líquido. . 12 . Sala de Leitura Densidade Conforme mostra a Figura 13, a seta partindo do centro de gravidade do objeto, para baixo, representa o peso (P): P = mobjeto . g (1) A seta partindo do centro de gravidade do objeto, para cima, é o empuxo - representado por (E): E = mágua . g (2) Como o volume do objeto é igual ao volume de água deslocado, se a massa do objeto for maior do que a massa do mesmo volume de água, o objeto afundará. Por outro lado, se o objeto flutua, significa que a massa dele é menor do que a massa do volume de água deslocado, ou seja, tem densidade menor do que a água. A Figura 14 mostra um experimento que comprova o empuxo. Observe a marcação na escala da balança. No caso de uma coroa feita de ouro, os pesos serão: fora da água = 1000 g; e mergulhada = 948,2 g. Figura 14: O peso aparente de um objeto mergulhado em um líquido é menor do que o peso do mesmo na atmosfera. Assim: Paparente = Pobjeto – E (3) Paparente = (mobjeto . g) – (mágua . g) (4) . 13 . Sala de Leitura Densidade Substituindo as massas pela relação (densidade . volume), pode-se determinar a densidade de um material por meio do seu peso aparente: Paparente = (dobjeto . Vobjeto . g) – (dágua . Vágua . g) (5) Como o volume do objeto é igual ao volume de água deslocado, pode-se isolar (V . g): Paparente = (Vobjeto . g) . (dobjeto .– dágua) (6) A partir dessa expressão você pode perceber que, se o objeto tem densidade maior do que a água, seu peso aparente será positivo, ou seja, ele afundará. Por outro lado, se a densidade do objeto for menor do que a da água, seu peso aparente será negativo e ele irá boiar. Por outro lado, voltando às equações (1) e (2): P = mobjeto . g = dobjeto . Vdeslocado . g (7) e E = mágua . g = dágua . Vdeslocado . g (8) Você pode reescrevê-las como: P / dobjeto = E / dágua (9) De (3), sabe-se que: E = Paparente – Pobjeto, Então: Pobj / dobj = (Paparente – Pobj) / dágua Ou seja: dobj = dágua . Pobj / (Paparente – Pobj) (10) . 14 . Sala de Leitura Densidade Que também poderão ser reescritas em função das massas, já que (P = m . g): dobj = dágua . mobj / (mobj – maparente) (11) E assim você conseguirá determinar a densidade de um objeto por meio da massa aparente. Densidade de soluções Tente fazer a seguinte experiência: mergulhe um ovo em água e observe. De início, o ovo afundará na água pura. Em seguida, adicione sal à água e veja o que acontece. Você notará que, depois de adicionar sal à água, o ovo boiará. A Figura 15 ilustra essa experiência. Figura 15: Um ovo afunda em água, mas boia em água com sal. O ovo afunda porque a densidade dele é um pouco maior do que a da água pura. Quando se adiciona sal à água, pelo fato do sal (NaCl) ser bem mais denso do que a água, a solução resultante terá uma densidade maior do que a da água pura. Nesse caso, o princípio é o mesmo que foi explicado em relação à densidade da coroa que pertencia ao rei Hieron: “a densidade da mistura é a média ponderada das densidades de cada componente (já vimos que média ponderada é a média considerando as porcentagens em massa).” Portanto, a densidade da solução de água com sal ficará maior do que a densidade do ovo e por isso ele boia. Esse mesmo fenômeno acontece no Mar Morto. Você sabia que é impossível afundar (Figura 16) - e, consequentemente, afogar-se nele? O Mar Morto, na verdade, é um lago de água salgada, localizado entre a Jordânia, Israel e a Cisjordânia (Figura 17). O Mar Morto é o ponto mais baixo da superfície da . 15 . Sala de Leitura Densidade Terra: fica a 392 m abaixo do nível do mar. É chamado de mar devido ao seu tamanho aproximadamente 85 km de comprimento por 17 km de largura - e de morto porque suas águas são tão salgadas que nenhum peixe ou alga vive nele. O clima daquela região é muito quente, o que faz a água evaporar e o sal dissolvido ficar mais concentrado, tornando a água mais salgada. Em algumas partes mais rasas pode-se até ver pequenas ilhas de sal, como mostra a Figura 18. Fazendo uma comparação, a quantidade de sal na água dos oceanos é de aproximadamente 3%, enquanto no Mar Morto - pode chegar até 30%! Com essa concentração, a densidade fica próxima da do corpo humano, tornando impossível alguém afogar-se nas suas águas Figura 16: É impossível afundar nas águas do Mar Morto. . 16 . Sala de Leitura Densidade Figura 17: Localização do Mar Morto, no Oriente Médio. Figura 18: Ilhas de sal nas regiões mais rasas do Mar Morto. . 17 . Sala de Leitura Densidade Da mesma maneira como foi feito para a coroa que pertencia ao rei Hieron, pode-se calcular a densidade das águas do Mar Morto (ou de qualquer solução) por meio da média ponderada. Considerando a água do Mar Morto uma solução de água com 30% de NaCl, pode-se calcular sua densidade: dH2O = 1,00 g cm-3 e dNaCl = 2,165 g cm-3 dsolução = x H2O . dH2O + x NaCl . dNaCl dsolução = 0,70 . 1,00 + 0,30 . 2,165 dsolução = 1,3495 g cm-3 A densidade da água do Mar Morto, portanto, deve ser de aproximadamente 1,35 g cm-3. Densidade maior do que a da média do corpo humano. Mas você já se perguntou qual é a densidade do corpo humano? É uma pergunta difícil, pois nosso corpo é formado por ossos, carne, muita água, gordura e o ar dos pulmões e das vísceras. Os ossos e a carne têm densidade maior do que a da água, mas a gordura e o ar têm densidade menor. Assim, conclui-se que o corpo humano possui uma densidade média muito próxima ou levemente menor do que a da água. Por isso, para boiar, basta encher os pulmões de ar! Densidade de líquidos As densidades de soluções e de líquidos podem também ser medidas facilmente - sem cálculo, por meio de um aparelho chamado densímetro, também conhecido como areômetro (Figura 19). O densímetro flutua no líquido quando seu peso é igual ao empuxo exercido pelo líquido. A densidade do líquido é indicada por meio da graduação na haste do equipamento, pelo valor da escala coincidente com a superfície do líquido. . 18 . Sala de Leitura Densidade Figura 19: Foto de dois densímetros com escalas diferentes. Esse tipo de equipamento é bastante utilizado para medir a graduação alcoólica de bebidas ou o teor de água no álcool combustível, por exemplo. O álcool etílico utilizado nos carros a álcool é chamado de AEHC (Álcool Etílico Hidratado Combustível) e possui um teor de água médio de 7%. A Agência Nacional de Petróleo, Gás Natural e Biocombustíveis (ANP) regulamenta o teor alcoólico do álcool combustível na faixa de 92,6º a 93,8º INPM. O grau INPM, definido pelo Instituto Nacional de Pesos e Medidas, é a fração em massa, ou seja, 1 kg de álcool combustível tem em média 930 g de álcool e 70 g de água. Teores de água acima dos valores permitidos pela ANP são característicos de combustíveis adulterados, que podem trazer prejuízos ao motor do veículo. Como as densidades da água (1000 kg m3) e do álcool (789,4 kg m-3) são diferentes, a solução resultante terá densidade proporcional às quantidades dos dois líquidos, facilmente medida com um densímetro. O mesmo aplica-se à gasolina adulterada por adição de etanol. A Figura 20 mostra a medida da densidade de uma série de gasolinas às quais foram adicionadas quantidades crescentes de álcool . 19 . Sala de Leitura Densidade combustível, usando dois densímetros com diferentes escalas. A gasolina que é vendida nos postos de combustível tem aproximadamente 25% de etanol e a densidade medida foi de 0,746 g mL-1, como pode ser observado no detalhe da Figura 20A. O etanol tem densidade maior do que a gasolina. Observa-se na figura que, à medida que etanol é adicionado (20B, 20C e 20D), a cor do combustível vai clareando e a densidade aumentando. Observe que nas Figuras 20A e 20B foi usado um densímetro com escala de 0,70 a 0,75 g mL-1, enquanto que - nas misturas 20C e 20D - foi usado um densímetro com escala entre 0,75 e 0,80 g mL-1 . 20A 20B 20C 20D Figura 20: Teste do densímetro para gasolina adulterada: o aumento crescente da quantidade de etanol torna a mistura mais clara e mais densa. Abaixo de cada foto, foram colocadas as fotos ampliadas das escalas dos densímetros. Submarino Até esse ponto, você já deve ter intuído que os navios, embora sendo feitos de materiais mais densos do que a água, não afundam por causa da sua forma, que mantém ar naturalmente no seu interior. Como o ar é bem mais leve do que a água, impede que o navio afunde. Mas você sabe como funcionam os submarinos que, mesmo sendo feitos de metal, podem afundar ou emergir? (Figura 21) Nos submarinos, existem compartimentos que podem ser cheios com ar ou com água para fazer com que este suba ou desça. Quando os compartimentos estão cheios de ar, o empuxo exerce força maior do que o peso do submarino e este sobe até a superfície (Figura 21C), até seu peso aparente se igualar . 20 . Sala de Leitura Densidade ao empuxo (Figura 21A). Substituindo o ar por água, o peso do submarino torna-se maior do que o empuxo. Logo, o submarino afunda (Figura 21B). Mas, se o submarino precisa de ar para emergir, ele precisaria carregar ar no seu interior, e esse ar o impediria de afundar, certo? Sim, porém, nesse caso, o ar tem de ser carregado sob pressão, na forma líquida. Como a densidade do líquido é bem maior do que a do gás, o peso do submarino fica maior do que o empuxo e ele pode afundar! Figura 21: Funcionamento de um submarino, que pode afundar ou emergir através de tanques que podem ser cheios com água ou ar. . 21 .
Baixar