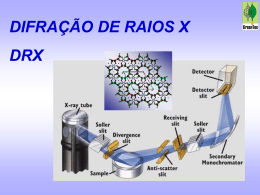
JUSTIFICATIVA Brasília, 7 de agosto de 2015 Processo nº: 25351.211949/2014-17 Consulta Pública nº 60/2015 Agenda Regulatória 2013-2014: Subtema nº 16.1 Assunto: Proposta de método geral, Difração de Raios X, para inclusão na Farmacopeia Brasileira, 6º edição. Diretor Relator: José Carlos Magalhães da Silva Moutinho Área responsável: COFAR/SUMED A Anvisa possui por competência legal promover a revisão e atualização periódica da Farmacopeia Brasileira, conforme disposto no inciso XIX do artigo 7º da Lei 9.782 de 26 de janeiro 1999. O contexto desta competência está apoiado nas ações de regulamentação sanitária e indução ao desenvolvimento científico e tecnológico nacional, que se concretiza por meio da revisão e incorporação de novos requisitos de qualidade para diversas substâncias de interesse farmacêutico e sua publicação na forma de monografias na Farmacopeia Brasileira, de modo a garantir a proteção da saúde dos brasileiros. A técnica de análise de substâncias químicas por difração de raios X é muito importante na elucidação da conformação de moléculas, principalmente na identificação das fases cristalinas, estimativa do grau de cristalinidade, microdeformação e tamanho médio do cristalito. A introdução deste método na Farmacopeia Brasileira traz avanços significativos para o controle da qualidade de fármacos, uma vez que será disponibilizado um método fundamental na caracterização do estado cristalino de insumos farmacêuticos. Esse controle é essencial para a identificação de formas polimorfas de substâncias, que embora apresentem o mesmo perfil físico-químico nos demais ensaios, podem ser distinguidos pela análise por difração de Raios X. Essa distinção é relevante, nos casos de insumos ativos cuja estrutura apresenta formas polimorfas diversas e com atividades farmacológicas diferentes. A iniciativa para a publicação da minuta do método geral Difração de Raios X foi aprovada pelo Despacho do Diretor-Presidente Substituto n° 76 de 22/10/2014. Considerando os aspectos mencionados acima e as informações complementares que instruíram o Processo, a Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (Anvisa), em reunião realizada no dia 30 de julho de 2015, aprovou a realização da presente Consulta Pública acerca da proposta do método geral Difração de Raios X, a fim de submeter o assunto a comentários e sugestões da sociedade em geral. O prazo previsto para envio das contribuições é de 30 dias, a partir do dia 14/08/2015, após o qual o processo seguirá novamente para análise técnica e apresentação da proposta final, a ser aprovada pela Diretoria Colegiada. Com o intuito de facilitar e agilizar as atividades de compilação, análise e resposta às contribuições da Consulta Pública, bem como possibilitar a visualização, em tempo real, das sugestões e críticas recebidas, a Anvisa adotou o uso do formulário eletrônico do DATASUS (FormSUS). Durante o período previsto para o envio das contribuições para esta consulta, o formulário estará disponível no endereço eletrônico http://formsus.datasus.gov.br/site/formulario.php?id_aplicacao=21959. Não é necessário o encaminhamento de contribuições por email ou por protocolo físico. 1 O aprimoramento das rotinas e dos procedimentos de Consulta Pública é um dos instrumentos do Programa de Melhoria do Processo de Regulamentação da Anvisa (PMR), também conhecido como Programa de Boas Práticas Regulatórias. O Programa, instituído em abril de 2008, tem o propósito de aprimorar e modernizar a atuação regulatória da Agência, na perspectiva de promover maior previsibilidade, transparência e estabilidade ao processo regulatório. Dessa forma, espera-se que o uso da nova ferramenta de contribuição eletrônica responda aos anseios da sociedade para estimular a participação social e garantir mais transparência no processo. A submissão de propostas de atos normativos à Consulta Pública visa colher subsídios para qualificar as decisões regulatórias da Anvisa e assim assegurar que comentários, pareceres e sugestões sobre esses atos possam ser conhecidos pela Agência e levados em consideração na decisão final do conteúdo da norma. 2
Baixar