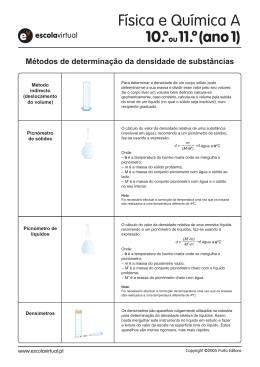
ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA O que se pretende Utilizar técnicas experimentais de determinação de propriedades físicas características das substâncias como métodos de identificação e avaliação da sua pureza. Verificar significados As substâncias puras possuem propriedades físicas características, como a massa volúmica, a densidade relativa, o ponto de fusão e o ponto de ebulição. Por determinação experimental destas grandezas físicas e sua comparação com os respectivos valores tabelados relativos a substâncias puras podem‐se tirar conclusões quanto à natureza e pureza das substâncias em análise. A massa volúmica (ρ) é por definição a razão entre a massa da substância e o seu volume, a uma determinada pressão e temperatura. Esta grandeza física exprime‐se em g/cm3 ou kg/m3 A densidade relativa (d) é a razão entre a massa volúmica de uma substância e a massa volúmica de um padrão (referência),nas mesmas condições de pressão e temperatura. A densidade relativa é pois uma grandeza física adimensional. Nos sólidos e nos líquidos o padrão é a água, à temperatura de 4 °C e à pressão de 105 Pa. Nos gases o padrão é o ar seco, à temperatura de 0 °C e à pressão 105 Pa. Se o volume da substância e do padrão forem iguais então a densidade relativa é igual ao quociente entre a massa da substância e massa do padrão. A densidade relativa de uma substância à temperatura T pode ser convertida na densidade relativa a 4 °C, através da seguinte expressão: á á O ponto de ebulição é a temperatura a que ocorre a passagem de uma substância do estado líquido para o estado gasoso, a uma determinada pressão. 1 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 O ponto de fusão é a temperatura a que ocorre a passagem de uma substância do estado sólido para o estado líquido, a uma determinada pressão. 1 – Determinação da massa volúmica de um cubo de metal Lista de material e reagentes Descrição Cubo de metal Craveira Balança automática Quantidade 1 1 1 Procedimento 1. Pesar o cubo de metal e medir a sua aresta como uma craveira, conforme ilustrado nas figuras abaixo. Registar os respectivos valores. Fig. 1 Pesagem do cubo de metal. Fig. 2 Medição da aresta do cubo de metal. Registos Massa do cubo (g) Comprimento da aresta do cubo (mm) 79,49 21,27 Cálculos 79,49 2,127 8,261 g/cm 2–Determinação da massa volúmica de um líquido por areometria Lista de material e reagentes Descrição Densímetro Proveta de 250 ml Termómetro Quantidade 1 1 1 2 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 Etanol comercial a 95 % 1 Procedimento 1. Transferir o etanol para a proveta. 2. Mergulhar o densímetro no líquido, sem que este toque nas paredes ou no fundo da proveta. 3. Ler o valor da massa volúmica na escala existente na haste (intercepção da parte inferior do menisco com a escala) e registar o valor 4. Medir a temperatura do etanol com o termómetro e registar o valor. Fig. 3 Medição da densidade. Registos Massa volúmica do etanol (g/cm3) Temperatura do etanol ( ) 0,810 17 2 – Determinação da densidade relativa de um líquido por picnometria Lista de material e reagentes Descrição Balança automática Picnómetro de líquidos Esguicho com água Etanol comercial a 96 % Papel Absorvente Quantidade 1 1 1 1 1 Procedimento 1. Medir a massa do picnómetro e registar o seu valor. 2. Encher completamente o picnómetro com etanol, tendo o cuidado de fazer escorrer o líquido lentamente pela parede (evitar formação de bolhas de ar). 3. Introduzir a tampa do picnómetro com um movimento vertical rápido que obrigue a entrar para o seu interior todo o líquido. 4. Secar o picnómetro com papel absorvente e verificar se está completamente cheio até à marca. Caso seja necessário adicionar mais etanol, utilizar uma pipeta de Pasteur, se pelo contrário o nível do líquido ultrapassar a marca utilizar papel absorvente para remover o excesso. 5. Medir a massa do picnómetro cheio de etanol e registar o seu valor. 6. Repetir os passos 2 a 4 utilizando água. Fig. 4 Pesagem do picnómetro cheio de etanol. 3 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 7. Medir a a massa do picnómetro cheio de água e registar o seu valor. 8. Medir a temperatura da água e registar o seu valor. Registos Massa do picnómetro (g) Massa do picnómetro cheio de etanol (g) Massa do picnómetro cheio de água (g) Temperatura da água ( ) 13,30 35,49 40,81 16,0 Cálculos 1‐ Cálculo da densidade relativa do etanol a 96 % à temperatura do ensaio: , , 0,8066 , , 2‐ Cálculo da densidade relativa do etanol a 96% à temperatura de 4 Dados: 3 á 1,00000 g/cm 0,99899 g/cm3 á Densidade relativa do etanol a 4 : 0,99899 0,8066 0,8058 1,00000 3 – Determinação da densidade relativa de um sólido por picnometria Lista de material e reagentes Descrição Balança automática Picnómetro de sólidos Esguicho com água Pedaços de metal Papel absorvente Quantidade 1 1 1 4 1 Procedimento 1. Encher completamente o picnómetro com água, tendo o cuidado de fazer escorrer o líquido lentamente pela parede (evitar formação de bolhas de ar). 2. Introduzir a tampa do picnómetro com um movimento vertical rápido que obrigue a entrar para o seu interior todo o líquido. 3. Secar o picnómetro com papel absorvente e verificar se está completamente cheio até à marca. Caso seja necessário adicionar mais água, utilizar uma pipeta de Pasteur, se pelo contrário o nível do líquido ultrapassar a marca utilizar papel absorvente para remover o excesso. 4 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 4. Medir a massa dos pedaços de metal e registar o seu valor. 5. Medir a massa do conjunto picnómetro cheio de água mais pedaços de metal. Registar esse valor. Fig. 5 Pesagem do conjunto picnómetro cheio de água + pedaços de metal. 6. Retirar um pouco de água do picnómetro. 7. Introduzir os pedaços de metal dentro do picnómetro e completar com água até à marca. Caso seja necessário adicionar mais água, utilizar uma pipeta de Pasteur, se pelo contrário o nível do líquido ultrapassar a marca, utilizar papel absorvente para retirar o excesso. 8. Secar o picnómetro com papel absorvente e medir a massa do picnómetro com água e pedaços de metal. Registar esse valor. Fig. 6 Pesagem do picnómetro cheio com água e pedaços de metal. 9. Medir a temperatura da água e registar o seu valor. Registos Massa dos pedaços de metal (g) Massa do conjunto picnómetro cheio de água mais pedaços de metal (g) Massa do picnómetro cheio com água e pedaços de metal (g) Temperatura da água ( ) 18,04 170,96 168,58 16,0 5 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 Cálculos 1‐ Cálculo da massa de água com o mesmo volume que o conjunto de pedaços de metal: 170,96 168,58 2,38 g 2‐ Cálculo da densidade relativa do metal à temperatura do ensaio: , 7,58 , 3‐ Cálculo da densidade relativa metal à temperatura de 4 Dados: 3 á 1,00000 g/cm 0,99899 g/cm3 á Densidade relativa do metal a 4 : 0,99899 7,58 7,57 1,00000 5 – Determinação do ponto de ebulição do etanol comercial a 95% por destilação utilizando um equipamento de aquisição e tratamento de dados Lista de material e reagentes Descrição Clips de plástico Alonga Erlenmeyer Suporte Universal e garra Esferas de vidro Sensor de temperatura e cabo de interface Adaptador para o sensor de temperatura Condensador de Liebig Cabeça de destilação Balão de destilação de fundo redondo Manta de aquecimento Mangueira para o arrefecimento Suporte Universal Garra Computador Quantidade 2 1 1 1 1 1 1 1 1 1 1 2 1 1 1 6 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 Procedimento 1. Colocar no balão de destilação umas quantas esferas de vidro e transferir para este amostra a analisar. 2. Observar a figura e efectuar a montagem para determinação do ponto de ebulição. Fig. 7 Montagem para determinação do ponto de ebulição por destilação. 3. Verificar se as mangueiras se encontram correctamente ligadas, isto é, a mangueira de entrada de água na parte inferior do condensador e a de saída de água na sua parte superior. 4. Conectar o sensor de temperatura ao computador através do respectivo cabo de interface. 5. Abrir a torneira da água e ligar a manta de aquecimento. 6. Prosseguir o ensaio até que após uma subida acentuada da temperatura esta então se mantenha constante. 7 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 Registos Gráfico 1 Temperatura em função do tempo durante a destilação do etanol comercial a 96 %. Temperatura de ebulição do etanol a 96% ( ) 78 6 – Determinação do ponto de fusão de um sólido utilizando um método tradicional Lista de material e reagentes Descrição Tubo de Thiele Bico de Bunsen Termómetro Capilar fechado numa das extremidades Capilar aberto nas duas extremidade Rolha cortiça com 2 perfurações Suporte universal e garra Vidro de relógio Elástico Naftaleno Quantidade 1 1 1 1 1 1 1 1 1 1 8 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 Procedimento 1. Pulverizar uma pequena quantidade de naftaleno (0,1 g), triturando‐o bem com uma microespátula, sobre uma placa de porcelana porosa ou uma folha de papel de filtro. 2. Transferir o naftaleno para um vidro de relógio e formar um pequeno monte. 3. Transferir o naftaleno para o capilar fechado numa das extremidades, enterrando a sua extremidade aberta no monte de naftaleno. Fig. 8 Transferir a amostra para o capilar. 4. Sacudir o sólido dentro do capilar, batendo cuidadosamente com a extremidade fechada na bancada, para que este desça para o fundo do capilar. Fig. 9 Compactar a amostra no capilar. 5. Repetir 3. e 4. até formar um camada compacta de sólido com cerca de 1 cm de altura. 6. Prender o capilar com um elástico ao termómetro por forma a que a sua extremidade fechada fique ao nível do bolbo do termómetro. 7. Preparar o banho de aquecimento num tubo de Thiele (encher até ao máximo de 2/3 da sua capacidade). 8. Inserir o termómetro/capilar fechado e o capilar aberto nas respectivas perfurações da rolha de cortiça. 9. Introduzir o conjunto montado na rolha cortiça no banho de aquecimento, e ajustar o termómetro/capilar de forma a que estes fiquem imersos no banho de aquecimento, mas com o elástico fora do banho. 9 ACTIVIDADE LABORATORIAL – QUÍMICA 10.º ANO – ALQ 1.3 Fig. 10 Montagem no tubo de Thiele. 10. Segurar o tubo de Thiele pela sua parte superior com uma garra fixa num suporte universal. 11. Posicionar o suporte universal de forma a que a chama do bico de Bunsen incida sob o ângulo da tubuladura lateral do tubo de Thiele. Fig. 11 Montagem para a determinação do ponto fusão. 12. Acender o Bico de Bunsen. 13. Aquecer o banho até atingir uma temperatura 20 abaixo do ponto de fusão previsto para a amostra. Então reduzir e controlar o aquecimento por forma a aquecer o banho lentamente (cerca de 2 por min). 14. Observar com atenção a amostra. 15. Registar a temperatura em que surge a primeira gota de líquido no capilar temperatura de e a temperatura em que o último traço de sólido desaparece. 16. Após a fusão da amostra desligar imediatamente o aquecimento e deixar arrefecer até que o banho atinja os 20 . Registos Intervalo de fusão ( ) 78,0 – 79,5 10
Baixar