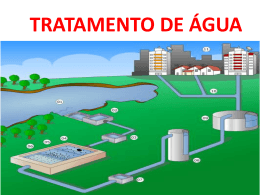
UNISALESIANO Centro Universitário Católico Salesiano Auxilium Bacharelado em Química Glauco Oliveira Santos Carlos Augusto de Jesus Xavier Luan da Silva Tomé POLÍMERO NATURAL DE FÉCULA DE MANDIOCA COMO AUXILIAR DE FLOCULAÇÃO EM TRATAMENTO DE ÁGUA PARA ABASTECIMENTO PÚBLICO LINS – SP 2012 GLAUCO OLIVEIRA SANTOS CARLOS AUGUSTO DE JESUS XAVIER LUAN DA SUILVA TOMÉ POLÍMERO NATURAL DE FÉCULA DE MANDIOCA COMO AUXILIAR DE FLOCULAÇÃO EM TRATAMENTO DE ÁGUA PARA ABASTECIMENTO PÚBLICO Trabalho de Conclusão de Curso apresentado à Banca Examinadora do Centro Salesiano Universitário Auxilium, Católico curso de Bacharelado em Química, realizado sob a orientação do Prof. Me. Olayr Modesto Júnior. LINS – SP 2012 Santos, Glauco Oliveira; Xavier, Carlos Augusto de Jesus; Tomé, Luan da Silva. S235p Polímero natural de fécula de mandioca como auxiliar de floculação em tratamento de água para abastecimento público / Glauco Oliveira Santos; Carlos Augusto de Jesus Xavier; Luan da Silva Tomé. – – Lins, 2012. 45p. il. 31cm. Monografia apresentada ao Centro Universitário Católico Salesiano Auxilium – UNISALESIANO, Lins-SP, para graduação em Química Bacharelado, 2012. Orientador: Olayr Modesto Junior 1. Polímero. 2. Fécula de Mandioca. 3. Tratamento de água. I. Título. CDU 54 GLAUCO OLIVEIRA SANTOS CARLOS AUGUSTO DE JESUS XAVIER LUAN DA SILVA TOMÉ POLÍMERO NATURAL DE FÉCULA DE MANDIOCA COMO AUXILIAR DE FLOCULAÇÃO EM TRATAMENTO DE ÁGUA PARA ABASTECIMENTO PÚBLICO Trabalho de Conclusão de Curso, apresentado ao Centro Universitário Católico Salesiano Auxilium, como requisito obrigatório, para obtenção do título de Bacharel em Química. Aprovado em: 04/12/2012. Banca Examinadora: Professor Orientador: OLAYR MODESTO JÚNIOR. Titulação: Mestre em Química. Assinatura: ______________________________. 1º Professor (a): JOÃO ARTUR IZZO. Titulação: Mestre em Comunicação. Assinatura: ______________________________. 2º Professor (a): FRANCISCO DE ASSIS ANDRADE. Titulação: Mestre em Ciência dos Materiais, Física da Matéria Condensada. Assinatura: ______________________________. DEDICATÓRIAS À minha mãe Alcemira, à minha esposa Rosilei e ao meu filho Lucas, pessoas que lutam diariamente ao meu lado, transmitindo fé, amor, alegria, determinação, paciência, e coragem, tornando os meus dias mais felizes e bonitos. Sem vocês eu não seria nada. Glauco À minha namorada Carla, que teve grande participação em muitas das minhas conquistas, repito aqui para que todos saibam “te amo hoje e sempre”. Carla espero cada dia estar mais junto a ti; e à minha mãe Maria com seu imenso carinho e amor sempre ao meu lado me dando força quando foi necessário e passando por todas as dificuldades comigo. Luan À minha esposa Cristiane que, durante os anos em que levou esse curso, “segurou a barra” junto comigo, lutou em casa para que eu pudesse alcançar esse objetivo, “te amo muito“; e à minha mãe Ivany que sempre deixou que eu estudasse mesmo passando dificuldades nunca me tirou da escola, apoiando-me para ser um homem de bem. Carlos Augusto AGRADECIMENTOS À Deus, pela graça que nos concedeu de vencer todos os obstáculos de nossas vidas que nos deu coragem para questionar realidades e propor sempre um novo mundo de possibilidades. Às nossas famílias, por sua capacidade de acreditar e investir em nós. Ao professor orientador Olayr Modesto Júnior por ter se dedicado a nos ajudar, sempre trazendo melhorias ao nosso trabalho, mostrando sempre o melhor caminho a seguir. A todos os professores do curso de Bacharelado em Química, por terem compartilhado seus conhecimentos. Aos nossos amigos, pelas alegrias, tristezas e dores compartilhadas. Podemos dizer que a nossa formação, inclusive pessoal, não teria sido a mesma sem a ajuda de vocês. A todos aqueles que de alguma forma estiveram próximos de nós, fazendo a nossa vida valer a pena cada vez mais. Glauco / Carlos Augusto / Luan “A mente que se abre a uma nova ideia jamais volta ao seu tamanho original.” Einstein “O homem fraco espera pela oportunidade; o homem comum agarra-a quando ela vem; o grande cria-a como ele a quer.” Adolf Tàrneros RESUMO Este trabalho mostra como pode ser produzido e utilizado o polímero de fécula de mandioca (PFM) como auxiliar de floculação em tratamento de água para abastecimento público. Teve-se como objetivo, testar a eficiência do PFM em comparação ao polímero sintético poliacrilamida (PA), que hoje é o mais utilizado para este fim. O tratamento com PFM, evita que a PA possa deixar na água o seu monômero acrilamida que é altamente tóxico, e se a contaminação ocorrer por um período de tempo longo pode-se até ter um efeito cancerígeno em quem consome esta água. A grande dificuldade que se encontra na maior parte das Estações de Tratamento de Águas (ETA), do Brasil, é o crescimento populacional acelerado, ou seja, o rápido aumento na demanda de água tratada. Devido à falta de investimentos para ampliação dos sistemas, a maior parte delas trabalha acima da sua capacidade de produção, fazendo com que a água produzida perca qualidade em detrimento da quantidade. As alternativas para voltar a atender, adequadamente, as demandas atuais são: investimentos para ampliação da ETAs existentes ou construção de novas e modificação no processo para aumentar a velocidade de produção. Assim, é neste sentido que se buscou através deste trabalho, avaliar os benefícios da utilização do PFM para aumentar a velocidade de decantação de uma ETA, melhorando a qualidade da água tratada, através da substituição de um polímero sintético, por um natural e mais eficiente. Nos testes realizados com o PFM foi possível constatar a sua eficiência, mostrando que realmente é possível substituir a poliacrilamida pelo polímero natural de fécula de mandioca. Palavras-chave: Química Industrial. Polímero de Fécula de Mandioca. Tratamento de Água. Poliacrilamida. . ABSTRACT This work shows how can be produced and used the cassava starch polymer (PFM) as an aid to flocculation on treatment of water for public supply. Had as goal, test efficiency PFM in comparison to synthetic polymer polyacrylamide (PA), which today is the most widely used for this purpose. Treatment with PMF, prevents the PA can let in water its monomer acrylamide that is highly toxic, and if contamination occurs for a long period of time can even have a carcinogenic effect in those who consume the water. The great difficulty that is found in most water treatment plants (ETA), of Brazil, is the rapid population growth, the rapid increase in the demand for treated water. Due to the lack of investments for expansion of the systems, most of them works above its production capacity, causing the water produced Miss quality rather than quantity. The alternatives to meet current demand properly are: investments for extension of existing and construction of new ETAs and modification in the process to speed up production. It is in this sense that if sought through this work, evaluate the benefits of the use of the PFM to speed up settlement of an ETA, improving the quality of treated water through the replacement of a synthetic polymer, for a natural and more efficient. In tests conducted with the PMF, proved its efficiency, showing that it really is possible to replace the PA by natural polymer of manioc starch. Keywords: chemical industries. Cassava starch polymer. Water treatment. Polyacrylamide. LISTA DE FIGURAS Figura 1: Fluxograma de uma Estação de Tratamento de Água....................... 14 Figura 2: Corte transversal de um decantador de ETA. .................................... 18 Figura 3: Sulfato de alumínio ............................................................................ 22 Figura 4: Cloreto férrico .................................................................................... 23 Figura 5: Acacia mearnsii De Wild - Acácia negra. ........................................... 24 Figura 6: Moringa oleífera Lam. - Moringa ........................................................ 26 Figura 7: Sistema laboratorial para floculação. ................................................. 31 Figura 8: Gráfico da velocidade de decantação por análises de turbidez. ........ 32 Figura 9: Análises em meio de cultura Rapid Coliform Broth. ........................... 38 Figura 10: Análise de presença-ausência de Coliformes fecais com RCB, a) água bruta, b) água tratada com PAC + PFM. ........................................... 38 Figura 11: Gráfico da velocidade de decantação por análises da cor aparente. ................................................................................................................... 40 LISTA DE TABELAS Tabela 1: Velocidade de decantação por análise de turbidez (NTU/min). ........ 33 Tabela 2: Análise microbiológica com o meio de cultura Count Plante Agar. ... 36 Tabela 3: Velocidade de decantação por análise de cor aparente ( UC/min). .. 41 LISTA DE SIGLAS E ABREVIATURAS ÁGUA B: Água Bruta ETA: Estação de Tratamento de Água NTU: Unidades Nefelométricas de Turbidez PA: Poliacrilamida PAC: (Poli Aluminium Chloride) Policloreto de Alumínio PCA: Plat Count Agar – Agar para contagem bacteriana PFM: Polímero de fécula de mandioca RCB: Rapid Coliform Brth - Caldo para cultivo de Coliformes UC: Unidade de cor uH: Unidade Hazen SUMÁRIO INTRODUÇÃO .................................................................................................. 11 CAPÍTULO I – ESTAÇÃO DE TRATAMENTO DE ÁGUA ................................ 13 1 PROCESSO DE POTABILIZAÇÃO DA ÁGUA DE RIOS .............................. 13 1.1 Etapas de tratamento em uma ETA ..................................................... 15 1.1.1 Sistemas de captação de água superficial ............................................... 15 1.1.2 Coagulação ou floculação .................................................................... 15 1.1.3 Decantação .......................................................................................... 17 1.1.4 Filtração ............................................................................................... 18 1.1.5 Desinfecção ......................................................................................... 19 1.1.6 Fluoretação .......................................................................................... 20 1.2 Coagulantes ......................................................................................... 20 1.2.1 Sulfato de alumínio............................................................................... 21 1.2.2 Cloreto férrico ....................................................................................... 22 1.2.4 Proteínas de Moringa oleífera Lam. – Moringa .................................... 25 CAPÍTULO II – POLÍMERO DE FÉCULA DE MANDIOCA ............................... 27 2 POLÍMERO DE FÉCULA DE MANDIOCA COMO AUXÍLIAR DE FLOCULAÇÃO EM TRATAMENTO DE AGUA................................................. 27 2.1 Vantagens e desvantagens da utilização do polímero de fécula de mandioca em relação à poliacrilamida .............................................................. 28 2.2 Produção do Polímero de Fécula de Mandioca ................................... 28 2.3 Análise de turbidez e velocidade de decantação ................................. 29 2.3.1 Avaliação da velocidade de decantação .............................................. 30 2.4 Análises bacteriológicas ....................................................................... 34 2.4.1 Análises microbiológicas com PCA ...................................................... 34 2.4.2 Análises microbiológicas com Rapid Coliform Broth ............................ 36 2.5 Análise da cor ...................................................................................... 39 CONCLUSÃO ................................................................................................... 42 REFERÊNCIAS ................................................................................................ 43 INTRODUÇÃO Nos dias atuais, quando se busca quantidade com qualidade, para se diminuir os custos de tudo o que a sociedade consome, cada vez mais fica claro que somente através de novas tecnologias aplicadas à produção podemse obter resultados neste sentido. Sendo assim, se faz necessário, cada vez mais, investimentos em novos equipamentos ou produtos químicos, para resolver velhos problemas que ainda hoje afetam a sociedade. Um exemplo é o problema estudado neste trabalho, ou seja, buscar uma solução para aumentar a quantidade de aguá tratada em uma Estação de Tratamento de Água (ETA), sem diminuir a qualidade do produto servido à população e sem ampliação da planta, ou seja, sem construir uma nova linha de tratamento. Devido à grande quantidade de água a ser tratada numa ETA, para dar conta da demanda de consumo, que a cada dia só faz crescer, somente a aplicação do floculante, policloreto de alumínio, não é suficiente, devido ao tempo necessário para a decantação dos flocos formados. O floculante necessita da ajuda de um auxiliar de floculação para aumentar a velocidade de decantação e diminuir o tempo do processo, possibilitando um aumento na capacidade de produção de água tratada pela ETA. Na maioria das ETAs, vem sendo aplicado como auxiliar de floculação, a poliacrilamida - PA, mas este polímero pode liberar na água seu monômero, a acrilamida, que é altamente toxico e pode causar câncer se consumido por longo período. Desta forma buscou-se encontrar um substituto para a poliacrilamida, um composto que não fosse tóxico, de fácil produção e baixo custo, que possa efetivamente aumentar a quantidade de água tratada sem prejudicar a qualidade. Tendo isto em mente questionou-se: é possível substituir a poliacrilamida pelo polímero de fécula de mandioca, já que este atende aos requisitos de ser barato, natural e não tóxico. No primeiro capítulo foi demonstrado como se faz o tratamento de água para abastecimento público e os produtos que são utilizados para este fim, explicando o que ocorre em cada etapa de uma ETA. 12 No segundo capitulo fala-se especificamente do polímero de fécula de mandioca, bem como, mostra-se e discutem-se os testes realizados para avaliação da eficiência desse material, como auxiliar de floculação. CAPÍTULO I ESTAÇÃO DE TRATAMENTO DE ÁGUA 1 PROCESSO DE POTABILIZAÇÃO DA ÁGUA DE RIOS Existem dois tipos de fontes para captação de água para abastecimento, os mananciais superficiais (rios, lagos, canais) e subterrâneos (lençóis freáticos e aquíferos). As águas de superfície são as de mais fácil captação e por isso acabam sendo uma tendência, para que sejam mais utilizadas no consumo humano, no entanto, tem-se que menos de 5% da água doce existente no globo terrestre encontra-se disponível superficialmente, ficando o restante armazenado em reservas subterrâneas. Assim, tendo-se em vista que quanto mais se perfuram poços, mais se criam pontos passíveis de contaminar estes mananciais, pois cada perfuração é uma possível porta de entrada para microorganismos até os lençóis subterrâneos, devem-se tomar precauções para evitar a contaminação (SHREVE; BRINCK JR, 1997). O tratamento da água através de uma purificação ou potabilização tem o objetivo de remover os contaminantes que eventualmente a água contenha, tornando-a potável, isto é, própria para o consumo humano. De acordo com a fonte de água, varias técnicas poderão ser empregada para esse fim, podendose também, acrescentar a ela substâncias que trazem beneficio ao ser humano, como exemplo o Flúor. O local onde se faz o citado tratamento chama-se Estação de Tratamento de Água ou abreviadamente ETA (GAUTO; ROSA, 2011). Na Figura 1 é mostrado um croqui de uma Estação de Tratamento de Água. Nela notam-se as seguintes partes: 1. Captação: estação elevatória por bombas centrífugas de captação de água bruta; 2. Pré-alcalinização: adição, se necessária, de compostos alcalinos para 14 ajustar o pH a valores necessários para uma eficiente coagulação; 3. Coagulação: adição de coagulante e auxiliares de coagulação, seguido de uma agitação enérgica da água para provocar a desestabilização elétrica das partículas, facilitando sua agregação; 4. Pós-alcalinização: adição, se necessária, de compostos alcalinos para ajustar o pH a valores necessários às demais fases do tratamento; 5. Floculação: agitação lenta da água para provocar a agregação das partículas e formação de flocos; 6. Decantação: passagem lenta da água por grandes tanques permitindo que a gravidade promova a decantação dos flocos de sujeira; 7. Filtração: passagem da água por tanques que contêm camadas de pedras, areia e carvão antracito para retirar pequenos flocos que passaram pelo decantador, bem como, cor e odor, se presentes na água; 8. Desinfecção: adição de desinfetantes à agua, normalmente a base de cloro, para promover sua desinfecção e garantir um teor residual até a chegada à casa do consumidor, atuando sobre contaminações do percurso; 9. Fluoretação: adição de flúor à água para a prevenção de cáries; 10. Amostragem: coleta de amostras para controle de qualidade. Figura 1: Fluxograma de uma Estação de Tratamento de Água. Fonte: RELATÓRIO ..., 2012. 15 1.1 Etapas de tratamento em uma ETA 1.1.1 Sistemas de captação de água superficial Uma captação deve priorizar o menor custo sem o sacrifício da funcionalidade. Para que se consiga isto, deve-se estudar com antecedência a vazão que pode ser retirada, a estabilidade natural do ponto de captação, a velocidade da correnteza, as consequências da utilização desse manancial e a existência de apoio às estruturas a serem edificadas; deve-se ainda estimar a vida útil do ponto de captação, a facilidade de acesso e de instalação de equipamentos e construção das edificações necessárias para uma boa captação da água de um rio para posterior tratamento (DI BERNARDO; DANTAS, 2005). A água é captada dos mananciais superficiais por meio de bomba centrífuga e encaminhada por meio de uma adutora para tanques na ETA. A extremidade onde ocorre a sucção da água é provida de grades para impedir a passagem de detritos, plantas, peixes e quaisquer objetos que possam ser sugados pelas bombas e adentrar na tubulação até o local de tratamento da água. Se as condições geograficas favorecerem essa captação também poderá ser feita aproveitando a ação da gravidade (DI BERNARDO; DANTAS, 2005). A água, antes de entrar na ETA, passa por um equipamento para medição de vazão, a CALHA PARSHALL. Esta é um canal com largura prédeterminada, medindo-se a velocidade e a altura da lâmina de água. Através de uma escala instalada na lateral do equipamento calcula-se a vazão, isto é necessário para a dosagem correta dos produtos que serão adicionados para o tratamento (DI BERNARDO; DANTAS, 2005). 1.1.2 Coagulação ou floculação O processo de coagulação é realizado por meio da adição de um produto coagulante, que pode ser sulfato de aluminio, policloreto de aluminio ou outros. A finalidade deste primeiro composto adicionado à água é promover a aglutinação de impurezas particuladas que se encontram na água, formando 16 uma suspensão fina ou coloidal, gerando flocos grandes, passíveis de decantação por ação da gravidade. Quando estas impurezas estão em um estado coloidal, ou seja, em um estado de equilíbrio na água, elas não se sedimentam pela força da gravidade. Isso pode ser explicado pelo fato das partículas presentes serem carregadas negativamente e sofrerem repulsão mutua, isto impede que elas se aproximem, se unam e formem partículas maiores que acabariam por se sedimentarem de forma natural. Desta maneira, com a utilização de agentes químicos coagulantes de carga elétrica oposta à das partículas, aqueles acabam atraindo as partículas em suspensão, estabelecendo assim um processo chamado de floculação, que nada mais é do que a transformação das impurezas que estavam num estado coloidal para um estado de aglomeração, provocando uma precipitação natural pela ação da gravidade (GAUTO; ROSA, 2011). Para a escolha do produto coagulante adequado, cloreto férrico, sulfato de alumino, policloreto de alumínio ou outro, deve-se levar em consideração diversos parâmetros, entre eles: pH da água a ser tratada, composição das partículas, e outros. Como a avaliação teórica é extremamente complexa, ensaios laboratoriais são realizados para verificar qual coagulante se adequa melhor àquele tipo de água (SHREVE; BRINCK JR, 1997). Após a medida da vazão e a adição adequada de floculante, a água é encaminhada para o tanque de floculação para que o agente de coagulação se misture uniformemente na água, agindo de uma forma homogênea e efetiva (SHREVE; BRINCK JR, 1997). Na etapa de floculação, a água é submetida à agitação mecânica branda, para possibilitar que os flocos agreguem cada vez mais partículas dos sólidos em suspensão, isto proporciona a formação de flocos maiores e uma decantação mais rápida. Em se tratando de tratamento de água, quanto mais rapida e eficiente for a fase de decantação, melhor será o resultado final do produto acabado, ou seja, tratar a maior quantidade possível de água em menor tempo e espaço. O aumento da eficiência possibilita trabalhar em espaços reduzidos, ou no caso da estrtutura já estar com seu espaço físico delimitado. Ao ser mais eficiente no tratamento, pode se evitar a construção de 17 uma nova ETA para atender ao aumento natural da demanda (GAUTO; ROSA, 2011). A equação 1, mostra, como exemplo, a reação de hidrólise do agente coagulante mais utilizado em ETAs, o sulfato de alumínio. Al2(SO4)3 + 12H2O → 2 Al(H2O)6 3+ + 3SO4-2 (1) Devido ao fato do íon hexa-aquo-alumínio, Al(H2O)6 3+, ser um ácido de Lewis, este reage com as partículas em suspensão, na água a ser tratada, que normalmente têm caráter de bases de Lewis e, por estas terem alcalinidade mais forte que a da água. Devido a estas características o Al(H2O)6 3+ tem reação preferencial com as sujidades da água, para só depois reagir com as moléculas de água. Com isto ocorre a perda da alcalinidade e, também, uma redução do pH, sendo desta maneira necessário, para águas que já possuíam um pH baixo, a adição de um agente alcalinizante junto ao uso do floculante, para que aja uma correção da alcalinidade da água e uma ação eficiente do floculante, para uma posterior decantação (DI BERNARDO; DANTAS, 2005). 1.1.3 Decantação A água que contém os flocos já formados ao entrar nos tanques, onde vai ocorrer à decantação, ela o faz lentamente e o tempo de retenção é de aproximadamente 4 horas. O tempo de permanência neste equipamento deve ser suficiente para que os flocos sofram sedimentação por ação da gravidade, devido à maior densidade dos flocos em comparação com a água. Para favoreçer ainda mais a decantação dos flocos, no tanque de sedimentação, água passa pelas seguintes zonas: de turbilhonamento, decantação, repouso e ascenção. As impurezas decantadas formam lama no fundo do tanque, composta basicamente por matéria orgânica, argila e microorganismos que se aglutinaram formando os flocos, esta lama por sua vez tem que ser retirada por um sistema de purga periódico, não comprometendo a agilidade do processo nem a qualidade da água (GAUTO; ROSA, 2011). 18 Figura 2: Corte transversal de um decantador de ETA. Fonte: AQUASTORE, 2012. Na Figura 2 mostra-se em destaque a ação do decantador, notar que ao entrar no tanque, os flocos começam a se sedimentar, formando uma lama no fundo do tanque, chamada zona de repouso. A água que sai do decantador é encaminhada para os filtros. 1.1.4 Filtração Praticamente isenta de flocos, a água que transborda do decantador chega aos filtros de leito poroso, o qual tem em sua estrutura uma camada de areia, com aproximadamente 75 cm de altura, que fica sobre uma camada de cascalho com 30 cm de altura, apoiada esta sobre uma base de tijolos de orifícios drenantes. A água atravessa os poros destas camadas, onde ficam retidas todas as impurezas, desde flocos menores que passaram pela decantação, e chegaram aos filtros até micro-organismos e bactérias. Isto pode ser inferido devido à formação de uma pelicula de material gelatinoso que se forma em torno dos grãos de areia, em sua maior parte de material biológico, que ajuda a reter tudo que vem com a água, inclusive as bactérias (GAUTO; ROSA, 2011). A retenção destas impurezas que se fixam no entorno dos grãos de areia vai criando uma obstrução dos poros, dificultando a passagem da água e, 19 desta maneira, faz-se necessário que seja feita uma retrolavagem dos filtros para que seja feita a sua limpeza e retirada do material que ficou retido e que agora obstrui a passagem da água (GAUTO; ROSA, 2011). 1.1.5 Desinfecção A água que sai dos filtros ainda não está potável, mesmo tendo sido retida no processo grande quantidade de bactérias. As barreiras formadas pelo decantador e pelo filtro não eliminam a totalidade das bactérias e outros microorganismos presentes, uma pequena quantidade de bactérias e microrganismos patogênicos podem passar e devem ser eliminados, por um processo não mecânico. A desinfecção biológica se faz através da aplicação de compostos químicos com poder desinfetante. O cloro gasoso é o mais usado atualmente para este fim. Além da quantidade necessária para eliminar as bactérias presentes na água, deve-se adicionar um excesso para manter na rede de distribuição certa quantidade da substância desinfetante para evitar que a água seja contaminada no trajeto da ETA até os seus consumidores (SHREVE; BRINCK JR, 1997). Segundo a Portaria Nº 2.914, de dezembro de 2011, em seu artigo 34º, é responsabilidade da União, dos Estados, dos Municípios e do Distrito Federal a adoção das medidas necessárias para o fiel cumprimento desta Portaria, a qual dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade, fica estabelecido que água fornecida seja obrigatória à manutenção de, no mínimo, 0,2 mg/L de cloro residual livre, ou 2 mg/L de cloro residual combinado ou de 0,2 mg/L de dióxido de cloro em toda a extensão do sistema de distribuição (reservatório e rede), na rede de distribuição, para a desinfeção, manutenção e prevenção contra micro-organismos patogênicos (BRASIL, 2011, p. 11). Para um desinfetante poder ser utilizado para o tratamento de águas para abastecimento público, este tem que ser capaz de eliminar micro-organismos patogênicos, na temperatura do lugar e em tempo curto de contato para que a água ao sair da ETA já esteja descontaminada. Além disso, não deve causar toxicidade e nem dar odor ou sabor a esta água, sendo possível 20 determinar facilmente a sua concentração na água. Deve permanecer um residual nesta água a fim de se evitar que esta seja contaminada posteriormente, ter um custo baixo, ser de fácil manuseio e obtenção, por todas estas razões a cloração é, até hoje, a mais utilizada para a desinfecção de águas. No entanto a desvantagem é que o cloro é corrosivo e na presença de compostos orgânicos, pode reagir formando substâncias cancerígenas, como as cloraminas. Por isso o processo de coagulação e decantação devem ser os mais eficientes possíveis (GAUTO; ROSA, 2011). 1.1.6 Fluoretação Para se diminuir a incidência de cárie dental são aplicados compostos fluorados à água para que ao ser consumida por crianças com dentição em formação fortalecendo o esmalte dos dentes e, ainda, permite a diminuição do número e do potencial de micro-organismos bucais, sendo considerada como uma concentração ótima na faixa entre 0,8 a 1,2 mg/L. Pesquisas recentes nesta área indicam que a aplicação de flúor na concentração indicada traz beneficios tambem aos adultos reduzindo a ocorrência de osteoporose e prevenindo o endurecimento das artérias. Os compostos fluoretados mais utilizados são o fluoreto de sódio (NaF), fluorsilicato de amônia - (NH4) 2 SiF6, e o ácido fluorsilícico H2SiF6, após esta etapa a água pode-se ser considerada potável, ou seja, dentro dos padrões de potabilidade exigidos atualmente no Brasil (GAUTO; ROSA, 2011). 1.2 Coagulantes Neste tópico, será abordada a ação dos diversos agentes coagulantes que são utilizados no tratamento de água para consumo humano. Esses agentes são adicionados na água com a função de reduzir as forças eletrostáticas de repulsão, que mantém separadas ás partículas em suspensão. Desta forma elimina-se ou se reduz a barreira de energia que impede a aproximação TRATAMENTO..., 2001). entre as diversas partículas presentes (O 21 Coagulação ou floculação é o processo de atração e adesão entre as partículas dispersas de um coloide por ação de agente coagulante. Esse processo é um das etapas mais importantes, pois ela facilita a remoção de turbidez e cor, auxilia na eliminação de bactérias, vírus e muitos outros agentes patogênicos, bem como, algas e plânctons (ARBOLEDA, 1991). A coagulação é feita para a remoção de partículas que existem na água, seja em suspensão ou na forma coloidal, onde o tamanho é aproximadamente 1 nm (10-9 m) a 0,1 nm (10-10 m), causando turbidez e mau cheiro, estas partículas por sua vez não se sedimentam e devem ser tratadas por meios físicos e químicos (DI BERNARDO; DANTAS, 2005). Esse processo é importante, pois com a eliminação e/ou redução desta barreira de energia possibilita a aglutinação destas partículas facilitando sua remoção por sedimentação e/ou filtração. Os coagulantes mais usados nessa etapa são o Sulfato de Alumínio e o Cloreto Férrico, pois liberam espécies químicas de alumínio e ferro de alta densidade de cargas elétricas, de sinal contrário às manifestadas pelas partículas presentes na água bruta. Eliminamse, assim, as forças de repulsão eletrostática originalmente presentes na água bruta, o que faz com que se acelere de forma significativa a floculação, pois assim tornam maiores esses sedimentos e assim mais densos, precipitando mais rapidamente (O TRATAMENTO..., 2001). 1.2.1 Sulfato de alumínio Acredita-se que desde 2000 a.C. os egípcios já utilizavam o sulfato de alumínio no tratamento de água. Mas foi somente em 1881, na cidade de Bolton, na Inglaterra que o mesmo começou a ser utilizado no tratamento de água para abastecimento publico (GAUTO; ROSA, 2011). O sulfato de alumínio é um sólido não inflamável, não explosivo e de baixa toxidade. É o agente coagulante mais utilizado nas ETAs brasileiras, é um acido de Lewis, reage com as bases que encontra na água, formando o hidróxido de alumínio. O hidróxido de alumínio formado pela hidrólise do sal de alumínio favorece a aglutinação das partículas coloidais permitindo assim sua precipitação em forma de flocos (GAUTO; ROSA, 2011). 22 Figura 3: Sulfato de alumínio Fonte: SULFATO ..., 2012. Os hidróxidos gelatinosos formados pelo sulfato de alumínio são insolúveis em água, eles desestabilizam, agregam e aderem às partículas do coloide, transformando-os em coágulos. O que determina a quantidade de reagentes a ser utilizada no processo são a turbidez e a coloração que tem que ser removida da água. Esta quantidade é determinada após testes de coagulação e floculação em laboratório. Os reagentes são aplicados na câmara de mistura rápida e tudo é enviado para o tanque de floculação, onde ocorre o crescimento dos coágulos formando flocos, os quais aderem uns aos outros, formando flocos ainda maiores, aumentando assim sua densidade e provocando a precipitação. Favorece, assim, a separação dessas partículas (GAUTO; ROSA, 2011). 1.2.2 Cloreto férrico Muitos acreditam que o tratamento de água com cloreto férrico é novo, mas essa prática é utilizada há mais de cem anos, foi o primeiro coagulante utilizado na cidade de Louisvile, no estado americano de Kentucky, em outras regiões seu uso é recente. O cloreto férrico (FeCl3), assim como o sulfato de alumínio, ao ser adicionado à água, em sua forma iônica, é convertido em hidróxido férrico, por reagir com as bases contidas na água. Quando o íon férrico interage com o material coloidal, a interação é tão forte que é difícil 23 encontrar desvantagem molar em seu uso sobre outros coagulantes (LIBÂNIO, 1995). Figura 4: Cloreto férrico Fonte: CLORETO ..., 2012. A massa molar deste composto é maior que a do sulfato de alumínio, assim sendo, seus flocos têm maior densidade, o que faz com que se precipitem mais rapidamente e formem uma lama mais compacta, trazendo algumas vantagens ao processo. A primeira, é que com essa forte interação é necessário menos coagulante para a remoção das partículas, o que o torna mais eficaz que o composto de alumínio; a segunda é que com flocos mais densos, pode se ter espaços menores para esse processo, que ocorrerá com maior agilidade quando comparado ao uso de sulfato de alumínio (LIBÂNIO, 1995). 1.2.3 Taninos de Acacia mearnsii De Wild - Acácia negra Há entre 120 e 130 variedades de acácia negra cultivadas no mundo, com uma expectativa de vida entre 10 e 15 anos para uso. A acácia negra é originária da Austrália, foi inicialmente exportada para a Índia em 1843, e logo em seguida foi para a África do Sul em 1868, com a finalidade de uso na produção de energia. No Brasil as primeiras árvores foram plantadas no Rio Grande do Sul em 1918. Porém, o cultivo comercial só teve início em 1930 com a importação de 30 kg de semente da África do Sul (CALDEIRA, et al., 2003). O principal objetivo da implantação da acácia negra no Brasil era para a extração de tanino, presente na casca da árvore, que tem grande utilidade em diversas aplicações industriais, como exemplo cita-se sua aplicação na indústria de peles e couros para curtimento destas. Conforme citado no texto 24 intitulado “Quantificação de tanino em três povoamentos de Acacia mearnsi”. Em muitos países o cultivo da acácia negra é utilizado para a fixação de nitrogênio no solo, porém, no Brasil está sendo cultivada com duas finalidades, para extração de tanino e produção de energia (MARTINEZ, 2006). A Figura 5 mostra um exemplar adulto de acácia negra, da qual se extrai um tipo de tanino que possui uma ampla utilidade em diversos segmentos industriais. Nos curtumes, é utilizado pra tratar peles de animais com a função de evitar que estas apodreçam. Isso ocorre por causa de uma reação deste com as cadeias peptídicas da molécula de colágeno. As moléculas do tanino são capazes de se ligarem por meio de pontes de hidrogênio com o grupo funcional da cadeia polipeptídica da pele animal (SHREVE; BRINCK JÚNIOR, 1980). Figura 5: Acacia mearnsii De Wild - Acácia negra. Fonte: EMBRAPA, 2012. Nos últimos anos vêm sendo estudados vários tipos de compostos alternativos para ajudar o tratamento de água na parte da coagulação e floculação, um deles é o tanino de acácia negra, visando à melhoria com a redução de lodo e de metais (FONTOURA, 2009). O tanino é um polieletrólito que combinado com sais metálicos adquire propriedades para fazer a coagulação e floculação, assim ele consegue desestabilizar os coloides, destruindo a camada de solvatação. Com isso, as partículas podem se agregar, formando flocos e são retiradas tanto por sedimentação como por filtração. Isto proporciona a clarificação da água, 25 retirando também uma grande parte dos microrganismos presentes, isso ocorre porque é um processo físico-químico com o coagulante formando flóculos de peso suficiente para separar da água na decantação (SILVA, 1999). 1.2.4 Proteínas de Moringa oleífera Lam. – Moringa A moringa é uma árvore da família Moringáceae, do gênero Moringa, ela é nativa do norte da Índia e possui um desenvolvimento bom em outros países tropicais. A moringa produz como fruto vagens contendo várias sementes. A moringa tem caule de grande diâmetro e altura aproximada de 10 metros, com folhas pequenas de cerca de 3 cm de diâmetro, a folha e seus frutos são comestíveis e a sua raiz tem efeito abortivo para o ser humano (PARTERNIANI; MANTOVANI; SANT`ANNA, 2009). Pode-se utilizar a moringa para várias finalidades na alimentação humana, as folhas que têm 27% de proteínas, também são ricas em vitaminas A e C, e podem ser consumidas como outros vegetais em época de seca; já a semente tem de 35 a 40% de óleo e outros nutrientes, podem ser colocadas em pequenas porções na alimentação de crianças atuando como complemento alimentar, deixando as refeições mais nutritivas e variadas (FOLKARD; SUTHERLAND, 2012). Devido a sua versatilidade, a moringa é utilizada para produção de remédios caseiros, como citado anteriormente. As raízes têm ação abortiva; as folhas, também podem ser usadas para produção de fertilizantes e alimentação do gado, os galhos aproveitam-se para fazer cercas, e a semente para extração do óleo utilizado na cozinha, produção de sabão, cosméticos e em iluminação a óleo (SANTANA et al., 2010). As pesquisas mais recentes, tendo a moringa como objeto de estudo, descobriram que na semente desta planta há proteínas de baixo peso molecular, que quando em pó e misturadas com água suas partículas positivas interagem com as negativas das sujidades presentes na água, tais como argila e silte, promovendo a formação flocos densos que sedimentam. (PARTERNIANI; MANTOVANI; SANT`ANNA, 2009). Para a obtenção das proteínas, se faz necessária a extração do óleo, 26 que é abundante nas sementes da moringa, primeiramente são retiradas as cascas, em seguida as sementes são trituradas, de forma que o material fique homogêneo, o óleo é então extraído com n-hexano, após a extração separamse por filtração solvente-óleo da torta, a torta é então colocada em uma estufa a 40°C, o limite de tolerância e de 60°C para que não degrade a proteína , por um período de 24 horas. Desta forma a moringa tem um importante papel podendo servir de base a estudos para descoberta de outros coagulantes, com compatibilidades semelhantes na sua estrutura molecular e na sua eficácia no tratamento de água para abastecimento público. (PAULA; PEREIRA; COSTA, 2009). Na Figura 6, mostra-se uma imagem da moringa para visualização de detalhes da planta. Figura 6: Moringa oleífera Lam. - Moringa Fonte: MORINGA. 2012. CAPÍTULO II POLÍMERO DE FÉCULA DE MANDIOCA 2 POLÍMERO DE FÉCULA DE MANDIOCA COMO AUXÍLIAR DE FLOCULAÇÃO EM TRATAMENTO DE AGUA Polímero é uma substância que, mesmo tendo estabilidade dimensional no seu uso normal, acaba apresentando um comportamento plástico quando da sua fabricação, pois esta tem uma elevada massa molecular que resulta de reações químicas de polimerização. Assim os polímeros são macromoléculas formadas a partir de unidades estruturais menores, chamadas de monômeros. (DI BERNARDO; DANTAS, 2005). A fécula de mandioca é um polissacarídeo, por hidrólise dá origem a uma grande quantidade de monossacarídeos, ou açúcares. São polímeros naturais, formados pela união de uma grande quantidade de monossacarídeos, desta maneira estes compostos apresentam uma massa molecular muito elevada dependendo do número de unidades de monossacarídeos que se uniram (SOUZA, 2004). Neste trabalho, o polímero de fécula de mandioca foi testado como auxiliar de floculação, tendo-se como composto de referência para comparação em termos de eficácia como auxiliar no tratamento de água, um polímero sintético chamado poliacrilamida (GROSSL, 2009). A poliacrilamida não é tóxica, porém, é obtida pela polimerização do monômero acrilamida, que é toxico, exigindo um cuidado extra na sua manipulação e utilização. Portanto, comparando-se o polímero feito de fécula de mandioca, com o polímero poliacrilamida utilizado como auxiliar de floculação na maioria das ETAs do Brasil, é possível verificar o imenso potencial e as vantagens que a fécula de mandioca tem em relação com este polímero sintético, figurando hoje como um dos melhores auxiliares de 28 floculação existentes no mercado (DI BERNARDO; DANTAS, 2005). O polímero de fécula de mandioca foi preparado sem adição de nenhum ácido ou base, pois desta maneira ele não influencia o pH da agua, evitando posteriores correções e adições de mais produtos (MEIRA, 2004). 2.1 Vantagens e desvantagens da utilização do polímero de fécula de mandioca em relação à poliacrilamida A utilização do polímero de fécula de mandioca tem a vantagem de ser um produto renovável, biodegradável e de fácil preparo, podendo inclusive ser feito in-loco, o que facilitaria a sua utilização, pela ausência de necessidade de transporte do produto (SOUZA, 2004). Pelo fato da fécula de mandioca ser um produto natural e produzido em larga escala no Brasil, não haveria desabastecimento do produto, não comprometendo a sua produção e utilização por falta do mesmo. Outra vantagem, o residual do polímero de fécula de mandioca que fica no fundo do decantador, pela legislação vigente, tem que ir para o aterro sanitário, neste caso não contaminará o meio ambiente, por não conter elementos que possam provocar prejuízo ao mesmo (MEIRA, 2004). 2.2 Produção do Polímero de Fécula de Mandioca A fécula de mandioca é misturada à água numa proporção de 1% em massa, ou seja, 10g de fécula com um litro de água. Nesta proporção a solução estará na concentração de 10.000 ppm, nada mais é adicionado nesta solução polimérica a não ser a energia em forma de calor pois esta deve ser aquecida a 100°C, mantendo-se sob agitação constante por 20 minutos até que se dê por completa a solubilização, após o esfriamento o produto já pode ser aplicado (SOUZA, 2004). Por ser um produto orgânico e natural, preparado sem a adição de qualquer tipo de conservante, a validade desta solução é extremamente curta, devendo ser utilizada em poucos dias, evitando a proliferação bacteriana e sua degradação. Nos ensaios realizados, apurou-se que a solução permaneceu 29 estável por 72 horas sem percepção de alteração na cor ou em seu efeito como auxiliar de floculação (GROSSL, 2009). Para poder aumentar o tempo de validade do produto, preservando suas características e qualidade, pode-se adicionar NaOH, numa proporção de 6 gramas por litro de solução, a elevação do pH, age como inibidor do desenvolvimento bacteriano, promovendo um aumento na validade da solução 10 dias, mas a adição de hidróxidos, libera hidroxila na água o que pode elevar o pH da mesma, porém sem maiores consequências devido à quantidade do produto a ser aplicado ser pequena diante da quantidade de água tratada. A quantidade aplicada no tratamento da água depende de ensaios laboratoriais, pois depende fundamentalmente das características da água captada (SOUZA, 2004). 2.3 Análise de turbidez e velocidade de decantação A análise de turbidez permite determinar se a aplicação do polímero de fécula de mandioca traz ou não ganho na velocidade de decantação possibilitando um aumento na produção de água de uma ETA. A turbidez é uma das características físicas da água, decorrente da presença de sólidos suspensos ou em estado coloidal e de micro-organismos. A avaliação da turbidez é feita avaliando-se a quantidade de luz refletida pelas partículas em suspensão (SHREVE; BRINCK JR, 1997). Para esta análise foi utilizado um turbidímetro microprocessado digital Del Lab, Modelo DLT-WV, com as seguintes características: - Princípio de medição: NEFELOMÉTRICO; - Faixas de medição: 0,00 a 1000 NTU; - Resolução: 0,01 - 0,1 - 1 NTU; - Seleção automática por faixa de trabalho; - Resposta frente a partículas maior que 0,1 microm; - Inserção de curva de calibração pelo usuário; - Emissor em estado sólido (LED) 890 nm, Norma ISO-7027; - Detector: fotocélula de silício; - Sistema de medição que elimina a interferência da cor na amostra. 30 2.3.1 Avaliação da velocidade de decantação O Departamento Autônomo de Água e Esgoto de Avanhandava – DAAEA disponibilizou o laboratório de controle de qualidade da água, para os testes de turbidez, cedendo gratuitamente equipamento, materiais e reagentes. Foi utilizado como parâmetro para se determinar a velocidade de decantação, análises de turbidez realizadas num prazo de 60 minutos, dividido em quatro etapas, a primeira amostragem ocorreu no tempo igual a 0 min, a segunda após 20 minutos, a terceira com 40 minutos e para concluir uma com 60 minutos. Para as avaliações foi adicionado uma alíquota de 0,14 ml do coagulante Policloreto de Alumino a uma concentração de 10.000 ppm, o que corresponde a uma adição de 1,4 ppm na amostra analisada. A aplicação de Poliacrilamida foi de 0,1 ml de uma solução com concentração de 600 ppm correspondendo a uma adição de = 0,06 ppm desta solução na amostra. O polímero de Fécula de Mandioca teve adição de 0,3 ml de uma solução com concentração de 10.000 ppm o que corresponde a uma adição de 3,3 ppm de polímero de fécula de mandioca na amostra. As amostras foram retiradas de águas em tratamento nas seguintes situações: 1ª) Água bruta, sem nenhum coagulante ou auxiliar de floculação; 2ª) Água tratada com coagulante, policloreto de alumínio (PAC), mas, sem auxiliar de floculação; 3ª) Água tratada com PAC e o auxiliar de floculação, poliacrilamida; 4ª) Água tratada com PAC e o auxiliar de floculação feito com o polímero de fécula de mandioca. A segunda condição, apenas com PAC, permite verificar quanto o auxiliar de floculação colabora para aumentar a velocidade de decantação. . Para garantir que as amostras não foram influenciadas pelo tempo de coleta e transporte até o laboratório, as mesmas foram mantidas sob agitação num aparelho JAR TEST MILAN MODELO. JTC/3P, por 5 minutos, numa rotação de 100 RPM, quando então se iniciaram as análises de turbidez e adição de compostos para sedimentação. 31 A velocidade de decantação é determinada pela diferença entre os resultados obtidos com aqueles das análises de turbidez. Após a agitação inicial da água, pelo aparelho Jar Test, por 5 minutos a 100 RPM, coletou-se as amostras iniciais, t0 = 0 min, adicionou-se então os compostos para floculação e seus auxiliares, nas respectivas águas em tratamento. Após a adição dos compostos para tratamento, a agitação foi mantida por 5 min. no mesmo equipamento, o qual promove uma agitação que simula aquela que ocorre num tanque de floculação para a aglutinação das partículas em suspensão e formação de flocos. Esse tempo é suficiente para que ocorra a aglutinação das partículas presentes, formando os flocos, aumentando sua densidade e causando precipitação. A Figura 7 mostra uma foto tirada no inicio da formação dos flocos, onde o PFM do Becker da direita exibe flocos maiores e mais nítidos. Figura 7: Sistema laboratorial para floculação. PAC + POLÍMERO DE PAC + POLIACRILAMIDA FÉCULA DE MANDIOCA Fonte: SANTOS, 2012. A foto, da Figura 7, mostra o que ocorre durante o tratamento com floculante e auxiliares de floculação. Pode-se notar a aglomeração das partículas em suspensão com a formação dos flocos. Até este momento a atuação do PFM mostrou-se mais eficiente, pois gerou flocos visualmente maiores. Após o tempo de floculação, passou-se para o tempo de decantação 32 durante o qual, mais três amostras foram coletadas, t 1 = 20 min, t2 = 40 min e t3 = 60 min; os resultados foram plotados no gráfico de turbidez em NTU (Unidades Nefelométricas de Turbidez) por tempo em minutos, mostrado na Figura 7, o qual possibilita uma visualização comparativa do desempenho dos diversos processos de tratamento utilizado na avaliação. Figura 8: Gráfico da velocidade de decantação por análises de turbidez. Fonte: SANTOS, 2012. No gráfico da Figura 8, é possível perceber que na água bruta sem aditivos, a velocidade de decantação é extremamente baixa, pois houve pouca mudança após o período completo de decantação, a diferença de turbidez foi de aproximadamente 3 NTU. No tratamento apenas com PAC, já é possível se notar uma significativa ação de coagulação e precipitação do material que estava em suspensão na água. Pode-se notar também que decorridos os 60 minutos de avaliação a turbidez das amostras de água com aditivos de coagulação eram muito próximas, com uma diferença de apenas 1 NTU em favor das amostras com auxiliar de floculação. Ainda na Figura 8, pode-se notar que nas amostras de água tratadas com PAC mais poliacrilamida ou PAC mais polímero de fécula de mandioca em comparação com a água tratada apenas com PAC, houve uma significativa aceleração no processo de decantação. A maior velocidade de decantação fez com que a turbidez, atingisse seu menor valor, aproximadamente 2,5 NTU, em 33 apenas 20 minutos. Na comparação entre as amostras de água tratadas com PAC mais PA e PAC mais PFM, nota-se que a velocidade de decantação promovida pela combinação PAC-PA é maior nos primeiros 20 min, 0,79 UT/min, contra 0,76 UT/min da combinação PAC-PFM. Porém, no segundo intervalo, de 20 a 40 min, nota-se que a combinação PAC-PFM continua ativa promovendo uma redução de 0,05 UT/min, enquanto a combinação PAC-PA se mantém quase estável, promovendo uma redução de apenas 0,01 UT/min nesse mesmo período. Ambos os auxiliares de floculação, PA e PFM, têm suas ações equiparadas por volta de 35 min após o inicio da decantação. Segue abaixo, na Tabela 1, as velocidades de decantação, ou seja, as reduções de unidades de Turbidez em NTU em função do tempo. As velocidades foram determinadas com a equação 1, mostrada abaixo. (2) Tabela 1: Velocidade de decantação por análise de turbidez (NTU/min). VELOCIDADE DE DECANTAÇÃO (UT/ min) 0 a 20 min 20 a 40 min 40 a 60 min Água B* - 0,04 - 0,07 - 0,01 Água B + PAC** - 0,52 - 0,25 - 0,03 Água B + PAC + PA*** - 0,79 - 0,01 - 0,04 Água B+PAC + PFM**** - 0,76 - 0,05 - 0,04 * Água Bruta,** Policloreto de alumínio, *** Poliacrilamida, ****Polímero de Fécula de Mandioca. Fonte: SANTOS, 2012. Na comparação de eficiência, a combinação PAC-PA foi mais eficiente, já que imprimiu uma maior velocidade de decantação, promovendo a maior redução de turbidez em aproximadamente 25 min. A combinação PAC-PFM, nesse tempo, ficou atrás apenas 0,5 UT. Outras considerações possíveis de serem feitas com base nesses dados são que a PA tem eficiência de mais ou menos 30%, no aumento da velocidade de decantação, portanto na produção de água. O mesmo valor é obtido com a adição PFM, enfatizando a atuação semelhante de ambos, PA e PFM. 34 2.4 Análises bacteriológicas A análise bacteriológica se faz necessária para verificar se o polímero de fécula de mandioca, atuando como auxiliar de floculação, tem alguma eficácia também na diminuição dos níveis de contaminação bacteriana presentes na água. A avaliação foi feita em comparação ao também auxiliar de floculação poliacrilamida. Para essas análises, foi coletada água do rio Alambari em Avanhandava/SP, a um 1 metro de profundidade, sendo que após a coleta, a água foi levada para o laboratório de microbiologia do UNISALESIANO na cidade de Lins/SP, preservada em caixa térmica com gelo sintético, onde foram realizadas as análises. A amostra de água bruta (sem tratar), foi divida em 5 sub-amostras, sendo que cada uma delas foi tratada de uma forma diferente, a primeira não recebeu tratamento, a segunda sofreu apenas diluição, a terceira foi tratada apenas com PAC, a quarta foi tratada com PAC e PA e a quinta foi tratada com PAC e PFM. As análises de interesse, por serem as recomendadas na Portaria nº 2.914/2011 do Ministério da Saúde, foram: contagem total de bactérias heterotróficas, presença ou ausência de Coliformes totais e presença ou ausência de Coliformes fecais. Para realizar essas análises foram utilizados dois meios de cultura, o Plate Count Agar (PCA) para contagem de bactérias heterotróficas e o Rapid Coliform Broth (RCB) para a verificação da presença ou ausência de Coliformes, tanto totais quanto fecais. 2.4.1 Análises microbiológicas com PCA De acordo com a metodologia descrita no Standards Method for Water and Wastewater efetuou-se a semeadura por profundidade, de alíquotas de 1,0 mL das amostras de água em placas de petri (20x100mm) com meio de cultura Plate Count Agar em triplicata, para posterior cálculo da média e desvio padrão (EATON et al., 2005). Todas as análises foram inoculadas em capela de fluxo laminar, evitando assim a contaminação de bactérias provenientes do ar. 35 Depois de inoculadas as placas de petri, contendo o meio PCA, foram incubadas em estufa por 24 horas a uma temperatura de 37 ± 1 ºC e após esse período foram retiradas e fez-se a contagem das colônias formadas. As amostras analisadas foram: 1) Água estéril para diluições; 2) PCA sem inoculação; 3) Água bruta; 4) Água bruta diluída na proporção de 1:100; 5) Água tratada com PAC; 6) Água tratada com PAC mais PA; 7) Água tratada com PAC mais PFM. As análises das amostras 1 e 2 foram realizadas para se certificar de que o processo de esterilização dos materiais utilizados para a quantificação bacteriológica foi eficiente. Com os resultados obtidos pode-se verificar a ausência total de formação de colônias tanto na água desmineralizada, utilizada para a diluição da água bruta, quanto no PCA, meio de cultura utilizado para o crescimento bacteriano, bem como nas placas de petri, utilizadas para a inoculação do meio com as amostras. Todos estavam estéreis resultando em ensaios mais confiáveis. As amostras 3 e 4, água bruta e água bruta diluída em 1:100, foram analisadas para uma quantificação inicial e avaliação da eficiência dos processos de tratamento. Nas placas com a amostra 3, a proliferação bacteriana foi intensa, como já era esperado, não sendo possível a quantificação pelo excesso de colônias. Já nas placas com a amostra 4 obtevese uma média de 833 UFC/mL. A amostra 5, composta por água tratada apenas com policloreto de alumínio apresentou uma média de 143 UFC/mL Já nas amostras 6 e 7, água tratada com PAC+PA e água tratada com PAC+PFM respectivamente, obteve-se médias de 37 e 74 UFC/mL também respectivamente. A Tabela 2 resume os resultados obtidos na quantificação microbiológica com PCA, e depois de realizadas as análises pôde-se comprovar que houve uma maior redução da população bacteriológica, presente na água bruta, com 36 o tratamento feito pela combinação policloreto de alumínio mais poliacrilamida. Porém, nota-se também que a substituição da poliacrilamida pelo polímero de fécula de mandioca reduziu a população bacteriológica, presente na água apenas com o tratamento com policloreto de alumínio, em aproximadamente 50%. Tabela 2: Análise microbiológica com o meio de cultura Plate Count Agar. POPULAÇÃO BACTERIANA AMOSTRAS UFC/mL 1 Água de diluição 0 2 Meio + Placa 0 3 Água B sem diluição Incontável 4 Água B diluída 1:100 833 ± 116 5 Água B + PAC 143 ± 47 6 Água B + PAC + PA 37 ± 13 7 Água B + PAC + PFM 74 ± 10 Fonte: SANTOS, 2012. Vale ressaltar que a etapa de desinfecção da água que será distribuída à população ainda irá ocorrer no final do processo de tratamento após a filtração, e ainda, que a legislação vigente preveja a possibilidade da existência de até 500 UFC/mL nas amostras coletadas nos pontos de consumo. O que mostra que o tratamento apenas com PAC já surtiu os efeitos desejados. 2.4.2 Análises microbiológicas com Rapid Coliform Broth A preparação e esterilização do Rapid Coliform Broth seguiram as orientações do fabricante. Após o processo de esterilização aguardou-se até que o meio de cultura estivesse à temperatura ambiente para se proceder à inoculação. Como prevê a legislação vigente, foram analisados 100 mL de cada amostra. As amostras analisadas foram: 1) RCB sem inoculação; 37 2) Água bruta; 3) Água tratada com PAC; 4) Água tratada com PAC mais PA; 5) Água tratada com PAC mais PFM. Utilizando-se a capela de fluxo laminar, para se trabalhar em ambiente asséptico, fez-se a inoculação de cada frasco contendo o meio de cultura, com 100 mL de amostra. Antes e após a inoculação o meio se mostrava de coloração amarelopalha. Os meios inoculados foram mantidos em estufa com a temperatura controlada de 37 ± 1 ºC durante 24 horas. Passado o tempo de incubação analisaram-se os resultados obtidos na análise. A não alteração da coloração inicial indica um resultado negativo e uma coloração verde-azulada, independente da intensidade indica resultado positivo para Coliformes total. O mesmo meio de cultura, também fornece resultados de presença-ausência de Coliformes fecais se colocado sob iluminação ultravioleta (UV-A λ ≈ 366 nm), uma fluorescência azulada, significa resultado positivo para coliforme fecal. A amostra 1 foi feita apenas para se certificar de que o processo de esterilização foi satisfatório. Após o período de incubação o meio não sofreu alteração de cor, indicando a ausência de bactérias do grupo Coliforme. A Figura 9 mostra os resultados obtidos com esta análise para as demais amostras, de 2 a 5. Como já era esperado, pela fonte de captação ser de água superficial, ou seja, do rio Alambari, todas as amostras continham bactérias do grupo Coliforme. Porém, é possível se perceber, pela diferença de tonalidade dos frascos, que nas amostras 3 e 5, tratadas respectivamente com policloreto de alumínio e policloreto de alumínio mais polímero de fécula de mandioca, a população bacteriana desse grupo parece ter sido reduzida pelo tratamento, em comparação com a tonalidade do frasco contendo a amostra 2, ou seja, a água bruta. O que chama a atenção na Figura 9 é o fato da água tratada com policloreto de alumínio mais poliacrilamida exibir uma intensidade de coloração equivalente à da água sem tratamento. 38 Figura 9: Análises em meio de cultura Rapid Coliform Broth. 2) 3) 4) 5) 2) Água Bruta; 3) Água + PAC; 4) Água + PAC + PA; 5) Água + PAC + PFM Fonte: TOMÉ, 2012. Na Figura 10, mostra-se uma foto tirada dos frascos contendo o meio RCB + amostras de água após o período de incubação, sob iluminação ultravioleta. Figura 10: Análise de presença-ausência de Coliformes fecais com RCB, a) água bruta, b) água tratada com PAC + PFM. a) b) Fonte: Tomé, 2012. O frasco (a) contendo água bruta exibe fluorescência indicando a 39 presença de Coliformes fecais, já o frasco (b) água tratada com policloreto de alumínio e polímero de fécula de mandioca não produziu luminescência quando sob luz ultravioleta, constatando que na água tratada com esses compostos a presença de Coliformes fecais não era mais detectável. Desta maneira fica claro que o polímero de fécula de mandioca é eficiente na remoção de Coliformes fecais, diminuindo a população bacteriana e reduzindo a carga orgânica residual que poderia reagir com o cloro, durante o processo de desinfecção. 2.5 Análise da cor Semelhante à avaliação feita através turbidez, fez-se também uma avaliação na redução da cor da água como consequência dos diferentes tipos de tratamento. Foram avaliadas quatro tipos de amostras para determinação da cor da água, sendo estas: 1) água bruta, sem nenhum coagulante ou auxiliar de floculação; 2) água tratada com o coagulante PAC (1,4 ppm), mas sem auxiliar de floculação; 3) água tratada com PAC (1,4 ppm) mais o auxiliar de floculação, PA (0,06 ppm); 4) água tratada com PAC (1,4 ppm) mais o auxiliar de floculação PFM (3,3 ppm). As análises da cor aparente da água foram realizadas com um aparelho da PoliControl, modelo AquaColor, com faixa de medição de 0 a 500 Unidades de Cor - UC1 ou unidades Hazen - uH. Para avaliar a redução da cor aparente da água, ou seja, o quanto da cor foi retirada em consequência da aplicação dos diferentes tipos de tratamento, e em que velocidade isto acontece, realizou-se em cada amostra 4 avaliações. A primeira avaliação ocorreu no tempo inicial, antes da aplicação dos diferentes tratamentos, a segunda, após 20 min do início da decantação, a terceira após 40 min e a terceira após 60 min do início da decantação. O 1 1 UC é equivalente a coloração produzida por 1 ppm de Pt/Co em água. 40 gráfico da Figura 11 mostra os resultados obtidos nestas análises. Figura 11: Gráfico da velocidade de decantação por análises da cor aparente. Fonte: SANTOS, 2012. Pôde-se observar que nas análises feitas após 20 min do início da ação dos agentes de floculação houve uma drástica diminuição da cor. A ação dos auxiliares de floculação fica clara nas curvas mostradas na Figura 9, tanto a PA quanto o PFM realizam praticamente toda a possível redução de cor nos primeiros 20 minutos. Novamente, pode-se perceber que a PA é pouca coisa mais eficiente que o PFM, reduzindo a cor da água em 5 UC a mais que este. As velocidades foram calculadas empregando-se a equação 3. (3) A Tabela 3 oferece uma comparação numérica da atuação dos agentes de floculação em termos de velocidade de decantação avaliada pela redução de cor aparente da água. 41 Tabela 3: Velocidade de decantação por análise de cor aparente ( UC/min). VELOCIDADE DE DECANTAÇÃO (UC/ min) 0 a 20 min 20 a 40 min 40 a 60 min Água B* - 0,27 - 0,42 - 0,10 Água B + PAC** - 2,85 - 1,40 - 0,20 Água B + PAC + PA*** - 4,33 - 0,06 - 0,26 Água B + PAC + PFM**** - 4,12 - 0,31 - 0,23 * Água Bruta, **Policloreto de alumínio, ***Poliacrilamida, **** Polímero de Fécula de Mandioca. Fonte: SANTOS, 2012 Na comparação da água tratada apenas com PAC e da água tratada com PAC + PFM, no tempo de 0 a 20 minutos, a redução da cor aparente foi de 30,9% maior com a adição desse auxiliar de floculação, mostrando que se empregado em uma ETA, traria um ganho considerável na produção de água. CONCLUSÃO Após o estudo de produção e aplicação do polímero de fécula de mandioca – PFM, como auxiliar de floculação no tratamento de água para abastecimento público, e comparação deste com o desempenho da poliacrilamida, foi possível concluir que apesar do PFM ser menos eficiente que PA, exigindo a aplicação de uma maior concentração para promover um desempenho equivalente ao da PA e, portanto não ser a solução para acelerar o processo e aumentar a quantidade de água tratada, há outros fatores que motivam a substituição da PA pelo PFM, sua produção é simples, barata, e pode ser feita no local de uso. Além disso, acredita-se que o ponto mais relevante a ser destacado é que o PFM não é tóxico e o monômero da PA o é, e este pode ser liberado na água pela PA. Ficou demonstrado que o PFM tem excelentes atuações na remoção de turbidez e cor aparente da água. O PFM também foi muito eficiente na remoção de bactérias, removendo 91,2% das bactérias presentes na água que foi tratada, como mostrou a análise com Count Plate Agar. Nos ensaios com o meio de cultura Rapid Coliform Broth verificou-se que o PFM também é capaz de diminuir a quantidade de bactérias do Gênero Coliforme da água. Por fim, pode-se afirmar que o PFM tem condições de substituir a PA como auxiliar de floculação, trazendo economia e eficiência ao processo sem o risco de liberar na água compostos tóxicos. O tema não se esgota aqui, sendo passível de pesquisas futuras. Como exemplo pode-se citar o estudo de comparação entre as cadeias poliméricas de amido obtidas a partir de diferentes fontes, como arroz, batata e outros. REFERÊNCIAS AQUASTORE. Processos de tratamento de água. Disponível em: <http://www.aquastore.com.br/default.aspx?code=64>. Acesso em: 20 Jun 2012. ARBOLEDA, J. V. Teoria y pratica de la purificación del água. Colômbia: Acordal, 1991. BRASIL. PORTARIA Nº 2.914, de 12 de dezembro de 2011. Diário Oficial da União, Seção 1, 14 de dezembro de 2011, p. 39. Disponível em: <http://189.28.128.179:8080/pisast/saude-ambiental/vigiagua/normas-elegislacoes/portaria-no-2.914-2011>. Acesso: 10 Jun. 2012. CALDEIRA, M. V. et al. Quantificação de tanino em três povoamentos de Acácia mearnsii. EMBRAPA. 2003. Disponível em: <http://www.cnpf.embrapa.br/publica/boletim/boletarqv/boletim37/mcaldeira.pdf >. Acesso: 15 Jun 2012. CLORETO férrico. Disponível em: <http://pt.made-in-china.com/ co_qingyachem/product_Ferric-Chloride-Hexahydrate-Fecl36H2O_hrsnieneg.html>. Acesso em: 20 Jun 2012. COELHO, T. M. et al. Estudo comparativo da floculação entre amido catiônico e amido interligado catiônico. Disponível em: <https://docs.google. com/viewer?a=v&q=cache:tr973Ik72S4J:www.abepro.org.br/biblioteca/enegep2 010_TN_STP_117_767_16465.pdf+ESTUDO+COMPARATIVO+DA+FLOCULA %C3%87%C3%83O+ENTRE+AMIDO+CATI%C3%94NICO+E+AMIDO+INTER LIGADO+CATI%C3%94NICO&hl=pt-BR&gl=br&pid=bl&srcid=ADGEESjkC2_ 7WP5BkHofqggpKRKE6GwowNB21_evnMvzmWu_ZVrICOMS7iBkG7zqbLwQ 50oaC0nP2wdIyVKrww36WGMWDpV02zeAc9DXB293op7TV0F9VenkOe440N Jx6fIAs9zl2xs_&sig=AHIEtbSzZNx8qsaloByvWvH99F_khidGQg>. Acesso em: 14 Mar. 2012. COSTA, E. R. H. da. Melhoria da qualidade da água tratada e aumento da capacidade de ETAs através da escolha adequada de coagulantes e auxiliares, em águas com alcalinidade alta. Disponível em: <https://docs. google.com/viewer?a=v&q=cache:gBNywPWKAysJ:www.abes-s/p.org.br/ arquivos/exemplo.doc+polimero+de+f%C3%A9cula+de+mandioca+como+auxili ar&hl=pt-BR&gl=br&pid=bl&srcid=ADGEESgJFoIYsROdb0SvC75jfo0mVIq97jfc N97Ue25di8Bd7weLekKGXwyA9E4nEo5agUALURhzcffhtu5OwFd67ULK74nBf iQCtYDsaBSJl1ThBre--XnSg4m5i9B9oYUNOaHZU9ls&sig= AHIEtbSjWkE0MaZ_qZNvCLGZsvHOTRQjkQ>. Acesso em: 14 de Mar. 2012. DI BERNARDO, A. S.; DI BERNARDO, L. Uso do amido de mandioca catiônico como auxiliar de floculação. Disponível em: <http://www.bvsde. 44 paho.org/bvsaidis/tratagua/ii-025.pdf>. Acesso em 14 Mar. 2012. DI BERNARDO, L.; DANTAS, A. D. B. Métodos e técnicas de tratamento de água. São Paulo: RIMA, 2005. Disponível em: <http://www.scielo.br/ pdf/rbeaa/v13n6/v13n6a15.pdf>. Acesso em: 20 Jun. 2012. EATON, A. D. et al. Standard methods for the examination of water & wastewater. 21th. ed. Washington: American Public Health, 2005. EMBRAPA. Cultivo da acácia negra. Disponível em: <http://sistemasdeproducao.cnptia.embrapa.br/FontesHTML/AcaciaNegra/Culti vodaAcaciaNegra/02_especies_de_acacia_para_plantio.htm>. Acesso em: 20 Jun 2012. FOLKARD, G; SUTHERLAND, J. Óleo de moringa. Disponível em: <https:// plus.google.com/104793974921983717565/posts/AcnpoE3Ru4q>. Acesso em: 20 Jun. 2012. FONTOURA, D. de A. Avaliação da eficiência: tanino X sulfato de alumínio, como coagulantes no tratamento de água para consumo humano. 2009. Trabalho de Conclusão de Curso (Bacharelado em Engenharia Industrial Química) – Centro Universitário Feevale. Novo Amburgo/RS. Disponível em: <http://tconline.feevale.br/tc/files/4202_12.pdf>. Acesso em: 20 Jun 2012. GRIGOLETTI, A. Cultivo da acácia negra. EMBRAPA, [on line], Jan. 2003. Disponível em: <http://sistemasdeproducao.cnptia.embrapa.br/ FontesHTML/AcaciaNegra/CultivodaAcaciaNegra/02_especies_de_acacia_par a_plantio.htm>. Acesso: 20 Jun 2012. GROSSL, K. Emprego do amido de mandioca como auxiliar de floculação no tratamento de águas de abastecimento. 2009. Disponível em: <http://anais.unicentro.br/siepe/2009/pdf/resumo_1284.pdf>. Acesso em 14 Mar. 2012. LIBÂNIO, M. Adequações de estações de tratamento de água alicerçadas nos diagramas de coagulação. BIO, ano IV, n.2, p.34-40, maio/setembro 1995. MARTINEZ, D. T. Seleção genética de Acacia mearnsii De Wild (Acácia negra) visando o aumento da qualidade e produtividade de madeira e tanino no Rio Grande do Sul. 2006. Dissertação (Mestrado em Ciências Florestais), Universidade Federal do Paraná. Disponivel em: <http://www. floresta. ufpr.br/pos-graduacao/defesas/pdf_ms/2006/d446_0635-M.pdf>. Acesso em: 02 Abr. 2012. MEIRA, R. C. de S. Avaliação da utilização de amido de mandioca e polímero catiônico como auxiliar de coagulação na remoção de cor aparente e turbidez de água bruta. 2004. Disponível em: <http://www.fit.br/home/link/02.pdf>. Acesso em 14 Mar. 2012. MORINGA. Disponível em: <http://belezadacaatinga.blogspot.com.br/2010/12/ 45 moringa.html>. Acesso em: 20 Jun. 2012. O TRATAMENTO de água. Disponível em: br/~bdta/index-v.html>. Acesso em: 10 Jun 2012 <http://www.fec.unicamp. PATERNIANI, J. E. S.; MANTOVANI, M. C.; SANT'ANNA, M. R.. Uso de sementes de Moringa oleifera para tratamento de águas superficiais. Rev. bras. eng. agríc. Ambient, [online], vol.13, n.6, pp. 765-771, 2009. PAULA, S. L.; PEREIRA, N. C.; COSTA, S. C. Aplicação da Moringa oleifera na clarificação do extrato aquoso de Stevia rebaudiana (Bert.) Bertoni. In: ENCONTRO NACIONAL DE MORINGA 2009, 2009, Aracaju. Anais ..., Aracaju: Disponivel em: <http://linux.alfamaweb.com.br/encontromoringa. com.br/site/trabalhos/05-01-ENAM2009.pdf> Acesso em: 15 Mai. 2012. PROCESSOS de tratamento de água. Disponível em: <http://www.aquastore. com.br/default.aspx?code=64>. Acesso: 20 Jun 2012. RELATÓRIO anual de qualidade da água. 2006. Disponível em: <http://www. agr.sc.gov.br/relatorios/relatorio2006>. Acesso em: 20 Jun 2012. ROSA, G.; GAUTO, M. A. Processos e operações unitárias da indústria química. Rio de Janeiro: Ciência Moderna, 2011. SANTANA, C. R. et al. Caracterização físico-química da moringa. 2010. Disponível em: <http://www.deag.ufcg.edu.br/rbpa/rev121/Art1217.pdf >. Acesso: 10 Jun 2012. SHREVE, R. N.; BRINK JR., J. A. Indústrias de processos químicos. 4. ed. Rio de Janeiro: LTC, 1997. SILVA, T. S. S. da. Estudo de tratabilidade físico-química com uso de taninos vegetais em água de abastecimento e esgoto. 1999. Dissertação (Mestrado em Saúde Pública) Fundação Oswaldo Cruz, Escola Nacional de Saúde Pública. Disponível em: <http://portalteses.icict.fiocruz.br/transf.php? script=thes_chap&id=00005802&lng=pt&nrm=iso>. Acesso em: 05 Mai. 2012. SOUZA, L. C. A. de. Influência da aplicação de polímero natural de fécula de mandioca como auxiliar de floculação na estação de tratamento de água nº 2 de Valinhos/SP: estudo de caso. 2004. Disponivel em: <http://www.bvsde.paho.org/bvsacd/assemae/agua/tratagvali.pdf >. Acesso em: 06 Fev. 2012. SULFATO de alumínio. Disponível em: <http://www.sulfatodealuminio.net/>. Acesso: 10 Jun 2012.
Download