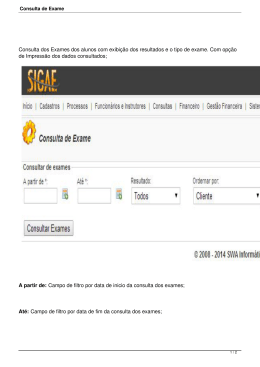
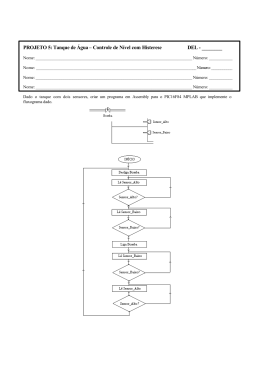
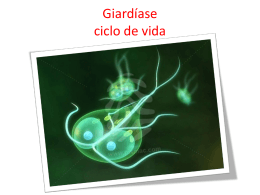
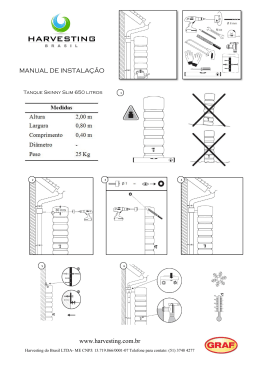
SISTEMA FECHADO SIMPLES DE LARVICULTURA DE MACROBRACHIUM ROSENBERGII. Responsáveis: Margarete Mallasen e Wagner Cotroni Valenti Centro de Aqüicultura da UNESP - CAUNESP 14884-900 Jaboticabal - SP Introdução Durante o II Encontro Nacional dos Produtores de Camarão de Água Doce realizado em Vitória, constatou-se que um dos principais pontos de estrangulamento da produção de camarões de água doce vem sendo a disponibilidade de pós-larvas (PL). Assim, decidiu-se que a produção e o fornecimento de pós-larvas não pode estar restrito às grandes larviculturas e optou-se por fomentar o estabelecimento de pequenas larviculturas simples. O Dr. M. New sugeriu a adoção do sistema desenvolvido no Centro de Aquicultura da UNESP como padrão. Assim, foi elaborado este projeto que apresenta um sistema muito simples, possível de ser instalado e operado em quase todas as fazendas de engorda. Este tem capacidade para produzir de 60.000 a 100.000 PL por mês, dependendo da experiência e dos cuidados do larvicultor. Considerou-se o uso de mão de obra familiar e seu custo não foi computado. Descrição do Sistema Fechado 1. Local de instalação O sistema poderá ser instalado em qualquer galpão previamente construído desde que não haja contaminação por produtos tóxicos ou excesso de pó. Quando não houver esta disponibilidade, pode-se construir uma estufa com 2 armação de bambu coberta com lona plástica. A área mínima deve ser de 15 m . 2. Tanques de eclosão Serão utilizadas caixas de polietileno brancas com capacidade para 35 a 50 litros. As caixas serão abastecidas com 25 litros de água salobra a 5‰ ou com água doce. No máximo, devem ser colocadas duas fêmeas por caixa e manter uma oxigenação moderada por meio de pedra porosa. 3. Tanque de cultivo Nestes tanques ocorrerão toda a operação de cultivo, portanto, são os mais importantes para o funcionamento do laboratório (Figura 1). As larvas serão distribuídas em duas caixas de cimentoamianto (135 x 113 cm), fibra de vidro ou polipropileno com capacidade para 1000 litros e volume útil de, aproximadamente, 850 litros preenchidos com água salobra (12‰). Será acoplado um filtro biológico para os dois tanques (Figura 2). Se forem de cimentoamianto, os tanques deverão ser impermeabilizados com tinta epoxi preta. Aquecedores o com termostatos manterão a temperatura da água em torno de 30 C (2 aquecedores de 300 W por caixa). A aeração será mantida constante por meio de oito pedras porosas distribuídas ao redor do tanque. Estas estarão conectadas a uma mangueira de aeração com 15 mm de diâmetro ou tubo de PVC de ½”, fixados na borda do tanque (Figura 1). A saída da água dos tanques de cultivo será realizada através de um tubo de PVC com diâmetro de 1 ½”, unido a um cotovelo articulado que permitirá um fácil controle do nível da mesma, bem como a interrupção do fluxo durante o manejo. Um tubo de PVC de 4” telado com 125 ou 250 µm, removível, será adaptado a esta tubulação, impedindo a passagem das larvas de camarão para o filtro. Junto a este tubo serão colocadas duas pedras porosas que impedirá o acúmulo de detritos sobre a tela (Figuras 3 e 4 ). Figura 1. Tanque de larvicultura. Figura 2. Esquema de um sistema simples modular com dois tanques conectados ao mesmo filtro (vista superior). T = Tanque de larvicultura, FB = Filtro biológico, FM = Filtro mecânico, A = Canos de PVC 3/4”, B = Canos de PVC 1 ½” . Figura 3. Vista lateral do sistema modular simples. A = Tubulação para o retorno da água para o tanque, B = Tubo telado para contenção das larvas, C = Tubo para saída da água do tanque, D = Filtro mecânico, E = Substrato de conchas marinhas, F = Mangueira e pedra porosa para a aeração do tanque, G = Termostato com aquecedor, H = “air-lift”. 4. Tanque de Artemia A alimentação das larvas de M. rosenbergii consiste em fornecer, diariamente, náuplios recém-eclodidos de Artemia. Esses náuplios eclodirão em garrafões de polietileno cortados (garrafão de água) com capacidade para 20 litros e volume útil de 15 litros. Os tanques ou garrafões serão abastecidos com água salobra a 5‰ ou com “água de Artemia” (ver Manejo dos cistos de Artemia item E). A aeração e a iluminação deverão ser mantidas constantes durante todo o processo de eclosão dos náuplios. O ar será fornecido por uma pedra porosa em cada tanque e a quantidade de luz deverá ser de 1000 lux, utilizando 2 lâmpadas fluorescentes de 20 W instaladas a uma distância de aproximadamente 20 cm. 5. Filtro biológico O cultivo será realizado, utilizando o sistema de recirculação, que permite reutilizar a água durante todo período de desenvolvimento das larvas. Este sistema consiste, basicamente, na passagem da água por um filtro biológico, no qual se desenvolvem bactérias responsáveis pelo metabolismo dos compostos nitrogenados, através do processo de nitrificação. O sistema fechado com recirculação permite reduzir os custos com água e energia, pois mantém constante a temperatura, além de melhorar a estabilidade nos níveis de amônia e nitrito. O filtro foi projetado para transformar de forma eficiente os subprodutos nitrogenados (amônio e nitrito), resultantes da excreção das larvas e da decomposição da matéria orgânica, evitando que atinjam níveis tóxicos. O filtro biológico será constituído de caixa de cimentoamianto, ou fibra de vidro ou polipropileno com capacidade de 250 litros (80 x 60 cm) subdividida em câmaras, por meio de placas de polietileno e preenchidas com fragmentos de conchas de moluscos marinhos (cerca de 5 mm de diâmetro) que serão utilizados como substrato pelas bactérias. Sobre a primeira câmara do filtro biológico será colocado um filtro mecânico com a finalidade de remover resíduos, evitando o acúmulo de material orgânico entre os fragmentos de conchas (Figuras 3 e 5). A aeração do sistema de filtro será realizada por meio de pedras porosas de 15 cm, localizadas em cada câmara sob o substrato de conchas, para uma oxigenação mais uniforme. A circulação será iniciada com a subida da água filtrada pelos seis tubos de PVC de 3/4”, impulsionada por “air -lift”, sendo conduzida até a s uperfície dos tanques de larvicultura. Devido ao princípio dos vasos comunicantes, ocorrerá, simultaneamente, a saída da água dos tanques de cultivo através dos tubos de PVC de 1½” que, portanto, será levada ao filtro por gravidade (Figura 3). Para maior segurança, pode-se construir um filtro biológico maior, utilizando-se uma caixa de cimentoamianto, fibra de vidro ou polipropileno com capacidade de 500 litros. Alternativamente, pode-se usar filtros individuais. Figura 4. Detalhe da tubulação de saída da água do tanque. 6. Filtro mecânico Este tipo de filtro impede que partículas orgânicas e inorgânicas caiam no filtro biológico e interfiram nos processos de nitrificação da amônia. O filtro mecânico será constituído por uma caixa (50 x 12 cm) feita com placas de polietileno ou de madeira (impermeabilizada com epoxi) com fundo telado de malha de 80 µm. Figura 5. Vista lateral do filtro biológico. A = Canos de PVC 3/4” adaptados com “air -lift” que conduzem a água filtrada para o tanque de larvicultura, B = Canos de PVC 1 ½” que conduzem a água que sai do tanque de larvicultura para o filtro biológico, C = Câmaras do filtro biológico, D = Filtro mecânico. Sistema de Aeração Todo o ar necessário para oxigenação das caixas, tanques e filtro biológico será proveniente de uma pequena rede instalada no laboratório de larvicultura abastecida por um compressor radial de 2,0 H.P. de potência. O sistema de aeração será construído com mangueira de 11/4” com redução para cano de PVC de 1”, fixados na parede ou na armação de bambu da estufa. Cada tanque de larvicultura e o filtro biológico possuirão uma derivação em conexão tipo tê de 1”, dotados de registros de esfera. Em cada terminal serão conectados tubos de PVC de 3/4” com 30 cm de comprimento e com saída para mangueiras de aeração de 5 mm (Figura 6). O fluxo de ar para oxigenação será proporcionado por pedras porosas localizadas dentro de cada caixa, tanques e filtro biológico. Rotina para instalação e manejo A- Maturação do filtro biológico 1- Monte o sistema de recirculação pelo menos 1 semana antes de ser utilizado. 2- Dilua 0,2 ml de NH4OH (amoníaco 25%) em 1 litro de água de torneira para cada 100 L de água salobra contida no sistema de larvicultura (resultará numa solução final de 0,5 mg/L). 3- Coloque de forma homogênea sobre a superfície da água do filtro. 4- Esta solução de amoníaco deve ser colocada no filtro a cada 3 dias. 5- Quando os níveis de amônio e nitrito estiverem próximos de zero, o filtro estará maduro. Figura 6. Esquema das tubulações do sistema de aeração B- Obtenção das larvas e povoamento 1- Coloque algumas fêmeas em fase final de desenvolvimento embrionário (ovos com coloração cinzaamarronzado) em caixas de polietileno com água salobra a 5‰ ou com água doce. 2- Coloque aeração e uma cobertura de tela ou pano escuro. 3- Sifone as fezes, diariamente e complete o volume. 4- Diariamente, verifique se houve eclosão. Em caso positivo acender uma lâmpada em uma das extremidades da caixa para atrair as larvas. 5- As larvas devem ser cuidadosamente sifonadas para um balde com aeração moderada, até aproximadamente 6 litros. 6- Homogeneize as larvas agitando ligeiramente a água com a mangueira de ar em movimentos zig-zag. Retire a pedra porosa da água, introduza uma pipeta com ponta cortada dentro do balde e conte o número de larvas retiradas com a pipeta. Faça 20 amostragens com reposição. 7- Calcule a média das 20 amostras e, por regra de três, estime o conteúdo do balde. Repita o procedimento e considere a média das amostragens. 8- Coloque, cuidadosamente, as larvas contidas no balde no tanque de larvicultura. Para evitar um choque térmico, faça uma aclimatação lenta com a água do tanque. 9- Observe a densidade de povoamento desejada (80 a 100 larvas/L). C- Manejo diário da larvicultura - Rotina 8:00 horas 1- Determine a temperatura da água dos tanques com um termômetro comum e verifique o fluxo d’água. 2- Limpe a tela de saída do tanque ou substitua por tela de malha com 250 µm (somente após o 5º dia de cultivo) para reduzir a quantidade de material em suspensão no interior dos tanques de cultivo. 3- Retire exuvias e larvas mortas da superfície da água com um puçá plano. Com uma esponja, retire os cistos aderidos às laterais do tanque. 4- Coloque água doce no filtro biológico repondo o que evaporou. 5- Forneça ração conforme tabela de alimentação. 11:30 horas 1- Coloque os cistos de Artemia para hidratar (consulte tabela de alimentação e manejo da Artemia). 2- Forneça ração. 15:00 horas 1- Determine o teor de nitrito utilizando kit para aquário (sempre antes de sifonar). 2- Sifone os resíduos do fundo do tanque, se o teor de nitrito for alto ou houver resíduos visíveis. a. Desligue a aeração e o sistema “air -lift” por aproximadamente 10 minutos. b. Sifone os resíduos mantendo a mangueira associada a um tubo de PVC de 1/2” sempre junto ao fundo. Pode ser vantajoso acender uma lâmpada próximo à superfície para atrair as larvas. A água deve drenar para um balde graduado (ou caixa de polietileno graduada). c. Retire os detritos aderidos às paredes laterais dos tanques e nas mangueiras de aeração com uma esponja. d. Restabeleça a aeração. e. Recolha cuidadosamente as larvas retidas no balde ou na caixa, utilizando um puçá ou sifonando as larvas com uma mangueira fina. f. A água retirada deve ser filtrada por meio de um filtro mecânico com malha de 80 µm e reposta no filtro biológico. g. Reponha no filtro, a quantidade de água salobra eventualmente perdida durante o processo de sifonamento. 3- Lave a tela de saída da água do tanque e o filtro mecânico. a. Levante o cano de drenagem de modo a interromper o fluxo. b. Retire o cartucho de tela. c. Lave a tela sob torneira esfregando levemente com a esponja. Nunca usar sabão, detergente ou qualquer outro produto de limpeza. d. Recoloque o cartucho no lugar. e. Lave filtro mecânico sob torneira. Recoloque-o sobre o cascalho do filtro biológico e retorne o cano de drenagem para a posição inicial. f. Após 10 minutos observe se há alguma larva presa na tela do filtro mecânico. Se houver, devolvê-la ao tanque. 16:30 - 17:00 horas 1- Determine a quantidade de náuplios de Artemia no interior dos tanques. a. Com uma pipeta de 5 ml (com a extremidade mais fina cortada), retire 10 amostras de água de um tanque e conte o número de náuplios de Artemia. Calcule a média e divida por 5 para obter o número de náuplios por ml. Repita o procedimento para o outro tanque. 2- Forneça Artemia. a. Desligue a aeração dos garrafões de eclosão de Artemia. b. Cubra os garrafões com um pano escuro, deixando apenas uma brecha para entrada de luz. Espere alguns minutos, os náuplios de Artemia ficarão concentrados no local iluminado do garrafão, os cistos não eclodidos decantarão e os fragmentos de cistos ficarão boiando na superfície. c. Recolha em um balde graduado somente os náuplios concentrados, sifonando-os com cuidado e evitando, o máximo que possível, a presença de cistos. d. Quando houver muitos cistos no balde, pode-se repetir a etapa b. Neste caso é necessário utilizar um balde translúcido. e. Divida o volume resultante entre os tanques, colocando maior quantidade de litros para o tanque com menor quantidade de náuplios restantes, determinados no item 1a. f. Concentre os náuplios em uma tela de 125 µm, desprezando a água de eclosão e lavando-os em água de torneira. g. Distribua homogeneamente no tanque. h. Após alguns minutos, determine a quantidade de náuplios de Artemia no interior dos tanques, seguindo o mesmo procedimento do item 1a. Esta deverá ser de aproximadamente 7 náuplios/ml. Caso seja menor, deve-se aumentar a quantidade de cistos necessária para eclodir. 3- Prepare nova cultura de Artemia utilizando os cistos hidratados (ver Manejo dos cistos de Artemia). 4- Verifique temperatura e fluxo. Observações: 1- Ao surgirem as primeiras pós-larvas deve-se colocar rolinhos de tela de polietileno no fundo do tanque para servirem de substratos. 2- Não mecha nos tanques de larvicultura sem lavar as mãos. 3- O local deve ser mantida tão limpo quanto for possível. Alimentação das larvas A alimentação adequada das larvas é um dos fatores de fundamental importância para o sucesso da larvicultura de M. rosenbergii. A Tabela 1 indica a quantidade de alimento de acordo com os estágios larvais. As larvas serão alimentadas, exclusivamente, com náuplios de Artemia durante os primeiros dez dias de cultivo. Posteriormente, também será fornecida ração inerte fresca, sua formulação está representada na Tabela 2. Tabela 1- Tábua de alimentação para a larvicultura de M. rosenbergii em sistema fechado simples. As quantidade estimadas são para estocagem de 70.000 larvas (valor médio). Dias de cultivo Estágios Cistos Artemia Ração Ração dominantes g/dia g/dia g/refeição Povoamento I - - - 2 I-II 20 - - 3 II-III 20 - - 4 III 30 - - 5 III-IV 40 - - 6-7 IV-V 50 - - 8 V 50 - - 9-10 V-VI 50 - - 11-12 VI-VII 50 30 15 13-14 VI-VII-VIII 50 30 15 15-18 VII-VIII-IX 50 30 15 19-21 VIII-IX 50 40 20 22-24 IX-X 50 50 25 25-30 X-XI-PL 50 50 25 31-40 XI-PL 50 40 20 A quantidade de alimento (ração - Artemia) que será fornecida diariamente, dependerá, também, do aproveitamento do mesmo pelas larvas. Portanto é importante realizar o controle visual do consumo, devendo haver pequena sobra de ração antes do sifonamento e aproximadamente 1 náuplio/ml de água antes do fornecimento de Artemia. A quantidade Artemia após o fornecimento da mesma, deve ficar ao redor de 7 náuplios/ml. As quantidades contidas na Tabela 1 podem variar com a taxa de eclosão dos cistos de Artemia. A superalimentação aumenta a quantidade de matéria orgânica que pode causar proliferação de bactérias indesejáveis e prejudicar a qualidade da água do sistema. Por outro lado, a deficiência de alimento provoca a canibalismo e o aparecimento de animais fracos e pequenos. Tabela 2- Formulação da ração inerte fresca para larvas de M. rosenbergii. Ingredientes Quantidades Lula 100g Filé de peixe 100g Leite em pó 40g Farinha de trigo 20g Mineral mix 8g Vitamina mix 8g Ovos Óleo de fígado de bacalhau 8 unidades Água 400ml 4ml Preparo: a- Bater todos os ingredientes no liqüidificador, até formar um creme. b- Cozinhar em banho-maria por aproximadamente 20 minutos (após a fervura da água) até atingir consistência de pudim. o c- Guardar em geladeira por até 2 dias ou congelar em freezer a -20 C em porções de uso diário. d- Antes de fornecer aos animais, passar a ração através de peneira de plástico de malha fina com auxílio de jatos d’água (conforme o crescimento das larvas utilize peneiras com abertura de malha maior). Observação: Esta formulação produz aproximadamente 1kg de ração inerte. Manejo dos cistos de Artemia A- Hidratação 1- Coloque os cistos em um recipiente para hidratar durante 1,5 a 2,0 horas, na concentração de 70 g de cistos/l (1 g/14 ml) de água doce. 2- Mantenha aeração e iluminação constantes. B- Descapsulação 1- Filtre os cistos em puçá com malha de 125 µm e lave-os em água corrente. 2- Coloque os cistos lavados em solução descapsulante. Solução descapsulante para 50 g de cistos: a- Dissolva, em um recipiente de vidro, 6,5 g de soda cáustica em 700 ml de água de Artemia. b- Dissolva, nesta mesma solução, 40,0 g de hipoclorito de cálcio. Mexa bem até que tudo esteja dissolvido. 3- Misture sem parar a solução, adicione gelo no interior do recipiente quando a temperatura aumentar (não o deixar que a temperatura ultrapasse os 36 C). 4- Quando a suspensão de cistos passar de marrom/cinza para alaranjado a descapsulação está completa. O tempo necessário para isso varia de 3 a 15 minutos. 5- Filtre a suspensão em puçá com malha de 125 µm e lavá-la em água corrente até desaparecer o odor de cloro. 6- Deixe os cistos descapsulados em repouso num recipiente com água doce para decantarem. Despreze toda a água juntamente com as impurezas que ficarem na superfície. 7- Coloque os cistos para eclodirem nos garrafões abastecidos com 15 litros de água salobra (5‰) ou “água de Artemia”. Mantenha a aeração e a iluminação constantes. O tempo de eclosão levará de 15 a 24 horas. Observação: Alguns cistos de Artemia não devem passar pelo processo de descapsulação, pois a eclosão e a quantidade de náuplios serão menores. Esta informação deverá estar indicada na embalagem. Neste caso, realize apenas a desinfecção dos cistos. C- Desinfecção dos cistos 1- Coloque os cistos em uma solução com 0,8 g/L de hipoclorito de cálcio por meia hora. 2- Lave bem os cistos em água corrente até desaparecer o odor de cloro. 3- Coloque os cistos nos tanques de eclosão de Artemia. D- Coleta e distribuição dos náuplios Este procedimento está descrito na Rotina para instalação e manejo (16:30 - 17:00 horas, item 2). E- Preparação da “água de Artemia” Para preparar 40 litros de água de Artemia, dissolva, separadamente, 320 g de sal grosso e 80 g de bicarbonato de sódio, em água doce. A salinidade desta água ficará em torno de 12‰. Preparação da água do mar artificial 1- Os sais utilizados na preparação estão descritos na Tabela 3. 2- Coloque cerca de 20 litros de água em um recipiente de aproximadamente 50 litros. Acomode uma pedra porosa no fundo deste recipiente de modo a promover a circulação da água. 3- Adicione o Cloreto de Sódio de forma gradativa sob agitação até que este se dissolva totalmente (utilize um pedaço de tubo de PVC para agitar). 4- Dissolva separadamente o sulfato de magnésio, cloreto de magnésio, cloreto de cálcio, cloreto de potássio e bicarbonato de sódio. Coloque-os em béqueres contendo 1 a 2 litros de água. 5- Adicione ao balde as soluções preparadas acima, separadamente, seguindo a ordem decrescente de concentração na água do mar (lave as paredes dos béqueres com uma piceta para não deixar resíduos). Agite continuamente e mantenha a aeração. 6- Após todos os sais terem sido adicionados, transfira a solução para um tanque de armazenagem já contendo cerca de 60 litros de água. Lave as paredes do balde para não deixar resíduos. 7- Complete o volume para 100 litros (deve haver uma marca prévia na parede do tanque, indicando este volume). Agite vigorosamente e meça a salinidade que deve estar por volta de 34‰. 8- Deixe 24 h sob aeração (a pedra de ar deve ser colocada no centro do recipiente, junto ao fundo). 9- Pese os cinco últimos sais e dissolva-os, separadamente, em béqueres contendo cerca de meio litro de água. Adicione as soluções ao tanque de armazenagem, agitando em seguida (lave as paredes do béquer para não deixar resíduos). 10- Agite vigorosamente a solução e deixe 24 h sob aeração. Observações: o 1- A utilização de água a 30-35 C para as diluições facilita bastante o trabalho. 2- Recomenda-se utilizar sais com grau de pureza U.S.P. ou P.A. de baixa qualidade. A utilização dos sais mais abundantes de grau comercial pode ser praticada, mais existe o risco dos mesmos conterem substâncias tóxicas. 3- Para a preparação de grandes quantidades, substitua o balde pelo próprio tanque de larvicultura e os béqueres por baldes de polipropileno. Dimensione de modo a completar o volume com água doce e obter a água salobra na salinidade desejada, evitando as transferências de tanque. Utilize água doce não clorada. 3 4- O custo do m de água do mar artificial é cerca de US$ 50,00 (considerando-se o cloreto de sódio comercial e os demais sais com grau de pureza P.A). Tabela 3 - Sais utilizados na preparação da água do mar artificial - CAUNESP. Sal Quantidade g/100 l de água Cloreto de Sódio (NaCl) 2760,0 Sulfato de Magnésio (MgSO4.7H2O) 690,0 Cloreto de Magnésio (MgCl2.6H2O) 540,0 Cloreto de Cálcio (CaCl2.2H2O) 140,0 Cloreto de Potássio (KCl) 60,0 Bicarbonato de Sódio (NaHCO3) 20,0 Brometo de Potássio (KBr) 2,7 Cloreto de Estrôncio (SrCl2.6H2O) 2,0 Sulfato de Manganês (MnSO4.H2O) 0,4 Fosfato de Sódio (NaHPO4) 0,4 Molibdato de Sódio (Na2MoO4.2H2O) 0,1 Preparação da água salobra 1- Após a filtragem e a desinfecção da água salgada, coloque uma amostra em uma proveta de 1000 ml e introduza, lentamente o densímetro. Faça a leitura ao nível da água, lembrando que o aparelho fornece 4 casas depois da vírgula e a primeira é sempre zero. 2- Meça a temperatura da água. 3- Com os valores de densidade e de temperatura, determine a salinidade correspondente na Tabela 4. 4- Calcule a proporção de água do mar que deve ser utiliza através da fórmula: salinidade desejada x 100 salinidade da água do mar % de água do mar = 5- Misture a água doce e salgada na proporção determinada acima e agite bem. A aeração intensa facilitará a homogeneização da água salobra. 6- Confirme o resultado obtido determinando a salinidade da mistura. 7- Se for necessário acrescente um pouco de água doce ou salgada até obter a salinidade desejada. Para elevar 0,5% acrescente água salgada na proporção e 3% do volume da mistura. Para abaixar 0,5% acrescente água doce na proporção de 5% do volume da mistura. Exemplo: supondo a preparação de 100 litros de água salobra. o a. A leitura realizada com densímetro indicou uma densidade de 1,0210 e temperatura de 20 C para a água do mar. b. Através da Tabela 4 obtém-se o valor 30. c. A proporção de água usada será: % de água do mar = 12 x 100 = 40 30 d. Mistura-se 40 litros de água do mar a 60 litros de água doce. e. Checa-se a salinidade obtida. Tabela 4 - Densidades aproximadas da água do mar e da água salobra, em relação a temperatura e salinidade. Salinidade Temperatura o o o (‰) 20 C 25 C 12 1,0075 1,0064 1,0055 13 1,0082 1,0072 1,0060 14 1,0090 1,0078 1,0065 15 1,0098 1,0086 1,0070 30 1,0211 1,0200 1,0184 35 1,0249 1,0236 1,0221 40 1,0289 1,0275 1,0259 Tratamento da água doce e salgada 30 C Tanto a água doce como a salgada, devem ser filtradas e desinfetadas antes da preparação da água salobra. A filtração remove as partículas sólidas em suspensão, substâncias tóxicas, parasitas e predadores, os quais podem prejudicar o desenvolvimento das larvas. Poderão ser utilizados filtros com cartucho de celulose (tipo cuno) com porosidade de 2 µm ou velas usadas em potes de cerâmica. Após filtrada, a água deve ser desinfetada. O tratamento básico pode ser feito adicionando hipoclorito de cálcio de modo a obter uma concentração de 6 ppm, manter cinco dias sob aeração e posteriormente, deixar decantar por um dia. Pode-se substituir o tratamento químico com cloro por um aparelho ultravioleta para desinfetar a água. O processo de filtragem é muito importante, pois impede a formação da cloramina que é uma substância produzida pela reação da matéria orgânica e amônia com o cloro. A cloramina não volatiliza e é muito tóxica aos organismos aquáticos. Descrição dos materiais usados Equipamentos Quantidade Compressor radial 2,0 H.P. 1 Geladeira dúplex 1 Aquecedor/Termostato 4 Liqüidificador 1 Fogão uma boca 1 Balança Simples 1 Densímetro 1 Filtro cuno 2µm 1 Aparelho ultravioleta 1 Termômetro (mercúrio) 1 Materiais para Instalação Quantidade Materiais para Instalação Quantidade Caixa 1000 litros 2 Adaptador curto 1” 1 Caixa 250 litros 1 Tê soldável 1” 3 Caixa de polietileno 50 litros 4 Bucha de redução soldável 1” - 3/4” 3 Garrafão de água 20 litros 4 Luva cola-rosca 3/4” 6 Tubo de PVC 4” (100 mm) 2m Registro de esfera de PVC 3/4” 3 Tubo de PVC 1” (32 mm) 6m Adaptador cola-rosca 3/4” 3 Tubo de PVC 1½” (50 mm) 6m Cap ¾” 15 Tubo de PVC 3/4” (25 mm) 6m Cap 1” 1 Adaptador cola-rosca de PVC 1½” 10 Mangueira transparente 11/4” 1m Niple de rosca de PVC 1½” 4 Mangueira para aeração 15 mm 5m Adaptador de flange de PVC 1½” 2 Mangueira para aeração 5 mm 20 m Luva RB 1½” 2 Pedra porosa 15 cm 5 Cap de PVC 4” (branco) 2 Pedra porosa 15 o Joelho de 90 soldável 1½” 6 Placa de polietileno 5 mm 2 m2 Joelho de 90o soldável 3/4” 6 Lâmpada fluorescente 2 Tê soldável 3/4” 6 Gaze Suíça 80, 125 e 250 µm 2 m cada Adaptador mangueira-rosca 1 /4” 1 Conector de mangueira 20 unidades Luva RB 1” 1 Regulador de ar 15 unidades 1 Tubo de adesivo plástico 4 Tinta epoxi preta 1 galão 1 1 Bucha de redução RB 1 /4” – 1” Utensílios Panela com forma de pudim para banho-maria Balde de plástico 10 litros Peneira comum com malha fina (1 mm) Béquer de plástico 500 ml Quantidade 1 3 3 4 Béquer de plástico 50 ml 4 Proveta 1000 ml 1 Pipeta 5 ml 1 Esponja simples 4 Material de Consumo Quantidade Cistos de Artemia 1 lata (1 Kg) Hipoclorito de cálcio 2 Kg Soda cáustica 500 g Kit Atlantis para amônia 1 caixa Kit Atlantis para nitrito 1 caixa Sal grosso 10 Kg Bicarbonato de sódio 3 Kg Ração fresca 1 Kg Água do mar 1 m3
Download