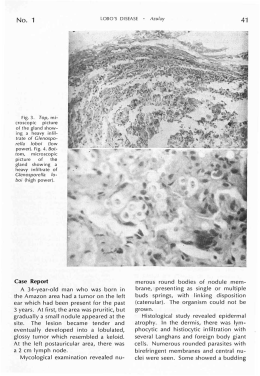
Prof . Mat eus Andrade T ERM OQU Í M I CA A T e r m o q u ím i c a t e m c o m o objet ivo o est udo das variaç ões de energia que ac om panham as r e a ç õ e s q u ím i c a s . N ã o h á r e a ç ã o q u ím i c a q u e oc orra sem variaç ão de energia ! A energia é c onservat iva. Não pode ser c riada o u d e s t r u íd a . A p e n a s t r a n s f o r m a d a ! Prof . Mat eus Andrade T ERM OQU Í M I CA As variaç ões de energia, nas r e a ç õ e s q u ím i c a s , m a n i f e s t a m -s e s o b a f o r m a d e c a l o r (g e r a l m e n t e ) e luz liberada ou absorvida. A origem da energia envolvida num a r e a ç ã o q u ím i c a d e c o r r e , basic am ent e, de um novo arranjo p a r a a s l i g a ç õ e s q u ím i c a s . O c o n t e ú d o d e e n e r g i a a r m a ze n a d o , p r i n c i p a l m e n t e n a f o r m a d e l i g a ç õ e s é c h a m a d o d e EN T A L PI A ( ent halpein, do grego = calor ) e s i m b o l i za d o p o r H ( heat ). Prof . Mat eus Andrade T ERM OQU Í M I CA Cl a s s i f i c a ç ã o d a s r e a ç õ e s t e r m o q u ím i c a s Em f u n ç ã o d a e n e r g i a e n v o l v i d a a s reaç ões podem ser de dois t ipos: I - Ex o t é r m i c a s : l i b e r a m e n e r g i a . • proc essos de c om bust ão, respiraç ão anim al. I I - En d o t é r m i c a s : a b s o r v e m e n e r g i a . • f o t o s s ín t e s e , c o zi m e n t o d o s a l i m e n t o s . Prof . Mat eus Andrade Re p r e s e n t a ç õ e s g r á f i c a s (1 ) T ERM OQU Í M I CA Co m b u s t ã o d o e t a n o l - e x o t é r m i c a H2 < H1 CA L OR L I B ERA DO DH = H 2 - H 1 DH < 0 Prof . Mat eus Andrade Re p r e s e n t a ç õ e s g r á f i c a s (2 ) T ERM OQU Í M I CA Fo t o s s ín t e s e - e n d o t é r m i c a H2 > H1 CA L OR A B SORV I DO DH = H 2 - H 1 DH > 0 Prof . Mat eus Andrade T ERM OQU Í M I CA Co m o p o d e s e r m e d i d o o c a l o r d e r e a ç ã o ? Pa r a r e a ç õ e s e m m e i o a q u o s o (e x .: n e u t r a l i za ç õ e s )u t i l i za s e u m c a l o r ím e t r o , q u e n a d a m a i s é d o q u e u m a g a r r a f a t é r m i c a (f i g u r a 1 ). Pa r a r e a ç õ e s d e c o m b u s t ã o u t i l i za -s e u m a b o m b a c a l o r i m é t r i c a (f i g u r a 2 ). f i g u r a 1 - c a l o r ím e t r o figura 2 - bom ba c alorim ét ric a Nos dois c asos o c alor é t ransferido para um a m assa de água e obt ido a part ir da ex pressão Q= m .c .DT Prof . Mat eus Andrade Eq u a ç õ e s t e r m o q u ím i c a s ( r e q u i s i t o s ) T ERM OQU Í M I CA 1 . Eq u a ç ã o q u ím i c a a j u s t a d a . 2 . I n d i c a ç ã o d o s e s t a d o s f ís i c o s e a l o t r ó p i c o s • (q u a n d o f o r o c a s o ) d o s c o m p o n e n t e s . 3. Indic aç ão da ent alpia m olar, ist o é, por m ol de produt o form ado ou reagent e c onsum ido. 4. Indic aç ão das c ondiç ões de pressão e t em perat ura em que foi m edido o D H. DH 0 En t a l p i a p a d r ã o : m e d i d a à 2 5 0 C e 1 a t m . Prof . Mat eus Andrade T ERM OQU Í M I CA • Es t a d o s a l o t r ó p i c o s m a i s c o m u n s Ca r b o n o Gr a f i t e Di a m a n t e En x o f r e Rô m b i c o M o n o c l ín i c o Rô m b i c o e m o n o c l ín i c o = f o r m a s d i f e r e n t e s d e c r i s t a l i za ç ã o Prof . Mat eus Andrade T ERM OQU Í M I CA Es t a d o s a l o t r ó p i c o s m a i s c o m u n s Fó s f o r o Branc o Verm elho Ox i g ê n i o O2 O 3 (o zô n i o ) Prof . Mat eus Andrade T i p o s d e En t a l p i a s o u Ca l o r e s d e Re a ç ã o T ERM OQU Í M I CA 1 . En t a l p i a d e M u d a n ç a d e Fa s e . 2 . En t a l p i a o u Ca l o r d e Fo r m a ç ã o . 3 . En t a l p i a o u Ca l o r d e De c o m p o s i ç ã o . 4 . En t a l p i a d e Co m b u s t ã o . 5 . En t a l p i a d e Di s s o l u ç ã o . 6 . En t a l p i a d e N e u t r a l i za ç ã o . 7 . En t a l p i a o u En e r g i a d e L i g a ç ã o . Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a d e M u d a n ç a d e Fa s e Co r r e s p o n d e à e n e r g i a e n v o l v i d a n a m u d a n ç a d e e s t a d o f ís i c o o u c r i s t a l i n o d e u m m o l d e subst ânc ia sim ples ou c om post a. Ex e m p l o s H 2 O (s ) à H 2 O (l ) DH 2 7 3 = + 6 ,0 1 1 k J /m o l C (g r a f .) à C (d i a m .) DH 2 9 8 = + 1 ,8 8 5 k J /m o l H 2 O (l ) à H 2 O (g ) S r ô m b i c o ) à S (m o n o c l ín i c o ) DH 2 9 8 = + 4 3 ,9 4 8 k J /m o l DH 2 9 8 = + 0 ,2 9 7 k J /m o l Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a d e Fo r m a ç ã o (DH f ) Co r r e s p o n d e à e n e r g i a e n v o l v i d a n a f o r m a ç ã o de um m ol de subst ânc ia a part ir de subst ânc ias sim ples, no est ado alot rópic o m ais c om um . Ex e m p l o s H 2 (g ) + 1 /2 O 2 (g ) à H 2 O (l ) C (g r a f i t e ) + O 2 (g ) à CO 2 (g ) 1 /2 N 2 (g ) + 1 /2 O 2 (g ) à N O (g ) DH f = - 2 8 5 ,5 k J /m o l DH f = - 3 9 3 ,3 k J /m o l DH f = + 4 5 ,9 k J /m o l En t a l p i a d e f o r m a ç ã o d e s u b s t â n c i a s s i m p l e s é n u l a ! Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a d e De c o m p o s i ç ã o Po d e s e r c o n s i d e r a d a c o m o a e n t a l p i a inversa à de form aç ão de um a subst ânc ia. Ex e m p l o s H 2 O (l à H 2 (g ) + 1 /2 O 2 (g ) CO 2 (g ) à C (g r a f i t e ) + O 2 (g ) N O (g ) ) à 1 /2 N 2 (g ) + 1 /2 O 2 (g ) DH = + 2 8 5 ,5 k J /m o l DH = + 3 9 3 ,3 k J /m o l DH = - 4 5 ,9 k J /m o l Ob s e r v e q u e a o i n v e r t e r a e q u a ç ã o a v a r i a ç ã o d e ent alpia t roc a de sinal algébric o ! Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a d e Co m b u s t ã o Co r r e s p o n d e à e n e r g i a l i b e r a d a n a reaç ão de 1 m ol de subst ânc ia (c o m b u s t ív e l ) c o m O 2 p u r o (c o m b u r e n t e ). Se o c o m b u s t ív e l f o r m a t e r i a l o r g â n i c o (C,H e O) a c o m b u s t ã o p o d e s e r d e d o i s t ipos: I - Co m p l e t a : o s p r o d u t o s s ã o CO 2 e H 2 O. II - Inc om plet a: além dos produt os ac im a f o r m a -s e , t a m b é m , CO e /o u C (f u l i g e m ). Prof . Mat eus Andrade Co m b u s t ã o c o m p l e t a CH 4 + 2 O 2 à CO 2 + H 2 O CH A M A A Z U L DH = - 8 8 9 ,5 k J /m o l T ERM OQU Í M I CA C 3 H 8 + 5 O 2 à 3 CO 2 + 4 H 2 O DH = - 1 .4 0 0 k J /m o l Na c om bust ão inc om plet a a c ham a é alaranjada. A c om bust ão do C t am bém é a f o r m a ç ã o d o CO 2 ! A c om bust ão inc om plet a origina m enor c alor liberado do que a c om bust ão c om plet a . Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a d e Di s s o l u ç ã o Co r r e s p o n d e a o c a l o r l i b e r a d o o u a b s o r v i d o n a d i s s o l u ç ã o ( à s v e ze s s e g u i d a d e dissoc iaç ão) de 1 m ol de subst ânc ia de t al m odo que pela adiç ão de quant idades c resc ent es de água, seja alc anç ado um lim it e a part ir do qual não há m ais liberaç ão ou absorç ão de c alor. Ex e m p l o s H 2 SO 4 (l ) + a q H 2 SO 4 (l ) + a q (2 m o l s ) à H 2 SO 4 (a q ) (1 0 0 m o l s ) à H 2 SO 4 (a q ) N H 4 N O 3 (s ) + a q à N H 4 + N O 3 -(a q ) DH = - 2 8 ,0 k J /m o l DH = - 8 4 ,4 k J /m o l DH = + 2 6 ,3 k J /m o l Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a d e N e u t r a l i za ç ã o Co r r e s p o n d e a o c a l o r l i b e r a d o na form aç ão de 1 m ol de água, a p a r t i r d a n e u t r a l i za ç ã o d e 1 m o l d e ío n s H + p o r 1 m o l d e ío n s OH -, e m s o l u ç ã o a q u o s a d i l u íd a . Ex e m p l o s H Cl + N a OH à N a Cl + H 2 O H N O 3 + K OH à K N O 3 + H 2 O DH - 5 8 ,0 k J /m o l DH - 5 8 ,0 k J /m o l Na reaç ão de ác idos fort es c om bases fort es a variaç ão de ent alpia é aprox im adam ent e c onst ant e pois a reaç ão é s e m p r e : H + + OH - à H 2 O ! Prof . Mat eus Andrade T ERM OQU Í M I CA En t a l p i a o u En e r g i a d e L i g a ç ã o É a quant idade de c alor absorvida na q u e b r a d e 6 ,0 2 .1 0 2 3 l i g a ç õ e s d e det erm inada espéc ie, supondo as s u b s t â n c i a s n o e s t a d o g a s o s o , à 2 5 0 C. A quebra de ligaç ões é sem pre um proc esso endot érm ic o enquant o a form aç ão de ligaç ões será sem pre ex ot érm ic o. Nos reagent es sem pre oc orrerá quebra de l i g a ç õ e s (DH > 0 ) e n o s p r o d u t o s o c o r r e r á f o r m a ç ã o d e l i g a ç õ e s (DH < 0 ) . Prof . Mat eus Andrade T ERM OQU Í M I CA Ex e m p l o s d e e n e r g i a s d e l i g a ç ã o Prof . Mat eus Andrade Cá l c u l o d e e n t a l p i a a p a r t i r d a s l i g a ç õ e s T ERM OQU Í M I CA Ca l c u l a r a v a r i a ç ã o d e e n t a l p i a n a r e a ç ã o : 2 H - H (g ) + O = O (g ) à 2 H - O - H (g ) DH r e a g e n t e s = 2 . 4 3 5 ,5 + 4 9 7 ,8 = + 1 .3 6 8 ,8 k J DH p r o d u t o s = - (4 . 4 6 2 ,3 ) = - 1 .8 4 9 ,2 k J A variaç ão de ent alpia da reaç ão será obt ida pela som a algébric a das ent alpias ac im a: D H r e a ç ã o = DH r e a g e n t e s + DH p r o d u t o s D H r e a ç ã o = + 1 .3 6 8 ,8 + (- 1 .8 4 9 ,2 ) D H r e a ç ã o = - 4 8 0 ,4 k J o u - 2 4 0 ,2 k J /m o l Prof . Mat eus Andrade T ERM OQU Í M I CA Prof . Mat eus Andrade T ERM OQU Í M I CA A Lei de Hess, t am bém c onhec ida c o m o L e i d a So m a d o s Ca l o r e s d e Re a ç ã o , d e m o n s t r a q u e a variaç ão de ent alpia de um a r e a ç ã o q u ím i c a n ã o d e p e n d e d o m odo ou c am inho c om o a m esm a é r e a l i za d a e s i m d o e s t a d o i n i c i a l (r e a g e n t e s ) e e s t a d o f i n a l (p r o d u t o s ) . Prof . Mat eus Andrade A Lei de Hess pode ser dem onst rada a part ir do seguint e ex em plo: T ERM OQU Í M I CA Ca m i n h o 1 C (g r a f .) + O 2 (g ) à CO 2 (g ) DH 1 = - 3 9 3 ,4 k J Ca m i n h o 2 C (g r a f .) + ½ O 2 (g ) à CO (g ) CO (g ) + ½ O 2 (g ) à CO 2 (g ) DH 2 = - 2 8 0 ,6 k J DH 3 = - 1 1 2 ,8 k J So m a n d o a s d u a s e q u a ç õ e s r e s u l t a : C (g r a f .) + O 2 (g ) à CO 2 (g ) DH 1 = - 3 9 3 ,4 k J A e n t a l p i a f i n a l s e r á DH 2 + DH 3 Prof . Mat eus Andrade T ERM OQU Í M I CA Ex e m p l o Ca l c u l a r a v a r i a ç ã o d e e n t a l p i a e n v o l v i d a n a c o m b u s t ã o d e 1 m o l d e CH 4 (g ), ex pressa por: CH 4 (g ) + 2 O 2 (g ) à CO 2 (g ) + 2 H 2 O (l ) sabendo que: 1 ) DH f o r m a ç ã o CH 4 (g ) = - 7 4 ,8 2 k J /m o l 2 ) DH f o r m a ç ã o CO 2 (g ) = - 3 9 3 ,4 k J /m o l 3 ) DH f o r m a ç ã o H 2 O (l ) = - 2 8 5 ,5 k J /m o l Prof . Mat eus Andrade T ERM OQU Í M I CA So l u ç ã o De s e n v o l v e n d o a s e q u a ç õ e s r e l a t i v a s à form aç ão dos c om ponent es: 1 . f o r m a ç ã o d o CH 4 C + 2 H2 CH 4 DH 1 = - 7 4 ,8 2 k J /m o l 2 . f o r m a ç ã o d o CO 2 C + O2 CO 2 DH 2 = - 3 9 3 ,4 k J /m o l 3 . f o r m a ç ã o d a H 2O H 2 + ½ O2 H 2O DH 3 = - 2 8 5 ,5 k J /m o l Prof . Mat eus Andrade So l u ç ã o T ERM OQU Í M I CA Aplic ando a Lei de Hess, para obt er a c o m b u s t ã o d o CH 4 d e v e r e m o s : a ) i n v e r t e r a e q u a ç ã o d e f o r m a ç ã o d o CH 4 ; CH 4 à C + 2 H 2 DH = + 7 4 ,8 2 k J b ) u t i l i za r d a f o r m a a p r e s e n t a d a a e q u a ç ã o d e f o r m a ç ã o d o CO 2 ; C + O 2 à CO 2 DH = - 3 9 3 ,4 k J c ) u t i l i za r a e q u a ç ã o d e f o r m a ç ã o d a água m u l t i p l i c a d a p o r 2 (i n c l u s i v e a e n t a l p i a ) 2 H 2 + O2 à 2 H 2 O DH = - 5 7 1 ,0 k J Prof . Mat eus Andrade So l u ç ã o 1 ) CH 4 à C + 2 H 2 DH = + 7 4 ,8 2 k J 3 ) 2 H 2 + O2 à 2 H 2O DH = - 5 7 1 ,0 k J T ERM OQU Í M I CA 2 ) C + O 2 à CO 2 DH = - 3 9 3 ,4 k J que som adas, result a CH 4 (g ) + 2 O 2 (g ) à CO 2 (g ) + 2 H 2 O (l ) A variaç ão da ent alpia será: DH RQ = + 7 4 ,8 2 + (- 3 9 3 ,4 ) +(- 5 7 1 ,0 ) DH RQ = - 8 8 9 ,5 8 k J /m o l d e CH 4 Es s e m é t o d o é c o n h e c i d o c o m o “ m é t o d o d a s e q u a ç õ e s t e r m o q u ím i c a s ” . Prof . Mat eus Andrade T ERM OQU Í M I CA A Lei de Hess pode ser aplic ada usando o “ m ét odo da ent alpia final e inic ial” , c onsiderando que a variaç ão d e e n t a l p i a d e u m a r e a ç ã o q u ím i c a s ó depende do est ado de energia de reagent es e produt os. DH RQ = S ni (DH f ) p r o d u t o s -S ni (DH f ) r e a g e n t e s o n d e ni s ã o o s c o e f i c i e n t e s est equiom ét ric os de reagent es e produt os da reaç ão. Prof . Mat eus Andrade Po r t a n t o p a r a a r e a ç ã o : T ERM OQU Í M I CA CH 4 (g ) + 2 O 2 (g ) à CO 2 (g ) + 2 H 2 O (l ) A variaç ão de ent alpia será: DH RQ = [ DH f (CO 2 ) + 2 DH f (H 2 )] - [ DH f (CH 4 ) + 0 ] DH RQ = [ (- 3 9 3 ,4 ) + 2 (- 2 8 5 ,5 )] - (- 7 4 ,8 2 ) DH RQ = - 8 8 9 ,5 8 k J o u l e /m o l A En t a l p i a d e f o r m a ç ã o d o O 2 é n u l a . (s u b s t â n c i a s i m p l e s ) Prof . Mat eus Andrade Aplic aç ões da Lei de Hess T ERM OQU Í M I CA 1 . Pr e v i s ã o d e c a l o r e s d e r e a ç ã o , a p a r t i r d e ent alpias c onhec idas. 2 . De t e r m i n a ç ã o d o p o d e r c a l o r íf i c o d e c o m b u s t ív e i s a u t o m o t i v o s e a l i m e n t o s . Ex e m p l o s Oc t a n o (g a s o l i n a ) = 4 7 ,8 k J o u l e /g r a m a Et a n o l (á l c o o l c o m u m ) = 4 4 ,7 k J o u l e /g r a m a M e t a n o (GN V ) = 4 9 ,0 k J o u l e /g r a m a Gl i c o s e (c a r b o h i d r a t o ) = 1 7 ,5 k J o u l e /g r a m a L i p íd i o (g o r d u r a s ) = 3 8 ,6 k J o u l e /g r a m a Prof . Mat eus Andrade Prof . Mat eus Andrade
Baixar