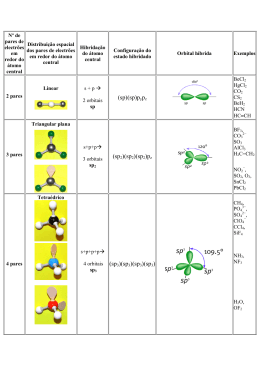
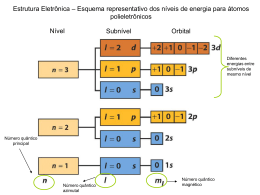
1- Ligação Química : Breve Revisão Configuração Electrónica – forma como os electrões estão distribuídos pelas várias orbitais atómicas. 1s Ordem pela qual as orbitais são preenchidas 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 6f 7s 7p 7d 7f 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 ... nº máximo de electrões que suporta cada orbital atómica s p d f 1- Ligação Química : Breve Revisão Regra do octeto - quando os átomos formam ligações covalentes partilham electrões de modo a ficarem rodeados por oito electrões de valência. C N O H H C H H H H N H H O H H H H C H H N H H O H H H Cl O C O N N Cl O C O N N Ligação simples Ligação dupla H Ligação tripla 1- Ligação Química : Breve Revisão LIGAÇÃO IÓNICA Os compostos iónicos em geral combinam um metal do grupo IA ou do grupo IIA com um halogéneo ou com oxigénio 3Li Li 1s2 2s1 1s2 2s1 + 9F F 1s2 2s2 2p5 LiF 1s2 2s2 2p5 Li+ F - (Li F) [He] [Ne] O electrão 2s1 do átomo de lítio é transferido para o átomo de flúor Os iões que formam a entidade Li+F- permanecem juntos devido à atracção electrostática ente o ião Li+ e o ião F-. O resultado desta atracção é a formação de uma ligação iónica, a qual faz com que os iões permaneçam ligados no composto iónico. 1- Ligação Química : Breve Revisão EXCEPÇÕES À REGRA DO OCTETO Octeto incompleto - quando o número de electrões que rodeia o átomo central é menor do que oito. F H Be H F B O N F Octeto expandido- quando o número de electrões que rodeia o átomo central é maior do que oito. F F F S F F F Cl F F F As F F Cl Cl Cl P Cl 1- Ligação Química : Breve Revisão Electronegatividade - tendência de um átomo numa ligação para atrair para si os electrões que formam essa ligação química. elementos mais electronegativos: halogénios, oxigénio, enxofre e azoto. pe rcentagem do ca rácter iónico da ligaç ão elementos menos electronegativos: metais alcalinos e alcalino-terrosos. aumento elec tronegativ idade aumento da electronegatividade 10 0 50 0 0 0,5 1,0 1,5 2,0 2,5 3,0 diferença de e le ctrone gativ ida de entre os átomos ligação covalente apolar ligação covalente polar ligação iónica partilha de electrões exactamente igual partilha desigual de electrões transferência de electrões Átomos do mesmo elemento Cl2 Elementos com electronegatividades semelhantes H-Cl d+ d- Elementos com electronegatividades muito diferentes NaCl 1- Ligação Química : Breve Revisão ESCRITA DE ESTRUTURAS DE LEWIS HClO3 Escrever o esqueleto estrutural do composto evidenciando os O átomos que se encontram ligados entre si H O Cl O O átomo menos electronegativo ocupa a posição central Contar todos os electrões de valência para aniões: adicionar o número de cargas negativas a esse total para catiões: subtrair o número de cargas positivas a esse total Desenhar uma ligação covalente simples entre o átomo central e cada um dos átomos ligandos O Cl H 6x3 7 1 26 e- O H O Cl O O Completar o octeto dos átomos ligados ao átomo central Colocar os electrões remanescentes no átomo central H O Cl O O H O Cl O 1- Ligação Química : Breve Revisão ESCRITA DE ESTRUTURAS DE LEWIS HClO3 Se a regra do octeto não se verificar para o átomo central, estabelecer ligações duplas ou triplas entre o átomo central e os ligandos utilizando para tal os pares isolados destes últimos átomos 2- O O C O 2- O O C O CARGA FORMAL E ESTRUTURAS DE LEWIS Carga formal de um átomo - diferença entre o número de electrões de valência num átomo isolado e o número de electrões atribuídos a esse átomo numa estrutura de Lewis. 1- Ligação Química : Breve Revisão CARGA FORMAL E ESTRUTURAS DE LEWIS Carga formal = nº total de electrões de valência no átomo electrões isolado não-ligantes O H2SO4 H O S nº total de - 1/2 nº total de electrões ligantes O O H H O O O S O H O H O S O O Estrutura II Estrutura I O O H O S 2+ O H O Estrutura I H O S O H O Estrutura II H 1- Ligação Química : Breve Revisão Licenciatura em Enologia Química Orgânica I (Lucinda Reis) 2- Ligação Química : Breve Revisão 9 1- Ligação Química : Breve Revisão CARGA FORMAL E ESTRUTURAS DE LEWIS Para moléculas neutras, a soma de todas as cargas formais tem de ser zero. Para catiões, a soma de todas as cargas formais tem de igualar a carga positiva do catião. Para aniões, a soma de todas as cargas formais tem de igualar a carga negativa do anião. Quando são possíveis várias estruturas de Lewis, aqu elas que tiverem cargas formais mais baixas são mais estáveis e, por isso, preferíveis. 1- Ligação Química : Breve Revisão O CONCEITO DE RESSONÂNCIA 2- O O S 2- O O O S 2- O O O S O Estruturas de ressonância (estruturas de Lewis equivalentes, que se podem converter umas nas outras mudando apenas as posições dos electrões) benzeno (C6H6) H H H C C C C C C H H H H H H C H C C C C C H H 1- Ligação Química : Breve Revisão GEOMETRIA MOLECULAR MODELO RPECV (Repulsão dos Pares Electrónicos da Camada de Valência) As ligações duplas e triplas podem ser tratadas como se fossem ligações simples. Se puderem ser escritas duas ou mais estruturas de ressonância para uma molécula, o modelo pode ser aplicada a qualquer delas. 180º H C C H Geometria linear O=C=O H 109,5º C H H H O 120º H O H Geometria triangular plana C H Geometria tetraédrica 104,5º Geometria angular H 1- Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão HIBRIDAÇÃO Hibridação sp3 6C H H C H estado fundamental 1s2 2s2 2px 2py 2pz 1s2 2s1 2px 2py 2pz estado excitado hibridação 1s2 4 orbitais híbridas sp3 H 1- Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão hibridação 1s 2 HIBRIDAÇÃO 2 orbitais híbridas sp 2 orbitais p puras Hib rid ação sp3 7N H N H estado fundam ental 1s 2 2s 2 2px 2py 2pz hibridação 1s 2 4 orbitais híbridas sp 3 H 1- Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão HIBRIDAÇÃO Hibridação sp2 6C H H C H estado fundamental 1s2 2s2 2px 2py 2pz 1s2 2s1 2px 2py 2pz estado excitado hibridação 1s2 3 orbitais híbridas sp2 orbital p pura C H 1- Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão HIBRIDAÇÃO Hib rid ação sp 6C H C C H estado fundam ental 1s 2 2s 2 2px 2py 2pz 1s 2 2s 1 2px 2py 2pz estado excitado hibridação 1s 2 2 orbitais híbridas sp 2 orbitais p puras Hib rid ação sp3 7N H N H H 1 - Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão 1- Ligação Química : Breve Revisão POLARIDADE MOLECULAR Momento dipolar =q xr (1 D = 3,33 x 10 -30 C m) Moléculas diatómicas homonucleares: = 0 moléculas apolares =0 H2 Moléculas diatómicas heteronucleares: ≠ 0 moléculas polares HCl Moléculas poliatómicas: depende da polaridade das ligações e da geometria molecular moléculas apolares CO2 CC l4 BC l3 =0 =0 =0 >0 1- Ligação Química : Breve Revisão POLARIDADE MOLECULAR moléculas polares H2O 0 NH3 >0 O momento dipolar é útil na distinção de moléculas diferentes Cl H C H Cl C =0 Cl C Cl C H H = 1,89 D
Baixar