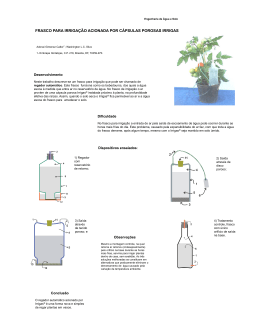
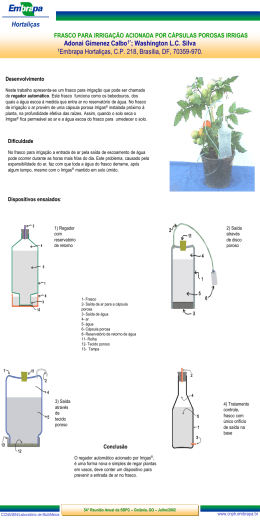
Estudo dos gases Variáveis de estado ou Variáveis termodinâmicas Pressão, Volume e Temperatura TRANSFORMAÇÃO ISOTÉRMICA • Temperatura constante • Volume inversamente proporcional à pressão P = 1/V P0V0 = PV TRANSFORMAÇÃO ISOBÁRICA • Pressão constante. • Volume diretamente proporcional à sua temperatura. V0/T0 = V/T TRANSFORMAÇÃO ISOVOLUMÉTRICA ( ISOCÓRICA ) •Volume constante •Pressão diretamente proporcional a temperatura Movimento Browniano Movimento aleatório de partículas num fluido (líquido ou gás) como consequência dos choques entre todas as moléculas ou átomos presentes no fluido. Equação de estado dos gases ideais Esta equação traduz a variação de uma determinada quantidade de gás ideal, com a pressão, o volume e a temperatura: PV = nRT onde: P - pressão do gás ( Pascal / atm); V - volume ocupado pelo gás ( m³ / l ); n - quantidade química (número de moles) de gás presente (mol); R - constante universal dos gases ideais; (8,31 J.mol-1.K-1 / 0,082atm . dm3 . mol-1 K-1 ) T - temperatura absoluta. Equação geral dos gases Exercício: 01 ] Certo gás contido em um recipiente de 1m³ com êmbolo exerce uma pressão de 250Pa. Ao ser comprimido isotermicamente a um volume de 0,6m³ qual será a pressão exercida pelo gás? 02 ] O gráfico abaixo mostra a isoterma de uma quantidade de gás que é levado de um estado 1 para um estado 2. O volume do estado 2, em litros, é: (a) 2 L (b) 4,5 L (c) 6 L (d) 4 L (e) 3 L 03 ] Q5 - Para se realizar uma determinada experiência, • coloca-se um pouco de água em uma lata, com uma abertura na parte superior, destampada, a qual é, em seguida, aquecida, como mostrado na Figura I; • depois que a água ferve e o interior da lata fica totalmente preenchido com vapor, esta é tampada e retirada do fogo; • logo depois, despeja-se água fria sobre a lata e observa-se que ela se contrai bruscamente, como mostrado na Figura II. Com base nessas informações, é CORRETO afirmar que, na situação descrita, a contração ocorre porque a) a água fria provoca uma contração do metal das paredes da lata. b) a lata fica mais frágil ao ser aquecida. c) a pressão atmosférica esmaga a lata. d) o vapor frio, no interior da lata, puxa suas paredes para dentro. 04 ] Enem - Partículas suspensas em um fluido apresentam contínua movimentação aleatória, chamado movimento browniano, causado pelos choques das partículas que compõem o fluido. A ideia de um inventor era construir uma série de palhetas, montadas sobre um eixo, que seriam postas em movimento pela agitação das partículas ao seu redor. Como o movimento ocorreria igualmente em ambos os sentidos de rotação, o cientista concebeu um segundo elemento, um dente de engrenagem assimétrico. Assim, em escala muito pequena, este tipo de motor poderia executar trabalho, por exemplo, puxando um pequeno peso para cima. O esquema, que já foi testado, é mostrado a seguir. A explicação para a necessidade do uso da engrenagem com trava é: A) O travamento do motor, para que ele não se solte aleatoriamente. B) A seleção da velocidade, controlada pela pressão nos dentes da engrenagem. C) O controle do sentido da velocidade tangencial, permitindo, inclusive, uma fácil leitura do seu valor. D) A determinação do movimento, devido ao caráter aleatório, cuja tendência é o equilíbrio. E) A escolha do ângulo a ser girado, sendo possível, inclusive, medi-lo pelo número de dentes da engrenagem. 05 ] (UFMG) Um cilindro tem como tampa um êmbolo, que pode se mover livremente. Um gás, contido nesse cilindro, está sendo aquecido, como representado na figura. Assinale a alternativa cujo diagrama MELHOR representa a pressão em função da temperatura nessa situação. 06 ] (FGV) Para garantir a dosagem precisa, um medicamento pediátrico é acompanhado de uma seringa. Depois de destampado o frasco de vidro que contém o remédio, a seringa é nele encaixada com seu êmbolo completamente recolhido. Em seguida, o frasco é posicionado de cabeça para baixo e o remédio é então sugado para o interior da seringa, enquanto o êmbolo é puxado para baixo. Como consequência da retirada do líquido, o ar que já se encontrava dentro do frasco, expande-se isotermicamente, preenchendo o volume antes ocupado pelo remédio. Ao retirar-se uma dose de 40 mL de líquido do frasco, que continha um volume ocupado pelo ar de 100 mL, o êmbolo encontra certa resistência, devido ao fato de a pressão no interior do frasco ter se tornado, aproximadamente, em Pa. Dados: Pressão atmosférica = 1,0x105 Pa --- Suponha que o ar dentro do frasco se comporte como um gás ideal --- Considere desprezível o atrito entre o êmbolo e a parede interna da seringa. a) 57 000. b) 68 000. c) 71 000. d) 83 000. e) 94 000. Correção 3C 4D 5A 6 ] Inicialmente destampado = pressão atmosférica. Vo (frasco) = 100ml V = 140ml. Considerando um gás ideal com transformação isotérmica: Po ⋅ Vo = P ⋅ V 1 ⋅ 105 ⋅ 100 = P ⋅ 140 P = 71 ⋅ 103N/m² Letra C
Baixar