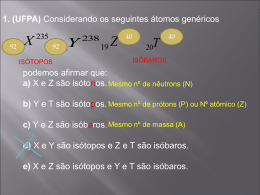
Reidratando cristais anidros FUNÇÕES INORGÂNICAS QUESTÃO 11 Nitratos e carbonatos formam compostos de grande utilidade na vida diária. Com relação a esses compostos, analise as afirmações abaixo. I. Alguns nitratos são muito utilizados como fertilizantes, na agricultura. II. O mármore (CaCO3) é resistente a ataque ácido, isto é, não reage com soluções ácidas. III. Oxido de cálcio (CaO), utilizado em estações de tratamento de água, pode ser obtido pelo aquecimento do carbonato de cálcio. IV. Mesmo sendo solúveis em água, os sais formados pelos nitratos não se dissociam em íons quando em solução aquosa. V. Amônia (NH3) pode reagir com o ácido nítrico, formando o nitrato de amônio (NH4NO3). Estão corretas apenas as afirmações: a) I, II e III b) II, IV e V c) I, II e IV d) III, IV e V e) I, III e V I. Alguns nitratos são muito utilizados como fertilizantes, na agricultura. RESOLUÇÃO CORRETA O nitrato de sódio é conhecido como salitre do Chile e é usado na fabricação de fertilizante e de pólvora. II. O mármore (CaCO3) é resistente a ataque ácido, isto é, não reage com soluções ácidas. RESOLUÇÃO FALSA O calcário – CaCO3 – constituinte também do mármore reage com ácidos, com liberação de gás carbônico. CaCO3 + 2HCl CaCl2 + CO2 + H2O IV. Mesmo sendo solúveis em água, os sais formados pelos nitratos não se dissociam em íons quando em solução aquosa. FALSA RESOLUÇÃO Os nitratos são solúveis em água, se dissociam em íons NaNO3(s) H2O Na+(aq) + NO-3(aq) V. Amônia (NH3) pode reagir com o ácido nítrico, formando o nitrato de amônio (NH4NO3). CORRETA RESOLUÇÃO NH3 + HNO3 NH4NO3 nitrato de amônia RESPOSTA: E QUESTÃO 12 As seguintes reações são, em parte, responsáveis pela formação da chuva ácida, que pode causar prejuízos para a saúde humana, provocar corrosão e tornar a água e o solo ácidos. SO3 + H2O 2NO2 + H2O H2SO4 HNO3 + HNO2 Sobre as duas reações, no sentido apresentado, considere as afirmativas a seguir. I. As espécies químicas SO3 e NO2 são classificadas como ácidos de Arrhenius, independente do solvente. II. O ácido nítrico quando reage com uma base forma um hidrogeno sal. III. Dos compostos formados, dois deles são classificados como ácidos fortes. IV. As espécies químicas SO3 e NO2, nas reações apresentadas, são classificadas como óxidos ácidos. Estão corretas apenas as afirmativas: a) I e II. b) I e IV. c) III e IV, d) I, II e III. e) II, III e IV. I. As espécies químicas SO3 e NO2 são classificadas como ácidos de Arrhenius, independente do solvente. FALSA RESOLUÇÃO SO3 e NO2 são óxidos ácidos Somente no solvente água com quem reagem são ácidos de Arrhenius. SO3 + H2O H2SO4(aq) 2NO2 + H2O 2H+ 2- (aq) + SO4(aq) HNO2 + HNO3 II. O ácido nítrico quando reage com uma base forma um hidrogeno sal. RESOLUÇÃO HNO3 + NaOH não forma hidrogeno-sal H2CO3 + NaOH forma hidrogeno-sal FALSA NaNO3 + H2O sal normal NaHCO3 + H2O Hidrogeno-carbonato de sódio hidrogeno-sal III. Dos compostos formados, dois deles são classificados como ácidos fortes. RESOLUÇÃO CORRETA SO3 + H2O H2SO4 2NO2 + H2O HNO3 ácidos fortes + HNO2 ácido moderado IV. As espécies químicas SO3 e NO2, nas reações apresentadas, são classificadas como óxidos ácidos. RESOLUÇÃO CORRETA Óxidos Ácidos ou Anidridos, reagem com água produzindo um ácido, ou reagem com uma base produzindo sal e água. SO3 + H 2O H2SO4 2NO2 + H2O HNO3 óxidos ácidos RESPOSTA: C + HNO2 QUESTÃO 13 Agentes protetores solares (ou filtros solares) ajudam a bloquear a radiação UV antes que ela cause danos à pele. Alguns produtos são opacos e refletem a radiação UV, como as pastas brancas que os salvavidas costumam usar no rosto. Essas pastas contêm pigmentos brancos refletores, como o dióxido de titânio (TiO2) e o oxido de zinco (ZnO). Em relação aos compostos citados, considere as afirmativas a seguir. I. O óxido de zinco reage com base forte e com ácido forte. II. A configuração eletrônica do íon titânio no TiO2 é 1s2, 2s2, 2p6, 3s2, 3p6. III. A configuração eletrônica do íon zinco no ZnO é 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d8. IV. O metal zinco apresenta maior raio atômico que o metal titânio. Estão corretas apenas as afirmativas: a) I e II. b) I e III. c) III e IV. d) I, II e IV. e) II, III e IV. I. O óxido de zinco reage com base forte e com ácido forte. RESOLUÇÃO CORRETA + ácido sal + água ZnO é um óxido anfótero + base sal + água ZnO + HCl ZnO + 2NaOH ZnCl2 + H2O Na2ZnO2 + H2O II. A configuração eletrônica do íon titânio no TiO2 é 1s2, 2s2, 2p6, 3s2, 3p6. RESOLUÇÃO CORRETA Ti O2 +4 -4 =0 +4 -2 Ti 22 4+ do átomo 1s2 2s2 2p6 3s2 3p6 4s2 3d2 do íon Ti4+ 1s2 2s2 2p6 3s2 3p6 III. A configuração eletrônica do íon zinco no ZnO é 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d8. RESOLUÇÃO FALSA Zn O +2 -2 =0 do átomo Zn 30 do íon 2+ Zn 30 1s2 2s2 2p6 3s2 3p6 4s2 3d10 1s2 2s2 2p6 3s2 3p6 3d10 IV. O metal zinco apresenta maior raio atômico que o metal titânio. RESOLUÇÃO 3 4 5 21 22 23 Sc Ti 45,0 39 IIIB IVB VB FALSA 6 VIB 7 8 9 VIII 10 11 12 VIIB VIIIB 24 25 26 27 28 29 30 V Cr Mn Fe Co Ni Cu Zn 47,9 50,9 52,0 54,9 55,8 58,9 58,7 63,5 65,4 40 41 42 43 44 45 46 47 48 RAIO AUMENTA RTi > RZn RESPOSTA: A VIII IB IIB QUESTÃO 14 Ácidos, bases e sais fazem parte de nossa vida. Estão presentes nos líquidos dos organismos vivos, nos processos Industriais e até em diversos acidentes que afetam o meio ambiente. Sobre esses tipos de substâncias químicas foram feitas as afirmações que seguem. Analise-as. I. Para neutralizar um derramamento de ácido sulfúrico, pode-se utilizar calcário (CaCO3). Formamse CaSO4, CO2 e água quando a neutralização é completa. II. A hiperacidez estomacal (azia) é reduzida de forma segura pela ingestão de pastilhas de NaOH. III. No rótulo de certa água mineral amplamente comercializada em Maringá lê-se que o valor do pH é 4,5. Logo, essa água mineral é fortemente alcalina. IV. Indicadores ácido-base são substâncias que mudam de cor conforme o pH do meio em que se encontram. Um exemplo de indicador ácido-base é o cloreto de sódio (NaCl). V. Um exemplo de substância de caráter básico freqüentemente utilizada na construção civil é a cal hidratada. Estão corretas apenas as afirmações: a) I e V b) III e IV c) II e IV d) I, II e III e) III, IV e V I. Para neutralizar um derramamento de ácido sulfúrico, pode-se utilizar calcário (CaCO3). Formamse CaSO4, CO2 e água quando a neutralização é completa. RESOLUÇÃO CaCO3 CORRETA sal de caráter básico, pH > 7, neutraliza ácido. H2SO4 + CaCO3 CaSO4 + CO2 + H2O II. A hiperacidez estomacal (azia) é reduzida de forma segura pela ingestão de pastilhas de NaOH. RESOLUÇÃO FALSA Para neutralizar a hiperacidez estomacal não se ingere soda cáustica – NaOH. Alguns antiácidos estomacais apresentam em sua composição, junto com hidróxido de magnésio – Mg(OH)2 – leite de magnésia – o hidróxido de alumínio – Al(OH)3 III. No rótulo de certa água mineral amplamente comercializada em Maringá lê-se que o valor do pH é 4,5. Logo, essa água mineral é fortemente alcalina. FALSA RESOLUÇÃO neutra pH 0 ácida 4,5 água ácida 7 básica 14 IV. Indicadores ácido-base são substâncias que mudam de cor conforme o pH do meio em que se encontram. Um exemplo de indicador ácido-base é o cloreto de sódio (NaCl). RESOLUÇÃO FALSA NaCl – Cloreto de Sódio não é um indicador. V. Um exemplo de substância de caráter básico freqüentemente utilizada na construção civil é a cal hidratada. RESOLUÇÃO CORRETA O hidróxido de cálcio é conhecido por cal hidratada, cal extinta ou cal apagada. Pode ser obtido da cal viva ou da cal virgem, pela reação com a água: CaO + H2O Ca(OH)2 + calor A preparação da argamassa utiliza a Ca(OH)2, ou Cal. É utilizado em grandes quantidades nas pinturas a cal (caiação). É usado na agricultura para neutralizar a acidez do solo, quando necessário. Ca(OH)2 cal hidratada é uma substância básica RESPOSTA: A
Download