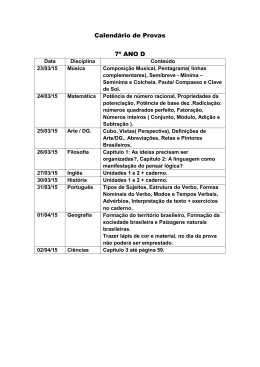
TECNICO I-I ANÁLISE QUÍMICA ORIENTAÇÕES AO CANDIDATO A Prova Escrita de cada cargo/perfil de Técnico valerá 10 (dez) pontos e será composta por 10 (dez) questões discursivas, 1 (uma) para cada tema do respectivo cargo/perfil, valendo 1 (um) ponto cada questão. A Comissão Examinadora terá 2 (duas) horas para elaboração da prova. A Prova Escrita será aplicada aos candidatos imediatamente após sua elaboração. Confira se seus dados indicados no caderno de respostas estão corretos. Se notar qualquer divergência, notifique imediatamente o Fiscal/Chefe Local. Terminada a conferência, efetue a desidentificação do caderno de respostas destacando a parte onde estão contidos os seus dados. A Prova Escrita terá a duração de 3 horas, incluindo o tempo gasto para a transcrição da área reservada para rascunho para a área reservada para a resposta. Somente será objeto de correção da Prova Escrita o que estiver contido na área reservada para a resposta. NÃO será considerado o que estiver contido na área reservada para rascunho. O caderno de respostas NÃO pode ser amassado, dobrado, manchado ou conter qualquer forma de identificação do candidato. Use somente caneta esferográfica azul ou preta, serão consideradas não válidas as provas ou trechos da prova que forem ilegíveis ou com rasuras. Para a realização da Prova Escrita será distribuído um caderno de respostas (contendo área reservada para rascunho e área reservada para a resposta), elaborado para esse fim, não sendo permitido o uso de qualquer outro papel ou folha diferente do material disponibilizado; Os candidatos, durante a Prova Escrita, NÃO poderão fazer qualquer tipo de consulta, seja a legislação ou qualquer material bibliográfico. Após 01 hora do início da Prova Escrita, o candidato poderá deixar a sala de prova entregando ao fiscal o caderno de respostas o caderno de perguntas, sem qualquer tipo de identificação. (Assinatura, rubrica, sinal, etc.), porém os 03 últimos só poderão sair juntos. Não será permitida, durante a realização da prova, a comunicação entre os candidatos, a utilização de aparelhos celulares ou similares, de máquinas calculadoras ou relógios, sendo eliminado do processo o candidato que descumprir esta determinação. O candidato NÃO poderá levar consigo o caderno de questões. O Resultado Preliminar da Prova Escrita será divulgado no dia 23 de outubro de 2012. AGUARDE O AVISO PARA INICIAR SUA PROVA, MANTENHA A CALMA E BOA SORTE. TÉCNOI-I ANÁLISE QUÍMICA QUESTÃO 1 É necessário analisar com rigor o elemento cálcio presente em uma amostra sólida friável, de aspecto heterogêneo e higroscópica, constituída por uma mistura de cloreto de cálcio e carbonato de cálcio. Apresente a sequência de procedimentos e equipamentos necessários para se obter a amostra apropriada à referida determinação, justificando a ordem apresentada. QUESTÃO 2 O Sistema Internacional (SI) de Unidades é adotado por praticamente todos os países. Nesse sistema são definidas sete grandezas físicas básicas ou fundamentais e as suas unidades: Grandeza Comprimento Massa Tempo Corrente elétrica Temperatura Quantidade de matéria Intensidade luminosa Unidade metro quilograma segundo ampère kelvin mol Símbolo m kg s A K mol candela cd As outras unidades são derivadas destas unidades básicas. Dê o nome e o símbolo da unidade SI para a pressão e escreva sua dimensão em função das unidades básicas. QUESTÃO 3 Em uma manipulação laboratorial foram dissolvidos 8,00 g de hidróxido de sódio sólido em 200 mL de uma solução 2,00 mol L-1 de ácido nítrico. Em seguida, o volume da solução foi ajustado para 2,00 L. Escreva a reação química ocorrida no processo e calcule o valor do pH e do pOH da solução após o ajuste final do volume. Dados: Massas atômicas em u.a.: Na= 23,0 ; N= 14,0 ; O= 16,0 ; H=1,00 QUESTÃO 4 A identificação e a aplicação de vidraria e equipamentos de laboratório são importantes para uma manipulação correta no preparo de soluções. Descreva, utilizando os equipamentos e vidrarias comuns de laboratório, a preparação de 500 mL de solução aquosa de cloreto de potássio (KC), com concentração igual a 0,200 mol L-1, a partir de cloreto de potássio anidro e água destilada. Dados: Massas atômicas em u.a.: K= 39,0 ; C= 35,5 2 TÉCNOI-I ANÁLISE QUÍMICA QUESTÃO 5 Uma dada amostra constituída de polímeros orgânicos e pigmentos brancos inorgânicos foi submetida à calcinação ao ar, cuja perda de massa é representada pelo gráfico abaixo (percentual de perda de massa contra a temperatura). a) Que informações se podem tirar a partir do perfil do gráfico observado? Identifique o componente da amostra responsável por tal perfil. b) A amostra final é constituída por uma mistura de carbonatos de cálcio, sódio e bário. Indique como digerir essa massa final e apresente o esquema de separação que pode ser aplicado à separação desses metais. QUESTÃO 6 A capacidade de troca de uma resina de troca iônica pode ser definida como o número de mol de sítios eletricamente carregados por grama de resina seca. Uma resina de estireno divinilbenzeno modificada para obtenção de uma resina de troca iônica com o grupamento –SO3- é indicada para retenção de que tipo de espécies iônicas? Justifique. QUESTÃO 7 Uma amostra de água foi analisada para identificar a presença de um dos seguintes íons: cloreto, brometo e iodeto. Com base nos ensaios qualitativos e dispondo de tetracloreto de carbono, solução aquosa de hipoclorito de sódio e solução aquosa de nitrato de prata em meio ácido, proponha ensaios químicos para identificação de cada um desses íons. Dados: ânion CBrI- Produto formado Cor do precipitado branco AgC AgBr AgI 3 amarelo amarelo TÉCNOI-I ANÁLISE QUÍMICA QUESTÃO 8 Para determinar o teor de ácido acético em uma amostra foi necessário utilizar uma solução de NaOH padronizada com HC. Para se padronizar 20,00 mL da solução de NaOH 0,1 mol L-1 utilizou-se 22,00 mL da solução de HC 0,1000 mol L-1. Na determinação da acidez total da amostra, uma alíquota de 25,00 mL consumiu 25,00 mL da solução padronizada de NaOH. a) Apresente vantagens e desvantagens dos métodos de análise gravimétrica e volumétrica. b) Determine o teor de ácido acético nesta amostra. Dado: massa molar do ácido acético: 60 g mol-1 QUESTÃO 9 Para realizar uma determinação do teor de Pb em óleo lubrificante por espectrometria de absorção atômica, 5,00 g da amostra foram dissolvidos em um solvente orgânico e transferidos para um balão volumétrico de 20,00 mL. A solução resultante foi aspirada em uma chama de ar-acetileno. A curva de calibração obtida para este elemento foi construída por meio da adição de quantidades conhecidas deste metal. A curva de calibração obtida neste experimento está apresentada abaixo e a absorvância obtida para a amostra foi 25,1 (Abs x100). Calcule o teor (% m/m) de Pb na amostra de óleo. QUESTÃO 10 Toda medida experimental possui uma certa incerteza que chamamos de erro experimental. O erro experimental pode ser classificado em erro sistemático e erro aleatório. Após realizar um trabalho de campo, um analista construiu a tabela abaixo com os resultados das análises (realizadas em triplicata) da concentração de ferro (μg L-1) em 3 amostras de água. a) Dê um exemplo de erro experimental e identifique o tipo de erro. b) Sabendo que águas com teores de ferro até 0,2 mg L-1 são consideradas aceitáveis para uso doméstico, diga se a amostra 3 está com teor de ferro aceitável para uso doméstico. Expresse os resultados do teor de ferro pelo intervalo de confiança, adotando t = 3,0 para 95% de confiança. s Dados: Intervalo de Confiança = X ± t n ; Amostra 1 2 3 3 = 1,7 ; massa molar do Fe = 56 g mol-1 Média da Concentração de Ferro (μg L-1) 3,6 3,4 3,3 4 Desvio padrão das análises 0,3 0,2 0,1
Baixar