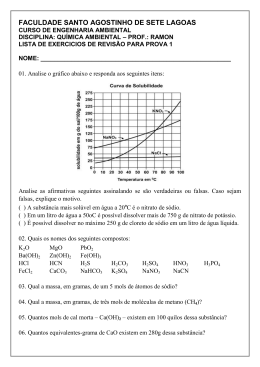
Relação entre normalidade e concentração em mol/L O equivalente-grama possui uma evidente relação com a sua massa molar e, portanto, a concentração em mol está relacionada com a quantidade em mols, enquanto a normalidade está relacionada com o número de equivalentes-gramas. Portanto a concentração em mol está diretamente relacionada com a normalidade. Veja a demonstração dessa relação: Sendo assim, podemos dizer que a normalidade de uma solução é equivalente à sua concentração em mol/L multiplicada pelo número k. Veja como é fácil: O número k: nos ácidos, é o número de hidrogênios ionizáveis; nas bases, é o número de hidroxilas; nos sais, é o total de valência dos cátions ou ânions; nos óxidos, é o total de valência do elemento combinado com oxigênio. Exemplos Solução 1M de HCl N=M.k∴N=1.1=1 Uma solução 1M de HCl é também 1N Solução 1M de H2SO4 N=M.k∴N=1.2=2 Uma solução 1M de H2SO4 é também 2N Sempre que k for um número inteiro podemos dizer que a normalidade é sempre igual ou maior do que a concentração em mol/L, jamais será menor. TQE Novembro de 2012
Baixar