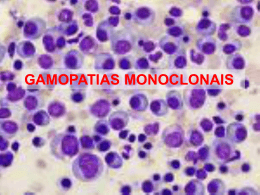
imunologia ELETROFORESE DE PROTEÍNAS E IMUNOFIXAÇÃO 1. INTRODUÇÃO 1.1. Conceitos básicos: Eletroforese é um termo amplo que se refere à migração de todos os solutos ou partículas carregadas em um meio líquido sob a influência de um campo elétrico. As proteínas possuem cargas positivas e negativas, sendo sua mobilidade eletroforética diretamente proporcional à carga da partícula e inversamente proporcional à viscosidade do meio (1,2). 1.2. Tipos de eletroforese: I. Eletroforese de zona: Técnica tradicionalmente utilizada na qual ocorre a migração das partículas como zonas, usualmente em um meio de suporte poroso como acetato de celulose, gel de agarose ou poliacrilamida, após a amostra ser misturada com uma solução tampão. Isto gera um eletroforetograma que dispõe as zonas de proteínas com limites precisos. As zonas de proteínas são visualizadas quando o meio de suporte é corado. A seguir, o meio de suporte é secado e as proteínas quantificadas em um densitômetro, que converte o padrão de bandas em picos. A agarose é um polissacarídeo complexo, em geral, livre de grupos ionizados. Apresenta as vantagens de pouca afinidade por proteínas e clareza após a secagem, permitindo excelente densitometria e eletroforese de alta resolução (1,3). II. Eletroforese capilar: É o mais recente método de separação baseado no fluxo através de um tubo capilar confeccionado para diferenciar diversas moléculas de acordo com o seu tamanho e outras propriedades físico-químicas. O método é similar à HPLC (Cromatografia Líquida de Alta Performance) e utiliza uma coluna com propriedades semelhantes à agarose, o que fornece resultados comparáveis à eletroforese em gel de agarose. Permite análise automatizada que detecta e quantifica as bandas de proteínas sem a necessidade de densitometria (4). Devido à sua alta resolução, a eletroforese capilar, permite a separação dos picos de Beta1 (transferrina e hemopexina) e Beta2 (Complemento C3), o que resulta em um padrão de seis bandas. Essa característica permite ganho adicional na avaliação de pacientes com gamopatias monoclonais (2,5). Estudos clínicos em pacientes com proteínas monoclonais mostram ser a sensibilidade da eletroforese capilar (93 a 95%) superior ao gel de agarose (86 a 91%) e ao acetato de celulose (74%). Quando se compara a eletroforese capilar com gel de agarose, observa-se que a primeira é mais eficaz em detectar pequenas concentrações de componentes monoclonais, especialmente IgA ou cadeias leves, que estão escondidas na eletroforese em gel agarose devido à co-migração com a transferrina e C3 (6, 7, 8, 9,10,11). Deve-se citar que a eletroforese capilar apresenta a particularidade de não detectar o fibrinogênio (11). O aumento de sensibilidade obtido com a eletroforese capilar permite ainda uma maior taxa de detecção de bisalbuminemia (12,13). A eletroforese capilar de proteínas está estabelecida, na literatura médica, como um método que permite aumento de sensibilidade, melhor quantificação, análise em amostras menores, com operação simples e rápida (5,11,14,15,16). 2. USO CLÍNICO DA ELETROFORESE DE PROTEÍNAS SÉRICAS: A eletroforese de proteína é utilizada no diagnóstico de processos inflamatórios, gamopatias e disproteinemias há mais de 50 anos. A realização da eletroforese de proteínas tem utilidade nas seguintes situações clínicas (11,14): 1 imunologia Suspeita de mieloma múltiplo, amiloidose ou outras gamopatias; dorsalgia em maiores de 50 anos; presença de osteoporose, presença de lesões osteolíticas ou hipercalcemia; presença de proteína de Bence Jones; elevação da creatinina; quadros de infecções recorrentes; neuropatia periférica inexplicável; insuficiência cardíaca refratária; síndrome nefrótica; quadros de má-absorção em maiores de 50 anos; quadros de anemia e hepatoesplenomegalia; avaliação de doença hepática crônica; pacientes com VHS elevado. 2.1. Principais proteínas encontradas nas bandas eletroforéticas A interpretação clínica da eletroforese é baseada nas variações das frações e na detecção de paraproteínas. Em um soro normal, utilizando técnica sensível como a eletroforese capilar, identifica-se seis bandas: albumina, alfa1, alfa2, beta1, beta2 e gama (vide figura 1). Figura 1 Alb. α1 α2 β1 β2 γ Descreve-se a seguir as principais proteínas constituintes das bandas eletroforéticas e a interpretação de suas alterações. A figura 2 mostra a posição das principais proteínas em uma eletroforese normal em gel de agarose, sendo o mesmo padrão válido para a eletroforese capilar (17). I. Albumina: Normalmente é a proteína mais abundante no plasma, sendo sua função principal a manutenção da pressão coloidosmótica. É sintetizada pelas células do parênquima hepático e apresenta meia vida de 15 a 19 dias. Níveis elevados podem ocorrer na desidratação aguda sem significado clínico. Diminuição dos níveis é encontrada em algumas condições: analbuminemia; inflamação aguda ou crônica; doença hepática; glomerulopatias; lesão tubular; enteropatia perdedora de proteínas; doença inflamatória intestinal; desnutrição protéica; linfomas; leucemia; hipertireoidismo; uso de corticóide. Na gravidez, níveis diminuem até oitava semana e retornam ao normal oito semanas após o parto. Em quadros agudos, infecciosos severos e traumas, a diminuição da albumina se inicia com 12 a 36h, apresentando queda máxima em 5 dias (18). A bisalbuminemia é uma anormalidade caracterizada pela presença de dupla banda de albumina à eletroforese, podendo ser congênita ou adquirida. Bisalbuminemia familiar é uma anormalidade rara, sem conseqüências patológicas ou necessidade de tratamento. Ao contrário, a 2 imunologia detecção de bisalbuminemia adquirida pode significar uso de antibióticos ou a presença de ascite e pseudocisto pancreático (12,13). Aumento de intensidade da interzona albumina/alfa1-globulina ocorre em casos de alcoolismo crônico e gravidez. A diminuição dessa pode ocorrer em quadros de cirrose, hepatites e inflamações (19). Figura 2 A Ib α α 1 β β 2 1 Gc γ 2 PI AT3 α Lp C1q CRP Hpt α1 Ac α1At α 2M α1Ag C1Lnh β Lp C1s Fibr C4 IaT I Pre A C3 Tf IgM C5 Hpx IgA IgD (E) Cer Alb IgG C1r FB Nota: Pre A = pré-Albumina Alb = albumina α1 Ac = alfa1-Antiquimiotripsina α1 Ag = alfa1-glicoproteína ácida α1 At = alfa1-antitripsina α2M = alfa2-macroglobulina αLp = alfa-lipoproteína Pl = plasminogênio Hpx = hemopexina Hpt = haptoglobina AT3 = antitrombina III β Lp = beta-lipoproteína C1q; C1r, C1s, C3, C4, C5, C1inh = complemento Cer = ceruloplasmina CRP = proteína C reativa Fibr = fibrinogênio IgA, IgD, IgE, IgG, IgM = imunoglobulinas Tf = transferrina FB = fator B II. Alfa1-globulinas: Esta banda é principalmente composta por alfa1-antitripsina. O restante (10%) se deve à alfa1-glicoproteína ácida, alfa-fetoproteína e certas proteínas carreadoras. Incrementos desta zona são encontrados nas seguintes situações: reação de fase aguda, cirrose, disproteinemia familiar idiopática, Doença de Hodgkin, carcinomatose metastática, úlcera péptica, gravidez, enteropatia perdedora de proteína, estresse, colite ulcerativa, uso de estrógenos, corticóides e 3 imunologia antiinflamatórios. Diminuição dessa banda ocorre na Hepatite viral aguda, má-absorção, enfisema pulmonar, síndrome nefrótica e no jejum prolongado (18,19,20). A alfa1-antitripsina, sintetizada no fígado, é o mais importante inibidor da elastase leucocitária no processo de fagocitose dos polimorfonucleados. A eletroforese geralmente detecta apenas os indivíduos homozigóticos com deficiência de alfa1-antitripsina, sendo usualmente normal em heterozigóticos. Sua deficiência está associada a quadro de enfisema pulmonar precoce. A Alfa1-glicoproteína ácida, também conhecida como orosomucóide, contém alta percentagem de carboidratos, sendo produzida pelas células do parênquima hepático. Aumenta na reação inflamatória de fase aguda, especialmente nas inflamações gastrointestinais e neoplasias malignas (18). III. Alfa2-globulinas: Inclui a Haptoglobina, Alfa2-macroglobulina e Ceruloplasmina. Esta área eletroforética raramente está deprimida (hepatite viral aguda, hipohaptoglobulinemia congênita, doença hepática, hemólise intravascular) uma vez que a diminuição de um componente geralmente é mascarada pelos demais. Encontra-se aumentada nas seguintes condições: febre reumática, senilidade, analbuminemia, hipoalbuminemia, glomerulonefrite, cirrose, diabetes, disproteinemia familiar idiopática, Doença de Hodgkin, infecção aguda, meningite, carcinomatose metastática, infarto agudo do miocárdio, mixedema, síndrome nefrótica, osteomielite, úlcera péptica, pneumonia, poliarterite nodosa, enteropatia perdedora de proteína, artrite reumatóide, sarcoidose, estresse, colite ulcerativa e uso de corticóides (18,20). A Haptoglobina é uma glicoproteína de síntese hepática que se liga, irreversivelmente à hemoglobina após sua hemólise, formando um complexo grande o suficiente para reduzir a perda de hemoglobina e a lesão renal. É um reator fraco e tardio da reação de fase aguda. Valores baixos de haptoglobina são os indicadores mais sensíveis de hemólise. A Alfa2-macroglobulina é o principal inibidor das proteinases plasmáticas. A Ceruloplasmina contém 95% do cobre sérico, podendo estar aumentada nas reações de fase aguda. Níveis diminuídos ocorrem na doença de Wilson, desnutrição, síndrome nefrótica e enteropatia perdedora de proteínas (20). IV. Beta-globulinas: Conforme exposto anteriormente, esta zona é melhor avaliada de forma separada: Beta1 (transferrina, hemopexina) e Beta2 (Complemento C3). A Transferrina é a principal proteína de transporte do ferro. Nos casos de anemia ferropriva seus níveis estão elevados, embora esteja menos saturada. Níveis baixos são encontrados na reação de fase aguda, neoplasias, desnutrição protéico-calórica e na perda de proteínas (síndrome nefrótica, enteropatias perdedoras) (18). O Complemento C3 é um reator de fase aguda fraco e tardio. Também se eleva na obstrução biliar. Podem ocorrer deficiências genéticas, embora as deficiências adquiridas, secundárias ao seu consumo sejam mais comuns: doenças infecciosas e inflamatórias agudas e crônicas (18,19). Diminuição da interzona Alfa2/Beta1 pode ocorrer no diabete melito, processos inflamatórios e pancreatite. V. Gamaglobulinas: Esta zona é predominantemente composta de imunoglobulinas do tipo IgG. As imunoglobulinas IgA, IgM, IgD e IgE se sobrepõem à junção Beta-Gama. Diminuição dessa banda ocorre na Hipogamaglobulinemia e Agamaglobulinemia, que podem ser primárias ou secundárias (uso de corticóides, síndrome nefrótica, infecções, leucemia linfocítica crônica, linfomas, mieloma múltiplo de cadeia leve). O aumento dos níveis de imunoglobulinas pode ocorrer de forma policlonal; monoclonal ou oligoclonal (vide figura 3). Picos policlonais decorrem da produção heterogênea de anticorpos que produzem elevação difusa das gamaglobulinas na resposta a quadros infecciosos e inflamatórios crônicos, doenças hepáticas e neoplasias. 4 imunologia Bandas oligoclonais (dois ou mais picos monoclonais) estão presentes ocasionalmente na hepatite aguda fulminante, infecções virais crônicas, infecções bacterianas e imunodeficiências. Os picos monoclonais são resultado de uma única classe ou subclasse de imunoglobulinas produzidas por uma única linhagem de plasmócitos ou linfócitos B. O significado e estudo das proteínas monoclonais será discutido adiante (18,20). Figura 3 Alb. α1 α2 β1 β2 γ Alb. α1 Pico Monoclonal de Gamaglobulinas α2 β1 β2 γ Pico Policlonal de Gamaglobulinas 2.2. Padrões de alterações típicas de eletroforese de proteínas O quadro 1 mostra alterações na eletroforese de proteínas em situações clínicas comuns (20). Quadro 1 ↓ Albumina + ↓ Gamaglobulinas + ↑ Alfa2 sugere perda seletiva de proteínas. ↑ Alfa1+ ↑ Alfa2: sugere uma reação de fase aguda. ↑ Alfa1 único: hepatite crônica; reação de fase aguda com hemólise; grávidas; uso de estrógeno. ↑ Alfa2 predominante: encontrado em doenças auto-imunes. Fusão das bandas beta e gama sugerem um aumento na IgA (ex.: cirrose, infecções respiratórias e de pele). Bandas intensamente coradas das regiões alfa à gama, em áreas que normalmente não contêm proteínas, sugerem imunoglobulinas monoclonais. Bandas múltiplas, ausência de bandas ou mobilidade diferente podem ocorrer por variantes genéticas. Aumento de mobilidade da albumina ocorre quando se liga à penicilinas, salicilatos ou quantidades aumentadas de bilirrubinas e ácidos graxos. Diminuição da mobilidade da alfa1 -antitripsina ocorre quando se liga a grupo tiol, enzimas ou proteínas de Bence Jones. Uma determinada proteína pode ter sua concentração elevada a um ponto que pode ser observada. Uma linha fina pode aparecer interzona na albumina/alfa1 quando há aumento de 100 vezes da alfafetoproteína. Da mesma forma, elevação da proteína C reativa pode levar a banda na região gama. O quadro 2 mostra alterações à eletroforese de proteínas em pacientes com quadros clínicos diversos em gel de agarose. 5 imunologia Quadro 2 Concentração 6800 – 8300 3500 – 5000 100 – 200 50 – 150 30 – 215 125 – 140 200 – 350 70 – 150 10 – 40 40 – 390 25 – 210 525 – 1650 <2 Gamopatia monoclonal igg (benigna) Padrão Proteínas Concentração TP 6900 Ç Alb 4380 Å AAT 200 AAG 50 Hp 75 AMG 220 TRF 270 C3 122 C4 24 IgA 70 Å IgM 170 Å IgG 1330 Ç PCR <1 Criança (normal) Proteínas Concentração TP 6900 Alb 4390 AAT 240 AAG 59 Hp 65 AMG 490 TRF 300 C3 127 C4 27 IgA 180 IgM 140 IgG 870 PCR <1 Gamopatia monoclonal iga (mieloma) Padrão Proteínas Concentração TP 9100 ↑ Alb 2170 ↓ AAT 250 AAG 63 Hp 97 AMG 170 TRF 150 C3 90 C4 20 IgA 5800 ↑ IgM 24 ↓ IgG 200 ↓ PCR <1 Adulto (normal) Padrão Proteínas TP Alb AAT AAG Hp AMG TRF C3 C4 IgA IgM IgG PCR Padrão Padrão Doença renal crônica Proteínas Concentração TP 2300 ↓ Alb 1110 ↓ AAT 260 Å AAG 72 Å Hp 101 AMG 180 TRF 81 C3 71 Å C4 14 Å IgA 67 Å IgM 47 Å IgG 200 ↓ PCR <1 Padrão Síndrome nefrótica Proteínas Concentração TP 2900 ↓ Alb 680 ↓ AAT 150 Å AAG 35 Å Hp 370 AMG 460 ↑ TRF 101 ↓ C3 125 Å C4 22 Å IgA 250 Å IgM 93 Å IgG 440 ↓ PCR <1 NOTA: Å Indica tendência à queda, mas dentro dos valores de referência. Ç Indica tendência à elevação, mas dentro dos valores de referência. ↓ Indica diminuição em relação aos valores de referência. ↑ Indica aumento em relação aos valores de referência. 6 imunologia Quadro 2 (continuação) Padrão Inflamação aguda Proteínas Concentração TP 5700 Å Alb 2470 ↓ AAT 400 ↑ AAG 170 ↑ Hp 340 ↑ AMG 210 TRF 71 C3 120 Ç C4 17 Ç IgA 270 IgM 137 IgG 1440 PCR 9.8 ↑ Padrão Lúpus Eritematoso Sistêmico Padrão Proteínas Concentração TP 7800 Alb 3390 Å AAT 230 AAG 43 Hp 111 Å AMG 240 TRF 310 C3 94 Å C4 12 Å IgA 650 ↑ IgM 170 IgG 2480 ↑ PCR 7,8 ↑ Padrão Padrão Artrite Reumatóide Proteínas Concentração TP 6300 Alb 2840 Å AAT 400 ↑ AAG 150 ↑ Hp 290 ↑ AMG 148 TRF 220 Å C3 90 Ç C4 13 Ç IgA 260 Ç IgM 880 ↑ IgG 930 Ç PCR 6,1 ↑ Deficiência de ferro Proteínas Concentração TP 6800 Alb 4770 AAT 280 AAG 44 Hp 101 AMG 220 TRF 530 ↑ C3 136 C4 22 IgA 150 IgM 82 IgG 880 PCR <1 Doença Hepática Crônica Proteínas Concentração TP 6300Å Alb 2240 ↓ AAT 97 Å AAG 19 Å Hp <1Å AMG 290 TRF 129 ↓ C3 53 Å C4 4Å IgA 480 ↑ IgM 620 Ç IgG 2370 ↑ PCR <1 Hemólise crônica + deficiência ferro Padrão Proteínas Concentração TP 6300 Alb 4010 AAT 190 AAG 43 Hp <1↓ AMG 400 TRF 390 C3 134 C4 14 IgA 180 IgM 170 IgG 700 PCR <1 NOTA: Å Indica tendência à queda, mas dentro dos valores de referência. Ç Indica tendência à elevação, mas dentro dos valores de referência. ↓ Indica diminuição em relação aos valores de referência. ↑ Indica aumento em relação aos valores de referência. 7 imunologia 3. ESTUDO DAS PROTEÍNAS MONOCLONAIS E IMUNOFIXAÇÃO. As moléculas de imunoglobulinas normais consistem de duas cadeias pesadas idênticas (α,δ,ε,γ,µ), que definem as classes de imunoglobulinas, e duas cadeias idênticas de cadeias leves: Kappa (κ) ou Lambda (λ). Normalmente, a produção da cadeia leve tipo Kappa é duas vezes maior que a do tipo Lambda (20,21,22). As imunoglobulinas monoclonais, também chamadas de paraproteínas ou Proteínas M, derivam de uma única linhagem de células plasmáticas que podem produzir altas concentrações de um único anticorpo monoclonal que aparece como uma linha estreita na eletroforese. Essas imunoglobulinas monoclonais podem ser fragmentos, polímeros ou monômeros. Quando fragmentos, usualmente são cadeias leves (Proteína de Bence Jones), mas raramente cadeias pesadas (11,23). Quando paraproteínas são detectadas na eletroforese de soro, urina ou líquor, devem ser classificadas pela imunofixação. A imunofixação, que substituiu a técnica de imunoeletroforese por ser mais sensível e rápida, combina as técnicas de eletroforese e imunoprecipitação. Após a separação das proteínas séricas por eletroforese, anti-soro (contra IgA, IgG, IgM, cadeia leve Kappa e Lambda) é colocado sobre as frações separadas. As proteínas não precipitadas são lavadas e o imunoprecipitado é a seguir corado. Este método tem grande aplicação na identificação de proteínas M presentes em pequenas quantidades, que são difíceis de detectar por outros métodos. O anti-soro deve ser utilizado em diluição ótima para garantir a equivalência antígeno/anticorpo (15,23). Condições clínicas associadas com a presença de proteína M no soro ou urina podem ser agrupadas como plasmáticas, linfocíticas, infiltrativas ou miscelânea. A incidência da maioria dessas desordens está listada na tabela 1. As características do mieloma múltiplo estão descritas no quadro 3. O quadro 4 mostra aspectos de outras causas de gamopatias monoclonais (11,15,16). Tabela 1 – Incidência anual de gamopatias monoclonais comuns nos EUA (15) Condição Número de casos Mieloma múltiplo 13.000 Macroglobulinemia Waldenström 3.000 Doenças infiltrativas Amiloidose 2.500 Doença do depósito de imunoglobulinas rara Gamopatia monoclonal de significado indeterminado >1.000.000 Plasmocitoma solitário Raro A detecção de cadeias leves monoclonais é importante, devendo ser determinada em todas as gamopatias monoclonais e especialmente nas doenças das cadeias leves, como mieloma de cadeias leves, amiloidose primária sistêmica e doença do depósito de cadeias leves. A quantificação de cadeias leves livres (CLL) por nefelometria é mais sensível que a imunofixação para detectar pequenas quantidades de cadeias leves livres monoclonais, sendo fundamental no diagnóstico e monitorização desses casos (10). Normalmente, níveis urinários de CLL urinários são baixos. Em rins saudáveis, células tubulares reabsorvem seletivamente. Assim sua presença na urina é provavelmente devido a secreção no trato urinário. Níveis elevados de CLL policlonais podem estar associados a doenças auto-imunes, como o Lúpus Eritematoso Sistêmico (26). 8 imunologia Quadro 3 (11,15,16) Mieloma múltiplo Neoplasia maligna de uma linhagem de plasmócitos que produz paraproteínas. Incide principalmente em maiores de 40 anos (pico aos 60 anos). Fraturas patológicas (lesões osteolíticas) e infecções por capsulados. Redução da hematopoiese (trombocitopenia, anemia, leucopenia). VHS aumentado. Diminuição da síntese de outras imunoglobulinas. Fosfatase alcalina elevada. Hipercalcemia em 30%; azotemia em 40 a 55%; proteinúria em 60 a 90%; hipoalbuminemia em 50%; hipergamaglobulinemia em 60% e hipogamaglobulinemia em 10% (mieloma de cadeia leve). Diagnóstico requer aspirado de medula óssea, que usualmente apresenta mais de 20% de plasmócitos. Uma vez que a infiltração medular é irregular, múltiplos aspirados podem ser necessários. Quando o esfregaço não é conclusivo, a biópsia de medula óssea é utilizada. Cerca de 75 a 80% dos pacientes com mieloma têm secreção de proteína monoclonal com peso e forma típica, que é evidenciado como um pico monoclonal na região gama-globulina, ocasionalmente na beta-globulina e raramente na alfa2. Tipos de proteínas monoclonais encontrados no mieloma múltiplo: 70% são IgG, 25% IgA e menos de 2% IgD ou IgE. Acrescenta-se que alguns pacientes com mieloma excretam uma forma anormal, incompleta de proteína de baixo peso conhecida como proteína de Bence Jones. Essa é composta apenas de cadeias leves de imunoglobulinas sendo filtradas no glomérulo. Na maioria dos casos é rapidamente depurada no plasma, podendo não ser detectada pela eletroforese. Cerca de 70% a 80% dos pacientes com mieloma apresentam proteína de Bence Jones na eletroforese de urina. Cerca de 1 a 5% dos pacientes com mieloma não mostram proteínas monoclonais em soro e urina ou cadeias livres (mieloma não secretor). Mieloma IgD tem algumas características não usuais, correspondendo a menos de 1% dos mielomas. A cadeia leve da IgD anormal é do tipo lambda em 90% dos casos, ao contrário dos demais tipos de mieloma onde o tipo Kappa predomina (70%). A ocorrência de proteinúria de Bence Jones é mais comum no mieloma IgD. 9 imunologia Quadro 4 (4,15,16) Plasmocitoma solitário Cerca de 5% dos pacientes com discrasias de plasmócitos têm tumor localizado. Aqueles em tecido ósseo são chamados de mieloma solitário (principalmente coluna) e aqueles em tecido mole são chamados de plasmocitomas extra-medulares (principalmente trato respiratório superior). Cerca de 20% dos pacientes têm proteína M na eletroforese. Amiloidose Pode ser primária, secundária, familiar, localizada ou senil. O amilóide da amiloidose primária é derivado da região variável das cadeias leves (mais comum lambda). Mieloma está associado em 20 a 30% desses pacientes. Eletroforese detecta pico monoclonal em 50%. Imunofixação é anormal em 90%. Diagnóstico é confirmado com biópsia do tecido afetado. Tumores linfóides Cerca de 1/5 destes pacientes (linfomas, leucemia linfocítica crônica) produzem paraproteínas, usualmente do tipo IgM. Macroglobulinemia de Waldenström Causado por linfócitos B maduros que produzem paraproteínas IgM. Leva à hiperviscosidade, aumento de linfonodos e organomegalias, tendo comportamento mais benigno e sintomas tratáveis por hemotransfusão devido à lenta infiltração da medula. Proteinúria de Bence Jones ocorre em 80% dos casos. Doenças das cadeias pesadas Raras e associadas à infiltração linfóide. Pode acometer o intestino levando à máabsorção. Crioglobulinemia Crioglobulina é uma proteína que se precipita a temperaturas abaixo da corporal. Pode ser primária ou secundária e levar à trombose periférica. A maioria das crioglobulinas gera picos policlonais, mas algumas são monoclonais, usualmente IgM. Gamopatia monoclonal de significado incerto Gamopatia monoclonal de significado indeterminado (GMSI) é caracterizada pela presença de IgG ou IgA monoclonal sem evidência de mieloma múltiplo. Acomete 3% dos pacientes com mais 70 anos. Risco de transformação maligna (mieloma, linfoma, amiloidose) é de 17% em 10 anos e 33% em 20 anos. Pacientes com GMSI apresentam, tipicamente, proteína M IgG < 20 g/l ou uma proteína M IgA < 10 g/l, associado com imunoglobulinas não suprimidas. Gamopatia monoclonal secundária a outras desordens Secundária a neoplasias (carcinoma colo-retal, próstata, mama, pulmão). Secundária a desordens não neoplásicas (doenças do colágeno, cirrose, infecções crônicas, Hepatite C, Doença de Gaucher, Doença de Paget, Sarcoidose e SIDA). O tipo de proteína M excretado pode ser IgG, IgA ou IgM. Cerca de 10% excretam proteína de Bence Jones na urina. No quadro 5 encontramos uma adaptação de orientações publicadas por Keren DF e colaboradores, em artigo de revisão, para a propedêutica das paraproteínas (15). 10 imunologia Quadro 5 Orientação 1: eletroforese de soro e urina de alta resolução é indicado para todos os pacientes com suspeita de terem discrasias de plasmócitos. Isso se aplica a quadros sugestivos de mieloma múltiplo, Macroglobulinemia de Waldenström, amiloidose, plasmocitoma solitário, Síndrome POEMS (neuropatia periférica, organomegalias, deficiência endócrina, gamopatia monoclonal, pigmentação da pele, lesões ósseas esclerosantes) e doença das cadeias pesadas. O nível de proteína M deve ser definido precisamente pela medida densitométrica do seu pico. Orientação 2: imunofixação está indicada para definir o tipo de proteína M. Mesmo em eletroforeses negativas, imunofixação com anti-soro contra cadeia leve kappa e lambda pode ser útil para identificar pequenas proteínas M em casos onde há suspeita de discrasias plasmáticas. Imunofixação não está indicado nos casos óbvios de gamopatia policlonal à eletroforese. Quando há assimetria na elevação policlonal da gamaglobulina, a imunofixação pode ser útil. O uso de imunoeletroforese é desaconselhado. Orientação 3: proteína M deve ser acompanhada usando-se quantificação densitométrica, a não ser que níveis baixos de proteína M sejam obscurecidos por outras proteínas. Nesses casos, a quantificação por nefelometria pode ser mais precisa. Orientação 4: para todos os pacientes com discrasias dos plasmócitos, medida direta das imunoglobulinas por nefelometria está indicada para definir o nível das imunoglobulinas não envolvidas. O uso de imunodifusão radial é desencorajado. Orientação 5: todos os pacientes com mieloma múltiplo, macroglobulinemia de Waldenström, amiloidose e desordens correlatas devem ser investigados para a presença de cadeias leves livres monoclonais. Isto é melhor realizado pela quantificação na urina de 24h, com medidas densitométricas do pico de cadeia leve em um espécime concentrado e imunofixação. Orientação 6: níveis de proteína monoclonal no soro ou urina devem ser monitorados periodicamente, cada um a dois meses, naqueles em tratamento de mieloma, macroglobulinemia de Waldenström ou amiloidose, e a cada ano em pacientes com gamopatia monoclonal de significado indeterminado. Orientação 7: síndrome de hiperviscosidade requer troca de plasma emergencial, com indicações baseadas em aspectos clínicos. A viscosidade sérica e a eletroforese de proteínas são recomendadas antes da primeira plasmaferese para correlacionar níveis de proteína M com os sintomas. Orientação 8: crioglobulinas devem ser avaliadas em todos os pacientes com proteínas M e sensibilidade ao frio. Orientação 9: técnicas atuais para avaliação das proteínas M consistem de eletroforeses de alta resolução (gel de agarose e eletroforese capilar). 11 imunologia 4. ELETROFORESE DE PROTEÍNAS NA URINA Normalmente a urina não apresenta proteínas, ou apenas contém débil banda de albumina e globulina, uma vez que o glomérulo previne a passagem de proteínas (14,19). As funções glomerular e tubular normais resultam em excreção de proteína inferior a 150 mg/dia. Dois terços da proteína filtrada é composta de albumina, transferrina, proteínas de baixo peso molecular e algumas imunoglobulinas. O restante, como a glicoproteína Tamm-Horsfall é derivado do próprio trato urinário. Lesão renal resulta em proteinúria. Eletroforese de proteínas na urina separa as proteínas de acordo com sua carga e permite a classificação do tipo de injúria. Um padrão normal de proteinúria consiste de albumina e ocasionalmente traços de bandas alfa1 e beta. A eletroforese de urina concentrada pode não detectar cadeias leves por falta de sensibilidade, sendo a imunofixação o próximo passo (19,24). Padrões de alterações da eletroforese de proteínas na urina Proteinúria glomerular (lesão mínima, glomerulonefrite, nefropatia diabética): aumento da albumina e bandas alfa1 e beta1. Proteinúria tubular (lesão medicamentosa, pielonefrite, doença renal vascular, rejeição à transplante): aumento de albumina, bandas alfa1, alfa2 e beta-globinas. Distúrbio misto glomerular e tubular. Presença de banda monoclonal. 5. ELETROFORESE DE PROTEÍNAS NO LÍQUOR Eletroforese de proteínas, em gel de agarose, do líquor é largamente utilizada na procura de bandas oligoclonais, definidas como duas ou mais bandas discretas na região gama que estão ausentes ou em menor intensidade em eletroforese de soro concomitante. A imunofixação, em geral, é preferida por fornecer melhor resolução e ter habilidade para identificar bandas de imunoglobulinas específicas. Bandas oligoclonais no líquor têm sido identificadas em 83% a 94% dos pacientes com Esclerose Múltipla estabelecida, 40 a 60% dos casos prováveis e 20 a 30% dos casos possíveis. Também são observadas em quase todos os casos de panencefalite subaguda esclerosante, em 25 a 50% das infecções virais do sistema nervoso central, nos casos de neuroborreliose, meningite criptocócica, neurosífilis, mielite transversa, carcinomatose meníngea, glioblastoma multiforme, linfoma de Burkitt, polineuropatia recorrente crônica, Doença de Behçet, cisticercose e tripanossomíase (3,25). Aumento da síntese intratecal de IgG é refletida no aumento da razão líquor/soro de IgG. Aumento da razão também pode ser determinado por aumento da passagem de IgG plasmático por quebra da barreira hemato-encefálica. A imunoglobulina derivada dessa passagem é corrigida dividindo a razão líquor/soro de IgG pelo índice líquor/soro de albumina, o que fornece o índice de IgG. O índice de IgG, cujo limite superior da normalidade é 0,8, apresenta uma sensibilidade de 90% no diagnóstico de esclerose múltipla (19,25). Em suma, índice de IgG elevado e a presença de bandas oligoclonais são achados complementares úteis no diagnóstico de esclerose múltipla, mas o valor preditivo positivo desses testes é dependente do grau de suspeita clínica (25). 12 imunologia O Instituto de Patologia Clínica Hermes Pardini disponibiliza: Líquor Eletroforese em gel de agarose com concentração Imunofixação IgG (nefelometria) Índice de IgG Urina Eletroforese em gel de agarose com concentração (Urina 24h) Imunofixação (Urina 24h) Proteínas de Bence Jones (cadeias leves): Precipitação/turvação Soro Eletroforese Capilar Cadeias leves Kappa e Lambda (Nefelometria) Imunofixação IgD (imunodifusão radial) IgA (imunoturbidimetria) IgG (imunoturbidimetria) IgM (imunoturbidimetria) Crioglobulinas (precipitação) Subclasses de IgG: IgG1, IgG2, IgG3, IgG4 (nefelometria) 6. BIBLIOGRAFIA 1. Karcher RE, Kern LN. Electrophoresis. In: Burtis CA, Ashwood ER. Tietz. Fundamentals of Clinical Chemistry. 5th. 2001.121-131. 2. Ferreira AW, Ávila SLM. Sorologia: importância e parâmetros. In: Ferreira AW, Ávila SLM. Diagnóstico Laboratorial das principais doenças infecciosas e auto-imunes. 2 ed. 2001. 169-76.11-14. 3. Le Carrer D. Serum protein and electrophoresis and immunofixation. Illustrated interpretations. Laboratorie Sebia. 4. McPherson RA. Specifics Proteins. In: Henry JB. Clinical Diagnosis and management by laboratory methods. 22th. 2001.249-63. 5. 6. 7. 8. 9. Katzmann JA, Clark R, Sanders E, et al. Prospective study of serum protein capillary electrophoresis and immunotyping of monoclonal proteins by immunosubtraction. Am J Clin Pathol. 1998; 110: 503-9. Bossuyt X, Mariën G. False-negative results in detection of monoclonal proteins by capillary zone electrophoresis. A prospective study. Clin Chem. 2001; 47: 1477-79. Bossuyt X, Bogaerts A, Schiettakatte, et al. Detection and classification of paraproteins by capillary immunofixation/subtraction. Clin Chem. 1998; 44: 760-64. 10. Katzmann JA, Clark RJ, Abraham RS, et al. Serum reference intervals and diagnostic ranges for free Kappa and free Lambda immunoglobulin light chains: relative sensitivity of detection of monoclonal light chains. Clin Chem. 2002; 48: 1437-44. Claeys R, Groven C, Gorus FK. Capillary zone electrophoresis of proteins in body fluids: comparison od capillary and agarose gel electrophoresis. Clin Chem. 2001; 5: 96770. 11. Keren DF. Capillary Zone electrophoresis in the evaluation of serum protein abnormalities. Am J Clin Pathol. 1998; 110: 248-52. Bossuyt X, Schiettekatte G, Bogaerts A, Blanckaert N. Serum protein electrophoresis by CZE 2000 clinical capillary electrophoresis system. Clin Chem. 1998; 44: 749-759. 12. Jaeggi-Groisman S, Byland C, Gerber H. Improved sensitivity of capillary electrophoresis for detection of bisalbuminemia. Clin Chem. 2000; 46: 882-3. 13 imunologia chain measurements. Clin Chem. 2002; 48: 1600-1. 13. Kobayashi S, Okamura N, Kamoi K, et al. Bisalbuminemia (fast and slow type) induced by human pancreatic juice. Ann Clin Biochem. 1995; 32: 63-67. Assessoria Científica 2003 14. Jacobs DS, DeMott WR, Oxley DK. Protein Electrophoresis. In: Jacobs DS, DeMott WR, th Oxley DK. Laboratory test handbook. 5 . 2001; 266-268. 15. Keren DF, Alexanian R, Goeken JA, et al. Guidelines for clinical and laboratory evaluation of patients with monoclonal gammopathies. Arch Pathol Lab Med. 1999;123:106-7. 16. Keren DF. Detection and characterization of monoclonal components in serum and urine. Clin Chem. 1998; 44: 1143-45. 17. Ritchie RF. Proteínas específicas. In: Henry JB. Diagnósticos Clíncios. Conduta Terapêutica por exames laboratoriais. 16ed.1982; 255-259. 18. Johnson AM, Rohlfs EM, Silverman LM, Proteins. In: Burtis CA, Ashwood ER. Tietz. Fundamentals of Clinical Chemistry. 5th. 2001;325-47. 19. Chernecky CC, Berger BJ. Protein Electrophoresis. In: Chernecky CC, Berger B. Laboratory Tests and Diagnostics procedures. 3th. 2001; 853-9. 20. Ravel. Serum Protein Assay methods. In: Ravel. Clinical Laboratory Medicine. 6 th. 1995; 342-57. 21. Jonsson M, Carlson J. Computer-supported interpretation of protein profiles after capillary electrophoresis. Clin Chem. 2002; 48: 108493. 22. Landers PL. Clinical Capillary electrophoresis. Clin Chem. 1995; 41: 495-509. 23. Paraskevas F, Foerster J. Immunodiagnosis. In Lee GR. Wintrobe’s Clinical Hematology. th 10 . 1999; 40-44. 24. Umbreit A, Wiedemann G. Determination of urinary protein fractions a comparison with different eletrophoretic methods and quantitatively determied protein concentrations. Clinica Chimica Acta. 2000; 297: 163-72. 25. Smith GP, Kjeldberg CR. Cerebrospinal, synovial, and serous body fluids. In: Henry JB. Clinical Diagnosis and management by laboratory methods. 22th. 2001. 407-9. 26. Mariën G, Oris E, Bradwell AR, et al. Detection of monoclonal protein in sera by capillary zone electrophoresis and free light 14
Baixar