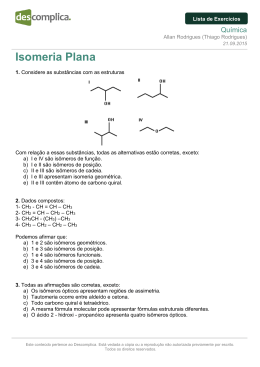
Atividades Química – 3ºAno – 2015 Profª Rejane C. Barcellos 1. Para as moléculas abaixo, informe qual o tipo de interação (força) intermolecular e a polaridade que ocorre em cada uma delas: A Substância B CH3-NH2 C CH3-O-CH3 D CH3-CH2-OH CH3-CH3 Interação (força) Intermolecular Polaridade De acordo com as informações da tabela colocar estes compostos em ordem crescente de P.E. Justifique sua resposta. 2. Analisar as informações da tabela e relacionar corretamente a substância com seu P.E. Justificar suas respostas. Cadeia Carbônica PE (ºC) A CH3 – CH2 – CH2 – CH2– CH2 – OH ( ) 64,5 B CH3 –CH2 – OH ( ) 78,3 C CH3 – OH ( ) 118,0 D CH3 – CH2 – CH2– CH2 – OH ( ) 138,0 3. Para as moléculas abaixo, informe e “desenhe” qual a geometria que ocorre entre as moléculas e qual a polaridade de cada uma delas: A Substância B CH2Cl2 C PH3 D HClO Geometria Polaridade Com base nas informações da tabela acima, responder: E CO2 BH3 a) Se a substância B for misturada em igual quantidade com a substância C, que tipo de mistura irá formar? Justifique sua resposta b) Se a substância E for misturada em igual quantidade de água, que tipo de mistura irá formar? Justifique sua resposta. 4. Equacionar as reações de neutralização total a seguir: a) H2PbO3(aq) + Cr(OH)3(aq) _____________________________________________ NH4OH(aq) _____________________________________________ b) H3AsO4(aq) + Pt(OH)4(aq) ________________________________________________ c) HCN(aq) + 5. Equacionar as reações de neutralização parcial a seguir: a) H2PbO3(aq) + Cr(OH)3(aq) ______________________________________________ NH4OH(aq) ______________________________________________ b) H3AsO4(aq) + Pt(OH)4(aq) _________________________________________________ c) HCN(aq) + 6. Verificar se as reações abaixo ocorrem ou não, consultando a tabela de reatividade dos elementos e efetuar o balanceamento das equações: a) HgSO4 + Ni b) Al + c) NaCl + H2SO4 NiSO4 + Hg ______________________________________ Al2(SO4)3 + H2 ______________________________________ Zn ZnCl2 + Na ________________________________________ d) AgBr + Mn MnBr2 + Ag _________________________________________ e) HNO3 + Mg Mg(NO3)2 + f) Pt + HCl PtCl4 + g) HCl + Zn h) Cr Al2(SO4)3 + H2 ______________________________________ H2 ____________________________________________ ZnCl2 + H2 _____________________________________________ Cr2(SO4)3 + Al ___________________________________ 7. Classificar as reações abaixo em: composição, decomposição, simples troca ou dupla troca efetuar o balanceamento das equações: a) Mg(OH)2 + b) I2 + AlBr3 c) CO2 + K2SO4 AlI3 + H2O MgSO4 + KOH ____________________________ Br2 ________________________________________ H2CO3 _____________________________________________ d) KOH H2O + K2O _________________________________________________ e) Na2O + HBr NaBr + H2O _________________________________________ f) Na2PbO3 + H2O PbO2 + NaOH _____________________________________ g) CaO + H2O Ca(OH)2 ______________________________________________ h) FeCl3 + Na Fe + NaCl __________________________________________ 8. (FGV/2007) Considere os compostos orgânicos: (I)butan-1-ol (II)metóxi-propano (IV)butanal (V)butanona (III)ác. Butanoico O etanoato de etila é isômero do composto: a) b) c) d) e) I II III IV V 9. (UNESP/2000) Considerando-se a posição de dois grupos – CH3 na cadeia aromática, ocorrerá a formação de: a) 10 isômeros b) 6 isômeros c) 5 isômeros d) 3 isômeros e) 2 isômeros Montar as cadeias dos isômeros formados. Montar as cadeias dos isômeros e justificar a resposta marcada. 10. Para a cadeia do hexanal, montar e nomear um isômero de função, um de cadeia e um tautômero. 11. Para a cadeia dietilamina, montar e nomear um isômero de compensação e um isômero de cadeia. 12. (PUC-MG) Analise os compostos a seguir: I. CH3-CO-CH3 II. CH3-COO-CH3 III. CH3-CH2-CHO IV. CH3-CH2-COOH V. CH3-CH2-CH2-OH VI. CH3-O-CH2-CH3 São isômeros os pares: a) b) c) d) e) I e V; II e IV II e IV; III e V I e III; II e IV III e VI; I e V II e IV; III e VI Nomear as cadeias dos isômeros e justificar a resposta marcada. 13. (Mackenzie) O número total de isômeros planos do propano-1-ol é: a) 3 b) 1 c) 2 d) 4 e) 5 Montar as cadeias dos isômeros e justificar a resposta marcada. 14. Para as estruturas a seguir verificar se formam isômeros espaciais. Para as cadeias que formarem, mostrar as estruturas CIS/TRANS ou E/Z, e para as que não formam, explicar por que não formam. (Massas atômicas(u): C=12,0 H=1,0 Cl=35,5 O=16,0 N=14,0 Br=80,0) a) 2-bromo pent-2-eno b) 1,3 – dicloro ciclo butano c) Ácido butenodióico d) 4-metil ciclo hexanol e) 5-etil 4-metil oct-2-eno f) propeno 15. (UEG-GO/2012) Considere o alceno de menor massa molecular e que apresenta isomeria geométrica (cis/trans): a) Montar a cadeia e mostrar os isômeros b) Mostrar todos os isômeros planos deste alceno 16. (UFC-CE) Uma das maneiras de se produzir cal viva, CaO (s) é através da pirólise do calcário, CaCO3(s) conforme a equação a seguir: CaCO3(s) CaO(s) + CO2(g) Uma amostra de 20 g de calcário produziu 10 g de cal viva. Calcular o rendimento desta reação. (Massas atômicas (u): Ca= 40,0; C= 12,0; O= 16,0) 17. (FMU-SP) O número de toneladas de H2SO4(aq) que poderia ser produzido em um dia, através de um processo que usa 3,2 toneladas por dia de SO 2(g), com uma eficiência de conversão de 70%, é aproximadamente: SO2(g) + O2(g) + H2O(L) H2SO4(aq) (Massas atômicas (u): S= 32,0; O= 16,0; H= 1,0) 18. (UFPI) Ao tratarmos 740g de hidróxido de cálcio, Ca(OH) 2, contendo 20% de impurezas, com excesso de solução de ácido sulfúrico, H2SO4(aq), calcular a quantidade de sulfato de cálcio, CaSO4(aq), produzido: Ca(OH)2(aq) + H2SO4(aq) CaSO4(aq) + H2O(L) (Massas atômicas (u): Ca= 40,0; O= 16,0; H= 1,0; S= 32,0) 19. Calcular o volume de amônia, NH3, obtido quando misturados 4L de gás nitrogênio, N 2, com 9L de gás hidrogênio, H2. Calcular também o volume do reagente em excesso. N2(g) + H2(g) NH3(g) (Volume molar = 22,7L; Massas atômicas (u): N=14,0; H= 1,0) 20. Equacionar as reações a seguir mostrando as etapas ocorridas e produtos obtidos: a) Benzeno com Cl2 b) Propeno com H2O c) Bromação do nitro benzeno d) Sulfonação do metil butano e) Hidratação do pent-2-ino f) Cloração parcial do but-2-ino g) Hidróxi benzeno com bromo metano h) Ciclo propano com HBr 21. Equacionar a reação correta para se obter como produto: a) Nitro benzeno b) 2,2 – dicloro propano 22. Equacionar a reação do benzeno com o cloro metano, mostrando suas etapas e produtos formados. Posteriormente, o produto orgânico obtido desta reação, sofreu uma segunda reação, uma nitração. Equacionar esta segunda reação mostrando as etapas e produtos formados. Radicais ORTO/PARA -CH3; -CH2-CH3; -NH2; -OH; -F; -Cl; -Br; -I Radicais META -NO2; -CHO; -COOH; -SO3H; 23. Equacionar as reações a seguir mostrando as etapas ocorridas, os reagentes e produtos obtidos: i) Oxidação parcial do metil propan-1-ol j) Redução do metil propanal k) Oxidação branda do pent-2-ino l) Oxidação enérgica do pent-2-eno 24. Os álcoois podem sofrer dois tipos de reação de desidratação. Equacionar, separadamente, as duas reações de desidratação do propan-2-ol, mostrando as etapas e os produtos formados nas reações. 25. Com a oxidação enérgica de um alcino foram obtidos ácidos, etanoico e metil propanoico, e água. Equacionar a reação de obtenção destes compostos, mostrando as etapas, os reagentes e os produtos formados na reação. 26. O ácido metil propanóico que foi obtido na questão anterior sofreu, posteriormente, uma reação de redução total. Equacionar esta reação, mostrando as etapas, reagentes e os produtos obtidos. 27. Equacionar a reação de redução para se obter a butanona, mostrando as etapas, reagentes e produtos obtidos. 28. Na reação PCl5(g) PCl3(g) + Cl2(g), a constante Kc vale 32,8 a 727ºC. Em um recipiente estão em equilíbrio 1,5.10-3M de PCl5 e 2,0.10-1M de Cl2. Calcular a concentração molar do PCl3 neste equilíbrio. 29. Considere a reação: 2Cl2(g) + 2H2O(g) 4HCl(g) + O2(g) ΔH= + 113kj. Admita que o sistema está em equilíbrio. O que ocorrerá com este equilíbrio quando: a) Adicionar O2_____________________________________________________________ __________________________________________________________________________ b) A pressão for aumentada __________________________________________________ __________________________________________________________________________ c) Aquecer o sistema ________________________________________________________ __________________________________________________________________________ Para este equilíbrio, o que ocorrerá com a quantidade de mol de água no recipiente quando for retirado HCl ___________________________________________________________________ __________________________________________________________________________________ As respostas da questão 2 devem ser justificadas! 30. O ácido acetilsalicílico, mais conhecido como aspirina, é um ácido orgânico fraco. Uma solução aquosa é preparada dissolvendo-se 0,1 mol deste ácido por litro. A concentração de [H+] nesta solução é de 0,004M. Calcular o Ka da aspirina. 31. Uma solução de ácido acético (HAc) 0,05M apresenta um grau de ionização igual 0,2%, à 25ºC. Para esta solução calcular: a) A constante do equilíbrio b) A concentração do íon acetato ([Ac-]) c) pH 32. A constante de dissociação do NH4OH é de 1,8. 10 – 5 M. Calcular a concentração molar e o pH de uma solução desta base, sabendo que o grau de dissociação é de 3%. 33. Em um produto de limpeza de uso doméstico, foi verificado que a concentração de íons [OH – ]igual a 1.10– 5 M. Calcular: a) A concentração de íons [H+] do produto b) pH c) Este produto é ácido, básico ou neutro? Explique. Bons Estudos!!
Baixar