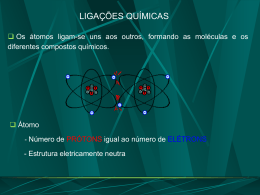
REVISÃO – FÍSICA/QUÍMICA 2° BIMESTRE DISTRIBUIÇÃO ELETRÔNICA EM CAMADAS Em torno do núcleo do átomo temos uma região denominada de eletrosfera que é dividida em 7 partes chamada camadas eletrônicas ou níveis de energia. K L M N O P Q 2 8 18 32 32 18 8 EXEMPLOS: O átomo de sódio possui 11 elétrons, assim distribuídos: K = 2; L = 8; M = 1. O átomo de bromo possui 35 elétrons, assim distribuídos: K = 2; L = 8; M = 18; N = 7 REGRAS: Verifica-se que a última camada de um átomo não pode ter mais de 8 elétrons. Quando isto ocorrer, devemos colocar na mesma camada, 8 ou 18 elétrons (aquele que for imediatamente inferior ao valor cancelado) e, o restante na camada seguinte. EXEMPLO: O átomo de cálcio tem 20 elétrons, inicialmente, assim distribuídos: K = 2; L = 8; M = 10 - errado Como na última camada temos 10 elétrons, devemos colocar 8 elétrons e 2 elétrons irão para a camada N. K = 2; L = 8; M = 8; N = 2 certo LIGAÇÕES QUÍMICAS Teoria do Octeto: os átomos apresentam 8 elétrons na camada de valência (ultima camada) assim como os gases nobres; Ao ligar-se a outro, um átomo pode ganhar, perder ou compartilhar elétrons. LIGAÇÃO IÔNICA – LIGAÇÃO ENTRE AS FAMÍLIAS 1A, 2A E 3A COM A 5A, 6A E 7A - Nesse tipo de ligação os átomos se encontram unidos por atração eletrostática. Isso significa que, ao ceder elétrons, um átomo fica eletricamente positivo (cátion) e o outro negativo (ânion). - OS ÁTOMOS COM MENOS DE 4 ELÉTRONS NA ÚLTIMA CAMADA TENDEM A PERDER ELÉTRONS; SENDO PORTANTO CÁTIONS. LIGAÇÃO COVALENTE – LIGAÇÃO ENTRE AS FAMÍLIAS 5A, 6A E 7A - Acontece entre átomos que compartilham elétrons: Ex: O2 O oxigênio tem 6 elétrons na camada de valência, portanto ambos precisam receber 2 elétrons. Como nenhum átomo pode doar seus elétrons eles passam a compartilhar. RESUMINDO... Metais Não-Metais Ligação com Não-Metais = Ligação Iônica. com Não-Metais = Ligação Covalente. Iônica = Transferência definitiva de elétrons, formação de íons. Ligação Covalente = Compartilhamento do par de elétrons em órbita comum. ÁCIDOS Apresentam as seguintes propriedades: Em solução aquosa liberam cátions hidrogênio (H+); Possuem sabor azedo; São bons condutores de corrente elétrica em solução aquosa; Nomenclatura * hidrácidos levam a terminação –ídrico Exemplos: HCl, HBr, HF * Oxiácidos levam a terminação –ico Exemplos: H2SO4, H2CO3, H3PO4 IMPORTÂNCIA DOS ÁCIDOS O ácido clorídrico faz parte de nosso suco gástrico; O ácido sulfúrico é empregado nas baterias de automóveis; Os ácidos nítricos e fosfórico são usados em fertilizantes agrícolas; O ácido ascórbico é a vitamina C NOMECLATURA DE ÁCIDOS Oficial (IUPAC) ÁCIDO – NOME DO ÂNION+ÍDRICO Ânions sem oxigênio (terminam em ETO) F- - Fluoreto S2- - Cl- - Cloreto sulfeto Se2- - seleneto Br- - Brometo Te2- - Telureto I- - Iodeto EXEMPLOS: HF ácido fluorídrico HCl – ácido clorídrico H2S – ácido sulfídrico OXIÁCIDOS: COM OXIGÊNIO Ácido “nome do ânion” – ato + ico ClO3- Clorato SO42- - Sulfato PO43- - Fosfato SIO44- - Silicato BO33- - Borato CO32- - Carbonato NO32- - Nitrato BASES Apresentam as seguintes propriedades: Em solução aquosa, dissociam-se fornecendo ânions hidróxido (OH-); Possuem sabor adstringente; São bons condutores de corrente elétrica em solução aquosa; Neutralizam os ácidos, formando sais (reação de neutralização); Nomenclatura: acrescenta-se as palavras hidróxido de e o nome do elemento químico: EXEMPLOS: NaOH – Hidróxido de Sódio KOH – Hidróxido de Potássio Mg(OH)2 – Hidróxido de Magnésio
Download