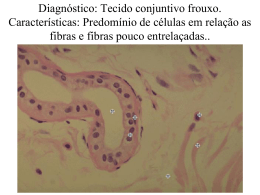
UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI RAFAEL MENEZES SILVA COMPÓSITOS DE CIMENTO IONOMÉRICO MODIFICADOS COM FIBRAS CELULÓSICAS: CARACTERIZAÇÃO, COMPORTAMENTO MECÂNICO, ATIVIDADE ANTIMICROBIANA E BIOCOMPATIBILIDADE DIAMANTINA - MG 2013 RAFAEL MENEZES SILVA COMPÓSITOS DE CIMENTO IONOMÉRICO MODIFICADOS COM FIBRAS CELULÓSICAS: CARACTERIZAÇÃO, COMPORTAMENTO MECÂNICO, ATIVIDADE ANTIMICROBIANA E BIOCOMPATIBILIDADE Dissertação apresentada à Universidade Federal dos Vales do Jequitinhonha e Mucuri, como parte das exigências do Programa de Pós-Graduação em Odontologia, para obtenção do título de Magister Scientiae. Área de concentração: Clínica Odontológica Orientadora: Profª. Drª. Maria Helena Santos – UFVJM Co-orientadora: Profª. Drª. Suelleng Maria Cunha Santos Soares - UFVJM DIAMANTINA – MG / UFVJM 2013 RAFAEL MENEZES SILVA COMPÓSITOS DE CIMENTO IONOMÉRICO MODIFICADOS COM FIBRAS CELULÓSICAS: CARACTERIZAÇÃO, COMPORTAMENTO MECÂNICO, ATIVIDADE ANTIMICROBIANA E BIOCOMPATIBILIDADE Dissertação apresentada à Universidade Federal dos Vales do Jequitinhonha e Mucuri, como parte das exigências do Programa de Pós-Graduação em Odontologia, para obtenção do título de Magister Scientiae. Área de concentração: Clínica Odontológica APROVADA em 06/02/2013 BANCA EXAMINADORA ____________________________________ Prof. Dr. Mauro Henrique Nogueira Guimarães de Abreu - UFMG ____________________________________ Prof. Dr. Juan Pedro Bretas Roa - UFVJM ____________________________________ Profª. Drª. Maria Helena Santos - UFVJM (orientadora) DIAMANTINA - MG 2013 DEDICATÓRIA A Deus, meu refúgio e fortaleza, pela dádiva do hoje! Aos meus pais e irmãos, por trazerem luz e alegria à minha vida. Por contribuírem para que eu alcançasse esse objetivo, por suportarem as ausências e as chatices e por estarem sempre ao meu lado nessa conquista, o meu amor e minha sincera gratidão. Vocês são eternos em meu coração. AGRADECIMENTOS Agradeço a Deus, pela vida que tenho e por me cercar por pessoas do bem, que contribuíram para a realização deste trabalho e finalização de mais essa etapa tão importante na minha vida. À Professora Profª. Drª. Maria Helena Santos, minha orientadora, amiga, conselheira e exemplo de pesquisadora, pelo equilíbrio, maturidade e olhar crítico durante minha orientação. Agradeço, ainda, pela credibilidade concedida a mim, por ter chamado minha atenção quando foi necessário e me elogiado quando fui merecedor, por ter me ensinado a crescer como pessoa e como profissional e por ter me concedido oportunidades que jamais obteria sozinho. Mais que uma orientadora, uma mãe! À Profª. Drª. Suelleng Maria Cunha Santos Soares, minha co-orientadora, pela amizade, compromisso, disponibilidade em ajudar sempre que possível, sendo uma das minhas grandes incentivadoras em buscar a excelência na pesquisa. À Profª. Drª. Maria Letícia Ramos Jorge, Coordenadora do Programa de Pósgraduação em Odontologia da UFVJM, que me recebeu com tanto carinho. Obrigado pela amizade, disponibilidade, apoio, compreensão e reflexão que seus conselhos me possibilitaram. Ao Professor Dr. Leandro Silva Marques, pelo enorme empenho e dedicação ao Programa de Pós-Graduação, pelos valiosos ensinamentos, fundamentais para minha formação, e pelas oportunidades que me concedeu durante essa etapa. Ao Professor Dr. Janir Alves Soares, pela dedicação ao PPGOdonto e ao BioMat, pela disponibilidade em sempre querer me ajudar e pela grande ajuda para a realização desta pesquisa. Exemplo de responsabilidade e compromisso! Ao Professor Dr. João Luis de Miranda, pelo empenho na realização do teste de biocompatibilidade, paciência, motivação, ensinamentos valiosos e pela oportunidade de conhecimento e experiência na área de patologia, abrindo novos caminhos na minha vida como pesquisador. Ao Professor Dr. Evandro Watanabe, pela parceria conosco na pesquisa, sendo fundamental para a realização da atividade antimicrobiana. Ao Professor Dr. Fabiano Vargas, pela abertura e ensinamentos do processamento das nanofibrilas. Você foi fundamental neste trabalho! Muito obrigado! Espero levar essa parceria para a vida! Ao Professor Dr. Álvaro Dutra, pela disponibilização do Laboratório da Farmácia Industrial para o desenvolvimento de parte do meu experimento. Obrigado pela confiança e pelos ensinamentos valiosos. Ao Prof. Dr. Mauro Henrique Nogueira Guimarães de Abreu, por participar da minha banca examinadora. Com certeza acataremos suas considerações! Muito importante sua vinda para o grupo BioMat! Ao Professor Dr. Juan Pedro Bretas Roa, pelos valiosos ensinamentos, sendo a pessoa responsável para o meu encontro e parceria com o Prof. Dr. Fabiano Vargas. Obrigado por aceitar participar da banca! Sei que nos trará contribuições essenciais! À Professora Drª. Tania Riul, por ceder, tão gentilmente, o Laboratório de Experiemntação Animal do Departamento de Nutrição-UFVJM para a realização de parte da pesquisa, pela amizade e torcida desde a minha graduação. Admiro-te muito!! À Professora Drª. Karine T. Tavano de Aguiar, por ser a fã n°.1 deste trabalho e sempre estar disposta a ajudar. Obrigado por tudo! Sua amizade é muito importante para mim!! Ao Professor Mr. Ricardo Lopes Rocha, pela amizade e companheirismo na disciplina de Pré-Clínica I do Curso de Odontologia, na qual tive a oportunidade de aprender e participar como professor de ensino superior durante o curso de mestrado. À Professora Dra. Patrícia Furtado Gonçalves, pela dedicação ao Programa de PósGraduação, pelos momentos de aprendizado e grande contribuição na minha didática e postura como futuro professor de ensino superior. Aos Professores do Programa de Pós-Graduação em Odontologia: Adriana Maria Botelho, Ana Teresinha Mesquita, Cássio Roberto Rocha dos Santos, Flaviana Dornela Verli, Marcos Luciano Pimenta Pinheiro, Fernanda de Oliveira Ferreira e Olga Dumont Flecha, pelos momentos de aprendizagem. Ao Professor Dr. Saul Martins de Paiva, pelos conselhos e incentivo à pesquisa. Ao Professor Dr. Sérgio d’Avila Lins Bezerra Cavalcante, que sempre me incentivou e apoiou nessa jornada. Ao colega de pesquisa Vitor, companheiro de caminhada, pela amizade, pelos momentos de estudo e bate-papo durante nossas pesquisas no BioMat. Aos colegas de Mestrado: Anne, Dhelfeson, Isabela, Márcio e Rafaela. Sentirei falta dos bons momentos de convivência ao longo dessa jornada! À Gislene Alessandra Santos, Secretária do Programa de Pós-Graduação em Odontologia, pela enorme disponibilidade para ajudar sempre. À Rosânia, funcionária do Laboratório de Materiais Odontológicos, pela amizade e pela dedicação em ajudar sempre que foi necessário. Aos funcionários Leo e Luís, pela ajuda durante a macroscopia das biópsias e processamento das lâminas histológicas. Ao funcionário Alexandre, pela paciência em me ensinar a trabalhar em um laboratório de experimentação animal. Muito obrigado pela imensa ajuda e prontidão em sempre colaborar! À FAPEMIG, CAPES, CNPq e à UFVJM, pela liberação de bolsas e recursos para o desenvolvimento da pesquisa. Aos alunos de iniciação científica: Vinícius Xavier, Leonardo Amaral e Felipe Mota, que se dedicaram com tanto empenho à pesquisa e que me possibilitaram a experiência da orientação científica. AGRADECIMENTOS AFETIVOS À minha mãe, Nívia de Menezes Silva, e ao meu pai, Adilson Ozório da Silva, pela dedicação e abnegação, por serem meus exemplos de vida, sempre apoiando minhas escolhas e por terem tanto orgulho de mim. Amo vocês, meus amores! Aos meus avós (in memorian), alicerce da família! Obrigado por me ensinarem honestidade, honra, respeito, compromisso e amor à família!!! À minha irmã Joanna, por ser meu exemplo de estudo dentro de casa, e ao meu irmão Pablo, pelo exemplo de independência e compromisso na vida, despertando uma vontade imensa de crescer profissionalmente. Obrigado por confiarem em mim e acreditarem no meu sucesso. À minha família – pedra fundamental da minha primeira escolaridade – aos tios, tias, primos e primas, pelo imenso afeto e por me apresentarem sempre em suas orações. Sempre dispostos a me ajudar. Muito obrigado! Aos meus cunhados Plínio e Marla, pelo carinho, amizade e por sempre me estimularem em busca de meus objetivos. Aos meus amigos de Corinto, que mesmo a distância física não pode nos separar. Sempre atenciosos, torceram comigo e me fizeram acreditar sempre na minha capacidade. Amo vocês para sempre! Aos meus amigos da 58ª Turma de Odontologia Rafael de Miranda Pereira, por torcerem sempre por mim, com muito carinho. Aos meus amigos de Diamantina, pelo fundamental apoio e compreensão nas horas de happy-hour, nas quais as cervejas foram muito importantes. Por vocês terem me aturado nesse período “tão complicado”. Aos meus colegas de república, pela convivência e companheirismo durante essa etapa e por terem aguentado minhas inúmeras reclamações, quando eu achei que não conseguiria concluir este trabalho a tempo. Ao Departamento de Odontologia da UFVJM, por me fazer sentir como membro importante da nossa tão querida “Odontologia de Diamantina”. À Diamantina, pelo acolhimento. Sentirei saudades dessa terrinha... e voltarei! RESUMO SILVA, Rafael Menezes. Universidade Federal dos Vales do Jequitinhonha e Mucuri, fevereiro de 2013. 115 p. Compósitos de cimento ionomérico modificados com fibras celulósicas: caracterização, comportamento mecânico, atividade antimicrobiana e biocompatibilidade. Orientadora: Maria Helena Santos. Co-orientadora: Suelleng Maria Cunha Santos Soares. Dissertação (Mestrado em Odontologia). O presente estudo foi dividido em três partes, com os seguintes objetivos: Parte 1 - modificar o cimento de ionômero de vidro (CIV) com duas concentrações de fibras da celulose de eucalipto processadas mecanicamente (CIVMF), avaliando os compósitos desenvolvidos quanto às propriedades mecânicas e caracterizando por microscopia eletrônica de varredura (MEV) e espectroscopia de energia dispersiva de raios-X (EDS). Parte 2 - obter microfibras (mfC) e nanofibrilas (nfC) de celulose e modificar o CIV com três concentrações de mfC (CIVmfC) e cinco concentrações de nfC (CIVnfC), avaliando novamente os compósitos obtidos quanto às suas propriedades mecânicas, caracterizando por MEV/EDS, difração de raios-X (DRX), espectroscopia de infravermelho por transformada de Fourier (FTIR) e analisando suas atividades antimicrobianas. Parte 3 – avaliar a biocompatibilidade dos compósitos obtidos. Os grupos experimentais obtidos foram: G1- CIV - controle, G2CIVMF1 e G3-CIVMF2 (parte 1); GC- CIV, G1- CIVmC 0,005g, G2- CIVmFC 0,010g e G3CIVmFC 0,015g (parte 2); e GC- CIV, G01- CIVnfC 1%, G02- CIVnfC 0,8%, G03- CIVnfC 0,6%, G04- CIVnfC 0,4% e G05- CIVnfC 0,2% (parte 3). Os corpos de prova dos grupos foram submetidos aos ensaios mecânicos e foram avaliados quanto à morfologia, composição química elementar qualitativa, cristalinidade e estrutura química molecular. CIVMF1(G2) apresentou resistência à compressão e tração diametral aumentada, quando comparado ao CIV. CIVMF2 (G3) apresentou melhores características de manipulação, além de apresentar maior resistência à compressão, tração diametral e módulo de elasticidade aceitável, devido à adição de maior concentração de fibras à constituição do material. Apesar de resultados não estatisticamente significativos, a adição de mfC no CIV aumentou suas propriedades mecânicas, sendo que o acréscimo de mFC no compósito CIVmfC (G3) aumentou seu módulo de elasticidade à compressão, significativamente. Nos compósitos CIVnfC a resistência mecânica também apresentou-se aumentada, sendo que CIVnfC 0,2% (G05) apresentou melhor resistência à tração diametral e CIVnfc 0,4% (G04) mostrou significativo aumento da resistência à compressão e excelente performance quanto ao desgaste e resistência à tração. Os compósitos CIVmfC e CIVnfC não apresentaram halo de inibição frente aos microrganismos analisados, comparando-se ao comportamento do CIV. Os compósitos apresentaram-se estáveis, com morfologia, estrutura e composição química elementar semelhantes aos seus materiais precursores. Não houve formação de nova fase cristalina ou novas ligações químicas detectáveis neste estudo. Nos compósitos CIVnfC observou-se formação de uma trama envolvendo nanofibrilas, matriz cimentícea e partículas de carga, sendo que a distribuição de nfC na massa de CIV mostrou-se mais homogênea no compósito CIVnfC 0,4%. CIVmfC e CIVnfC foram biocompatíveis, apresentando ação estimuladora celular e baixa irritabilidade tecidual, semelhante ao grupo controle (CIV). As nanofibrilas de celulose apresentaram-se como uma promissora opção para reforço do CIV, com melhoria das propriedades mecânicas finais dos compósitos desenvolvidos, resultando em um novo e promissor biomaterial restaurador dentário. Palavras-chave: cimento de ionômero de vidro, microfibrilas de celulose, nanofibrilas de celulose, resistência mecânica, atividade antimicrobiana, biocompatibilidade. ABSTRACT SILVA, Rafael Menezes. Federal University of the Vales do Jequitinhonha e Mucuri, february 2013. 115 p. Glass ionomer composites modified with cellulose fibers: characterization, mechanical behavior, antimicrobial activity and biocompatibility. Advisor: Maria Helena Santos. Co-advisor: Suelleng Maria Cunha Santos Soares (Master’s degree in Dentistry). The present study was divided in three parts, with the following objectives: Part 1 - modify the glass ionomer cement (CIV) with two concentrations of mechanically processed eucalyptus cellulosic fibers (CIVMF), evaluating the developed composites according to their mechanical properties and characterizing by scanning electron microscopy (SEM) and energy dispersive X-ray spectroscopy X (EDS). Part 2 – to obtain cellulose microfibers (mfC) and celulose nanofibrils (nfC) and modify the CIV with three concentrations of mfC (CIVCmfC) and five concentrations of nfC (CIVnfC), evaluating the developed composites according to their mechanical properties, characterizing by SEM/EDS, X-ray diffraction (XRD), Fourier transform infrared spectroscopy (FTIR) and analyzing their antimicrobial activity. Part 3 – to evaluate the biocompatibility of the composites. The experimental groups were: G1-CIV control, G2 (CIVMF1) and G3 (CIVMF2) (part 1), GC-CIV, G1-CIVmfC 0.005 g, G2CIVmfC 0.010 g and G3-CIVmfC 0.015 g (part 2), and GC-CIV, G01-CIVnfC 1%, G02CIVnfC 0.8%, G03- CIVnfC 0.6%, G04- CIVnfC 0.4% and G05- CIVnfC 0.2% (part 3). Specimens from both groups were subjected to mechanical tests and were evaluated for morphology, qualitative chemical composition, crystallinity and molecular structure. CIVMF1 (G2) had compressive strength and diametral tensile increased when compared to the GIC. CIVMF2 (G3) showed better handling characteristics, besides higher compressive strength, tensile modulus and diametral acceptable due to the addition of higher concentration of fibers to the constitution of the material. Although not statistically significant, the addition of mfC in CIVmfC increased its mechanical properties; the addition of mfC in the composite CIVmfC (G3) increased their compressive modulus significantly. In the composite CIVnfC , the mechanical strength was also increased, with CIVnfC 0.2% (G05) showing better results in the diametral tensile and CIVnfC 0.4% (G04) showed significant increase in compressive strength and excellent performance for wear resistance and tensile strength. The composites CIVmfC and CIVnfC showed no zone of inhibition against the microorganisms analyzed compared to the CIV. The composites were stable, morphology; structure and chemical composition were similar to their precursor materials. In this study there was no formation of new crystallographic phase or new chemical bonds detectable. It was observed the formation of net involving nanofibrils, cementitious matrix and filler particles, and the distribution of nfC of the mass of CIV proved to be more homogeneous in the composite CIVnfC 0.4%. CIVmfC and CIVnfC were biocompatible presenting cell stimulatory action and low irritability to the tissue, similar to the control group (CIV). The cellulose nanofibers proved to be an excellent option for strengthening the CIV with improved mechanical properties of the final developed composites, resulting in a new and promising restorative dental biomaterial. Keywords: glass ionomer cement, cellulose microfibrils, cellulose nanofibrils, strength mechanical, antimicrobial activity, biocompatibility. SUMÁRIO 1. CONSIDERAÇÕES INICIAIS....................................................................... 13 2. ARTIGOS.......................................................................................................... 18 2.1. Artigo 1........................................................................................................... 19 2.1.1. Página de título............................................................................................. 22 2.1.2. Resumo......................................................................................................... 23 2.1.3. Introdução..................................................................................................... 24 2.1.4. Metodologia.................................................................................................. 25 2.1.5. Resultados.................................................................................................... 27 2.1.6. Discussão...................................................................................................... 28 2.1.7. Conclusão..................................................................................................... 30 2.1.8. Agradecimentos............................................................................................ 31 2.1.9. Tabelas.......................................................................................................... 32 2.1.10. Referências................................................................................................. 34 2.1.11. Legenda das figuras.................................................................................... 36 2.2. Artigo 2........................................................................................................... 39 2.2.1. Página de título............................................................................................. 41 2.2.2. Resumo......................................................................................................... 42 2.2.3. Introdução..................................................................................................... 43 2.2.4. Metodologia.................................................................................................. 43 2.2.5. Resultados.................................................................................................... 46 2.2.6. Discussão...................................................................................................... 48 2.2.7. Conclusão..................................................................................................... 51 2.2.8. Agradecimentos............................................................................................ 51 2.2.9. Referências................................................................................................... 51 2.2.10. Legenda...................................................................................................... 54 2.3. Artigo 3........................................................................................................... 61 2.3.1. Página de título............................................................................................. 63 2.3.2. Resumo......................................................................................................... 64 2.3.3. Introdução..................................................................................................... 65 2.3.4. Metodologia.................................................................................................. 65 2.3.5. Resultados.................................................................................................... 67 2.3.6. Discussão...................................................................................................... 68 2.3.7. Conclusão..................................................................................................... 70 2.3.8. Agradecimentos............................................................................................ 70 2.3.9. Referências................................................................................................... 70 2.3.10. Legenda...................................................................................................... 72 3. CONSIDERAÇÕES FINAIS........................................................................... 82 4. REFERÊNCIAS GERAIS............................................................................... 84 5. ANEXOS............................................................................................................ 88 5.1. Anexo A – Normas para publicação do artigo 1.............................................. 89 5.2. Anexo B – Normas para publicação do artigo 2 e 3........................................ 105 1. CONSIDERAÇÕES INICIAIS 14 Considerações iniciais CONSIDERAÇÕES INICIAIS Os cimentos de ionômero de vidro tornaram-se disponíveis a partir dos estudos pioneiros de Wilson e Kent (1971) sendo comercializados por volta de 1975. Na Odontologia, o cimento de ionômero de vidro (CIV) é um material em destaque, pois veio agregar propriedades físicas e biológicas favoráveis, que não eram obtidas com outros materiais (Mount, 1999), assim como biocompatibilidade, capacidade de adesão à estrutura dentária e liberação de flúor, cuja presença está relacionada ao potencial de remineralização e à ação antibacteriana (Anusavice, 1996; Davidson, 2006). No entanto, este cimento ainda apresenta características a serem melhoradas como material restaurador, as quais incluem baixa resistência à abrasão, translucidez reduzida, friabilidade e sensibilidade à técnica (Liporoni et al., 2003). Uma limitação do CIV convencional está relacionada também com a ação de soluções com baixo pH, que pode deteriorar a superfície da restauração, tornando-os mais susceptíveis à falha clínica (Mohamed-Tahir e Yap, 2004; Ribeiro, 2006). Outra está relacionada com a última fase do processo de presa do material, que é muito lenta e se estende por até vinte e quatro horas, expondo estes materiais às alterações higroscópicas do meio, sinérese e embebição (Craig e Powers, 2004; Anusavice, 1996). A capacidade de resistência mecânica é um requisito importante para um material designado para restaurar dentes anteriores e posteriores (Anusavice, 1996), bem como na utilização protética e ortodôntica (Paradella, 2004). Ainda hoje, os cimentos ionoméricos são bastante estudados e diversos materiais com as mais variadas composições foram introduzidos no mercado odontológico, procurando melhorar suas propriedades de resistência (Algera et al., 2006; Zhao J, Xie D, 2009). Partículas metálicas foram adicionadas à composição do CIV com o objetivo de aumentar sua resistência, gerando os cimentos chamados “Cermets” (Manfio et al., 1994), porém com desvantagens estéticas. Em outros cimentos ionoméricos foram adicionados monômeros resinosos para melhorar a estética e a resistência mecânica. Porém, desvantagens como necessidade de técnica incremental, maior contração de polimerização, maior citotoxicidade, necessidade de fotoativação e maior custo estão presentes nestes cimentos de ionômero de vidro modificados por resina (Mount, 1999; Xie et al., 2004). Surgiram também os cimentos ionoméricos de alta viscosidade, contendo em sua composição maior número de partículas de menor tamanho, para que pudessem ser 15 empregados com sucesso em áreas expostas a grandes esforços mastigatórios (Anusavice, 1996; Vieira et al., 2006). Um compósito consiste da combinação de dois ou mais materiais ou fases visando à manipulação de propriedades e comportamento (Hench, 1991; Alexander, 1996). Suas propriedades devem ser superiores ou intermediárias àquelas dos constituintes individuais (Anusavice, 1996). Por muitos anos, tenta-se incorporar fibras como agente de reforço nos materiais para aumentar sua resistência. Nas últimas décadas tem havido um rápido desenvolvimento na elaboração de compósitos reforçados por fibras celulósicas, que possuem muitas características que tornam seu uso vantajoso, como baixo custo, baixa densidade, resistência específica e módulo de elasticidade elevado, além disso, não são abrasivas e nem tóxicas, podem ser facilmente modificadas por agentes químicos, são abundantes e provém de fontes renováveis (Reddy et al., 2005; Jústiz-Smith et al., 2008; Zhang et al., 2010; Vila et al., 2011), conferindo propriedades interessantes aos mesmos como, melhor resistência mecânica e aumento do módulo de elasticidade. No uso de fibras de origem natural em compósitos a compatibilização entre a fibra e a matriz é de importância fundamental, bem como a incorporação de uma quantidade relativamente alta de fibras e sua capacidade de molhabilidade, aumentando a transferência de carga para as mesmas (Reddy e Yang, 2009). O eucalipto é uma planta bastante versátil e com inúmeras aplicações industriais. Algumas espécies são utilizadas para a produção de celulose, apresentando vantagens em comparação a outras espécies utilizadas no mundo. As fibras do eucalipto são consideradas curtas dentre as demais usadas para modificação de compósitos. Além disso, apresentam granulação reduzida, que lhe proporciona lisura. O alto número de fibras por grama (faixa de 20 milhões) proporciona resistência ao achatamento e rigidez, devido à arquitetura das microfibrilas, que são os componentes básicos da parede da fibra (Ferreira et al., 2006a; Ferreira et al., 2006b). Estas mesmas características intrínsecas das fibras de eucalipto associadas à natureza de seus componentes químicos, tais como as hemiceluloses, tornam boa sua absorção de líquidos e sua reatividade. Além de todas estas vantagens, a pasta de celulose do eucalipto pode ser produzida com teores diferentes de brancura e baixíssimo teor de impurezas (Ferreira et al., 2006a; Ferreira et al., 2006b; Vila et al., 2011). Silva et al. (2013) foram os primeiros pesquisadores a modificarem um material odontológico com fibras a fim de melhorar suas propriedades mecâncias. Eles adicionaram diferentes concentrações de fibras de eucalipto ao cimento de ionômero de vidro convencional, como agente de reforço. Dentro de níveis aceitáveis, o acréscimo de fibras ao 16 cimento ionomérico, não interferiu no seu tempo de trabalho e de presa, nem nas suas propriedades de sinérese, embebição e solubilidade, além da resistência à tração diametral, melhorando sua resistência compressiva, desgaste e adesão química à estrutura dentária. Frente aos fatos apresentados na literatura, o conhecimento das propriedades físicoquímicas e biológicas do CIV modificado com fibras é de fundamental importância para a aplicação clínica deste material no atual cenário econômico-mundial. Devido às características intrínsecas da celulose aliado ao desenvolvimento tecnológico altamente sustentável, tem surgido um grande número de pesquisas focadas nesse material orgânico como fonte de matéria-prima e melhoramento de materiais. As nanofibrilas ou também denominados nanocristais, presentes nas fibrilas de celulose possuem propriedades semelhantes aos nanotubos de carbono, com a vantagem de serem considerados os materiais orgânicos mais abundantes do planeta, apresentam excelente dispersão na matriz com consequente transferência de carga para a mesma, mantendo a integridade e a pureza, além do baixo custo, quando comparado ao nanotubo de carbono (Coleman et al, 2006; Ajayan e Tour, 2007; Beecher, 2007; Tsuguyuki Saito, 2007; Vila et al., 2011). Os biomateriais funcionam em contato íntimo com diferentes tecidos humanos e precisam enquadrar-se na definição de biomateriais. A biocompatibilidade de um material é um parâmetro que deve ser considerado para sua formulação e uso. A Ciência dos Biomateriais tem a necessidade de acompanhar, conhecer e apreciar certas considerações biológicas que estão associadas com o uso e a seleção dos materiais a serem empregados nos tecidos humanos. Suas propriedades mecânicas deixam de ser prioridade se o material causa danos a esses tecidos (Anusavice, 1996). O CIV convencional está envolvido na remineralização da dentina afetada remanescente e no controle da recidiva de cárie, devido à sua natureza anticariogênica e, sendo quimicamente ativado, dispensa o uso de aparelhos especiais como os de fotoativação. Sua adesividade minimiza a microinfiltração na interface dente/restauração e sua biocompatibilidade evita novas lesões ao dente tratado, dispensando o uso de materiais de proteção, a não ser em cavidades consideradas muito profundas, onde é necessário usar o cimento de hidróxido de cálcio como material forrador (Anusavice, 1996). Com a inclusão de microfibras e de nanofibrilas de celulose no CIV espera-se que este apresente uma maior resistência mecânica, sem que haja interferência nas suas propriedades positivas. Órgãos internacionais procuram respostas para a necessidade de se encontrar um método de preservação dos dentes de indivíduos de todas as idades, nas comunidades carentes de países em desenvolvimento, onde os recursos são escassos. Para tal, foi aprovada e 17 divulgada pela Organização Mundial de Saúde (OMS) a técnica do tratamento restaurador atraumático (TRA), (Atraumatic Restorative Treatment - ART), que preconiza o tratamento das lesões cariosas pela remoção parcial da cárie dentária que consiste na remoção da dentina infectada e na manutenção da dentina afetada, usando apenas instrumentos manuais. Este tipo de tratamento tem como princípio a preservação máxima das estruturas dentárias e usando principalmente, este cimento para restauração dos dentes (Frencken, 2010). O desenvolvimento do CIV modificado por fibras vai ao encontro desta necessidade, e poderá ser empregado como material restaurador definitivo no TRA, técnica simples que, independentemente das condições sócio-econômicas, é indicada para adultos e crianças. Assim, esta intervenção poderá evitar que as lesões de cárie tornem-se cada vez maiores até que os dentes sejam perdidos pela esfoliação natural. Portanto, os objetivos deste estudo foram modificar um cimento de ionômero de vidro restaurador convencional com fibras celulósicas processadas mecanicamente, com microfibras e nanofibrilas de celulose de eucalipto, avaliar suas propriedades mecânicas, caracterizá-los, avaliar sua atividade antimicrobiana e biocompatibilidade. 2. ARTIGOS 2.1. ARTIGO 1 Brasilian Oral Research - BOR 20 UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI www.ufvjm.edu.br Programa de Pós-Graduação em Odontologia – PPGOdonto Prezado Editor, Numerosos estudos envolvendo a adição de fibras de celulose têm mostrado comprovados resultados de propriedades mecânicas superiores. Nós modificamos o cimento de ionômero de vidro restaurador dentário com fibras de celulose do eucalipto, avaliamos suas propriedades mecânicas e caracterizamos os compósitos desenvolvidos. Nós, os autores citados abaixo, submetemos o manuscrito intitulado "Adição de fibras celulósicas processadas mecanicamente no cimento ionomérico: propriedades mecânicas" para apreciação e análise do Editorial da revista Brasilian Oral Research, para possível publicação. Atenciosamente, Rafael Menezes Silva Vinícius Xavier Mattar de Carvalho Vítor César Dumont Ana Márcia Macedo Ladeira Carvalho Maria Helena Santos 21 TERMO DE TRANSFERÊNCIA DE DIREITOS AUTORAIS E DECLARAÇÕES DE RESPONSABILIDADE À Comissão de Publicação da Brazilian Oral Research (BOR) Os autores Rafael Menezes Silva, Vinícius Xavier Mattar de Carvalho, Vitor César Dumont e Maria Helena Santos (doravante denominados "Autores") submetem o manuscrito original intitulado “Adição de fibras celulósicas processadas mecanicamente no cimento ionomérico: propriedades mecânicas” à Brazilian Oral Research - BOR, representada pela Comissão de Publicação do periódico, e atestam que o manuscrito submetido para publicação (doravante denominado "Manuscrito") é original e não infringe patente, marca registrada, direito autoral, segredo comercial ou quaisquer outros direitos proprietários de terceiros. Os Autores também declaram que, exceto quando explicitamente informado, não têm qualquer interesse financeiro ou acordo com qualquer entidade que possa ser percebido como tendo influência sobre a objetividade do Manuscrito, a não ser que tal interesse financeiro ou acordo tenha sido revelado por escrito à BOR, em documento separado e firmado por todos os Autores. Os Autores declaram ainda que o estudo, cujos resultados estão relatados no Manuscrito, foi realizado observando-se as políticas vigentes nas instituições às quais os Autores estão vinculados relativas ao uso de humanos e/ou animais, e/ou material derivado de humanos ou animais (Aprovação em Comitê de Ética Institucional). Os Autores concordam em indenizar a BOR e em eximi-la de quaisquer alegações, custos, honorários advocatícios, indenizações ou custos de licenças de utilização incorridos pela BOR em consequência de qualquer alegação, infração de direitos, ou não observância das determinações do Comitê de Ética Institucional ocasionadas pela publicação, em todo ou em parte, do Manuscrito. Publicação: Brazilian Oral Research Título do manuscrito: Adição de fibras celulósicas processadas mecanicamente no cimento ionomérico: propriedades mecânicas Autores: Rafael Menezes Silva, Vinícius Xavier Mattar de Carvalho, Vitor César Dumont e Maria Helena Santos. Local e data: Diamantina, de 2013. Assinaturas: Rafael Menezes Silva Vinícius Xavier Mattar de Carvalho Vitor César Dumont Ana Márcia Macedo Ladeira Carvalho Maria Helena Santos 22 Pesquisa Original – Materiais dentários Adição de fibras celulósicas processadas mecanicamente no cimento ionomérico: propriedades mecânicas Rafael Menezes Silva1,2* Vinícius Xavier Mattar de Carvalho1,2 Vitor César Dumont1,2 1 Centro Avançado de Biomateriais – BioMat - UFVJM, Diamantina/MG, CEP 39100-000, Brasil 2 Departamento de Odontologia, Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM, Diamantina/MG, CEP 39100-000, Brasil Ana Márcia Macedo Ladeira Carvalho3 3 Departamento de Engenharia Florestal, Universidade Federal de Viçosa - UFV, Viçosa/MG, CEP 36570- 000, Brasil Maria Helena Santos1,2 1 Centro Avançado de Biomateriais – BioMat - UFVJM, Diamantina/MG, CEP 39100-000, Brasil 2 Departamento de Odontologia, Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM, Diamantina/MG, CEP 39100-000, Brasil * Autor correspondente: Rafael Menezes Silva Centro Avançado de Biomateriais – BioMat Rua da Glória, 187, Diamantina/MG, CEP39100-000, Brasil Phone: +55 38 3532 6066 [email protected] Fax: +55 38 3532 6077 23 Resumo O cimento de ionômero de vidro é um material largamente utilizado pelo cirurgião-dentista, entretanto apresenta algumas limitações mecânicas, sendo, ainda hoje, um dos materiais mais estudados na odontologia. O objetivo deste estudo foi modificar um cimento de ionômero de vidro restaurador convencional (CIV) com fibras de celulose processadas mecanicamente, avaliar sua resistência à tração, à compressão e módulo de elasticidade, e caracterizá-lo por microscopia eletrônica de varredura e espectroscopia de energia dispersiva de raios-X. Duas concentrações diferentes de fibras foram pesadas e aglutinadas ao CIV durante sua manipulação. Três grupos experimentais foram obtidos: grupo 1 (G1CIV), controle; grupo 2 (G2-CIVMF1 - CIV modificado por fibras, concentração 1) e grupo 3 (G3CIVMF2 - concentração 2). Após avaliação das propriedades de resistência à compressão, tração diametral e módulo de elasticidade, os resultados foram submetidos à análise estatística e os compósitos foram avaliados quanto a sua morfologia, além da análise da composição química elementar qualitativa. CIVMF1 apresentou uma resistência à compressão e à tração diametral aumentada, quando comparado ao CIV. O CIVMF2 apresentou melhores características. A proporção de fibras usadas neste compósito proporcionou maior resistência à compressão, à tração diametral e um módulo de elasticidade aceitável, devido a maior concentração de fibras adicionadas à constituição do material, o que diminuiu sua friabilidade. A adição de fibras celulósicas processadas fisicamente no CIV aumentou sua resistência mecânica. As análises morfológicas e química elementar de CIVMF2 mostraram a formação de um novo e estável compósito com interação entre fibras/matriz ionomérica/partículas de carga. Palavras-chave: cimento de ionômero de vidro; fibras de celulose; compósito; propriedade mecênica; microscopia. 24 1. Introdução A celulose é uma fibra natural, considerada como um dos principais componentes da parede celular das plantas, que oferece integridade mecânica e suporte para as mesmas, sendo bastante usada na indústria. 1,2 Atualmente, as fibras de celulose da madeira são importantes objetos de pesquisa em várias áreas do conhecimento para aplicações de uso final. Tais fibras podem ser utilizadas como reforço de compósitos e matérias-primas para a produção de bioenergia e bioquímica.3-5 Estudos envolvendo a adição de fibras celulósicas a matrizes cimentíceas mostraram resultados satisfatórios, conferindo-lhes aumento da resistência mecânica e módulo elástico.6,7 O cimento de ionômero de vidro convencional (CIV) é um material restaurador bastante utilizado na clínica odontológica, apresentando inúmeras vantagens. O CIV está envolvido na remineralização da dentina afetada remanescente e no controle da recidiva de cárie devido à sua natureza anticariogênica e, sendo quimicamente ativado, dispensa o uso de aparelhos especiais como os de fotoativação. A adesividade do cimento ionomérico minimiza a microinfiltração na interface dente/restauração e sua biocompatibilidade evita novas lesões ao dente tratado, dispensando o uso de materiais de proteção, a não ser em cavidades consideradas muito profundas.8 No entanto, este cimento apresenta uma série de desvantagens como susceptibilidade à desidratação e propriedades de resistência à tração, tenacidade à fratura e ao desgaste muito baixas, características que requerem limitadas melhorias possíveis na sua consistência coesiva.8,9 Silva et al.10 (2013) foram os primeiros a desenvolver estudos com a inclusão de fibras celulósicas ao CIV na tentativa de conferir resistência mecânica maior a este material restaurador promissor. As fibras foram usadas como reforço para o compósito e os resultados mostraram que o acréscimo de fibras na proporção ideal não interferiu no tempo de trabalho e de presa final do material. O CIV modificado com fibras celulósicas apresentou propriedades de sinérese e embebição, solubilidade e desintegração em água e resistência à tração diametral similares ao cimento convencional. Entretanto, o compósito desenvolvido apresentou aumento da resistência à compressão e abrasão, além de uma adesão maior à estrutura dentária. A caracterização através de microscopia eletrônica de varredura confirmou a formação de um novo e estável compósito. Ainda hoje, os cimentos ionoméricos são bastante estudados e materiais com as mais variadas composições foram introduzidos no mercado odontológico, na expectativa de melhorar sua resistência. O 25 uso de fibras celulósicas vai ao encontro desta necessidade por possuírem algumas características intrínsecas desejáveis como, baixo custo e densidade, resistência específica e módulo de elasticidade elevado, resistência ao achatamento e rigidez, não são abrasivas e nem tóxicas, podem ser facilmente modificadas por agentes químicos, além de provir de fontes renováveis e serem o composto orgânico mais abundante do planeta.3,6,11,12 Portanto, pensando-se nas propriedades positivas e nas perspectivas do CIV com propriedades mecânicas desejáveis para uso na odontologia 9,13-15 , o objetivo deste estudo foi modificar um cimento de ionômero de vidro restaurador convencional com fibras de celulose processadas mecanicamente, avaliar sua resistência à tração, à compressão, seu módulo de elasticidade, e caracterizá-lo por microscopia eletrônica de varredura e espectroscopia de energia dispersiva de raios-X. 2. Metodologia 2.1. Desenvolvimento do compósito As fibras de celulose foram obtidas da madeira de eucalipto e individualizadas com hidróxido de sódio e sulfeto de sódio (Processo Kraft de cozimento), de acordo com Ferreira et al.,16 (2006a). Em seguida, foram branqueadas por uma sequência dos três estágios (OD(PO)) descritos a seguir: deslignificação com oxigênio (O), deslignificação com dióxido de cloro (D) e extração alcalina com peróxido de hidrogênio pressurizado (PO). As fibras foram obtidas com uma alvura final desejada em torno dos 80% ISO, segundo Ferreira et al.,17 (2006b). O material foi armazenado dentro de invólucros plásticos, à temperatura de 6ºC para evitar a proliferação fúngica. Para obtenção das fibras, foram adicionadas 200 ml de água destilada a 2,5 g das fibras celulósicas e levadas a um misturador (Ultra-turrax T 25, IKA-WERKE, Staufen, Suíça), durante 3 h à velocidade de 9.500 rpm. Em seguida, a mistura foi secada em estufa (Fanem, São Paulo, Brasil) à 37ºC (± 1ºC), obtendo-se uma lâmina, que foi recortada em pedaços diminutos e mantidos à mesma temperatura até o momento de uso. Quantidades diferentes de fibras foram pesadas em balança analítica (Mettler Toledo, São Paulo, Brasil) e aglutinadas ao CIV durante sua manipulação, seguindo as recomendações do fabricante. Três grupos experimentais foram obtidos: grupo 1 (G1-CIV), controle; grupo 2 (G2-CIVMF1- CIV 26 modificado com fibras na concentração 1) e grupo 3 (G3-CIVMF2 - CIV modificado com fibras na concentração 2). 2.2. Ensaio de resistência à compressão e tração diametral Corpos de prova (cps) (n=20) de cada um dos grupos experimentais foram confeccionados em uma matriz de Teflon com 4 mm de diâmetro e 8 mm de comprimento, apoiada sobre uma placa de vidro. No G1 o cimento foi inserido na matriz, sob pressão, através de uma seringa específica (Centrix, DFL Ind., São Paulo, SP, Brasil), para minimizar a formação de bolhas no corpo do cimento. Nos G2 e G3 o cimento foi colocado no interior da matriz com espátula de inserção e compactado com o auxílio de um condensador de amálgama. Após preenchimento total da matriz, uma tira de poliéster foi pressionada sobre a superfície do cimento, sob um peso de 500 g, até atingir seu tempo de presa, a fim de se obter adequado escoamento e lisura superficial do material. Após 24 horas de armazenamento em água destilada, à temperatura de 37ºC (± 1ºC), cps (n=10) de G1-CIV, G2-CIVMF1 e G3-CIVMF2 foram submetidos ao teste de resistência à compressão em uma máquina de ensaio universal EZ Test (Shimadzu, Japão) com célula de carga de 200 kgf à velocidade de 1 mm/min, com seu longo eixo na posição vertical, até sua fratura. Para o teste de resistência à tração diametral, cps (n=10) foram submetidos à mesma célula de carga, porém com velocidade de 0,5 mm/min e com seu longo eixo na posição horizontal. O módulo de elasticidade dos cps testados também foi mensurado através dos ensaios de compressão e tração diametral. Os resultados obtidos foram transformados em MPa. 2.3. Análise estatística Após avaliação da normalidade (Teste Shapiro-Wilk) e homogeneidade de variância (Teste de Levene), os resultados foram submetidos à análise de variância (ANOVA) e ao post-hoc de Tukey. O nível de significância para todas as análises foi (p<0,05). O programa SPSS (Statistical Package for the Social Sciences) para Windows, versão 17.0 (SPSS Inc., USA) foi utilizado para análise. 2.4. Microscopia eletrônica de varredura e espectroscopia de energia dispersiva de raios-X 27 As fibras foram imersas em água destilada por 30 min, sob leve agitação, e foram desidratadas com concentrações crescentes (50, 70, 95 e 100%) de solução de acetona (Sigma-Aldrich Co., St. Louis, MO, USA). Depois de identificadas as fibras foram secadas à temperatura de 37ºC por 12 h. Após o ensaio mecânico, amostras das fibras desidratadas e amostras significativas dos compósitos de cada um dos grupos foram cobertas com uma fina camada de ouro-paládio (~15 nm), utilizando-se um metalizador (SC 7620, Emitech, Reino Unido) para permitir a transmissão de elétrons nessas superfícies. As amostras foram analisadas através de microscopia eletrônica de varredura (MEV) (CS-3500, Shimadzu, Japão) e espectroscopia de energia dispersiva de raios-X (EDS), (CS3200, Oxford, Inglaterra), usando feixe de elétrons de 10 e 15 kV. 3. Resultados Houve diferença estatisticamente significativa de G1 em relação a G2 e G3 para os testes de resistência à compressão (Tabela 1) e à tração diametral (Tabela 2). O teste post-hoc de Tukey mostrou diferença estatisticamente significativa para o teste de compressão entre G1 e G2 (p=0,001) e G1 e G3 (p<0,001). Na análise dos valores de resistência à tração diametral, o pós-teste também mostrou diferença entre G1 e G2 (p<0,001) e entre G1 e G3 (p<0,001). Para o módulo de elasticidade, o teste ANOVA mostrou diferença estatisticamente significativa entre os grupos. O post-hoc revelou diferença estatisticamente significativa de G2 em relação a G1 (p=0,035) e a G3 (p=0,013) para a resistência à compressão (Tabela 1), e entre G1 e G2 (p=0,003) para a resistência à tração diametral (Tabela 2). Tabela 1 Tabela 2 A micrografia de MEV das fibras de celulose mostrou um aspecto aglomerado com fibras de forma alongada e extremidade delgada (Fig. 1A). A forma cilíndrica e bem definida dessas fibras foi perdida após processamento mecânico. Ainda foi possível observar a presença de estrias ao longo de sua superfície, o que lhes conferiu um aspecto rugoso (Fig. 1B). Observamos ainda a presença de fibras espedaçadas e abertas devido à quebra mecânica (Fig. 1C). Figura 1 28 O compósito CIV (G1) apresentou-se como uma estrutura compacta e homogênea, com trincas e bolhas na sua superfície (Fig. 2A). As áreas de fratura de espécimes representativos de CIVMF1 (G2) e CIVMF2 (G3) apresentaram uma distribuição aleatória das fibras celulósicas em toda a extensão da matriz gelatinosa, além das partículas de carga (Fig. 2B e 2C). O espectro de EDS do compósito CIVMF2 (Fig. 2c) mostrou a presença de carbono (C) e oxigênio (O), evidenciados por picos de alta intensidade correspondentes à estrutura das fibras celulósicas de eucalipto e da matriz cimentícea ionomérica, e de picos de alta intensidade de Cálcio (Ca), Flúor (F), Alumínio (Al) e Silício (Si) e de baixa intensidade de bário (Ba), correspondentes às partículas de carga do CIV. Figura 2 4. Discussão Propriedades como adesão à estrutura úmida do dente e aos metais, ação anti-cariogênica devido à liberação de flúor, compatibilidade térmica com o esmalte dentário devido a baixos coeficientes de expansão térmica, biocompatibilidade e baixa toxicidade tornam os cimentos ionoméricos bastante atraentes como materiais dentários de uso clínico. No entanto, as baixas forças mecânicas apresentadas nas formulações convencionais os tornam inadequados para uso em locais onde concentram altas tensões, como restaurações em dentes posteriores (classe I e II). 18 Estudos demonstraram resistência mecânica aumentada em compósitos, após a inclusão de fibras celulósicas no material.7,19 Com a modificação de sua estrutura física com as fibras celulósicas, os compósitos CIVMF1 e CIVMF2 mostraram resistência à compressão aumentada, sendo que o compósito CIVMF2 obteve o melhor comportamento frente a esta propriedade. Na análise dos resultados encontrados neste estudo, observou-se que a concentração de fibras no compósito é um ponto crítico na resistência final do material. Uma concentração menor, como em CIVMF1, acarreta uma fragilidade estrutural do compósito, pois a pequena quantidade de fibras é incapaz de formar uma rede de reforço, sendo assim insuficiente para absorver as tensões de ruptura exercidas. Ao contrário dos resultados de Silva et al., 10 (2013), que não encontrou diferença entre os cimentos ionoméricos modificados com fibras e o convencional, usando fibras macro de celulose, os valores de resistência à tração diametral praticamente dobraram para os novos compósitos, nos quais 29 foram usados as mesmas fibras, porém processadas mecanicamente. CIVMF2 foi o que mostrou maior resistência, provavelmente, pela concentração maior de fibras que foram adicionadas a este compósito, justamente pela sua estrutura modificada pelo processo mecânico. Os cimentos de ionômero de vidro são friáveis, propriedade que limita seu uso como opção de material restaurador em dentes permanentes.8 Assim, há necessidade do acréscimo de fibras celulósicas no cimento de ionômero de vidro com tamanho e concentração ideal, de modo que aumente a resistência à compressão e diminua a friabilidade. 10 Ainda é necessário que o cimento mantenha viscosidade tal, que facilite sua manipulação e não interfira na sua capacidade de molhamento da estrutura dentária, propriedade primordial para uma adesão eficaz. O módulo de elasticidade descreve a relativa rigidez de um material, sendo cerca de três vezes maior no esmalte em relação à dentina.8 Enquanto o módulo de elasticidade do esmalte é de 82,7 GPa e o da dentina é de 18,6 GPa,20 o módulo de elasticidade dos cimentos de ionômero de vidro é cerca de 11 GPa,21 e é considerado um dos materiais com módulo de elasticidade mais próximo ao da dentina. Nesse estudo verificou-se que o acréscimo de fibras diminuiu o valor do módulo de elasticidade, sendo altamente significativo (p<0,001) para o compósito CIVMF1, quando comparado com o CIV convencional. Dessa forma, a carga necessária para promover o seu rompimento seria menor, o que poderia comprometer o sucesso clínico restaurador, pois aumenta sua friabilidade. O CIVMF2 apresentou diminuição do módulo de elasticidade, no teste de resistência à tração, entretanto não significativa. Isto se deve ao fato que o maior acréscimo de fibras celulósicas nesse grupo, o que garantiu a transferência de carga para as mesmas, diminuindo sua friabilidade.5 Inicialmente, as fibras foram embebidas ao líquido do CIV para posterior aglutinação, tornando possível sua incorporação ao compósito pela característica intrínseca de polaridade das mesmas, causada principalmente pela natureza hidrofílica da celulose. Só assim foi possível a modificação e interação da celulose com os constituintes do cimento restaurador.6,7 Algumas vantagens destacaram-se nesse trabalho, no que diz respeito a propriedades mecânicas. Abre-se, portanto, uma nova vertente para a tentativa de aumentar as qualidades dos materiais odontológicos, especialmente do cimento ionomérico. Pelo fato de CIVMF1 e CIVMF2 apresentarem resistência à compressão e resistência à tração diametral maiores que o grupo controle, pode-se dizer que a estrutura das fibras tem real importância nas propriedades finais do cimento de ionômero de vidro. Novos estudos para aprimorar cada vez mais a resistência mecânica deste material restaurador promissor 30 têm sido desenvolvidos, modificando o cimento ionomérico com a inserção de microfibras e nanocristais de celulose, no intuito de que possa ser usado na clínica odontológica. 5. Conclusões A adição de fibras celulósicas processadas fisicamente no CIV aumentou sua resistência mecânica. A proporção de fibras usadas em CIVMF2 propiciou propriedades de resistência à compressão e à tração diametral maiores e módulo de elasticidade aceitável. As análises morfológicas e química elementar de CIVMF2 mostraram a formação de um novo e estável compósito com interação entre fibras/matriz ionomérica/partículas de carga. 31 Agradecimentos Agradecemos a Secretaria de Estado de Ciência, Tecnologia e Ensino Superior de Minas Gerais (SECTES), a Fundação de Amparo à Pesquisa do Estado de Minas Gerais – FAPEMIG, CAPES e CNPq pelo auxílio financeiro. 32 Tabela 1 – Médias, desvios-padrão e significância estatística de resultados dos testes de resistência à compressão e módulo de elasticidade para os grupos de corpos de prova dos compósitos. Compósito Grupo Módulo de Elasticidade (MPa) Resistência à compressão (MPa) Média (DP) CIV G1 23,66 (8,48) CIVMF1 G2 40,91 (10,05) CIVMF2 G3 47,17 (8,98) p* <0,001 PostHoc** Média (DP) A 1002,77 (153,60) B 784,79 (164,03) B 1047,20 (232,93) p* PostHoc** A 0,009 *Teste ANOVA (p<0,005). **Teste de Tukey. Letras diferentes indicam que houve diferença estatisticamente significante (p<0,05), em relação aos compósitos. B A 33 Tabela 2 – Médias, desvios-padrão e significância estatística de resultados dos testes de resistência à tração diametral e módulo de elasticidade para os grupos de corpos de prova dos compósitos. Compósito Grupo Resistência à tração diametral (MPa) Média (DP) CIV G1 22,37 (6,04) CIVMF1 G2 45,55 (4,90) CIVMF2 G3 49,56 (5,03) p* <0,001 Módulo de Elasticidade (MPa) PostHoc** Média (DP) A 722,03 (284,11) B 281,70 (250,44) B 519,88 (281,51) p* PostHoc** A 0,005 B AB *Teste ANOVA (p<0,005). **Teste de Tukey. Letras diferentes indicam que houve diferença estatisticamente significante (p<0,05), em relação aos compósitos. 34 Referências 1. Carpita N, McCann M. The plant cell wall. In: Buchanan B, Gruissem W, Jones R. Biochemistry and Molecular Biology of Plants. Lancaster, Pa: Plant Physiol; 2000. p. 52-108. 2. Somerville C. Cellulose synthesis in higher plants. Annu Rev Cell Dev Biol. 2006;22:53-78. 3. Nogueira GM, Rodas ACD, Leite CAP, Giles C, Higa OZ, Polakiewicz B, et al. Preparation and characterization of ethanol-treated silk fibroin dense membranes for biomaterials application using waste silk fibers as raw material. Bioresour Technol. 2010;101(21):8446-51. 4. Turbak AF, Snyder FW, Sandberg KR. Microfibrillated cellulose, a new cellulose product: properties, uses, and commercial potential. J Appl Polym Sci Appl Polym Symp, 1983. 37:815-27. 5. Herrick FW, Casebier RL, Hamilton JK, et al. Microfibrillated Cellulose: Morphology and accessibility. J Appl Polym Sci Appl Polym Symp, 1983; 37:797-813. 6. Huda S, Yang Y. Chemically extracted fibers as reinforcement in light-weight poly (propylene) composites. Macromol Mater Eng. 2008; 293:235–43. 7. Reddy N, Yang Y. Preparation and Properties of Starch Acetate Fibers for Potential Tissue Engineering Applications. Biotechnol Bioeng. 2009;103(5):1016-22. 8. Anusavice KJ. Phillips’ science of dental materials. St. Louis: Saunders Elsevier, 2003. 9. Arita K, Yamamoto A, Shinonaga Y, Harada K, Abe Y, Nakagawa K, et al. Hydroxyapatite particle characteristics influence the enhancement of the mechanical and chemical properties of conventional restorative glass ionomer cement. Dent Mater J. 2011;30:672–83. 10. Silva RM, Santos PHN, Souza LB, et al. Effects of cellulose fibers on the physical and chemical properties of glass ionomer dental restorative materials. Mater Res Bull. 2013;48:118–126. 11. Vila C, Romero J, Francisco JL, et al. Extracting value from Eucalyptus wood before kraft pulping: effects of hemicelluloses solubilization on pulp properties. Bioresour Technol. 2011;102(8):5251-4. 12. Carlmark A, Malmström EE. "ATRP Grafting from Cellulose Fibers to Create Block-Copolymer Grafts. Biomacromolecules. 2003;4(6):1740-5. 13. Mount GJ, Clinical performance of glass-ionomers. Biomaterials. 1998;19(6):573-9. 14. Kobayashi M, Kon M, Miyai K, et al. Strengthening of glass-ionomer cement by compounding short fibres with CaO-P2O5-SiO2-Al2O3 glass. Biomaterials. 2000;21:2051-8. 35 15. Xie D, Chung ID, Wu W, et al. Synthesis and evaluation of HEMA-free glass-ionomer cements for dental applications. Dent Mater. 2004;21(20):470-8. 16. Ferreira CR, Fantini Junior M, Colodette J, et al. Avaliação tecnológica de clones de eucalipto: parte I - qualidade da madeira para produção de celulose Kraft. Scientia Forestalis. 2006;70:161-70 (a). 17. Ferreira CR, Fantini Junior M, Colodette J, et al. Avaliação tecnológica de clones de eucalipto: parte II - qualidade da celulose branqueada Kraft para papel de imprimir e escrever. Scientia Forestalis. 2006;71:09-18 (b). 18. Xiea D, Brantleyb WA, Culbertsonb BM, et al. Mechanical properties and microstructures of glassionomer cements. Dent Mater. 2000;16:129–38. 19. Reddy N, Yang Y. Properties and potential applications of natural cellulose fibers from the bark of cotton stalks. Bioresour Technol. 2009;100(14):3563-69. 20. Zimehl R, Hannig M. Non metallic restorative materials based on glass ionomer cements – recent trends and developments. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2000;163:55-62. 21. Yap AUJ, Wang X, Wu X. Comparative hardness and modulus of tooth colored restoratives: A depthsensing microindentation study. Biomaterials. 2004;25(11):2179-85. 36 Legenda das Figuras Figura 1 – Micrografias de MEV da morfologia superficial das fibras de celulose do eucalipto, após processamento físico, aumento de 200X (A), 500X (B) e 800X (C), feixe de elétrons de 10 kV, BioMat/UFVJM. Figura 2 – Micrografias de MEV de áreas de fratura do CIV, aumento 200X (A); do compósito CIVMF1 (B) e do compósito CIVMF2 (C), aumento 100X. Espectros de EDS de CIV com picos de alta intensidade de (C e O) e dos elementos químicos constituintes do vidro fluoraluminossilicato de cálcio (SiO2 - Al2O3 - CaF2 - Na3AlF6 - AlPO4) do cimento ionomérico (a); e dos compósitos CIVMF1 (b) e CIVMF2 (c) com picos do fluoraluminossilicato de cálcio e picos característicos da cadeia química da celulose, além de (C e O), feixe de elétrons de 10 e 15 kV, BioMat/UFVJM. 37 Figura 1 38 Figura 2 2.2. ARTIGO 2 Journal of Dentistry 40 UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI www.ufvjm.edu.br Programa de Pós-Graduação em Odontologia - PPGOdonto/ UFVJM Prezado Editor, Nós, autores do manuscrito intitulado "Propriedades mecânicas e atividade antimicrobiana de cimento ionomérico modificado com microfibras e nanofibrilas de celulose - Parte 1", submetemos o manuscrito para a apreciação e análise do Editorial do Journal of Dentistry, para possível publicação. O manuscrito não foi publicado anteriormente e não será enviado para publicação em outra revista. Todos os autores estão de acordo com os direitos de exclusividade do Journal of Dentistry, caso o manuscrito seja aceito para publicação. Atenciosamente, Rafael Menezes Silva Vitor César Dumont Fabiano Vargas Pereira Evandro Watanabe Suelleng Maria Cunha Santos Soares Maria Helena Santos A eficiência dos materiais odontológicos é cada vez mais aprimorada e testada, buscando-se a produção de compósitos com propriedades biologicamente favoráveis e bom desempenho clínico. Este trabalho modificou um cimento de ionômero de vidro convencional com microfibras e nanofibrilas obtidas da celulose de eucalipto, avaliou suas propriedades mecânicas, caracterizou os compósitos desenvolvidos e seus precursores e observou sua atividade antimicrobiana. Somado ao experimento in vivo, esse novo material contribuem para a elaboração e aplicação de um promissor material restaurador. Dessa forma, será possível utilizar o novo cimento como uma estratégia de controle da cárie dentária no sistema de saúde pública. 41 Propriedades mecânicas e atividade antimicrobiana de cimento ionomérico modificado com microfibras e nanofibrilas de celulose - Parte 1 Cimento ionomérico modificado: propriedades mecânicas e atividade antimicrobiana Rafael M. Silva¹,²*, Vitor C. Dumont1,2, Fabiano V. Pereira³, Evandro Watanabe4, Suelleng M. C. S. Soares¹,², Maria Helena Santos¹,² ¹Departamento de Odontologia, Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM, Diamantina/MG, CEP 39100-000, Brasil ²Centro Avançado de Biomateriais – BioMat, Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM, Diamantina/MG, CEP 39100-000, Brasil ³Departamento de Química, Universidade Federal de Minas Gerais – UFMG, Belo Horizonte/MG, CEP 31270-901, Brasil Departamento de Odontologia Restauradora da Faculdade de Odontologia de Ribeirão Preto – USP, Ribeirão Preto/SP, CEP 14040-904, Brasil 4 * Autor correspondente: Rafael Menezes Silva Centro Avançado de Biomateriais – BioMat Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM Rua da Glória, 187, Diamantina/MG, CEP39100-000, Brasil Telefone: +55 38 3532 6066 Fax: +55 38 3532 6077 [email protected] Palavras-chave: ionômero de vidro, microfibrilas, nanofibrilas, celulose, resistência mecânica, atividade antimicrobiana. 42 Resumo Propriedades mecânicas e atividade antimicrobiana de cimento ionomérico modificado com microfibras e nanofibrilas de celulose - Parte 1 Objetivo: Modificar um cimento de ionômero de vidro convencional com microfibras (mfC) e nanofibrilas (nfC) obtidas da celulose de eucalipto, avaliar suas propriedades mecânicas, caracterizar os compósitos desenvolvidos e seus precursores e observar sua atividade antimicrobiana. Metodologia: Três concentrações de mfC, em peso, foram previamente preparadas e adicionadas ao líquido do CIV obtendo-se três grupos: G1- CIVmfC 0,005 g, G2- CIVmfC 0,010 g e G3- CIVmfC 0,015 g. Corpos de prova (cps) com diferentes concentrações de nfC no total de sua massa foram confeccionados obtendo-se os grupos experimentais: G01- CIVnfC 1%, G02- CIVnfC 0,8%, G03CIVnfC 0,6%, G04- CIVnfC 0,4% e G05- CIVnfC 0,2%. Um grupo controle, GC- CIV, também foi obtido. Os espécimes foram submetidos a ensaios de resistência mecânica e caracterizados através de microscopia eletrônica de varredura, espectroscopia de energia dispersiva de raios-X, microscopia eletrônica de transmissão, difração de raios-X e espectroscopia de infravermelho por transformada de Fourier. Resultados: A única melhoria observada, quanto aos CIVmfC, foi o acréscimo de mfC em G3 para o módulo de elasticidade à compressão. G04 apresentou melhor compressão, resistência ao desgaste e um bom resultado quanto à tração diametral, enquanto G05 apresentou melhor resistência à tração diametral. Os compósitos desenvolvidos apresentaram estabilidade e características morfológicas, estruturais e químicas similares aos seus materiais precursores, além de não apresentar halo de inibição frente aos microrganismos analisados, assim como o controle. Conclusão: A modificação do cimento de ionômero de vidro convencional com nanofibrilas de celulose resultou em um novo, estável e promissor biomaterial restaurador dentário. Significado clínico: As fibras da celulose de eucalipto vão ao encontro da idéia de desenvolvimento de biomateriais, biotecnologia e desenvolvimento sustentável. O uso do CIV modificado por nanofibrilas de celulose apresenta-se como uma excelente opção para reforço com melhorias das propriedades mecânicas finais, tornando-se uma promissora opção como material restaurador dentário. 43 1. Introdução O cimento de ionômero de vidro é usado com frequência na Odontologia restauradora e suas propriedades são constantemente aprimoradas pela sua expressiva diversidade de aplicações clínicas. O cimento ionomérico é indicado por órgãos internacionais como material restaurador definitivo em populações de baixa renda, no atual cenário econômico mundial, pelo seu desempenho clínico favorável [1-3]. O volume de investigações científicas envolvendo tal material é relevante; apesar de apresentar propriedades desejáveis, suas deficiências ainda podem ser sanadas ou amenizadas. Assim, novas formulações do cimento de ionômero de vidro são desenvolvidas, principalmente considerando-se sua propriedade de resistência, levando à demanda maior desses cimentos na clínica odontológica [4,5]. Por vários anos as fibras celulósicas são estudadas no sentido de incorporá-las a diversos compósitos como agente de reforço. Estudos relataram melhorias significativas nas propriedades mecânicas dos materiais, proporcionais às concentrações da adição de fibras [6-8]. Zang et al., 2010 [9], verificaram a incorporação de celulose em hidrogéis para aumentar a geleificação, força mecânica e liberação sustentada de drogas. Silva et al., 2013 [10], foram os pioneiros no uso de fibras celulósicas para modificar propriedades de resistência de um material restaurador dentário. Diferentes quantidades de fibras de eucalipto foram adicionadas a um cimento de ionômero de vidro convencional (CIV) como agente de reforço. Em níveis aceitáveis, o acréscimo de fibras ao cimento ionomérico, na proporção ideal, não interferiu nos tempos de trabalho e de presa do material, nem nas suas propriedades de sinérese e embebição, solubilidade e desintegração em água e resistência à tração diametral, que foram similares CIV. Entretanto, o compósito desenvolvido apresentou aumento da resistência à compressão e abrasão, além de uma adesão maior à estrutura dentária. A caracterização através de microscopia eletrônica de varredura mostrou a formação de um novo e estável compósito. O grande desenvolvimento nas pesquisas em nanotecnologia, aliado ao clímax do desenvolvimento sustentável, tem atraído o uso da celulose neste contexto, devido às suas características de provir de fontes renováveis e abundantes, além de não serem tóxicas e possuírem densidade e expansão térmica baixas [11,12]. As nanofibrilas presentes na celulose possuem propriedades semelhantes aos nanotubos de carbono, atualmente usados para reforço de materiais. Entretanto, as nanofibrilas de celulose apresentam-se mais vantajosas, pois são consideradas os materiais orgânicos mais abundantes do planeta, apresentam excelente dispersão na matriz com consequente transferência de carga para a mesma, e mantêm a integridade e a pureza. Soma-se a estas características primordiais, um custo bastante inferior, quando comparado ao nanotubo de carbono [12-15]. Considerando que os nanocompósitos de base biológica são a geração de materiais para o futuro e a originalidade do estudo da aplicação de microfibras e nanofibrilas de celulose em um material dentário restaurador, nosso objetivo foi modificar um cimento de ionômero de vidro convencional com microfibras e nanofibrilas obtidas da celulose de eucalipto, avaliar suas propriedades mecânicas, caracterizar os compósitos desenvolvidos e seus precursores e observar sua atividade antimicrobiana. 2. Metodologia 2.1. Cálculo amostral Para determinar o tamanho amostral (n), foi utilizada a fórmula de comparação de médias. Considerou-se nível de significância (Zα) e poder estatístico (Zβ) em 95% e 80%, respectivamente. A diferença (D) a ser detectada entre os grupos foi estipulada em 16. O valor referente ao desvio padrão (dp=11,49) foi obtido após estudo piloto. Acresceu-se 20% ao valor encontrado para prevenir eventuais perdas. Com isso, o mínimo a ser investigado foi 9,69. 2.2. Obtenção das microfibras de celulose As microfibras de celulose (mfC) foram preparadas com 6 g de fibras de celulose do eucalipto, processadas de acordo com Ferreira et al., 2006a [16] e 2006b [17]. O material foi pesado em balança analítica de precisão (Mettler Toledo, São Paulo, SP, Brasil) e misturadas à 250 ml de ácido clorídrico 44 à 37%. A mistura foi submetida a um agitador eletrônico de hélice (S32, Eurostar, Gehaka Ltda, São Paulo, SP) durante 2 h e, logo depois, a suspensão de aparência grumosa foi aquecida a 50°C durante 3 h, sob agitação constante, em agitador magnético (ARE, Velp Scientifica, Porto Alegre, RS, Brasil). A mistura esfriou-se à temperatura ambiente por 1 h. Em seguida, a suspensão foi filtrada e lavada com água destilada até que o pH ficasse equivalente ao da água destilada. O produto obtido foi adicionado a 200 ml de água destilada e levado a um sonicador (desruptor de células ultra-sônico) (modelo DE S500, UNIQUE, , Indaiatuba, SP, Brasil) por cinco ciclos de 2 min cada. A ponta de titânio do sonicador foi mergulhada na solução, respeitando-se a profundidade de 5 mm, sendo que no intervalo de cada ciclo a temperatura foi aferida. O material obtido foi congelado em nitrogênio líquido e mantido à temperatura de -50°C em freezer biológico, até o momento que foram concentradas em aparelho liofilizador (Liotop, Ind. Com. e Serv. de Liofilizadores, São Carlos, Brasil), onde permaneceram por 26 h. As mfC foram mantidas em geladeira. 2.3. Obtenção das nanofibrilas de celulose Uma celulose de eucalipto, após processo Kraft, contendo -celulose (96-98%), foi generosamente fornecida por uma empresa brasileira. A hidrólise da polpa de madeira do eucalipto foi realizada com ácido sulfúrico (Sigma-Aldrich Co., St. Louis, MO, USA) como descrito na literatura [18-20], com algumas modificações. Após obtenção de um pó fino, as partículas de celulose foram tratadas com solução de NaOH (Sigma-Aldrich Co., St. Louis, MO, USA) e, em seguida, um tratamento de branqueamento foi realizado utilizando solução tampão com ácido acético a 99% e ácido clorídrico (Sigma-Aldrich Co., St. Louis, MO, USA), (1,7% em peso em água). As fibras foram filtradas e enxaguadas com água desionizada, entre cada passo. Uma solução de 64% em peso de ácido sulfúrico foi adicionada às fibras, sob forte agitação mecânica, para preparar a dispersão de nanofibrilas de celulose da polpa branqueada. O processo de hidrólise foi realizado a 50°C durante cerca de 50 min. Em seguida, a dispersão foi diluída duas vezes e foi lavada três vezes com água desionizada por meio de centrifugação. A diálise contra água desionizada foi realizada até a dispersão atingir pH ~ 6. A dispersão foi ultrasonificada (Sonifier Cole Parmer, Derwood, Maryland, E.U.A.) durante cerca de 5 minutos e, finalmente, filtrada utilizando um filtro com poros de 20 m. A concentração final da dispersão de nanofibrilas de celulose (nfC) foi de aproximadamente 1% em peso. As nfC foram mantidas resfriadas. 2.4. Confecção dos corpos de prova Quantidades distintas de mfC, em peso, foram previamente preparadas e adicionadas ao líquido do CIV, durante sua manipulação, para preparo dos compósitos de cimento de ionômero de vidro modificado com mfC (CIVmfC), obtendo-se três grupos: G1- CIVmfC 0,005 g, G2- CIVmfC 0,010 g e G3- CIVmfC 0,015 g. Um grupo controle, GC- CIV, também foi obtido. Previamente ao preparo dos compósitos de cimento de ionômero de vidro modificado com nfC (CIVnfC), as nanofibrilas foram adicionados ao líquido do CIV em cinco concentrações diferentes e levados ao sonicador por 2 min para completa homogeinização. Corpos de prova (cps) com diferentes concentrações de nfC no total de sua massa foram confeccionados obtendo-se os grupos experimentais: G01- CIVnfC 1%, G02- CIVnfC 0,8%, G03- CIVnfC 0,6%, G04- CIVnfC 0,4% e G05- CIVnfC 0,2%. Os compósitos foram preparados respeitando a proporção pó:líquido de 1:1 e manipulados seguindo as recomendações do fabricante. Os cps foram armazenados em água destilada à temperatura de 37°C (±1ºC). 2.5. Avaliação da resistência à compressão, tração diametral e módulo de elasticidade Vinte cps de cada um dos grupos foram confeccionados em uma matriz de Teflon com 4 mm de diâmetro e 8 mm de comprimento, apoiada sobre uma placa de vidro. Para a confecção dos cps do GC o CIV foi manipulado e inserido no interior da matriz sob pressão, através de uma seringa específica (Centrix, DFL Ind., São Paulo, SP, Brasil). No preparo dos cps dos outros grupos o cimento foi 45 inserido com uma espátula de inserção e compactado com o auxílio de um condensador de amálgama. Após o preenchimento total da matriz, uma tira de poliéster foi pressionada sobre ela com um peso de 500 g, até atingir seu tempo de presa, a fim de se obter adequado escoamento e lisura superficial. Após 24 horas de armazenamento em água destilada, à temperatura de 37ºC (±1ºC), cps (n=10) de cada grupo foram submetidos ao teste de resistência à compressão em uma máquina de ensaio universal (EZ-L Test, Shimadzu, Kyoto, Japão) com célula de carga de 200 kgf na velocidade de 1 mm.min-1 e com seu longo eixo na posição vertical, até que ocorresse a fratura. Para o teste de resistência à tração diametral, cps (n=10) de cada grupo foram submetidos à mesma célula de carga, porém com velocidade de 0,5 mm.min-1 e com seu longo eixo na posição horizontal. O módulo de elasticidade apresentado pelos cps também foi obtido durante o ensaio de compressão e de tração diametral. Os resultados obtidos foram transformados em MPa. 2.6. Avaliação da microdureza superficial Cps (n=10), com 5mm de diâmetro e 3 mm de profundidade, de todos os grupos experimentais foram embutidos em tubo de policloreto de vinila clorado (CPVC), (AMANCO, São Paulo, SP, Brasil) e preenchidas com resina poliéster (Resina Cristal, Casa da Resina, Belo Horizonte, MG, Brasil). Cada grupo foi identificado com corantes para resina. As superfícies dos cps foram polidos em lixadeira e politriz metalográfica (Modelo PLFDV, Fortel, São Paulo, SP, Brasil), utilizando uma sequência de lixas de granulação 320, 400 e 600. Cada corpo de prova (cp) foi submetido a cinco impressões em sua superfície com 0,2 mm de distância entre cada indentação, através de uma ponta de diamante piramidal (Vickers), com uma carga de 300 gf por 15 s. O resultado final foi a média das cinco leituras realizadas, calculadas em número de dureza Vickers (VHN). 2.7. Avaliação da resistência ao desgaste Cps de 4x8 mm (n=10) de todos os grupos foram confeccionados, como anteriormente, e armazenados em água destilada por 14 dias, à temperatura de 37ºC (± 1ºC). Após secagem por 12 h à temperatura ambiente, os cps foram pesados em balança analítica e foram montados em dispositivo apropriado com capacidade para seis cps sobre lixa de granulação 800 na lixadeira e politriz metalográfica. Os cps foram submetidos a um ciclo do ensaio de desgaste por abrasão, utilizando carga de 100 g à velocidade de 100 rpm, durante 30 min, sob irrigação constante com água. A lixa utilizada foi substituída por uma nova a cada grupo de cinco cps. Depois do desgaste, os cps foram lavados em água destilada durante 3 min, sob agitação lenta, e secados por 12 h. Os cps foram pesados novamente, a fim de avaliar a quantidade de estrutura perdida por meio da ação mecânica. 2.8. Análise estatística Os resultados da avaliação das propriedades mecânicas foram analisados utilizando o software SPSS (Statistical Package for Social Sciences, IBM Inc., New York, NY, USA), versão 17.0, através de análise estatística descritiva. A normalidade e homogeneidade de variância dos dados coletados foram verificadas pelos testes Shapiro-Wilk e teste de Levene, respectivamente. Os dados coletados da avaliação de microdureza, resistência à compressão, à tração diametral e módulo de elasticidade foram submetidos à Análise de Variância e ao Teste de Tukey, adotando o nível de significância de 95% (p<0,050). Para o cálculo da porcentagem de perda de massa (X) foi aplicada a fórmula (Eq. 1): Eq.1 X= (100*(∆)) massa inicial sendo, ∆ = massa final – massa inicial. Em seguida, as porcentagens foram submetidas à Análise de Variância e ao Teste de Tukey (p<0,050). 2.9. Avaliação da atividade antimicrobiana 46 CIV, CIVmfC e CIVnfC foram avaliados in vitro quanto à sua atividade antimicrobiana, utilizando as bactérias Staphylococcus aureus (S. aureus) (ATCC 25923), Streptococcus mutans (S. mutans) (ATCC 25175), Escherichia coli (E. coli) (ATCC 25922), Pseudomonas aeruginosa (P. aeruginosa) (ATCC 27853), Enterococcus faecalis (E. faecalis ) (ATCC 292012) e uma levedura padrão, a Candida albicans (C. albicans) (ATCC 10231), em duplicata. Os meios de cultura foram: Muller Hinton Agar para o S. aureus, E. coli e P. aeruginosa; Tryptic Soy Agar para S. mutans e E. faecalis e Sabouraud Dextrose Agar para C. albicans. O controle-positivo (com atividade antimicrobiana) foi a solução de clorexidina 0,12% e o controle-negativo (sem atividade antimicrobiana) a solução de cloreto de sódio 0,85%. Os cps foram colocados sobre a camada base e cobertos com a camada seed, enquanto que 20 µl das soluções foram aplicados nos poços confeccionados com auxílio de canudos. As placas foram pré-incubadas à temperatura ambiente (25 ºC) por 2 h para permitir a difusão dos materiais e soluções no meio de cultura e, logo depois, foram incubadas a 37 ºC (±1ºC) por 24 h em aerobiose (S. aureus, E. coli e P. aeruginosa) ou microaerofilia (S. mutans e E. faecalis). Decorrido o período de incubação os halos de inibição dos crescimentos microbianos foram mensurados e expressos em milímetros, e submetidos às análises estatísticas. 2.10. Caracterização dos materiais 2.10.1. Microscopia eletrônica de varredura e Espectroscopia de energia dispersiva de raios-X O pó do CIV foi disperso em solução de 50% de álcool etílico e 50% de água destilada em uma lâmina de vidro e levado à estufa de secagem (FANEM, São Paulo, SP, Brasil). Pequenas quantidades de mfC e nfC foram imersas em água destilada por 30 min, sob leve agitação, e foram tratadas com concentrações crescentes (50, 70, 95 e 100%) de solução de acetona (Sigma-Aldrich Co., St. Louis, MO, USA). O pó, as fibras, e amostras representativas dos grupos experimentais do CIV e dos compósitos desenvolvidos foram recobertos com uma fina camada de ouro-paládio. Os materiais preparados foram observados através de microscopia eletrônica de varredura (MEV), usando feixe de elétrons de 10 a 15 kV (CS-3500, Shimadzu, Kyoto, Japão). A análise elementar qualitativa de microrregiões das amostras foi realizada, através de espectroscopia de energia dispersiva de raios-X (EDS), (CS3200, Oxford, Oxfordshire, Inglaterra). 2.10.2. Microscopia eletrônica de transmissão Uma suspensão de nanofibrilas de celulose foi obtida a partir de dispersão aquosa (0,01% m/v). As imagens das nanofibrilas foram realizadas através da microscopia eletrônica de transmissão (MET) no equipamento FEI Tecnai G2-Spirit (Hillsboro, Oregon, USA). O material foi depositado em uma grade de cobre de 300 mesh coberta com Formvar/Carbono. As amostras foram, subsequentemente, tratadas com acetato de uranila 2% para aumentar o contraste das microfibrilas à microscopia eletrônica de transmissão. 2.10.3. Difração de raios-X Amostras dos materiais de cada grupo foram submetidas à difração de raios-X (DRX), no difratômetro (modelo RXD6000 Shimadzu, Kyoto, Japão), com radiação monocromatizada KαCu (1,5406Aº) e tubo operacional com voltagem de 40 kV e corrente de 30 mA com velocidade de varredura e intervalo de 80o. 2.10.4. Espectroscopia de infravermelho por transformada de Fourier Espectros de amostras dos materiais foram obtidos com 32 varreduras, no intervalo entre 675 à 4000 cm-1, com resolução de 4 cm-1 e unidades de absorbância (abs), através de espectroscopia de infravermelho por transformada de Fourier (FTIR) pela técnica da reflectância total atenuada (ATR), (Nicolet 6700, Thermo Electron Scientific Instruments Corp., Madison, WI, USA). 3. Resultados 47 Houve diferença estatisticamente significativa de GC em relação a G1, G2 e G3 para o módulo de elasticidade durante o teste de resistência à compressão (p=0,029) e para o teste de microdureza (p=0,001). O teste post-hoc de Tukey mostrou diferença estatisticamente significativa para o módulo de elasticidade à compressão entre GC e G3 (p=0,016), (Tabela 1), e para o teste de microdureza entre G1 e G3 (p=0,002) e entre G2 e G3 (p=0,003), (Tabela 2). Houve diferença estatisticamente significativa de GC em relação a G01, G02, G03, G04 e G05 para os testes de resistência à compressão (p<0,001) e seu módulo de elasticidade (p<0,001), resistência à tração diametral (p=0,006), microdureza (p<0,001) e resistência ao desgaste (p=0,017). O teste posthoc de Tukey para o teste de resistência à compressão mostrou diferença estatística significativa (p<0,001) entre GC e G04, G01 e G04, G02 e G04, G03 e G04, e G04 e G05. Quanto à resistência à tração diametral houve diferença estatisticamente significativa entre GC e G05 (p=0,013) e G03 e G05 (p=0,017). Para o módulo de elasticidade durante o teste de resistência à compressão, mostrou diferença estatisticamente significativa (p<0,001) entre GC e todos os outros grupos (Tabela 1). O teste post-hoc de Tukey para o teste de microdureza mostrou diferença estatisticamente significativa entre GC e todos os outros grupos: GC e G01 (p=0,001), GC e G02 (p=0,001), GC e G03 (p<0,001), GC e G04 (p<0,001) e GC e G05 (p<0,001). Houve diferença estatisticamente significativa para a resistência ao desgaste entre G01 e G04 (p=0,009), (Tabela 2). As médias e desvios-padrão de cada um dos grupos de CIVmfC e CIVnfC em relação a CIV (controle), quanto a todos os testes realizados, podem ser visualizados nas tabelas 1 e 2. As micrografias de MEV da fibra de celulose do eucalipto original mostraram um aglomerado de fibras longas, de forma cilíndrica (fig. 1A) e aspecto rugoso, com a presença de estrias e lacunas em toda sua extensão (fig. 1B). As mfC apresentaram-se com tamanho heterogêneo e características semelhantes às fibras originais (fig. 1C e 1D). Algumas delas não mantiveram a forma cilíndrica, apresentaram aspecto laminar (fig. 1D). Na micrografia de MEV as nfC mostraram-se em forma de placas de diferentes tamanhos (fig. 1E) e na micrografia de MET apresentou-se como nanocristais individuais, de tamanho uniforme, e alguns agregados (fig. 1F). A partir de várias outras imagens de MET, os valores médios do comprimento e do diâmetro dos nanocristais isolados foram determinados como sendo 145 (± 25 nm) e 6 (± 1,5 nm), respectivamente, apresentando uma razão de forma aproximada de 24. Nas micrografias de MEV o pó do CIV mostrou-se constituído de partículas irregulares (fig. 2A). Em amostras representativas dos compósitos (fig. 2) observou-se a morfologia do CIV (GC) com matriz envolvendo partículas de tamanho heterogêneo e a presença de algumas bolhas (fig. 2B). As superfícies de fratura de compósitos CIVmfC com 0,010 g de mfC (G2) mostraram presença de mfc e partículas de vidro na matriz do cimento ionomérico modificado (fig. 2C e 2D). A superfície de CIVnfC 0,4% (G04) mostrou nfC de tamanho uniforme e com distribuição aleatória na matriz gelatinosa (fig. 2E). As nfC mostraram-se interligadas, além de aderidas também às partículas de carga do CIV (fig. 2F). Os espectros de EDS das mfC e nfC foram similares ao das macrofibras de celulose (fig. 1A), que mostraram picos de alta intensidade de Carbono (C) e Oxigênio (O) correspondentes à constituição da celulose. O espectro de EDS do pó de CIV (fig. 2A) apresentou picos de alta intensidade de Cálcio (Ca), Flúor (F), Alumínio (Al) e Silício (Si). O espectro de CIV mostrou os mesmos picos do espectro do pó correspondentes à sua carga inorgânica, além de picos de C e O da matriz orgânica do cimento. Os espectros de CIVmfC e de CIVnfC apresentaram o mesmo padrão do espectro do CIV. Picos de Ouro e de Paládio, provenientes da metalização dos materiais, também podem ser visualizados, entretanto não foram identificados nos espectros. A estrutura das fibras e dos compósitos foi analisada pelos espectros gerados pela DRX (fig. 3). Na análise qualitativa de DRX das fibras de celulose originais observou-se que seu difratograma mostrou características típicas de um material com fase amorfa e cristalinidade parcial. Os difratogramas das microfibras e, principalmente, das nanofibrilas indicaram diminuição da fase amorfa (fig. 3A). Os compósitos CIVmfC (G1 a G3) apresentaram grande halo nos difratogramas correspondente à fase amorfa, similar àquele do difratograma do cimento ionomérico (GC), (fig. 3B). Os compósitos CIVnfC também mostraram difratogramas característicos, com grande quantidade de material amorfo, como o CIV (GC), com exceção de G04, que praticamente não apresentou fase amorfa e mostrou pico cristalino de baixa intensidade (fig. 3C). 48 Nos espectros de FTIR da fibra de celulose original (fig. 4) observou-se a presença de bandas de absorção referentes aos grupamentos –0H, em 3409, 3339 e 3276 cm-1; banda referente a –CH3 dos grupamentos metílicos em 2896 cm-1; bandas em 1428 cm-1 dos grupamentos metilênicos (–CH2); bandas em 1370 e 1278 cm-1 referentes a C–H; bandas 1337 e 1206 cm-1 correspondentes a C–OH; e das bandas 1161, 1065 e 1034 cm-1correspondentes aos grupamentos C–O–C da estrutura sacarídea, atribuída a celulose e hemicelulose. As mfC e nfC apresentaram o mesmo padrão de espectros de FTIR da fibra de celulose original. O espectro de FTIR do pó de CIV mostrou banda intensa dos grupamentos COO-, correspondente à presença de ácido poliacrílico liofilizado no pó. O compósito CIV (GC) mostrou bandas dos grupamentos Si–OH livres em 3650 e 3680 cm-1 e Si–OH em 3200 e 3450 cm-1 referentes à água absorvida e/ou referentes a ligações de H aos grupos Si–OH; bandas referentes aos grupamentos C–O em 1637 cm-1; dos grupamentos COO-(n+)(n = Al3+ e Ca2+) em 1585 cm-1 e de COO-Ca+ em 1456 e 1410 cm-1; de Si–OH em 957 a 970 cm-1; e de Si–O–Si em 800 a 810 cm-1. Nos espectros dos compósitos mfC (G1, G2 e G3) e dos compósitos nfC (G01, G02, G03, G04 e G05) observou-se bandas de absorção características de seus materiais precursores. Zonas de inibição não foram observadas nos compósitos CIVmfC e CIVnfC frente a todos os microrganismos utilizados na atividade antimicrobiana. Os compósitos desenvolvidos mostraram o mesmo comportamento do CIV, não apresentando halo de inibição frente aos microrganismos analisados. Já a Clorexidina (controle positivo) apresentou halo de inibição frente a Staphylococcus aureus (14 mm), Streptococcus mutans (16,5 mm), Enterococcus faecalis (14 mm), Escherichia coli (15,5 mm), Pseudomonas aeruginosa (6 mm) e Candida albicans (6 mm). 4. Discussão As propriedades finais dos cimentos ionoméricos são diretamente influenciadas pela proporção pó:líquido, de acordo com a norma ISO 9917-1:2007 [21] e, principalmente, pelas características intrínsecas do agente de reforço e não apenas pelo aumento do seu teor de carga [22-24]. Um aumento da viscosidade desses cimentos pode aumentar sua resistência final, entretanto, pode interferir negativamente na sua manipulação, tempo de trabalho, tempo de presa e adesão [27,28]. Sabe-se que o sucesso no desenvolvimento ou modificação de compósitos depende do equilíbrio entre as propriedades físico-químicas originais e aquelas com desempenho superior às de seus componentes formadores. Para tal, torna-se necessário encontrar uma concentração ideal de fibras, diminuindo assim a friabilidade dos compósitos [10,25,26]. O acréscimo de fibras na constituição do cimento aumentou a resistência dos compósitos desenvolvidos, tanto nos modificados por microfibras (G1 e G2) como em todos aqueles modificados por nanofibrilas, que não apresentaram dificuldades quanto à aglutinação e tempo de trabalho, respeitando as características clínicas relevantes do material. Apenas a concentração de fibras adicionadas na matriz do G3 aumentou negativamente sua viscosidade. Uma concentração excessiva de fibras, de um modo geral, não melhora as propriedades mecânicas do compósito, ao contrário, funcionam como um ponto crítico para a resistência final do material [29]. Nos testes avaliados neste estudo, os resultados encontrados nos compósitos CIVmfC não diferiram daqueles do CIV, exceto no G3 que apresentou aumento significativo do módulo de elasticidade à compressão. Provavelmente, tanto no G3 como nos outros grupos, que também apresentaram os módulos de elasticidade à compressão e tração aumentados, a adição de fibras ocasionou um aumento da sua energia interna, suportando força maior que a do CIV até o seu limite de proporcionalidade. Entretanto, as concentrações usadas nos compósitos CIVmfC não contribuíram para melhorar as demais propriedades finais dos mesmos. Isto pode estar associado à estrutura mais compacta das mfC com diminuição da área de superfície, dificultando a interação da celulose com os componentes da matriz e a consequente capacidade de transmissão de forças [16,17]. Resultados diferentes foram relatados por Silva et al., 2013 [10], que encontraram aumento no valor de resistência à compressão e ao desgaste de CIV modificado com três concentrações de macrofibras celulósicas. Estas, por apresentarem estrutura oca, foram preenchidas pela matriz ionomérica, ocorrendo maior facilidade de interação entre seus componentes e os do cimento. Neste estudo, as menores concentrações de nfC acrescidas aos compósitos foram responsáveis pelos melhores resultados de resistência. O aumento do módulo elástico se deve puramente ao fato da incorporação de nanofibrilas de celulose que exibem um módulo de elasticidade de 120-150 GPa [30]. Dentre os grupos de compósitos CIVnfC, o G04 apresentou resistência à compressão equivalente a um 49 cimento modificado por resina [31] e o G05 aumentou significativamente a tração diametral do compósito, que apresentou resultados muito superiores à cimentos ionoméricos de alta viscosidade [32,33]. Isto pode ser explicado pela natureza significativa de auto associação das nanofibrilas de celulose, o que é vantajoso para a formação de arquiteturas de suporte de carga de percolação dentro da matriz cimentícea, pois apresentam a formação de redes de nanofibrilas rígidas em que a transferência de esforço é facilitada pela ligação do hidrogênio entre elas [34], além da presença de interações de van der Waals [35]. Uma das maiores desvantagens dos cimentos ionoméricos restauradores convencionais é o fato de apresentarem baixa resistência à abrasão e tração diametral, principalmente quando comparados a outros materiais restauradores como resina composta, amálgama e os próprios cimentos ionoméricos modificados por resina. Desse modo evita-se seu uso em restaurações sujeitas a grandes áreas de desgaste e alto esforço mastigatório [25]. O aumento da resistência à tração diametral de materiais friáveis, como o CIV, é extremamente difícil [33,36]. Portanto, o aumento dessa propriedade nos compósitos desenvolvidos neste estudo é um grande achado clínico, visto que os cimentos ionoméricos devem ser suficientemente fortes para resistir aos esforços gerados no interior de sua estrutura, quando carregados com forças oclusais mastigatórias. Apesar de melhorar as propriedades finais de modo geral, percebeu-se que o acréscimo de pequena quantidade de nfC, foi responsável pelo menor desgaste apresentado pelos compósitos CIVnfC em relação ao CIV. Fato semelhante foi observado no teste de microdureza, no qual o acréscimo de uma menor quantidade de nfC no G05 não interferiu no seu valor de microdureza Vickers, diferente daqueles valores apresentados com a adição de concentrações maiores. O resultado de maior dureza superficial apresentado por G05 e de menor desgaste apresentado pelo G05 e pelo G04, embora não estatisticamente significativo, pode ser explicado pela presença de um número maior de partículas de vidro na superfície desses compósitos. Por outro lado, o acréscimo de quantidades mais elevadas de nfC diminuiu os valores de microdureza e de resistência ao desgaste, devido ao enfraquecimento do compósito [37] pela presença de maior quantidade de fibras na superfície [38]. De forma simplificada, pode-se inferir que a dureza, apesar de não ser uma propriedade intrínseca de um material dentário, é a mensuração da sua resistência à penetração e pode ser considerada um indicativo direto da sua resistência ao desgaste na cavidade bucal [25]. Por ser um material friável, o teste padrão mais indicado para verificação da dureza do cimento inomérico é a dureza Vickers. Entretanto, com o aumento de fibras na superfície dos novos compósitos modificados e aumento do seu módulo de elasticidade à tração diametral, novo estudo usando o teste de dureza Knoop pode ser mais interessante, uma vez que este desconsidera a possível deformação elástica que o material pode apresentar durante a penetração por um indentador de diamante [25]. Talvez seja também mais adequada a avaliação da nanodureza, e não microdureza, dos compósitos modificados com nfC [39]. Em comparação com as fibras de celulose originais, o método de obtenção utilizado modificou a superfície das mfC pela diminuição de seu tamanho, como também proporcionou a abertura do seu formato cilíndrico macro. Entretanto, a análise das micrografias de MEV juntamente com as outras caracterizações realizadas não mostrou indícios de maior interação das mfC com a matriz cimentícea, do CIV. Apesar da diminuição das mfC, o tratamento químico não foi suficiente para a quebra da sua estrutura macrofibrilar e microfibrilas. Assim, os compósitos modificados com as concentrações de mfC utilizadas neste estudo, mesmo com a capacidade de apresentar massa de cimento estável e viscosidade adequada para compactação, não se apresentaram como uma boa alternativa para a modificação do CIV. O formato laminar bem fino das nfC, também relatado por Peng et al., 2012 [40], facilitou sua dispersão homogênea no líquido do CIV e sua inserção e distribuição mais uniforme em toda a massa cimentícea. As micrografias de MEV dos compósitos CIVnfC mostraram um agregado fibrilar de nanopartículas entremeadas na matriz do CIV, conferindo-lhe aspecto de ''teia'' e sugerindo a formação de um único complexo, o que nos remete à completa interação das nanofibrilas com a matriz cimentícea e suas partículas de pó não atacadas. Nos compósitos CIVnfC observou-se formação dessa trama envolvendo nanofibrilas, matriz cimentícea e partículas de carga, sendo que a distribuição de nfC na massa de CIV mostrou-se mais homogênea no compósito CIVnfC 0,4%. A concentração usada nestes compósitos pode ter propiciado uma interação ideal entre os próprios cristais e com a massa cimentícea durante sua reação química, com a formação de uma real rede de reforço, considerando que 50 o tratamento com ácido sulfúrico proveu a superfície das fibras com grandes quantidades de grupamentos COO-. O aparecimento de agregados com cristais unidos lateralmente nas imagens de MET provavelmente resulta em diminuição da área superficial e fortes ligações de hidrogênio estabelecidas entre os nanocristais. Estes agregados podem se formar em suspensão e feixes de cristais podem ser ainda mais numerosos, quando o meio de dispersão é removido, como no caso da preparação da amostra para MET [41]. Entretanto, sua dispersão em meio polar torna-se facilitado pelas suas características superficiais, devido ao ácido sulfúrico usado na hidrólise. A mistura, composição, e dispersão uniforme em não-polares ainda é desafiador [26,42]. A adição das nfC ao líquido do CIV se mostrou uma excelente alternativa, com dispersão completa e homogênea, visto que não interferiu na fluidez do líquido e no tempo de trabalho do cimento, fatores clínicos extremamente relevantes. A análise qualitativa por difração de raios-X é um poderoso método de análise química, considerando que toda estrutura cristalina possui um padrão de difração e que a mesma substância sempre apresenta o mesmo modelo [43]. Assim, de acordo com relatos da literatura, na análise dos difratogramas dos materiais estudados observou-se que a celulose [44] e o cimento de ionômero de vidro [45] apresentaram picos padronizados. A presença de grande quantidade de fase amorfa no difratograma das fibras de celulose originais deve-se à sua natureza polimérica, que mostrou características típicas do grupo denominado celulose I de estrutura alomórfica, constituinte básico das fibrilas de celulose da madeira [46]. Nos difratogramas apresentados pelas mfC e, mais especificamente, pelas nfC observou-se uma maior cristalinidade, que está relacionada com a quebra das ligações químicas das hemiceluloses e os nanocristais, após tratamento químico das fibras. Apesar do CIV apresentar partículas de carga, que são partículas de vidro, a partir do ataque do ácido poliacrílico às suas superfícies durante sua reação de presa, há formação de grande quantidade de gel de sílica. Esta matriz orgânica circunda as partículas atacadas e envolve as partículas do pó de CIV não atacadas. Assim, o difratograma de CIV (GC) mostrou-se também característico de material amorfo. Os compósitos desenvolvidos, consequentemente, apresentaram o mesmo padrão de difratogramas mostrado para a celulose e CIV. Apenas G04 apresentou difratograma de material cristalino, com alguns picos de baixa intensidade, mas bem definidos, fato que pode estar relacionado com a concentração de 0,4% de nfC no total da massa do CIV, devido a uma maior interação química. Os gráficos resultantes da energia absorvida pela amostra em razão do número de onda em que esta energia foi absorvida são representados pelo espectro de FTIR. A estrutura molecular da celulose e dos compósitos desenvolvidos apresentou excitações vibracionais resultantes das ligações covalentes dos grupos funcionais específicos presentes nos materiais [47]. As mfC e nfC mantiveram características primordiais do CIV e das fibras de celulose originais. Neste estudo não foi possível identificar nenhuma ligação química diferente nos novos compósitos, apesar do tratamento químico das mfC e nfC durante sua preparação. Neste estudo observou-se que os compósitos com a presença de fibras comportaram-se da mesma forma que o CIV, nenhum dos grupos apresentou atividade antimicrobiana. Provavelmente, o deslocamento de íons como, F-, Na+, Ca+2 e Al+3, com possível liberação para o meio, não influenciou na atividade antimicrobiana em nenhum dos grupos avaliados. Ao contrário dos resultados relatados em outros estudos [48,49], o CIV apresentou atividade antimicrobiana frente aos diversos microrganismos estudados. Talvez este fato esteja relacionado com a metodologia empregada, pois os autores testaram os cimentos imediatamente após a manipulação, através da “técnica do poço”. Isto propicia maior superfície de contato e, consequentemente, maior difusão, favorecendo assim a formação de halos de inibição com diâmetros maiores. Outro estudo [50] atribuiu à atividade antimicrobiana ao fluoreto que é libertado dentro de um curto intervalo de tempo. Por conseguinte, o desenvolvimento de novos cimentos ionoméricos com propriedades antibacterianas é essencial para obtenção de benefícios terapêuticos que possam aumentar a longevidade das restaurações. A Odontologia tem focado em diferentes tecnologias para o desenvolvimento de novos materiais restauradores [51]. Com esse objetivo, o uso de fibras celulósicas, em especial microfibras e nanofibrilas de celulose de eucalipto vão de encontro a essa idéia de desenvolvimento de biomateriais, biotecnologia e desenvolvimento sustentável [12,13,15]. A cárie dentária e seus efeitos continuam a ser um sério problema de saúde pública, apresentando uma elevada incidência na população mais necessitada que não tenha acesso ao tratamento curativo ou preventivo em nosso país [2]. No Brasil, é responsável pela perda de dentes em toda a população, 51 independentemente da idade, com uma tendência maior em população de baixa renda [52]. O Tratamento Restaurador Atraumático (TRA) constitui um excelente exemplo da filosofia da Dentística Minimamente Invasiva (DMI), diferindo-se de suas demais abordagens operatórias por fazer uso unicamente de instrumentos manuais tanto para escavação da dentina quanto para a ampliação do acesso à cavidade [1,3]. No entanto, no Brasil, o custo elevado dos cimentos de ionômero de vidro indicados para esta técnica limita sua aplicação. O uso do CIV modificado por fibras nas indicações e técnicas corretas do TRA pode alcançar a simplificação do procedimento restaurador, somado aos benefícios sociais. Dessa forma, será possível aumentar a cobertura de uma população não assistida, auxiliando na redução das perdas dentárias. Outro resultado esperado refere-se ao custo-benefício do TRA com o uso do CIV modificado com fibras, o que deverá proporcionar sua aceitação por parte de uma comunidade assistida nos moldes convencionais de intervenção odontológica, favorecendo sua utilização como uma estratégia de controle da cárie dentária no sistema de saúde pública. O futuro dos cimentos ionoméricos modificados com fibras celulósicas depende de mais estudos como o teste de biocompatibilidade e testes clínicos para o total entendimento das propriedades e características desses materiais, sobretudo em ambiente bucal. 5. Conclusões De um modo geral, a adição de microfibras celulósicas no CIV não melhorou suas propriedades mecânicas. A adição de nanofibrilas de celulose na concentração de 0,4% no CIV (G04) apresentou significativo aumento da resistência à compressão e melhor performance frente às propriedades de resistência à tração diametral e ao desgaste. A adição de nanofibrilas de celulose na concentração de 0,2% no CIV (G05) apresentou a mais significativa resistência à tração diametral. Os compósitos apresentaram-se estáveis, com morfologia, estrutura e composição química elementar semelhantes aos seus materiais precursores. A formação de novas estruturas cristalinas ou novas ligações químicas não foram detectadas neste estudo. Nos compósitos CIVnfC observou-se formação de uma trama envolvendo nanofibrilas, matriz cimentícea e partículas de carga, sendo que a distribuição de nfC na massa de CIV mostrou-se mais homogênea no compósito CIVnfC 0,4%. Todos os compósitos desenvolvidos mostraram atividade antimicrobiana similar à do CIV, não apresentando halo de inibição frente aos microrganismos analisados. A modificação do cimento de ionômero de vidro convencional com nanofibrilas de celulose resultou em um novo e promissor biomaterial restaurador dentário. Agradecimentos Os autores agradecem ao Laboratório Multiusuário de Microscopia Avançada – LMMA (FAPEMIG-Processo CEX 112/10) do Departamento de Química/UFVJM pela obtenção dos espectros de DRX e a CAPES, SECTES/FAPEMIG e CNPq pelo apoio financeiro. 6. Referências 1. Massoni ACLT, Pessoa CP, Oliveira AFB. Tratamento restaurador atraumático e sua aplicação na saúde pública. Revista de odontologia da UNESP 2006; 35: 201-207. 2. Frencken JE. The ART approach using glass-ionomers in relation to global oral health care. Dental materials 2010; 26: 1-6. 3. Frencken JE, Leal SC. The correct use of the ART approach. Journal of applied oral science 2010; 18: 1-4. 4. Algera TJ, Kleverlaan CJ, Prahl-Andersen B, Feilzer AJ. The influence of environmental conditions on the material properties of setting glass-ionomer cements. Dental materials 2006; 22: 852-6. 5. Zhao J, Xie D. Effect of Nanoparticles on wear resistance and surface hardness of a dental glassionomer cement. Journal of composite materials 2009; 43: 2739-52. 6. Turbak AF, Snyder FW, Sandberg KR. Microfibrillated cellulose, a new cellulose product: properties, uses, and commercial potential. Journal of composite materials 1983; 37: 815-827. 52 7. Reddy N, Yang Y. Biofibers from agricultural byproducts for industrial applications. Trends in biotechnology 2005; 23: 22-27. 8. Jústiz-Smith NG, Junior Virgo G, Buchanan VE. Potencial of Jamaican banana, coconut coir and bagasse fibres as composite materials. Materials characterization 2008; 59: 1273-78. 9. Zhang X, Huang J, Chang PR, Li J, Chen Y, Wang D, et al. Structure and properties of polysaccharide nanocrystal-doped supramolecular hydrogels based on cyclodextrin inclusion. Polymers 2010; 51: 4398–4407. 10. Silva RM, Santos PHN, Souza LB, Dumont VC, Soares JA, Santos MH. Effects of cellulose fibers on the physical and chemical properties of glass ionomer dental restorative materials. Materials research bulletin 2013; 48: 118–126. 11. Beecher J F. Organic materials: Wood, trees and nanotechnology. Nature nanotechnology 2007; 2: 466–467. 12. Vila C, Romero J, Francisco JL, Garrote G, Parajo´ JC. Extracting value from Eucalyptus wood before kraft pulping: effects of hemicelluloses solubilization on pulp properties. Bioresource technology 2011; 102: 5251-4. 13. Coleman JN, Khan U, Gun'ko YK. Mechanical Reinforcement of Polymers Using Carbon Nanotubes. Advanced materials 2006; 18: 689–706. 14. Saito T, Kimura S, Nishiyama Y, Isogai A. Cellulose Nanofibers Prepared by TEMPO-Mediated Oxidation of Native Cellulose. Biomacromolecules 2007; 8: 2485-2491. 15. Ajayan PM, Tour JM. Nanotube Composites. Nature 2007; 447: 1066–1068. 16. Ferreira CR, Fantini Junior M, Colodette J, Gomide JL, Carvalho AMML. Avaliação tecnológica de clones de eucalipto: parte I - qualidade da madeira para produção de celulose Kraft. Scientia forestalis 2006a; 70: 161-170. 17. Ferreira CR, Fantini Junior M, Colodette J, Gomide JL, Carvalho AMML. Avaliação tecnológica de clones de eucalipto: parte II - qualidade da celulose branqueada Kraft para papel de imprimir e escrever. Scientia forestalis 2006b; 71: 09-18. 18. De Rodriguez NLG, Thielemans W, Dufresne A .Sisal cellulose whiskers reinforced polyvinyl acetate nanocomposites. Cellulose 2006; 13: 261–270. 19. De Mesquita JP, Patricio PS, Donnici C. Hybrid layer-by-layer assembly based on animal and vegetable structural materials: multilayered films of collagen and cellulose nanowhiskers. Soft matter 2011; 7: 4405–4413. 20. Brito BSL, Pereira FV, Putaux JL, Jean B. Preparation, morphology and structure of cellulose nanocrystals from bamboo fibers. Cellulose 2012; 19: 1527-1536. 21. International Organization of Standardization. Dental-Water-Based Cements ISO No. 99171:2007;1-22. 22. Hill RG, Wilson AD, Warrens CP. The influence of poly(acrylic acid) molecular weight on the fracture toughness of glass-ionomer cements. Journal of materials science 1989; 24: 363–71. 23. Bertolini MJ, Zaghete MA, Gimenes R, Padovani GC. Determination of the properties of an experimental glass polyalkenoate cement prepared from niobium silicate powder containing fluoride. Dental materials 2008; 24: 124-8. 24. Mount GJ. Clinical performance of glass-ionomers. Biomaterials 1998; 19:573-9. 25. Samir MASA, Alloin F, Dufresne A. Review of recent research into cellulosic whiskers, their properties and their application in nanocomposite field. Biomacromolecules 2005; 6: 612–626. 26. Oksman K, Mathew AP, Bondeson D, Kvien I. Manufacturing process of cellulose whiskers/polylactic acid nanocomposites. Composites science and technology 2006; 66: 2776–2784. 27. Billington RW, Williams LA, Pearson GJ. Variation in powder/liquid ratio of a restorative glassionomer cement used in dental practice. Brazilian dental journal 1990; 169: 164-7. 28. Zahra VN, Kohen SG, Macchi RL. Powder-liquid ratio and properties of two restorative glass ionomer cements. Acta odontológica latinoamericana 2011; 24: 200-4. 29. Chinga-Carrasco G, Yu Y, Diserud O. Quantitative electron microscopy of cellulose nanofibril structures from Eucalyptus and Pinus radiata kraft pulp fibers. Microscopy and microanalysis 2011; 17: 563-71. 30. Sturcova A, Davies JR, Eichhorn SJ. Elastic modulus and stress-transfer properties of tunicate cellulose whiskers. Biomacromolecules 2005; 6: 1055-61. 53 31. Mallmann A, Ataíde JCO, Amoedo R, Rocha PV, Jacques LB. Compressive strength of glass ionomer cements using different specimen dimensions. Brazilian oral research 2007; 21: 204-8. 32. Fonseca RB, Branco CA, Quagliatto PS, Gonçalves LS, Soares CJ, Carlo HL, Correr-Sobrinho L. Influence of poder/liquid ratio on the radiodensity and diametral tensile strength of glass ionomer cements. Journal of applied oral science 2010; 18: 577-84. 33. Yap AU, Pek YS, Cheang P. Physico-mechanical properties of a fast-set highly viscous GIC restorative. Journal of oral rehabilitation 2003; 30: 1-8. 34. Capadona JR, Shanmuganathan K, Tyler DJ, Rowan SJ, Weder C. Stimuli-responsive polymer nanocomposites inspired by the sea cucumber dermis. Science 2008; 319: 1370-4. 35. Wågberg L, Decher G, Norgren M, Lindstro¨m T, Ankerfors M, Axns KJ. The Build-Up of Polyelectrolyte Multilayers of Microfibrillated Cellulose and Cationic Polyelectrolytes. Langmuir 2008; 24: 784-795. 36. Yamazaki T, Schricker SR, Brantley WA, Culbertson BM, Johnston W. Viscoelastic behavior and fracture toughness of six glass-ionomer cements. The journal of prosthetic dentistry 2006; 96: 266-72. 37. Prentice LH, Tyas MJ, Burrow MF. The effect of ytterbium fluoride and barium sulphate nanoparticles on the reactivity and strength of a glass-ionomer cement. Dental materials 2006; 22: 746–751. 38. Elsaka SE, Hamouda IM, Swain MV. Titanium dioxide nanoparticles addition to a conventional glass-ionomer restorative: Influence on physical and antibacterial properties. Journal of dentistry 2011; 39: 589–598. 39. Byung-Dong H, Jung-Min L, Dong-Soo P, Jong-Jin C, Ryu J, Woon-Ha Y, Byoung-Kuk L, DuSik, Hyoun-Ee K. Mechanical and in vitro biological performances of hydroxyapatite–carbon nanotube composite coatings deposited on Ti by aerosol deposition. Acta biomaterialia 2009; 5: 3205– 3214. 40. Peng Y, Gardner DJ, Han Y. Drying cellulose nanofibrils: in search of a suitable method. Cellulose 2012; 19: 91–102. 41. Elazzouzi-Hafraoui S, Nishiyama Y, Putaux JL, Heux L, Dubreuil F, Rochas C.The shape and size distribution of crystalline nanoparticles prepared by acid hydrolysis of native cellulose. Biomacromolecules 2008; 9: 57–65. 42. Zhang Y, Lim CT, Ramakrishna S, Huang ZM. Recent development of polymer nanofibers for biomedical and biotechnological applications. Journal of materials science 2005; 16: 933-946. 43. Cullity BD, Stock SR. Elements of X-ray diffraction. New Jersey: Prentice Hall, 2001. 44. de Mesquita JP, Donnici CL, Pereira FV. Biobased Nanocomposites from Layer-by-Layer Assembly of Cellulose Nanowhiskers with Chitosan. Biomacromolecules 2010, 11: 473–480. 45. Tomlinson SK, Ghita OR, Hooper RM, Evans KE. Investigation of the dual setting mechanism of novel dental cement using infrared spectroscopy. Vibrational spectroscopy 2007, 45: 10-7. 46. Saito T, Hirota M, Tamura N, Kimura S, Fukuzumi H, Heux L, Isogai A. Individualization of Nano-Sized Plant Cellulose Fibrils by Direct Surface Carboxylation Using TEMPO Catalyst under Neutral Conditions. Biomacromolecules 2009, 10: 1992–1996. 47. Pavia DL, Lampman GM, Kriz GS, Vyvyan JR. Introduction to spectroscopy. Estados Unidos: Cengage Learning, 2009. 48. Yap AU, Khor E, Foo SH. Fluoride release and antibacterial properties of new-generation toothcolored restoratives. Operative dentistry 1999; 24: 297–305. 49. da Silva RC, Zuanon AC, Spolidorio DM, Campos JA. Antibacterial activity of four glass ionomer cements used in atraumatic restorative treatment. Journal of materials science 2007; 18: 1859-62. 50. Lewinstein I, Matalon S, Slutzkey S, Weiss EI. Antibacterial properties of aged dental cements evaluated by direct-contact and agar diffusion tests. Journal of materials science 2005; 93: 364–371. 51. Jiang L, Morelius E, Zhang J, Wolcott M, Holbery J. Study of the Poly(3-hydroxybutyrate-co-3hydroxyvalerate)/Cellulose Nanowhisker Composites Prepared by Solution Casting and Melt Processing. Journal of composite materials 2008; 42: 2629–2645. 52. Caldas Júnior AF, Marcenes W, Sheiham A. Reasons for tooth extraction in a Brazilian population. International dental journal 2000; 50: 267-73. 54 Legenda Tabela 1 – Médias, desvios-padrão e significância estatística de resultados dos testes de resistência à compressão, módulo de elasticidade à compressão, resistência à tração diametral e módulo de elasticidade à tração para os grupos de corpos de prova dos compósitos CIV (GC), CIVmfC (G1 a G3) e CIVnfC (G01 a G05). Tabela 2 – Médias, desvios-padrão e significância estatística de resultados dos testes de microdureza e resistência ao desgaste para os grupos de corpos de prova dos compósitos CIV (GC), CIVmFC (G1 a G3) e CIVnfC (G01 a G05). Figura 1 – Micrografias de MEV das fibras de celulose originais (A e B) e respectivo espectro de EDS (A). As setas indicam a presença de lacuna e estrias na fibra celulósica. Micrografias de MEV das mfC (C e D) e das nfC (E) e micrografia de MET das nfC (F). Figura 2 – Micrografias de MEV do pó de CIV (A) e dos compósitos CIV - GC (B), CIVmfC - G2 (C e D), CIVnfC - G04 (E e F) e seus respectivos espectros de EDS. As setas indicam a presença de microfibras (C e D) e de nanofibrilas (F) nos compósitos. Figura 3 – Difratogramas das fibras de celulose originais, mfC e nfC (A); dos compósitos CIV (GC) e CIVmfC (G1 a G3), (B); e dos compósitos CIV (GC) e nfC (G01 a G05), (C). Figura 4 – Espectros de FTIR das fibras celulósicas originais, mfC, do pó de CIV, dos compósitos CIV (GC) e dos compósitos CIVmfC (G1 a G3), com bandas vibracionais características de seus grupamentos químicos (A). Espectros de FTIR das fibras celulósicas originais, nfC e dos compósitos CIV (GC) e CIVnfC (G01 a G05). 55 Tabela 1 Compósito Grupo Resistência à compressão (MPa) Média (DP) CIV CIVmFC CIV CIVnfC *Teste p* GC G1 G2 49,15 (46,00) 60,42 (11,49) 59,91 (19,57) G3 64,93 (24,90) GC G01 G02 G03 G04 49,15 (46,00) 53,68 (24,90) 61,81 (14,32) 74,30 (18,86) <0,001 103,22 (26,42) G05 57,57 (17,46) PostHoc** Módulo de Elasticidade à compressão (MPa) Média (DP) 512,61 (205,61) 825,77 (410,25) 830,04 (420,87) 0,173 p* 0,029 Módulo de Elasticidade à tração (MPa) Resistência à tração diametral (MPa) PostMédia (DP) Hoc** A 28,27 (14,27) AB 36,03 (9,04) AB 28,12 (10,77) 1084,36 (491,60) B 28,84 (12,48) A A A A B 512,61 (205,61) 1268,94 (89,93) 1142,46 (305,54) 1370,34 (223,19) <0,001 1337,75 (215,32) A B B B B 28,27 (14,27) 39,55 (9,73) 37,57 (9,82) 28,86 (9,73) 43,16 (14,39) A 1321,03 (532,81) B 48,52 (15,98) p* PostHoc** Média (DP) 1437,92 (268,52) 1598,79 (152,15) 1638,93 (64,31) 0,493 p* 0,319 1596,77 (259,41) 0,006 A AB AB A AB 1437,92 (268,52) 2009,92 (268,51) 1894,15 (169,89) 1879,47 (197,95) 1783,64 (475,05) B 1994,13 (532,81) ANOVA (p<0,050). **Teste de Tukey. Letras diferentes indicam que houve diferença estatisticamente significante (p<0,050), em relação aos compósitos. 0,067 56 Tabela 2 Microdureza Vickers (VHN) Compósito Grupo Média (DP) CIV CIVmFC CIV CIVnfC p* G2 42,92 (6,22) 50,80 (5,30) 50,16 G3 GC G01 G02 G03 G04 37,38 (7,23) 42,92 (6,22) 25,44 (8,51) 26,10 (6,09) 23,82 (5,96) <0,001 23,61 (8,38) GC G1 G05 0,001 (10,66) 47,56 (14,62) Resistência ao desgaste AB A Perda de massa (%) Média (DP) 10,95 (4,51) 13,10 (9,51) A 11,77 (18,04) B A B B B B 13,36 (5,11) 10,95 (4,51) 19,04 (17,91) 7,77 (2,87) 9,05 (8,27) 3,87 (1,83) A 6,54 (3,09) PosHoc** p* PostHoc** 0,968 0,017 AB A AB AB B AB *Teste ANOVA (p<0,050). **Teste de Tukey. Letras diferentes indicam que houve diferença estatisticamente significante (p<0,050), em relação aos compósitos. 57 B A Intensidade (contagens) lacuna estrias Energia (kV) C 20 µm 20 µm D 66,65 µm 10,27 µm E F Figura 1 Intensidade (contagens) Intensidade (contagens) Intensidade (contagens) Intensidade (contagens) 58 A B Energia (kV) E Energia (kV) C D microfibra microfibra Energia (kV) F Energia (kV) nanofibrila Figura 2 59 A nfC mfC fibra de celulose (original) B C Figura 3 60 A G3 G2 3+ Al Absorbância (u.a.) 2+ Ca G1 (n+) COO– Si–OH GC C–O–C Si–O–Si + COO–Ca Si–OH Si–O–Si COO– CIV pó - mfC C–O–C Fibra de celulose 4000 3600 O–H 3200 C–H 2800 2400 -CH2 1600 2000 C–OH C–H 1200 800 1200 800 -1 Número de onda (cm ) B G05 G04 Absorbância (u.a.) G03 G02 G01 GC nfC Fibra de celulose 4000 3600 3200 2800 2400 2000 -1 Número de onda (cm ) Figura 4 1600 2.3. ARTIGO 3 Journal of Dentistry 62 UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI www.ufvjm.edu.br Programa de Pós-Graduação em Odontologia - PPGOdonto/ UFVJM Prezado Editor, Nós, autores do manuscrito intitulado "Biocompatibilidade de cimento ionomérico modificado com microfibras e nanofibrilas de celulose – Parte II", submetemos o manuscrito para a apreciação e análise do Editorial do Journal of Dentistry, para possível publicação. O manuscrito não foi publicado anteriormente e não será enviado para publicação em outra revista. Todos os autores estão de acordo com os direitos de exclusividade do Journal of Dentistry, caso o manuscrito seja aceito para publicação. Atenciosamente, Rafael Menezes Silva Felipe Alisson Prates Mota Janir Alves Soares Suelleng Maria Cunha Santos Soares Maria Helena Santos João Luis de Miranda Devido ao sucesso da modificação do cimento de ionômero de vidro convencional com as microfibras e nanofibrilas de celulose de eucalipto, este estudo caracterizou os compósitos modificados e avaliou sua biocompatibilidade, visto que esse teste é fundamental para que o novo compósito possa ser usado como material restaurador odontológico. Dessa forma, será possível aplica-lo, futuramente, na clínica odontológica para o total entendimento das propriedades e características desses materiais, sobretudo em ambiente bucal, pensando em sua aplicação como material restaurador pelos odontólogos. 63 Biocompatibilidade de cimento ionomérico modificado com microfibras e nanofibrilas de celulose – Parte II Cimento ionomérico modificado: avaliação da biocompatibilidade Rafael M. Silvaa,b, Felipe A. P. Motaa,b, Janir A. Soaresa,b, Suelleng M. C. S. Soaresa,b, Maria Helena Santosa,b, João Luiz de Mirandaa,c Departamento de Odontologia, Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM, Diamantina/MG, CEP 39100-000, Brasil a Centro Avançado de Biomateriais – BioMat, Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM, Diamantina/MG, CEP 39100-000, Brasil b c Departamento de Ciências Básicas e da Saúde, Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM, Diamantina/MG, CEP 39100-000, Brasil * Autor correspondente: Rafael Menezes Silva Centro de Avaliação e Desenvolvimento de Biomateriais – BioMat Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM Rua da Glória, 187, Diamantina/MG, CEP39100-000, Brasil Telefone: +55 38 3532 6066 Fax: +55 38 3532 6077 e-mail: [email protected] Palavras-chave: Biocompatibilidade, celulose, cimento de ionômero de vidro, microfibras, nanofibrilas de celulose. 64 Biocompatibilidade de cimento ionomérico modificado com microfibras e nanofibrilas de celulose – Parte II Resumo Objetivo: avaliar a biocompatibilidade de cimentos de ionômero de vidro modificados com microfibras (mfC) e nanofibrilas (nfC) de celulose. Metodologia: implantou-se na região dorsal de 15 ratos, três corpos de prova, sendo um de cada cimento: compósito de ionômero de vidro convencional (CIV- GC), compósito de ionômero de vidro modificado com mfC (CIVmfC- G1) e compósito de ionômero de vidro modificado com nfC (CIVnfC- G2). Os animais foram sacrificados em períodos de 7, 30 e 60 dias após a implantação dos compósitos. Em amostras representativas dos grupos de estudo foram realizadas análise morfológica e estrutural de superfície por meio de microscopia eletrônica de varredura (MEV), análise qualitativa dos elementos químicos por espectroscopia de energia dispersiva de raios-X (EDS), assim como a identificação da estrutura química molecular dos compósitos por espectroscopia de infravermelho por transformada de Fourier (FTIR). Resultados: para avaliação da biocompatibilidade foi considerada a ocorrência de eventos histopatológicos como infiltrado inflamatório, capacidade de celularidade e atividade dos macrófagos. Os resultados demonstraram que no período de sete dias houve diferença significativa entre os grupos, quando se avaliou fibroblastos (p=0,035) e macrófagos (p=0,015). Porém, nos períodos de 30 e 60 dias nenhuma diferença significativa foi observada entre os grupos, considerando-se os eventos histopatológicos analisados. Quanto à espessura da cápsula fibrosa, houve diferença somente no período de 60 dias entre os grupos G1 e G2 (p=0,025). Conclusão: Diante dos resultados obtidos pode-se afirmar que os materiais testados apresentaram comportamentos semelhantes entre eles e se mostraram biocompatíveis. Significado clínico: As propriedades de biocompatibilidade do compósito ionomérico modificado com microfibras e nanofibrilas de celulose devem ser previamente estudadas para serem testadas na clínica odontológica. Do ponto de vista biológico, seu potencial irritante deve ser avaliado, porque eventuais componentes tóxicos podem causar irritação, degeneração ou mesmo necrose dos tecidos adjacentes. 65 1. Introdução Vários autores são unânimes em afirmar que o cimento de ionômero de vidro (CIV) é responsável por um marco de grande importância dentro da odontologia, devido às suas propriedades de liberação de flúor, adesão química à estrutura dentária e compatibilidade biológica [1,2]. Considerando suas características químicas e de biocompatibilidade, o CIV também vem sendo utilizado em outras áreas do conhecimento [3,4]. No entanto, estes cimentos possuem algumas características consideradas limitantes do seu uso como deficiência de sua integridade mecânica e de sua capacidade de suportar cargas de fratura [2,5]. Assim, diversas modificações têm sido realizadas com o intuito de aumentar a sua resistência [6-9]. Nos últimos anos, o interesse mundial nas tecnologias sustentáveis aumentou bastante, buscando a criação de produtos com menor impacto ambiental [10,11]. Desse modo, são desenvolvidos uma vasta gama de pesquisas e trabalhos na área de materiais poliméricos e compósitos. Destaque deve ser dado à celulose que representa uma espécie de fibra de origem vegetal que pode ser utilizada em sua forma microcristalina [12,13] ou em dimensões nanométricas, denominada nanofibrilas. Existem vários materiais nanoestruturados, como nanotubos de carbono e nanofibrilas inorgânicas [14,15], contudo as nanofibrilas de celulose apresentam várias vantagens sob estes, como seu baixo custo, facilidade no processo de formação e, principalmente, melhores propriedades mecânicas em relação a estes materiais. As fibras de celulose se destacam ainda pela sua alta disponibilidade, com a vantagem de ser uma fonte renovável para a produção de polímeros, abrindo assim espaço para avanços tecnológicos nas mais diversas áreas e como uma grande possibilidade de troca às fibras inorgânicas [16-22]. Silva et al., 2013 [9], estudaram a inclusão de fibras celulósicas ao CIV na tentativa de conferir resistência mecânica maior a este material. Os resultados do reforço dos compósitos mostraram que o acréscimo de fibras na proporção ideal não interferiu nas propriedades de manipulação do material. O CIV modificado com fibras celulósicas apresentou propriedades de sinérese e embebição, solubilidade e desintegração em água e resistência à tração diametral similares ao cimento convencional. Entretanto, o compósito desenvolvido apresentou aumento da resistência à compressão e abrasão, além de uma adesão maior à estrutura dentária. A caracterização através de microscopia eletrônica de varredura confirmou a formação de um novo e estável compósito. Desse modo, esse estudo visa caracterizar compósitos modificados com microfibras e nanofibrilas de celulose de eucalipto e avaliar sua biocompatibilidade, visto que esse teste é fundamental para que o novo compósito possa ser usado como material restaurador odontológico. 2. Metodologia 2.1. Desenvolvimento dos compósitos As microfibras da celulose (mfC) foram obtidas através do processamento de 6 g de fibras de celulose (FC) de eucalipto, conforme descrito por Ferreira et al., 2006a [21] e 2006b [22]. O material foi obtido pela hidrólise com ácido clorídrico 37%. Em seguida, a suspensão foi filtrada e lavada com água destilada até que o pH se igualasse ao da mesma. O produto obtido foi misturado à 200 ml de água destilada e levado a um sonicador por cinco ciclos de 2 min cada, sendo que no intervalo de cada ciclo a temperatura foi aferida. O material obtido foi congelado em nitrogênio líquido e liofilizado. Para obtenção das nanofibrilas, a celulose de eucalipto contendo α-celulose (96-98%), foi hidrolizada com ácido sulfúrico como descrito na literatura [23-25]. O processo de hidrólise foi realizado a 50°C durante cerca de 50 min. A dispersão foi diluída duas vezes e lavada três vezes com água desionizada, por meio de centrifugação. A diálise contra água desionizada foi realizada até a dispersão atingir pH ~ 6 e, logo depois, foi ultrassonificada por 5 minutos e filtrada. A concentração final de nanofibrilas de celulose (nfC) na dispersão foi de aproximadamente 1% em massa. Três grupos de corpos de prova (cps) (n=15) foram confeccionados para avaliação da biocompatibilidade. Inicialmente, foi obtido o grupo controle (GC) aglutinando o pó ao líquido do CIV. Uma concentração de 0,010 g em peso de mfC, previamente preparada, foi adicionada ao líquido do CIV, durante sua manipulação, para preparo dos cps do grupo (G1) de compósitos de ionômero de vidro modificados com mfC (CIVmfC). Para preparo do compósito de ionômero de vidro modificado 66 com nfC (CIVnfC), as nanofibrilas foram preparadas e também adicionadas ao líquido do CIV para sua manipulação. Assim, o G2 foi obtido com cps que apresentaram concentrações de 0,4% de nfC no total da sua massa. Os compósitos foram preparados respeitando a proporção pó:líquido de 1:1 e a manipulação foi realizada de acordo com as recomendações do fabricante. Os cps foram armazenados em água destilada à temperatura de 37°C (±1ºC). 2.2. Caracterização dos compósitos Amostras de áreas de fratura dos compósitos de cada um dos grupos foram cobertas com uma fina camada de ouro-paládio para permitir a transmissão de elétrons nessas superfícies. As amostras foram analisadas através de microscopia eletrônica de varredura (MEV) (CS-3500, Shimadzu, Kyoto, Japão) e espectroscopia de energia dispersiva de raios-X (EDS), (CS3200, Oxford, Oxfordshire, Inglaterra), usando feixe de elétrons de 10 e 15 kV. Espectros de amostras dos materiais foram obtidos com 32 varreduras, no intervalo entre 675 à 4000 cm-1, com resolução de 4 cm-1 e unidades de absorbância (abs), através de espectroscopia de infravermelho por transformada de Fourier (FTIR) pela técnica da reflectância total atenuada (ATR), (Nicolet 6700, Thermo Electron Scientific Instruments Corp., Madison, WI, USA). 2.3. Teste de biocompatibilidade – Implante subcutâneo Este estudo foi realizado com aprovação do Comitê de Ética no Uso de Animais (CEUA) da Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM) assentindo para com os conceitos éticos do uso de animais em laboratório para todos os níveis do experimento. Quinze ratos jovens foram utilizados (Rattus norvegicus albinus, Holtzman), com idade de três a quatro meses de idade e peso médio de 141,15 g. Os animais foram mantidos em gaiolas plásticas individuais (33x40x16 cm), higienizadas, colocadas em ambiente arejado e iluminado naturalmente, recebendo água ad libidum e alimentação constituída de ração comercial balanceada (Nuvilab, Colombo, PR, Brasil). Para o procedimento, os animais foram anestesiados com 1 ml (mg/Kg de peso vivo do animal) de Cetamina (Clortamina – cloridrato de cetamina, injetável IM/IV – 50mg/ml – Biochimico, Rio de Janeiro, RJ, Brasil), administrada por via intraperitonial. Cada animal recebeu três corpos de prova na região dorsal, sendo um de cada material a ter sua biocompatibilidade avaliada. O corpo de prova do GC foi colocado na região superior esquerda, o do G1 na região superior direita e o do G2 na região inferior central. Após a implantação e sutura, os animais foram mantidos em gaiolas individuais e acompanhados até que se recuperassem da anestesia. Os mesmos foram observados diariamente para verificação do comportamento com finalidade de evitar ocorrências que pudessem comprometer o experimento durante todos os períodos de observação. Após 7, 30 e 60 dias os ratos foram sacrificados por overdose anestésica e os corpos de prova retirados para análise histopatológica. Desse modo, havia 5 animais para cada período de estudo, totalizando 15 amostras no final dos períodos avaliados. As amostras foram fixadas em formol tamponado a 10% durante 48 horas. Em seguida, os espécimes foram desidratados e embebidos em parafina. Secções seriadas de 6 µm de espessura foram obtidas e coradas com hematoxilina e eosina para análise morfológica e morfométrica. As análises foram realizadas em um microscópio óptico (Zeiss – PrimoStar, Oberkochen, Alemanha) acoplado com sistema de captura de imagem (Axio com ERc5s, Jena, Alemanha) e o programa AxioVision LE 4.8.2.0 (Oberkochen, Alemanha) para Windows, sendo a área total de análise do campo 55896 µm². A análise morfológica foi realizada pela observação do tecido conjuntivo de dois campos superiores e dois campos inferiores da cápsula fibrosa considerando os seguintes eventos histopatológicos: infiltrado inflamatório (células polimorfonucleares e células mononucleares), capacidade de celularidade (fibroblastos e vasos sanguíneos) e atividade dos macrófagos (macrófagos e células gigantes inflamatórias) [26]. Para quantificar a presença ou ausência desses eventos foram utilizados os seguintes escores: (-) ausente, (+) leve, (++) moderada e (+++) intensa. De acordo com a presença ou ausência das células do infiltrado inflamatório acima especificadas, o processo inflamatório foi considerado agudo ou crônico seguindo os mesmos escores. A espessura da cápsula 67 fibrosa (μm) foi medida em quatro regiões distintas usando o software AxioVision (Oberkochen, Alemanha). 2.4. Análise estatística Os resultados da avaliação dos eventos histopatológicos e espessura da cápsula foram analisados utilizando o software SPSS (Statistical Package for Social Sciences, IBM Inc., USA), versão 17.0. A normalidade e homogeneidade de variância dos dados coletados foram verificadas pelos testes Shapiro-Wilk e teste de Levene, respectivamente. Além da análise estatística descritiva, os dados dos eventos histopatológicos também foram submetidos ao teste de Friedman e ao pós-teste de Wilcoxon. Os dados coletados da espessura de cápsula foram submetidos ao teste de Friedman e ao Teste de Wilcoxon. Análise de correlação entre a espessura da cápsula e os eventos histopatológicos nos períodos de coleta também foi realizada. Para todas as análises, adotou-se o nível de significância de 5% (p<0,05). 3. Resultados 3.1. Caracterização dos compósitos Áreas de fratura dos compósitos foram eleitas para análise no MEV para observação das características morfológicas e estruturais intrínsecas desses materiais e para análise qualitativa dos seus elementos químicos. Nas micrografias de MEV da figura 1 observou-se a formação da matriz envolvendo partículas de carga com tamanho heterogêneo no CIV (fig. 1A). No compósito CIVmfC observou-se área superficial semelhante à do CIV com presença de mfC espaças entre as partículas inorgânicas (fig. 1B). O compósito CIVnfC mostrou-se completamente entremeada com nfC, distribuídas de forma aleatória pela matriz do cimento e sugerindo união entre elas e com a massa cimentícea e partículas do CIV (Fig. 1C). O espectro de EDS do CIV (fig. 1A) apresentou picos de alta intensidade de Cálcio (Ca), Flúor (F), Alumínio (Al) e Silício (Si) correspondentes à sua carga inorgânica, além de picos de C e O da matriz orgânica do cimento. Os espectros de CIVmfC (fig. 1B) e de CIVnfC (fig. 1C) apresentaram o mesmo padrão do espectro de EDS do CIV. As mfC e nfC apresentaram o mesmo padrão de espectros de FTIR da fibra de celulose original (fig. 2). Observou-se a presença de bandas de absorção referentes aos grupamentos –0H, em 3409, 3339 e 3276 cm-1; banda referente à –CH3 dos grupamentos metílicos em 2896 cm-1; bandas em 1428 cm-1 dos grupamentos metilênicos (–CH2); bandas em 1370 e 1278 cm-1 referentes a C–H; bandas 1337 e 1206 cm-1 correspondentes a C–OH; e das bandas 1161, 1065 e 1034 cm-1correspondentes aos grupamentos C–O–C da estrutura sacarídea, atribuída a celulose e hemicelulose. O espectro de FTIR do pó de CIV mostrou banda intensa dos grupamentos COO-, correspondente à presença de ácido poliacrílico liofilizado no pó. O compósito CIV (GC) mostrou bandas dos grupamentos Si–OH livres em 3650 e 3680 cm-1 e Si–OH em 3200 e 3450 cm-1 referentes à água absorvida e/ou referentes a ligações de H aos grupos Si–OH; bandas referentes aos grupamentos C–O em 1637 cm-1; dos grupamentos COO-(n+) (n = Al+3 e Ca+2) em 1585 cm-1 e de COO-Ca+ em 1456 e 1410 cm-1; de Si–OH em 957 a 970 cm-1; e de Si–O–Si em 800 a 810 cm-1. Nos espectros de FTIR dos compósitos CIVmfC (G1) e CIVnfC (G2) observou-se bandas de absorção similares entre eles e bandas características da celulose e do CIV (fig. 2). 3.2. Análise quantitativa e qualitativa do teste de biocompatibilidade Os dados obtidos para todos os eventos histopatológicos avaliados em cada período de estudo são apresentados na tabela 1. Pode-se observar que células polimorfonucleares e gigantes multinucleadas estiveram ausentes nos três períodos de avaliação para os três grupos avaliados. No período de avaliação de 7 dias, observou-se presença moderada de células mononucleares, vasos sanguíneos e macrófagos somente para o G1, considerando-se ausente a inflamação aguda e moderada a inflamação crônica. Nos grupos CG e G2 a inflamação aguda estava ausente e a crônica mostrou-se de forma leve (fig. 3 e 4). Os fibroblastos apresentaram moderada presença para o grupo G2, ao passo que para os GC e G1 eles mostraram leve presença (tabela 1). Entretanto, no período de 30 e 60 dias, encontrou-se 68 um mesmo padrão de eventos histopatológicos para os três grupos avaliados, também, estando ausente a inflamação aguda. A inflamação crônica presente foi do tipo leve ou ausente (fig. 3 e 4). Na análise de 7 dias, o teste Friedman revelou não haver diferença estatisticamente significativa entre os grupos para contagem de polimorfonucleares (p=1,000), mononucleares (p=0,067), vasos sanguíneos (p=0,225) e células gigantes (p=1,000). Houve diferença estatisticamente significativa entre os grupos quando se avaliou fibroblastos (p=0,022) e macrófagos (p=0,019). Nas análises póstestes observou-se diferença entre GC e G1 para macrófagos (p=0,022). Quando se comparou GC e G2 observou-se diferença estatisticamente significativa para macrófagos (p=0,008) e mononucleares (p=0,033). Para G1 e G2 houve diferença estatisticamente significativa no post-hoc para fibroblastos (p=0,010). Nas análises dos períodos de 30 e 60 dias, o teste Kruskall Wallis não revelou diferença estatisticamente significativa entre os grupos para todos os eventos histopatológicos analisados (tabela 1). Quanto à espessura da cápsula fibrosa formada em torno do corpo de prova, não houve diferença estatisticamente significativa entre os grupos para os períodos de tempo avaliados em 7 e 30 dias. Já para a avaliação de 60 dias, houve diferença estatisticamente significativa entre os grupos G1 e G2 (p=0,025) (tabela 2). A análise de correlação foi realizada para os três grupos do estudo considerando-se todos os períodos de tempo e eventos histopatológicos pesquisados, além da espessura de cápsula. Os resultados das análises mostraram que no período de 7 dias os grupos GC e G1 apresentaram correlação positiva entre as células mononucleares e macrófagos, enquanto o G2, apresentou correlação positiva entre mononucleares e macrófagos e ainda entre fibroblastos e macrófagos (tabela 3). No período de 30 dias, os grupos GC e G2 apresentaram correlação positiva entre as células mononucleares e macrófagos e o G1 entre mononucleares e macrófagos, mononucleares e espessura da cápsula e entre macrófagos e espessura da cápsula (tabela 4). Já no período de 60 dias, observou-se uma maior correlação entre os eventos histopatológicos e entre estes e a espessura da cápsula para todos os grupos do estudo (tabela 5). 4. Discussão Nanotubos de carbono de alta qualidade são melhores como material de reforço em compósitos devido ao seu pequeno tamanho e alto módulo de Young. Entretanto, apresentam alguns problemas limitantes de seu uso, como por exemplo, dispersão na matriz e transferência da carga, a integridade da estrutura (densidade de defeitos) dos nanotubos, pureza e o custo elevado [27]. Como a celulose é o composto orgânico mais abundante no planeta, torna-se um exemplo clássico de uma fonte natural para a produção de elementos orgânicos para reforços, incluindo as microfibras e nanofibrilas de celulose. A grande vantagem de usá-los inclui sua natureza renovável, de baixo custo, baixa densidade, propriedades mecânicas altamente específicas, não abrasiva e facilmente processadas [28]. Além disso, o grande interesse econômico está no fato de poderem ser preparadas a partir de uma grande variedade de fontes naturais, incluindo resíduos agrícolas tais como bagaço de cana, casca de arroz e palha de milho, sendo uma forma alternativa de preparo de nanocompósitos ecologicamente sustentáveis [29,30]. Apesar de prévios estudos já terem demonstrado a biocompatibilidade do cimento de ionômero de vidro convencional [31,32] e com diferentes formulações [33] o presente trabalho procurou comparar, caracterizar e avaliar a biocompatibilidade de cimentos de ionômero de vidro modificados pela adição de microfibras e nanofibrilas de celulose, por se tratar de um novo compósito. A análise por MEV/EDS e FTIR dos materiais mostraram as mesmas características do CIV e da celulose de eucalipto relatadas na literatura [9,21,22,25], constatando-se que os compósitos deste estudo mantiveram as principais características dos seus materiais formadores. Compósitos novos foram desenvolvidos com a modificação do CIV com fibras celulósicas, principalmente o compósito CIVnfC, no qual observou-se maior estabilidade e provável reforço, devido à completa interação das nanofibrilas com a matriz cimentícea e suas partículas de pó não atacadas durante a sua reação química de presa. Assim, previamente ao teste in vivo em humanos, um método simples e rotineiro utilizado para se avaliar a biocompatibilidade é o implante subcutâneo do material a ser estudado em animais de 69 pequeno porte como ratos [34,35]. A partir daí, avalia-se então a presença de irritação, reações indesejadas ou necrose do tecido em comparação com grupos controle, por meio de investigações histopatológicas sobre a resposta inflamatória adjacente aos materiais [36]. Normalmente, os materiais a terem sua biocompatibilidade testada são inseridos em tubos de polietileno ou silicone antes de serem implantados no tecido conjuntivo subcutâneo de animais. Porém, no presente estudo os corpos de prova foram implantados sem a ajuda dos tubos, pois os corpos de prova testados apresentaram solubilidade inferior a 3% em sua massa inicial. Essa metodologia pôde ser utilizada com segurança, pois se baseou nos resultados de Silva et al., 2013 [9] que após avaliarem a solubilidade e desintegração do cimento ionomérico modificado por fibras celulósicas em diferentes concentrações, constataram, que após 14 dias, a solubilidade não ultrapassou 0,78% em peso de sua massa inicial, o que está dentro da especificação No. 57, 1983 da A.D.A. [37], a qual defende que a solubilidade em água do cimento ionomérico não deve ultrapassar 3% em peso da massa original, sem sinal de desintegração [34,35,38]. Após implantação in vivo do biomaterial, espera-se existir um mecanismo de cicatrização de ferida normal, um processo complexo que envolve a dinâmica interação de diferentes tipos de células, como as células inflamatórias, células musculares lisas vasculares, células endoteliais e fibroblastos. Essas interações in vivo são mais complexas do que as in vitro, pois refletem a resposta de corpo inteiro do organismo, tais como resposta imune e inflamatória [1-4,39]. Tais respostas foram testadas no experimento ora apresentado, pois todas as populações de células envolvidas na reação de cicatrização em torno dos corpos de prova foram quantificadas e a presença das mesmas correlacionadas. Os fibroblastos são células que desempenham um papel crucial na regeneração de tecidos, devido a sua capacidade de produzir componentes da matriz extracelular como colágeno. Além disso, estas células também são capazes de liberar fatores de crescimento que promovem a homeostase do tecido. A angiogênese também representa um passo crucial nesta cascata de acontecimentos, uma vez que proporciona a formação de novos vasos sanguíneos à partir de preexistentes, para assegurar o transporte de oxigênio, nutrientes e fatores de crescimento para promover a vascularização e remodelação do tecido correspondente ao local do implante [40,41]. Nos grupos experimentais avaliados foram quantificados os fibroblastos e os vasos sanguíneos, os quais mostraram presença variável, de acordo com o material testado e com o tempo de experimentação, conforme pode ser observado na tabela 1. No presente estudo observou-se uma correlação positiva entre a presença de macrófagos, monucleares e fibroblastos entre si e, destes para com a espessura da cápsula; o que permite inferir que, provavelmente, estas células produzam citocinas e fatores de crescimento, que ao atuarem de maneira autócrina e parácrina contribuíram para melhorar o processo de cicatrização em torno do corpo de prova, o que se denota pela menor espessura da cápsula fibrosa, proporcional com o aumento do tempo da experimentação. Assim como no GC, provavelmente as células presentes nos tecidos em torno do corpo de prova contribuíram positivamente para acelerar a cicatrização e reduzir a espessura da cápsula, quando do aumento do tempo de experimentação e, havendo uma cápsula menos espessa nesse grupo G1 em comparação com o grupo GC, pode-se inferir que as partículas de microfibra se interagiram bem com as populações celulares, permitindo maior metabolização por parte destas. Também, no grupo G2 observou-se correlações positivas entre as populações celulares presentes e a redução da espessura da cápsula à medida que aumentou o tempo de experimentação. Isso permite inferir que as nanofibrilas podem ter interagido positivamente com as populações celulares, estimulando melhor cicatrização e formação da cápsula em torno do corpo de prova, quando comparados com o GC e o G1. A correlação positiva entre as células presentes nos tecidos em torno dos corpos de prova do grupo controle e dos grupos experimentais, em especial nos primeiros sete dias de experimento, permite inferir que todos os materiais testados provocaram baixa irritabilidade aos tecidos, haja vista, que não foi observada a presença de polimorfonucleares em nenhum grupo. Nos períodos mais avançados de experimentação (30 e 60 dias) não foram observadas as células gigantes multinucleares inflamatórias em quaisquer dos grupos, bem como foi observada uma correlação positiva entre as populações celulares e a redução da espessura da cápsula fibrosa em torno dos corpos de prova. Esses achados corroboram com os resultados de Hurrell-Gillingham et al., 2006 [33] e Garcia et al., 2010 [42] e indicam que todos os materiais se mostraram biocompatíveis e, naqueles em que houve uma redução 70 mais significativa da cápsula fibrosa, houve uma ação estimuladora da função celular, beneficiando mais ainda o processo de cicatrização tecidual. 5. Conclusão Os resultados deste estudo demonstraram que os materiais testados – G1-CIVmfC e G2-CIVnfC obtiveram resposta semelhante ao do GC-CIV, pois apresentaram ação estimuladora celular e baixa irritabilidade tecidual, indicando assim que os mesmos foram biocompatíveis. Agradecimentos Ao Laboratório de Patologia do Departamento de Ciências Básicas e da Saúde (DCBS) da Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM) e ao Laboratório de Experimentação Animal do Departamento de Nutrição da UFVJM. À FAPEMIG, CAPES e CNPq, pela liberação de bolsas e recursos para a pesquisa. 6. Referências 1. Anusavice KJ (Ed.), Phillips: Science of dental materials. St. Louis:Elsevier, 1996. 2. Mount GJ. Clinical performance of glass-ionomers. Biomaterials 1998; 6: 573-9. 3. Zollner W, Rudel C. In: Hunt PC, editor. Glass ionomers: the next generation. Philadelphia: International Symposium in Dentistry; 1994. p. 57-60. 4. Brook IM, Hatton PV. Glass-ionomers: bioactive implant materials. Biomaterials 1998; 6: 565-71. 5. Xu X, Burgess JO. Compressive strength, fluoride release and recharge of fluoride-releasing materials. Biomaterials 2003; 24: 2451-2461. 6. Kobayashi M, Kon M, Miyai K, Asaoka K. Strengthening of glass-ionomer cement by compounding short fibres with CaO-P2O5-SiO2-Al2O3 glass. Biomaterials 2000; 21: 2051-8. 7. Xie D, Chung ID, Wu W, Mays J. Synthesis and evaluation of HEMA-free glass-ionomer cements for dental applications. Dental Materials 2004; 20: 470-8. 8. Arita K, Yamamoto A, Shinonaga Y, Harada K, Abe Y, Nakagawa K, Sugiyama S. Hydroxyapatite particle characteristics influence the enhancement of the mechanical and 13 chemical properties of conventional restorative glass ionomer cement. Dental materials journal 2011; 30: 672–83. 9. Silva RM, Santos PHN, Souza LB, Dumont VC, Soares JA, Santos MH. Effects of cellulose fibers on the physical and chemical properties of glass ionomer dental restorative materials. Materials research bulletin 2013; 48: 18–126. 10. Kvien I, Tanem BS, Oksman K. Characterization of cellulose whiskers and their nanocomposites by atomic force and electron microscopy. Biomacromolecules 2005; 6: 3160-5. 11. John MJ, Thomas S. Biofibres and biocomposites. Carbohydrate polymers 2008; 71: 343-364. 12. Sturcova A, Davies GR, Eichhorn SJ. Elastic modulus and stress-transfer properties of tunicate cellulose whiskers. Biomacromolecules 2005; 6: 1055-61. 13. Noorani S, Simonsen J, Atre S. Nano-enabled microtechnology: polysulfone nanocomposites incorporating cellulose nanocrystals. Cellulose 2007; 14: 577-584. 14. Nunes AA, Franca AS, Oliveira LS. Activated carbons from waste biomass: an alternative use for biodiesel production solid residues. Bioresource technology 2009; 100: 1786-92. 15. Karagöz S, Tay T, Ucar S, Erdem M. Activated carbons from waste biomass by sulfuric acid activation and their use on methylene blue adsorption. Bioresource technology 2008; 99: 6214-22. 16. Garg U, Kaur MP, Jawa GK., Sud D, Garg VK. Removal of cadmium (II) from aqueous solutions by adsorption on agricultural waste biomass. Journal of hazardous materials 2008; 154: 1149-57. 17. Kaikake K., Hoaki K., Sunada H, Dhakal RP, Baba Y. Removal characteristics of metal ions using degreased coffee beans: adsorption equilibrium of cadmium(II). Bioresource technology 2007; 98: 2787-91. 18. Boucher J, Steiner Z, Marison IW. Bio-sorption of atrazine in the press-cake from oilseeds. Water research 2007; 41: 3209-3216. 19. Tan IAW, Hameed BH, Ahmad AL. Equilibrium and kinetic studies on basic dye adsorption by oil palm fibre activated carbon. Chemical engineering jornal 2007; 127: 111-119. 71 20. Crini G. Non-conventional low-cost adsorbents for dye removal: a review. Bioresource technology 2006; 97: 1061-85. 21. Ferreira CR, Fantini Junior M, Colodette J, Gomide JL, Carvalho AMML. Avaliação tecnológica de clones de eucalipto: parte I - qualidade da madeira para produção de celulose Kraft. Scientia Forestalis 2006a; 70: 161-170. 22. Ferreira CR, Fantini Junior M, Colodette J, Gomide JL, Carvalho AMML. Avaliação tecnológica de clones de eucalipto: parte II - qualidade da celulose branqueada Kraft para papel de imprimir e escrever. Scientia Forestalis 2006b; 71: 09-18. 23. De Rodriguez NLG, Thielemans W, Dufresne A .Sisal cellulose whiskers reinforced polyvinyl acetate nanocomposites. Cellulose 2006; 13: 261–270. 24. De Mesquita JP, Patricio PS, Donnici C. Hybrid layer-by-layer assembly based on animal and vegetable structural materials: multilayered films of collagen and cellulose nanowhiskers. Soft matter 2011; 7: 4405–4413. 25. Brito BSL, Pereira FV, Putaux JL, Jean B. Preparation, morphology and structure of cellulose nanocrystals from bamboo fibers. Cellulose 2012; 19: 1527-1536. 26. Silva RA, Assed S, Nelson-Filho P, Silva LA, Consolaro A. Subcutaneous tissue response of isogenic mice to calcium hydroxide-based pastes with chlorhexidine. Brazilian Dental Journal 2009; 20: 99-106. 27. De Heer Walt, A. Nanotubes and the Pursuit of Applications. Materials research society bulletin 2004; 29: 281–285. 28. Samir MASA, Alloin F, Dufresne A. Riview of recent research into cellulosic whiskers, their properties and their application in nanocomposite field. Biomacromolecules 2005; 6: 612–626. 29. Oksman K, Mathew AP, Bondeson D, Kvien I. Manufacturing process of cellulose whiskers/polylactic acid nanocomposites. Composites science and technology 2006; 66: 2776–2784. 30. Jiang L, Morelius E, Zhang J, Wolcott M, Holbery J. Study of the poly(3-hydroxybutyrate-co-3hydroxyvalerate)/cellulose nanowhisker composites prepared by solution casting and melt processing. Journal of composite materials 2008; 42: 2629–2645. 31- Kawahara H, Imanishi Y, Oshima H. Biological evaluation on glass ionomer cement. Journal of dental research 1979; 58: 1080-1086, 32- Tobias RS, Browne RM, Plant CG, Ingram DV. Pulpar response to a glass ionomer cement. Brazilian Dental Journal 1978; 144: 345-350. 33- Hurrell-Gillingham K, Reaney IM, Brook I, Hatton PV. In vitro biocompatibility of a novel Fe2O3 based glass ionomer cement. Journal of Dentistry 2006; 34: 533-538. 34 - Costa CA, Oliveira MF, Giro EMA, Hebling J. Biocompatibility resin-based materials used as pulp-capping agents. International endodontic journal 2003; 36: 831-839. 35- Zmener O. Tissue response to a new methacrylate-based root canal sealer: preliminary observations in the subcutaneous connective tissue of rats. Journal of endodontics 2004; 30: 348-351. 36- McNamara RP, Henry MA, Schindler WG, Hargreaves KM. Biocompatibility of accelerated mineral trioxide aggregate in a rat model. Journal of endodontics 2010; 36: 1851–5. 37- American Dental Association. Specification n. 57 for Endodontic filling materials; 1983. 38. Wang XY, Baba A, Taniguchi K, Hagio M, Miyazaki K. Study on rat subcutaneous reaction to experimental polyurethane elastomers. Dental Materials J 2004; 23: 512-516. 39- Guan GP, Bai L, Zuo BQ, Li MZ, Wu ZY, Li YL. Scaffolds decorated by in vivo environment improve cell proliferation and wound healing. New York: IEEE, 2009. 40- Rickert D, Moses MA, Lendlein A, Kelch S, Franke RP. The importance of angiogenesis in the interaction between polymeric biomaterials and surrounding tissue. Clinical hemorheology and microcirculation 2003; 28: 175–81. 41- Ghanaati S, Unger RE, WebberMJ, Barbeck M, Orth C, Kirkpatrick JA, et al. Scaffold vascularization in vivo driven by primary human osteoblasts in concert with host inflammatory cells. Biomaterials 2011; 32: 8150–60. 42- Garcia LF, Pires-de-Souza FC, Calefi PS, Ciuffi KJ, Nassar EJ. Synthesis and biocompatibility of an experimental glass ionomer cement prepared by a non-hydrolytic sol-gel method. Brazilian Dental Journal 2010; 21: 499-507. 72 Legenda Tabela 1 - Frequência dos eventos histopatológicos observados em cada grupo nos diferentes períodos de estudo. Tabela 2 - Médias, desvios-padrão e significância estatística dos resultados para espessura de cápsula em cada grupo nos diferentes períodos de estudo. Tabela 3 - Associação entre os eventos histopatológicos e espessura de cápsula no período de 7 dias. Tabela 4 - Associação entre os eventos histopatológicos e espessura de cápsula no período de 30 dias. Tabela 5 - Associação entre os eventos histopatológicos e espessura de no período de 60 dias. Figura 1 - Micrografias de MEV de CIV (GC), (fig. 1A), dos compósitos CIVmfC (G1), (fig. 1B) e CIVnfC (G2) (fig. 1C) e seus respectivos espectros de EDS. As setas indicam a presença de microfibras e de nanofibrilas nos compósitos. Figura 2 - Espectros de FTIR dos compósitos CIVnfC (G3), CIVmfC (G2) e dos seus materiais precursores CIV (GC), mfc e nfC, mostrando as principais bandas de absorção de seus constituintes químicos moleculares. Figura 3 - A) Grupo GC aos 07 dias após experimento, exibindo presença de macrófagos (M) (+), outros mononucleares (MN) (+) e fibroblastos (F) (+). B) Grupo G1 aos 07 dias após experimento, exibindo presença de macrófagos (++), outros mononucleares (++), vasos sanguímeos (VS) (++) e fibroblastos (+). C) Grupo G2 aos 07 dias após experimento, exibindo presença de macrófagos (+), outros mononucleares (+), vasos sanguímeos (+) e fibroblastos (++). D) Grupo GC aos 30 dias após experimento, exibindo presença de macrófagos (+), vasos sanguíneos (+), fibroblastos (++) e moderada colagenização. E) Grupo G1 aos 30 dias após experimento, exibindo presença de macrófagos (+), fibroblastos (++) e moderada colagenização. F) Grupo G2aos 30 dias após experimento, exibindo presença de macrófagos (+), vasos sanguíneos (+), fibroblastos (++) e moderada colagenização. G) Grupo GC aos 60 dias após experimento, exibindo presença de inúmeros fibroblastos (++), escasso vasos sanguíneos (+) e abundante colagenização. H) Grupo G1 aos 60 dias após experimento, exibindo presença de inúmeros fibroblastos (++) e abundante colagenização. I) Grupo G2 aos 60 dias após experimento, exibindo presença de inúmeros fibroblastos (++) e abundante colagenização. HE 400x. Figura 4 - A) Grupo GC aos 07 dias após experimento, exibindo espessa cápsula fibrosa (CF) (62,86±30,65) pouco colagenizada (CL). B) Grupo G1 aos 07 dias após experimento, exibindo cápsula fibrosa de média espessura (50,49±17,65) pouco colagenizada. C) Grupo G2 aos 07 dias após experimento, exibindo espessa cápsula fibrosa (61,83±23,91) pouco colagenizada. D) Grupo GC aos 30 dias após experimento, exibindo cápsula fibrosa com média espessura (56,08±25,02) e moderada colagenização. E) Grupo G1 aos 30 dias após experimento, exibindo espessa cápsula fibrosa (65,76±59,88) e moderada colagenização. F) Grupo G2 aos 30 dias após experimento, exibindo cápsula fibrosa com média espessura (50,52±17,63) e moderada colagenização. G) Grupo GC aos 60 dias após experimento, exibindo cápsula fibrosa delgada (30,15±4,28) e abundante colagenização. H) Grupo G1 aos 60 dias após experimento, exibindo cápsula fibrosa delgada (41,21±3,98) e abundante colagenização. I) Grupo G2 aos 60 dias após experimento, exibindo cápsula fibrosa delgada (26,72±2,87)e abundante colagenização. HE 400x. 73 Tabela 1 7 dias 30 dias 60 dias Eventos Histopatológicos GC G1 G2 GC G1 G2 GC G1 G2 Polimorfonucleares - - - - - - - - - Mononucleares + ++ + + + + + + + Fibroblastos + + ++ ++ ++ ++ ++ ++ ++ Vasos sanguíneos + ++ + + + + + + + Macrófagos + ++ + + + + + + + Células gigantes inflamatórias - - - - - - - - - Escores: (-) ausente, (+) leve, (++) moderada e (+++) intensa. 74 Tabela 2 Grupos GC G1 G2 Média (DP) – 7 dias 62,86 (30,65) 50,49 (17,65) 61,83 (23,91) p* 0,229 Espessura Cápsula (µm) Média (DP) – 30 Média (DP) – 60 p* dias dias 56,08 (25,02) 30,15 (4,28) 65,76 (59,88) 0,522 41,21 (3,98) 50,52 (17,63) 26,72 (2,87) p* 0,024 *Teste de Friedman (p<0,050). **Teste de Wilcoxon. Letras diferentes indicam que houve diferença estatisticamente significativa (p<0,05). Posthoc** AB A B 75 Tabela 3 Grupos Eventos Polimorfonucleares Mononucleares Fibroblastos GC Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares Mononucleares Fibroblastos G1 Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares Mononucleares Fibroblastos G2 Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p a Mononucleares Fibroblastos Vasos sanguíneos Macrófagos Células gigantes a A a a a 1,00 -- -0,42 0.860 1,00 -- 0,145 0,543 0,035 0,885 1,00 -- 0,761* <0,001 0,151 0,526 0,201 0,397 1,00 -- a a a a a Espessura cápsula a -0,072 0,763 0,177 0,455 0,021 0,930 0,018 0,939 a 1,00 -- a A a a a 1,00 -- 0,356 0.124 1,00 -- 0,346 0,135 0,351 0,130 1,00 -- 0,921* <0,001 0,411 0,072 0,419 0,066 1,00 -- a a a a a a a -0,050 0,833 -0,242 0,304 0,034 0,886 -0,215 0,363 a 1,00 -- a r. valor de correlação p. valor de significância estatística a. dados não computados porque a variável não foi contabilizada *. Existe correlação A a a a 1,00 -- 0,353 0.127 1,00 -- -0,125 0,599 -0,320 0,169 1,00 -- 0,898* <0,001 0,511* 0,021 -0,216 0,360 1,00 -- a a a a a a a 0,283 0,241 0,105 0,670 -0,440 0,060 0,327 0,172 a 1,00 -- 76 Tabela 4 Grupos Eventos Polimorfonucleares Mononucleares Fibroblastos GC Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares Mononucleares Fibroblastos G1 Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares Mononucleares Fibroblastos G2 Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p a Mononucleares Fibroblastos Vasos sanguíneos Macrófagos Células gigantes a A a a a 1,00 -- -0,077 0.747 1,00 -- 0,518 0,019 -0,258 0,272 1,00 -- 0,931* <0,001 -0,070 0,770 0,439 0,053 1,00 -- a a a a a Espessura cápsula a 0,116 0,626 0,128 0,590 -0,087 0,714 0,077 0,706 a 1,00 -- a A a a a 1,00 -- 0,274 0.243 1,00 -- -0,087 0,714 -0,281 0,230 1,00 -- 0,957* <0,001 0,155 0,515 0,000 1,000 1,00 -- a a a a a a a 0,791* <0,001 0,199 0,401 -0,267 0,256 0,818* <0,001 a 1,00 -- a r. valor de correlação p. valor de significância estatística a. dados não computados porque a variável não foi contabilizada *. Existe correlação A a a a 1,00 -- 0,324 0.163 1,00 -- 0,066 0,783 -0,019 0,938 1,00 -- 1,000* <0,001 0,324 0,163 0,066 0,783 1,00 -- a a a a a a a 0,013 0,956 -0,011 0,962 -0,424 0,062 0,013 0,956 a 1,00 -- 77 Tabela 5 Grupos Eventos Polimorfonucleares Mononucleares Fibroblastos GC Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares Mononucleares Fibroblastos G1 Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares Mononucleares Fibroblastos G2 Vasos sanguíneos Macrófagos Células gigantes Espessura cápsula Polimorfonucleares r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p r p a Mononucleares Fibroblastos Vasos sanguíneos Macrófagos Células gigantes a A a a a 1,00 -- 0,999* <0,001 1,00 -- 0,994* <0,001 0,988* <0,001 1,00 -- 0,994* <0,001 0,988* <0,001 1,000* <0,001 1,00 -- a a a a a Espessura cápsula a -0,534* 0,033 -0,496 0,051 -0,617* 0,011 -0,617* 0,011 a 1,00 -- a A a a a 1,00 -- 0,099* <0,001 1,00 -- 0,093* <0,001 0,974* <0,001 1,00 -- 0,097* <0,001 0,992* <0,001 0,992* <0,001 1,00 -- a a a a a a a -0,860* <0,001 -0,876* <0,001 -0,833* <0,001 -0,860* <0,001 a 1,00 -- a r. valor de correlação p. valor de significância estatística a. dados não computados porque a variável não foi contabilizada *. Existe correlação A a a a 1,00 -- 0,973* <0,001 1,00 -- 0,995* <0,001 0,972* <0,001 1,00 -- 1,000* <0,001 0,973* <0,001 0,995* <0,001 1,00 -- a a a a a a a -0,810* <0,001 -0,880* <0,001 -0,825* <0,001 -0,810* <0,001 a 1,00 -- 78 Figura 1 79 G2 Absorbância (u.a.) 3+ Al 2+ Ca G1 -n+ COO 1585 Si–O–Si 1178-1080-1000 Si–OH GC C–O–C COO 1637 + Ca Si–OH 3450-3200 3680-3650 Si–OH 970-957 Si–O–Si 1456-1410 C–O–C 810-800 1161-1065-1034 nfC Figura 2 C–OH 1337-1206 O–H 3409-3276 C–H -CH2 1428 2896 mfC 4000 C–H 1370-1278 3600 3200 2800 2400 2000 1600 - Número de onda (cm 1 ) Figura 2 1200 800 80 Figura 3 81 Figura 4 3. CONSIDERAÇÕES FINAIS 83 Considerações finais CONSIDERAÇÕES FINAIS A inclusão de nanofibrilas de celulose ao CIV aumentou suas propriedades mecânicas não interferindo nas suas propriedades positivas. A melhoria no cimento ionomérico deverá proporcionar uma maior longevidade clínica das restaurações dentárias realizadas com este material. Com o uso do CIV modificado com nanofibrilas de celulose nas indicações e técnicas corretas do TRA espera-se alcançar a simplificação do procedimento restaurador somado aos benefícios sociais. Dessa forma, será possível alcançar um aumento da cobertura de uma população não assistida, auxiliando na redução das perdas dentárias. Outro resultado esperado refere-se ao custo-benefício do TRA com o uso do CIV modificado por fibras, o que deverá proporcionar sua aceitação por parte de uma comunidade assistida ou não nos moldes convencionais de intervenção odontológica, favorecendo sua utilização como uma estratégia de controle da cárie dentária no sistema de saúde pública. Do ponto de vista biológico, eventuais componentes tóxicos podem causar irritação, degeneração ou mesmo necrose dos tecidos. Os compósitos desenvolvidos apresentaram ação estimuladora celular e baixa irritabilidade tecidual, mostrando-se biocompatíveis. O futuro dos cimentos ionoméricos modificados com nanofibrilas de celulose depende de mais estudos e, principalmente, testes clínicos para o total entendimento das propriedades e características desses materiais em ambiente bucal. 4. REFERÊNCIAS GERAIS 85 ALEXANDER, H. Composites. In: Ratner, B.D.; Hoffman, A.S.; Schoen, F.J.; Lemons, J.E. Biomaterials science: an introduction to materials in medicine. San Diego: Academic Press. Chapter 2.8, p.94-105. 1996. ALGERA, T.J.; KLEVERLAAN, C.J.; PRAHL-ANDERSEN, B.; FEILZER, A.J. The influence of environmental conditions on the material properties of setting glassionomer cements. Dent Mater, Copenhagen: v.22, n.9, p.852, Sep. 2006. AJAYAN, P.M.; TOUR, J.M. Nanotube Composites. Nature, New York: v. 447, p. 1066– 1068, Jun. 2007. ANUSAVICE, K.J. (Ed.). Phillips: Science of dental materials. 11th ed. St. Louis: Elsevier, 1996. BEECHER, J.F. Organic materials: Wood, trees and nanotechnology. Nat Nanotechnol, Londres; v. 2, n.8 , p. 466–467, Aug. 2007. CRAIG, R.G.; POWERS, J.M. Materiais Dentários Restauradores. 13ª Ed. São Paulo: Livraria Santos Editora. 2004. COLEMAN, J.N.; KHAN, U.; GUN'KO, Y.K. Mechanical Reinforcement of Polymers Using Carbon Nanotubes. Adv Mater, Germany: v. 18, p. 689–706, mar 2006. FERREIRA, C.R.; FANTINI JUNIOR, M.; COLODETTE, J.; GOMIDE, J.L.; CARVALHO, A.M.M.L. Avaliação tecnológica de clones de eucalipto: parte I - qualidade da madeira para produção de celulose Kraft. Scientia Forestalis, Piracicaba: v. 70, n.70, p. 161-170, abril 2006. FERREIRA, C.R.; FANTINI JUNIOR, M.; COLODETTE, J.; GOMIDE, J.L.; CARVALHO, A.M.M.L. Avaliação tecnológica de clones de eucalipto: parte II - qualidade da celulose branqueada Kraft para papel de imprimir e escrever. Scientia Forestalis, Piracicaba: v. 71, n. 71, p. 09-18, agosto 2006. 86 FRENCKEN, J.E. The ART approach using glass-ionomers in relation to global oral health care. Dent Mater, Washington, D.C.: v. 26, n. 1, p. 1- 6, Jan. 2010. HENCH, L.L. Bioceramics: from concept to clinic. J Am Ceram Soc, Westerville: v. 74, n. 7, p. 1487-1510, Apr. 1991. JÚSTIZ-SMITH N.G.; VIRGO, G.J.; BUCHANAN, V.E. Potencial of Jamaican banana, coconut coir and bagasse fibres as composite materials. Mater Charact, [S.I.]: v. 59, p. 1273-78, Sep. 2008. LIPORONI, P.; PAULILLO, L.A.M.S.; CURY, J.A.; DIAS, C.T.S.; PARADELLA, T.C. Surface finishing of resin-modified glass ionomer. Gen Dent, Chicago; v.51, n.6, p.03636771, Nov., 2003. MANFIO, A.P.; ISHIKIRIAMA A.; PEREIRA, J. Cimento de ionômero de vidro: seu potencial como material para inlay. ROU, São Paulo: v. 8, n. 3, p. 163-169, Jul. 1994. MOHAMED-TAHIR, M.A.; YAP, A.U. Effects of pH on the surface texture of glass ionomer based/containing restorative materials. Oper Dent, v.29, p.586-591, 2004. MOUNT, G.J. Glass ionomers: a review of their current status. Oper Dent , Seattle; v. 24, n.2 , p.115–24, Mar. 1990. PARADELLA, T.C. Cimentos de ionômero de vidro na odontologia moderna. ROU, São Paulo; v.33, n.4, p.157-161, 2004. REDDY N, YANG Y. Biofibers from agricultural byproducts for industrial applications. Trends Biotechnol England: v. 23, n. 1. p. 22-27, Jan. 2005. REDDY, N; YANG, Y. Properties and potential applications of natural cellulose fibers from the bark of cotton stalks. Biotechnol Bioeng, New York: v. 100, n. 14, p. 3563-9, Jul. 2009. 87 RIBEIRO, J.C.R.; FONTANA, U.F.; MOYSÉS, M.R.; REIS, A.C.; DIAS, S.C.; RIBEIRO, J.G.R. Avaliação da solubilidade e desintegração de cimentos de ionômero de vidro modificados por resina e compômeros em função de proteção superficial. ROU, São Paulo; v.35, n.4, p.247-252, 2006. SAITO, T.; KIMURA, S.; NISHIYAMA, Y.; ISOGAI, A. Cellulose Nanofibers Prepared by TEMPO-Mediated Oxidation of Native Cellulose. Biomacromolecules, Washington, DC: v. 8, n. 8, p. 2485-2491, Aug. 2007. SILVA, R.M.; SANTOS, P.H.N.; SOUZA, L.B.; DUMONT, V.C.; SOARES, J.A.; SANTOS, M.H. Effects of cellulose fibers on the physical and chemical properties of glass ionomer dental restorative materials. Mater Res Bull, Local: v. 48, n. 1, p. 118–126, Jan. 2013. VIEIRA, I.M.; LOURO, R.L.; ATTA, M.T.; NAVARRO, M.F.L.; FRANCISCONI, P.A.S. O cimento de Ionômero de vidro na odontologia. Saúde Com., [S.I.]: v. 2, n. 1, p. 75-84, 2006. VILA, C.; ROMERO, J.; FRANCISCO, J.L.; GARROTE. G.; PARAJO,´J.C. Extracting value from Eucalyptus wood before kraft pulping: effects of hemicelluloses solubilization on pulp properties. Bioresour Technol, London: v. 102, n. 8, p. 5251, Apr. 2011. XIE, D.; CHUNG, I.D.; WU, W.; MAYS, J. Synthesis and evaluation of HEMA-free glassionomer cements for dental applications. Dent Mater, Washington, D.C.: v. 20, n. 5, p. 470478, Jun. 2004. ZHANG, X.; HUANG, J.; CHANG, P. R.; LI, J.; CHEN, Y.; WANG, D.; YU J.; CHEN J., Structure and properties of polysaccharide nanocrystal-doped supramolecular hydrogels based on cyclodextrin inclusion. Polymers, Switzerland: v. 5, n. 19, p. 4398– 4407, Sep. 2010. ZHAO, J.; XIE, D. Effect of Nanoparticles on wear resistance and surface hardness of a dental glass-ionomer cement. J Compos Mater, Thousand Oaks: v. 43, n. 23, p. 2739, Sep. 2009. 88 5. ANEXOS 89 5.1. ANEXO 1 90 ANEXO 1 INSTRUÇÕES AOS AUTORES MISSÃO, ESCOPO E POLÍTICA DE SUBMISSÃO A Brazilian Oral Research - BOR é a publicação oficial da Sociedade Brasileira de Pesquisa Odontológica - SBPqO (Divisão brasileira da "International Association for Dental Research" - IADR). A revista tem periodicidade bimestral, é revisada por pares (sistema duplo-cego), e tem como missão disseminar e promover o intercâmbio de informações sobre as diversas áreas às quais se dedica a pesquisa odontológica. A BOR convida a submissão dos seguintes tipos de artigos: Pesquisa Original (artigo completo ou "Short Communication"), Revisão Crítica da Literatura, Revisão Sistemática (e Meta-Análise), além de Cartas ao Editor. Todas as submissões deverão ser exclusivas à BOR. A submissãoo dos manuscritos, e de toda correspondência relacionada, deve ser realizada exclusivamente pelo link de submissão online. O processo de avaliação do manuscrito será iniciado somente após o atendimento integral a todos os requisitos descritos nestas Instruções aos Autores. O manuscrito em desacordo com estes requisitos será devolvido ao autor de correspondência, junto a ofício solicitando adequações e nova submissão. Importante: após ser aceito por seu mérito científico, todo manuscrito deverá ser submetido a uma revisão gramatical e estilística do idioma inglês, para depois ser resubmetido juntamente com um certificado de revisão de inglês fornecido por uma das empresas de edição de idioma listadas abaixo (lista baseada na recomendação feita pelo "Journal of Dental Research" - JDR): www.americanjournalexperts.com - edição técnica e científica em geral www.biomeditor.com - edição técnica e científica em geral www.ic.com.br - edição técnica e científica em geral, expertise na área odontológica 91 www.internationalscienceediting.com - edição técnica e científica em geral [email protected] (NCristina Martorana Traduções S/C Ltda.) - edição técnica e científica em geral www.sci-edit.com - edição técnica e científica em geral www.sciencedocs.com - edição técnica e científica em geral www.scientific-editor.com - edição técnica e científica em geral www.writescienceright.com - edição técnica e científica em geral APRESENTAÇÃO DO MANUSCRITO O texto do manuscrito deverá estar redigido em inglês, devidamente revisado quanto ao estilo e à gramática, e fornecido em arquivo digital compatível com o programa "Microsoft Word" (em formato DOC, DOCX ou RTF). Todas as figuras deverão ser fornecidas em arquivos separados (não inseridas no arquivo de texto). Fotografias, micrografias e radiografias deverão ser fornecidas em formato TIFF ou JPG; gráficos, desenhos/esquemas e demais ilustrações vetoriais deverão ser fornecidos em formato PDF. Na reprodução de documentação clínica, deve-se evitar o uso de iniciais, nomes e números de registro de pacientes. A identificação de pacientes não é permitida. Um termo de consentimento esclarecido, assinado pelo paciente, quanto ao uso de sua imagem e documentação odontológica deverá ser fornecido pelo(s) autor(es) quando solicitado pela BOR. Ao reproduzir no manuscrito algum material previamente publicado (incluindo textos, gráficos, tabelas, figuras ou quaisquer outros materiais), a legislação cabível de direitos autorais deverá ser respeitada. As seções do manuscrito devem ser apresentadas observando-se as características específicas de cada tipo de manuscrito e na seguinte ordem: folha de rosto, resumo, descritores, introdução, metodologia, resultados, discussão, conclusão, agradecimentos, referências e legendas de figuras. 92 Folha de rosto (dados obrigatórios) Indicação do tipo de manuscrito e da especialidade ou área de pesquisa enfocada no manuscrito. Título informativo e conciso, limitado a um máximo de 110 caracteres incluindo espaços. Nomes e sobrenomes de todos os autores por extenso (os mesmos informados no termo de transferência de direitos autorais e nas declarações de responsabilidade), incluindo os respectivos números de telefone e endereços de Email. São permitidos, no máximo, 5 (cinco) autores. Quando esse número for excedido, a participação de cada um dos autores deverá ser justificada por escrito em folha separada (e fornecida num arquivo PDF), observando-se os critérios de autoria e co-autoria adotados pelo "International Committee of Medical Journal Editors" (http://www.icmje.org/ethical_1author.html). Dados de afiliação institucional/profissional de todos os autores, incluindo departamento, faculdade e universidade (ou outra instituição), além de cidade, estado e país, apresentados de acordo com as normas internas de citação estabelecidas pela instituição de cada um dos autores. É permitida apenas uma afiliação institucional/profissional por autor. Autor de correspondência, com endereço postal completo, número de telefone e endereço de e-mail. Texto Principal Resumo: deve ser apresentado na forma de um parágrafo único não estruturado (sem sub-divisões em seções), contendo proposição do trabalho, metodologia, resultados e conclusões. Descritores: devem ser fornecidos de 3 (três) a 5 (cinco) descritores principais, escolhidos dentre os descritores cadastrados em http://decs.bvs.br/ ou http://www.nlm.nih.gov/mesh/MBrowser.html (não serão aceitos sinônimos). Os descritores devem ser separados por ponto-evírgula (;). Introdução: deve apresentar o estado da arte do assunto pesquisado, a relevância do estudo e sua relação com outros trabalhos publicados na mesma linha de pesquisa ou 93 área, identificando suas limitações e possíveis vieses. O objetivo do estudo deve ser apresentado concisamente no final desta seção. Metodologia: devem ser fornecidas todas as características do material pertinente ao assunto da pesquisa (ex.: amostras de tecido, pacientes ou população). Os métodos experimentais, analíticos e estatísticos devem ser descritos de forma concisa, porém suficientemente detalhada para permitir que outros possam repetir o trabalho. Os dados de fabricantes ou fornecedores de produtos, equipamentos, ou softwares devem ser explicitados na primeira menção feita no texto, como segue: nome do fabricante, cidade e país. Os programas de computador e métodos estatísticos devem ser especificados. A menos que o objetivo do trabalho seja comparar produtos ou sistemas específicos, os nomes comerciais de técnicas, bem como de produtos ou equipamentos científicos ou clínicos só devem ser citados nas seções de "Metodologia" e "Agradecimentos", de acordo com o caso. No restante do manuscrito, os nomes genéricos devem ser utilizados. Nos manuscritos que envolvam radiografias, microrradiografias ou imagens de MEV, devem ser incluídas as seguintes informações: fonte de radiação, filtros e níveis de kV utilizados. Os manuscritos que relatem estudos em humanos devem incluir comprovação de que a pesquisa foi conduzida eticamente de acordo com a Declaração de Helsinki ("World Medical Association"). Alternativamente, o número de protocolo de aprovação emitido por um Comitê Institucional de Ética deve ser fornecido. Ensaios clínicos devem ser relatados de acordo com o protocolo padronizado da "CONSORT Statement". O "CONSORT checklist" deve ser submetido juntamente com o manuscrito e, quando solicitado pela BOR, deve conter comentários analíticos sobre o ensaio clínico realizado. Manuscritos que relatem a realização de estudos em animais devem também incluir comprovação de que a pesquisa foi conduzida de maneira ética, e o número de protocolo de aprovação emitido por um Comitê Institucional de Ética deve ser fornecido. Caso a pesquisa envolva um registro gênico, antes da submissão, as novas sequências genéticas devem ser incluídas num banco de dados público, e o número de acesso deve ser fornecido à BOR. Os autores poderão utilizar as seguintes bases de dados: GenBank: http://www.ncbi.nlm.nih.gov/Genbank/submit.html EMBL: http://www.ebi.ac.uk/embl/Submission/index.html DDBJ: http://www.ddbj.nig.ac.jp/sub-e/html 94 As submissões de manuscritos que incluam dados de "microarray" devem incluir a informação recomendada pelas diretrizes MIAME ("Minimum Information About a Microarray Experiment" - http://www.mged.org/index.html) e/ou descrever, na forma de itens, como os detalhes experimentais foram submetidos a uma das bases de dados publicamente disponíveis, tais como: ArrayExpress: http://www.ebi.ac.uk/arrayexpress/ GEO: http://www.ncbi.nlm.nih.gov/geo/ Resultados: devem ser apresentados na mesma ordem em que o experimento foi realizado, conforme descrito na seção "Metodologia". Os resultados mais significativos devem ser descritos. Texto, tabelas e figuras não devem ser repetitivos. Os resultados significativos devem vir acompanhados dos respectivos valores de p. Tabelas: devem ser numeradas consecutivamente em algarismos arábicos. Todas as tabelas devem ser inseridas e citadas no texto principal. As legendas devem ser posicionadas no topo das tabelas. Discussão: deve discutir os resultados do estudo em relação à hipótese de trabalho e à literatura relevante. Deve descrever as semelhanças e as diferenças do estudo em relação aos outros estudos pertinentes encontrados na literatura, e fornecer possíveis explicações por que as diferenças ocorreram. Deve também identificar as limitações do estudo e fazer sugestões para pesquisas futuras. Conclusões: devem ser apresentadas concisamente e estar estritamente fundamentadas nos resultados obtidos na pesquisa. O detalhamento dos resultados, incluindo valores numéricos etc., não deve ser repetido. Agradecimentos: as contribuições de colegas (por assistência técnica, comentários críticos etc.) devem ser informadas, e qualquer vinculação de autores com firmas comerciais deve ser revelada. Esta seção deve descrever a(s) fonte(s) de financiamento da pesquisa, incluindo os respectivos números de processo. Referências: só serão aceitas como referências as publicações em periódicos revisados por pares. Não serão aceitos como referências manuscritos em processo de redação, dissertações, teses, ou resumos apresentados em congressos. Livros devem ser mantidos 95 ao mínimo indispensável uma vez que refletem a opinião dos respectivos autores e/ou editores. Só serão aceitas as referências a livros mais recentes. As citações de referências devem ser identificadas no texto por meio de números arábicos sobrescritos. A lista completa de referências deve vir após a seção de "Agradecimentos", e as referências devem ser numeradas e normalizadas de acordo com o Estilo Vancouver, em conformidade com as diretrizes fornecidas pelo "International Committee of Medical Journal Editors", conforme apresentadas nas "Uniform Requirements for Manuscripts Submitted to Biomedical Journals" (http://www.ncbi.nlm.nih.gov/books/NBK7256/). Os títulos de periódicos devem ser abreviados de acordo com o "List of Journals Indexed in Index Medicus" (http://www.ncbi.nlm.nih.gov/nlmcatalog/). A correta apresentação das referências é de responsabilidade exclusiva dos autores. Notas de rodapé no texto principal: devem ser indicadas por meio de asteriscos e restritas ao mínimo indispensável. Grafia de termos científicos: nomes científicos (binômios de nomenclatura microbiológica, zoológica e botânica) devem ser escritos por extenso e em itálico. Nomes de compostos e elementos químicos devem ser escritos por extenso. Unidades de medida: devem ser apresentadas de acordo com o Sistema Internacional de Medidas (http://www.bipm.org/ ou http://www.inmetro.gov.br/infotec/publicacoes/Si.pdf) Figuras Fotografias, micrografias e radiografias devem ter uma largura mínima de 10 cm, resolução mínima de 300 dpi, e devem ser fornecidas em formato TIFF ou JPG; gráficos, desenhos/esquemas e demais ilustrações vetoriais devem ser fornecidos em formato PDF. Todas as figuras devem ser submetidas, individualmente, em arquivos separados (não inseridas no arquivo de texto). As figuras devem ser numeradas consecutivamente em 96 algarismos arábicos, e todas devem ser citadas no corpo do texto. As legendas das figuras devem ser inseridas todas juntas no final do texto, após as referências. Importante: os autores que desejem publicar figuras coloridas devem manifestar sua intenção por escrito no momento da submissão do manuscrito. Nesse caso, os custos de reprodução colorida serão arcados pelo(s) autor (es). Caso contrário, todas as figuras serão publicadas em preto & branco. CARACTERÍSTICAS E FORMATAÇÃO DOS TIPOS DE MANUSCRITOS Pesquisa Original Artigos de Pesquisa Original devem ser limitados a 23.000 caracteres incluindo espaços (considerando-se resumo, descritores, introdução, metodologia, resultados, discussão, conclusão, agradecimentos, tabelas, referências e legendas de figuras). Será aceito um máximo de 6 (seis) figuras e 30 (trinta) referências. O resumo deve conter, no máximo, 250 palavras. Formatação - Arquivos de Texto Folha de rosto - conforme descrito acima Texto principal (23.000 caracteres incluindo espaços) Resumo - máximo de 250 palavras Descriptors - de 3 (três) a 5 (cinco) descritores principais Introdução - conforme descrito acima Metodologia - conforme descrito acima Resultados - conforme descrito acima Discussão - conforme descrito acima Conclusão - conforme descrito acima Agradecimentos - conforme descrito acima Tabelas - conforme descrito acima Referências - máximo de 30 referências, conforme descrito acima 97 Legendas de figuras - conforme descrito acima Formatação - Arquivos de figuras Figuras - máximo de 6 (seis) figuras, conforme descrito acima "Short Communication" "Short Communications" devem ser limitados a 10.000 caracteres incluindo espaços (considerando-se resumo, descritores, introdução, metodologia, resultados, discussão, conclusão, agradecimentos, tabelas, referências e legendas de figuras). É permitido um máximo de 2 (duas) figuras e 12 (doze) referências. O resumo deve conter, no máximo, 100 palavras. Formatação - Arquivos de texto Folha de rosto: conforme descrito acima Texto principal (10.000 caracteres incluindo espaços) Resumo - máximo de 100 palavras Descritores - de 3 (três) a 5 (cinco) descritores principais Introdução - conforme descrito acima Metodologia - conforme descrito acima Resultados - conforme descrito acima Discussão - conforme descrito acima Conclusão - conforme descrito acima Agradecimentos - conforme descrito acima Tabelas - conforme descrito acima Referências - máximo de 12 referências, conforme descrito acima Legendas de figuras - conforme descrito acima Formatação - Arquivos de figuras 98 Figuras - máximo de 2 (duas) figuras, conforme descrito acima Revisão Sistemática e Meta-Análise Ao resumir os resultados de estudos originais, sejam eles quantitativos ou qualitativos, este tipo de manuscrito deve responder a uma questão específica, ser limitado a 23.000 caracteres incluindo espaços, e seguir o estilo e formato Cochrane (www.cochrane.org). O manuscrito deve informar detalhadamente como se deu o processo de busca e recuperação dos trabalhos originais, o critério de seleção dos estudos incluídos na revisão e fornecer um resumo dos resultados obtidos nos estudos revisados (com ou sem uma abordagem de meta-análise). Não há limite para a quantidade de referências. Tabelas e figuras, caso sejam incluídas, devem apresentar as características dos estudos revisados, as intervenções que foram comparadas e respectivos resultados, além dos estudos excluídos da revisão. Demais tabelas e figuras pertinentes à revisão devem ser apresentadas como descrito anteriormente. Formatação - Arquivos de texto Folha de rosto - conforme descrito acima Texto principal (23.000 caracteres incluindo espaços) Resumo - máximo de 400 palavras Formulação da pergunta - deve seguir as diretrizes descritas em estudos - deve seguir as diretrizes descritas em www.cochrane.org Localização dos www.cochrane.org Avaliação crítica - deve seguir as diretrizes descritas em www.cochrane.org Coleta de dados - deve seguir as diretrizes descritas em www.cochrane.org Análise e apresentação dos dados - deve seguir as diretrizes descritas em www.cochrane.org Aprimoramento - deve seguir as diretrizes descritas em www.cochrane.org 99 Atualização da revisão - deve seguir as diretrizes descritas em www.cochrane.org Referências - não há limite para a quantidade de referências, conforme descrito acima Tabelas - conforme descrito acima Formatação - Arquivos de figuras Figuras - não há limite para a quantidade de figuras, conforme descrito acima Revisão Crítica Em geral, a submissão desse tipo de manuscrito será realizada a convite da Comissão de Publicação da BOR. Autores com expertise em assuntos específicos poderão submeter revisões críticas, mas o aceite do manuscrito para a avaliação no processo de revisão por pares da BOR ficará condicionado à aprovação da Comissão de Publicação. Em todo caso, todos os manuscritos, convidados ou submetidos espontaneamente, serão submetidos à revisão por pares. Este tipo de manuscrito deve ter um conteúdo descritivo-discursivo, com foco numa apresentação e discussão abrangente de questões científicas importantes e inovadoras, e ser limitado a 23.000 caracteres incluindo espaços (considerando-se resumo, descritores, introdução, metodologia, resultados, discussão, conclusão, agradecimentos, tabelas, referências e legendas de figuras). Deve incluir uma apresentação clara do objeto científico de interesse, argumentação lógica, uma análise crítica metodológica e teórica dos estudos e uma conclusão resumida. Revisões críticas devem ser produzidas por estudiosos da área de interesse ou por especialistas renomados. É permitido um máximo de 50 referências. O resumo deve conter, no máximo, 250 palavras. É permitido um máximo de 6 (seis) figuras. Formatação - Arquivos de texto Folha de rosto - conforme descrito acima Texto principal (23.000 caracteres incluindo espaços) Resumo - máximo de 250 palavras 100 Descritores - de 3 (três) a 5 (cinco) descritores principais Introdução - conforme descrito acima Metodologia - conforme descrito acima Resultados - conforme descrito acima Discussão - conforme descrito acima Conclusão - conforme descrito acima Agradecimentos - conforme descrito acima Tabelas - conforme descrito acima Referências - máximo de 50 referências, conforme descrito acima Legendas de figuras - conforme descrito acima Formatação - Arquivos de figuras Figuras - máximo de 6 (seis) figuras, conforme descrito acima Carta ao Editor Cartas devem incluir evidências que sustentem a opinião do(s) autor(es) sobre o conteúdo científico ou editorial da BOR, e ser limitadas a 500 palavras. Figuras ou tabelas não são permitidas. TERMO DE TRANSFERÊNCIA DE DIREITOS AUTORAIS E DECLARAÇÕES DE RESPONSABILIDADE O manuscrito submetido para publicação deve ser acompanhado de um Termo de Transferência de Direitos Autorais e Declarações de Responsabilidade, firmado por todos os autores, conforme o modelo apresentado abaixo. Esse termo deve ser enviado para [email protected], em formato PDF. TERMO DE TRANSFERÊNCIA DE DIREITOS AUTORAIS E DECLARAÇÕES DE RESPONSABILIDADE À Comissão de Publicação da Brazilian Oral Research (BOR) 101 Os autores [inserir os nomes e sobrenomes completos e sem abreviaturas de todos os autores] (doravante denominados "Autores") submetem o manuscrito original intitulado [inserir o título do manuscrito] à Brazilian Oral Research - BOR, representada pela Comissão de Publicação do periódico, e atestam que o manuscrito submetido para publicação (doravante denominado "Manuscrito") é original e não infringe patente, marca registrada, direito autoral, segredo comercial ou quaisquer outros direitos proprietários de terceiros. Os Autores também declaram que, exceto quando explicitamente informado, não têm qualquer interesse financeiro ou acordo com qualquer entidade que possa ser percebido como tendo influência sobre a objetividade do Manuscrito, a não ser que tal interesse financeiro ou acordo tenha sido revelado por escrito à BOR, em documento separado e firmado por todos os Autores. Os Autores declaram ainda que o estudo, cujos resultados estão relatados no Manuscrito, foi realizado observando-se as políticas vigentes nas instituições às quais os Autores estão vinculados relativas ao uso de humanos e/ou animais, e/ou material derivado de humanos ou animais (Aprovação em Comitê de Ética Institucional). Os Autores concordam em indenizar a BOR e em eximi-la de quaisquer alegações, custos, honorários advocatícios, indenizações ou custos de licenças de utilização incorridos pela BOR em consequência de qualquer alegação, infração de direitos, ou não observância das determinações do Comitê de Ética Institucional ocasionadas pela publicação, em todo ou em parte, do Manuscrito. Publicação: Brazilian Oral Research Título do manuscrito: [inserir título completo do manuscrito] Autores: [inserir nomes e sobrenomes completos e sem abreviaturas de todos os autores] Local e data: [inserir local e data] Assinaturas: [inserir as assinaturas de todos os autores] "CHECKLIST" PARA SUBMISSÃO INICIAL 102 Arquivo de folha de rosto (em formato DOC, DOCX ou RTF), contendo os nomes e sobrenomes de todos os autores por extenso, respectivos números de telefone e endereços de Email. O endereço postal completo do autor de correspondência deve ser fornecido. Arquivo do texto principal (manuscrito), em formato DOC, DOCX ou RTF. Termo de transferência de direitos autorais e declarações de responsabilidade, em formato PDF Declaração de interesses e de financiamento, se aplicável, submetida em um documento separado e em formato PDF. Justificativa para a participação de cada um dos autores, se aplicável (mais de 5 autores), fornecida em um documento separado e em formato PDF. Arquivos de figura - Fotografias, micrografias e radiografias (largura mínima de 10 cm e resolução mínima de 300 dpi) em formato TIFF ou JPG; gráficos, desenhos/esquemas e demais ilustrações vetoriais em formato PDF. Todas as figuras devem ser submetidas em arquivos separados (não inseridas no arquivo de texto). EXEMPLOS DE REFERÊNCIAS Periódicos Goracci C, Tavares AU, Fabianelli A, Monticelli F, Raffaelli O, Cardoso PC, et al. The adhesion between fiber posts and root canal walls: comparison between microtensile and push-out bond strength measurements. Eur J Oral Sci. 2004 Aug;112(4):353-61. Bhutta ZA, Darmstadt GL, Hasan BS, Haws RA. Community-based interventions for improving perinatal and neonatal health outcomes in developing countries: a review of the evidence. Pediatrics. 2005;115(2 Suppl):519-617. doi:10.1542/peds.2004-1441. Usunoff KG, Itzev DE, Rolfs A, Schmitt O, Wree A. Nitric oxide synthase-containing neurons in the amygdaloid nuclear complex of the rat. Anat Embryol (Berl). 2006 Oct 103 27; [Epub ahead of print]. Available from: http://www.springerlink.com/content/14320568/. Artigos com Título e Texto em Idioma Diferente do Inglês Li YJ, He X, Liu LN, Lan YY, Wang AM, Wang YL. [Studies on chemical constituents in herb of Polygonum orientale]. Zhongguo Ahong Yao Za Zhi. 2005 Mar;30(6):444-6. Chinese. Suplementos ou Edições Especiais Pucca Junior GA, Lucena EHG, Cawahisa PT. Financing national policy on oral health in Brazil in the context of the Unified Health System. Braz Oral Res. 2010 Aug;24 Spec Iss 1:26-32. Periódicos Online Barata RB, Ribeiro MCS de A, De Sordi M. Desigualdades sociais e homicídios na cidade de São Paulo, 1998. Rev Bras Epidemiol. 2008;11(1):3-13 [citado 23 fev. 2008]. Disponível em: http://www.scielosp.org/pdf/rbepid/v11n1/01.pdf. Livros Stedman TL. Stedman's medical dictionary: a vocabulary ofmedicine and its allied sciences, with pronunciations and derivations. 20th ed. Baltimore: Williams & Wilkins; 1961. 259 p. Livros Online Foley KM, Gelband H, editors. Improving palliative care for cancer [monograph on the Internet]. Washington: National Academy Press; 2001 [cited 2002 Jul 9]. Available from: http://www.nap.edu/books/0309074029/html/. Websites 104 Cancer-Pain.org [homepage on the Internet]. New York: Association of Cancer Online Resources, Inc.; c2000 [cited 2002 Jul 9]. Available from: http://www.cancer-pain.org/. Instituto Brasileiro de Geografia e Estatística [homepage]. Brasília (DF): Instituto Brasileiro de Geografia e Estatística; 2010 [citado 27 nov. 2010]. Disponível em: http://www.ibge.gov.br/home/default.php. World Health Organization [homepage]. Geneva: World Health Organization; 2011 [cited 2011 Jan 17]. Available from: http://www.who.int/en/. 105 5.1. ANEXO 2 106 ANEXO 2 Guide for Authors – Journal of Dentistry http://www.elsevier.com/journals/journal-of-dentistry/0300-5712/guide-for-authors Editor-in-Chief Christopher D. Lynch School of Dentistry Cardiff University Heath Park, Cardiff, CF14 4NQ, UK Email: [email protected] Editorial Office Elsevier Ltd Stover Court Bampfylde Street Exeter EX1 2AH, UK Tel: +44 (0) 1392 285879 Fax: +44 (0) 1865 853132 E-mail: [email protected] The Journal of Dentistry is the leading international dental journal within the field of Restorative Dentistry. Placing an emphasis on publishing novel and high-quality research papers, the Journal aims to influence the practice of dentistry at clinician, research, industry and policy-maker level on an international basis. Topics covered include the management of dental disease, periodontology, endodontology, operative dentistry, fixed and removable prosthodontics, and dental biomaterials science, long-term clinical trials including epidemiology and oral health, dental education, technology transfer of new scientific instrumentation or procedures, as well clinically relevant oral biology and translational research. Submissions are welcomed from other clinically relevant areas, however, the Journal places an emphasis on publishing high-quality and novel research. 107 Queries in relation to manuscript content should be directed to the Journal Editorial Office in the first instance. Submissions The requirements for submission are in accordance with the "Uniform Requirements for Manuscripts Submitted to Biomedical Journals," Annals of Internal Medicine, 1977, 126, 36-47. Authors are requested to submit their original manuscript and figures via the online submission and editorial system for Journal of Dentistry. Using this online system, authors may submit manuscripts and track their progress through the system to publication. Reviewers can download manuscripts and submit their opinions to the editor. Editors can manage the whole submission/review/revise/publish process. Please register at:http://ees.elsevier.com/jjod Authors unable to submit online should contact the Editorial office: Matt Walmsley, Journal Manager, Journal of Dentistry, Elsevier, Bampfylde Street, Exeter, UK, EX1 2AH. [email protected] TEL: +44 (0)1392 285879 Fax: +44 (0)1865 853132. Contributions falling into the following categories will be considered for publication: - Original Research Reports: maximum length 6 printed pages approximately 20 typescript pages, including illustrations and tables. - Review articles: maximum length 10 printed pages, approximately 33 typescript pages, including illustrations and tables. - Short communication for rapid publication: maximum length 2 printed pages, approximately 7 typescript pages, including illustrations. - Letters providing informed comment and constructive criticism of material previously published in the Journal. All typescripts must be accompanied by a Permission Note. This is a letter signed by each author (not just the corresponding author), affirming that the paper has been submitted solely to Journal of Dentistry and that it is not concurrently under consideration for publication in another journal. Prospective authors should confirm that the submitted work, including images, are original. Authors are reminded that if included images (e.g. Tables and Figures) have been previously published may require copyright permission. 108 Authorship: Only those persons who have made a significant contribution to the manuscript submitted should be listed as authors. The Editor-in-Chief expects that a manuscript should normally have no more than 6 authors, unless a case is made by the corresponding author within the article cover letter to include other authors. All of the named authors should have been involved in the work leading to the publication of the paper and should have read the paper before it is submitted for publication. Notes for Typescript Preparation The title page should contain the following information: - Title of paper - Short title - Name(s), job titles and address(es) of author(s) (no academic degrees necessary) - Name, address, telephone, fax and e-mail of the corresponding author - Up to 6 keywords Spelling: International English. Authors are urged to write as concisely as possible. The house style of Journal of Dentistry requires that articles should be arranged in the following order: Title, Abstract, Introduction, Materials and Methods, Results, Discussion, Conclusions, Acknowledgements, References, Tables, Figures. A cover letter should accompany the new manuscript submission, within which the authors should indicate the significance of the work being submitted in a statement no more than 100 words. A signedpermission note (details below) must also be included. Abstract: should not exceed 250 words and should be presented under the following subheadings: Objectives, Methods; Results; Conclusions (For Reviews: Objectives; Data; Sources; Study selection; Conclusions). A 50 word 'Clinical Significance' statement should appear at the end of the abstract advising readers of the clinical importance and relevance of their work. These subheadings should appear in the text of the abstract. Please repeat the title of the article at the top of the abstract page. 109 Introduction: must be presented in a structured format, covering the following subjects, although not under subheadings: succinct statements of the issue in question, and the essence of existing knowledge and understanding pertinent to the issue. In keeping with the house style of Journal of Dentistry, the final paragraph of the introduction should clearly state the aims and/or objective of the work being reported. Prospective authors may find the following form of words to be helpful: "The aim of this paper is to ..." Where appropriate, a hypothesis (e.g. null or a priori) should then be stated. Keywords: up to 6 keywords should be supplied. Abbreviations and acronyms: terms and names to be referred to in the form of abbreviations or acronyms must be given in full when first mentioned. Units: SI units should be used throughout. If non-SI units must be quoted, the SI equivalent must immediately follow in parentheses. The complete names of individual teeth must be given in the test. In tables and legends for illustrations individual teeth should be identified using the FDI two-digit system. Statistics Statistical methods should be described with enough detail to enable a knowledgeable reader with access to the original data to verify the reported results. When possible, findings should be quantified and appropriate measures of error or uncertainty (such as confidence intervals) given. Details about eligibility criteria for subjects, randomization and the number of observations should be included. The computer software and the statistical method(s) used should be specified with references to standard works when possible (with pages specified). Seehttp://www.icmje.org/manuscript_1prepare.html for more detailed guidelines. References: These should appear in the text in numerical order and should follow a modified form of the Vancouver Reference system (details may be found at http://www.icmje.org/index.html#reference. Please note that the house style of the Journal of Dentistry is different from the standard Vancouver reference style in that it includes a requirement: 110 - to refer to the name of the Journal in full - to put the name of the Journal in Italics - to put the volume number in bold Examples as follows: Journal articles Lynch CD, Frazier KB, McConnell RJ, Blum IR, Wilson NHF. State-of-the-art techniques in Operative Dentistry: contemporary teaching of posterior composites in UK and Irish dental schools. British Dental Journal 2010; 209: 129 - 36. Wilson NHF, Mjör I. The teaching of class I and class II direct composite restorations in European dental schools.Journal of Dentistry 2000; 28: 15-21. Please note that in-press/ accepted articles that are awaiting assignment of page numbers should be cited including their DOI number (Digital Object Identifier), for example: Books Lynch CD. Successful posterior composites. London: Quintessence Publishing Co., 2008. Book chapters Phillips SJ, Whisnant JP. The role of dentine under restorations. In: Laragh JH, Brenner BM, editors. The science of restorative dentistry. 2nd ed. Oxford: Elsevier; 2003. p.26678. If there are seven or more authors please list the first six and et al., otherwise list all authors. Journal titles should be given in full. If websites are used as references, the full URL should be cited, along with the date on which it was accessed. Illustrations: should be submitted electronically using appropriate commercial software. Prospective authors should follow the relevant guidelines (available from: http://www.elsevier.com/artworkinstructions). In addition, it is noted that while authors sometimes need to manipulate images for clarity, manipulation for purposes of 111 deception or fraud will be seen as scientific ethical abuse and will be dealt with accordingly. For graphical images, journals published by Elsevier apply the following policy: no specific feature within an image may be enhanced, obscured, moved, removed, or introduced. Adjustments of brightness, contrast, or color balance are acceptable if and as long as they do not obscure or eliminate any information present in the original. Nonlinear adjustments (e.g. changes to gamma settings) must be disclosed in the figure legend. Offprints and page charges: no page charges are levied on articles published in Journal of Dentistry. The corresponding author, at no cost, will be provided with a PDF file of the article via e-mail. The PDF file is a watermarked version of the published article and includes a cover sheet with the journal cover image and a disclaimer outlining the terms and conditions of use. The Editor and Publisher reserve the right to make such corrections to typescripts as may be necessary for clarity of expression, or to conform to the style required. Randomised controlled trials: All randomised controlled trials submitted for publication in Journal of Dentistryshould include a completed Consolidated Standards of Reporting Trials (CONSORT) flow chart. Submitted manuscripts that do not include this flow chart, where appropriate, will be rejected without entering the review process. Please refer to the CONSORT statement website at http://www.consort- statement.org for more information. Journal of Dentistry has adopted the proposal from the International Committee of Medical Journal Editors (ICMJE) which require, as a condition of consideration for publication of clinical trials, registration in a public trials registry. Trials must register at or before the onset of patient enrolment. The clinical trial registration number should be included at the end of the abstract of the article. For this purpose, a clinical trial is defined as any research study that prospectively assigns human participants or groups of humans to one or more health-related interventions to evaluate the effects of health outcomes. Health-related interventions include any intervention used to modify a biomedical or health-related outcome (for example drugs, surgical procedures, devices, behavioural treatments, dietary interventions, and processof-care changes). Health outcomes include any biomedical or health-related measures obtained in patients or participants, including pharmacokinetic measures and adverse events. Purely observational studies (those in which the assignment of the medical 112 intervention is not at the discretion of the investigator) will not require registration. Further information can be found at http://www.icmje.org Disclosure of Clinical Trial Results: In line with the position of the International Committee of Medical Journal Editors , the journal will not consider results posted in the same clinical trials registry in which primary registration resides to be prior publication if the results posted are presented in the form of a brief structured (less than 500 words) abstract or table. However, divulging results in other circumstances (eg, investors' meetings) is discouraged and may jeopardise consideration of the manuscript. Authors should fully disclose all posting in registries of results of the same or closely related work. Patient consent: Studies on patients or volunteers require ethics committee approval and informed consent which should be documented in your paper. Patients have a right to privacy. Therefore identifying information, including patients images, names, initials, or hospital numbers, should not be included in videos, recordings, written descriptions, photographs, and pedigrees unless the information is essential for scientific purposes and you have obtained written informed consent for publication in print and electronic form from the patient (or parent, guardian or next of kin where applicable). If such consent is made subject to any conditions, Elsevier must be made aware of all such conditions. Written consents must be provided to Elsevier on request. Even where consent has been given, identifying details should be omitted if they are not essential. If identifying characteristics are altered to protect anonymity, such as in genetic pedigrees, authors should provide assurance that alterations do not distort scientific meaning and editors should so note. If such consent has not been obtained, personal details of patients included in any part of the paper and in any supplementary materials (including all illustrations and videos) must be removed before submission. Proofs: Proofs will be sent to the author (first-named author if no corresponding author is identified on multi-authored papers) by PDF wherever possible and should be returned within 48 hours of receipt, preferably by e-mail. Corrections should be restricted to typesetting errors; any other amendments made may be charged to the author. Any queries should be answered in full. Elsevier will do everything possible to get your article corrected and published as quickly and accurately as possible. 113 Therefore, it is important to ensure that all of your corrections are returned to us in one all-inclusive e-mail or fax. Subsequent additional corrections will not be possible, so please ensure that your first communication is complete. Should you choose to mail your corrections, please return them to: Log-in Department, Elsevier, Stover Court, Bampfylde Street, Exeter, Devon EX1 2AH, UK. Funding body agreements and policies Elsevier has established agreements and developed policies to allow authors whose articles appear in journals published by Elsevier, to comply with potential manuscript archiving requirements as specified as conditions of their grant awards. To learn more about existing agreements and policies please visithttp://www.elsevier.com/fundingbodies The decision of the Editor-in-Chief is final in relation to all manuscript submissions. Updated September 2011
Download