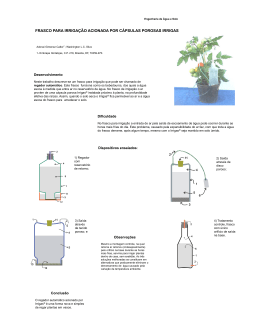
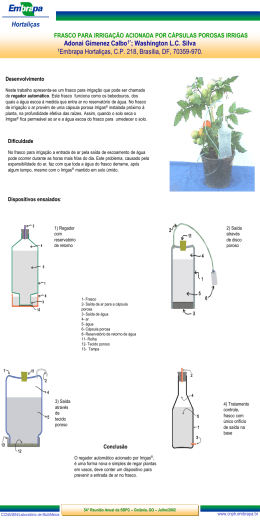
Elementos de Microscopia e Microanálise Docente: Profª Drª Maria Tercília V. A. Oliveira Discente: Bruna Victorasso Jardim CULTURA CELULAR Definição Conjunto de técnicas que permitem cultivar células fora do organismo dadas as condições apropriadas Tecidos Humanos Animais Vegetais IN VITRO X IN VIVO Histórico Cultivou células de embrião de aves e, solução salina aquecida Wilhen Roux - 1885 Pioneiro no cultivo celular de animais Ross Harrison - 1907 Hipótese Doutrina do neurônio Origem do axônio - cada fibra nervosa é o produto de uma única célula nervosa e não da fusão de várias. • fragmentos de tecido da medula espinhal de anfíbios • linfas coaguladas como meio de cultura • armazenadas em câmara úmida e morna • microscópio – intervalos regulares de tempo • células nervosas individuais com um axônio cada Base para a cultura celular 1ª limitação Desenvolvimento de meios nutritivos Burrows – 1910 Plasma de aves nutrir explantes de tec. embrionário -Subculturas para prolongar a vida das células - utilizando meio nutritivo Plasma Alexis Carrel Extratos de embrião Rous e Jones - 1916 Tripsina para dissociar células embrionárias 2ª Limitação Contaminação Desenvolvimento de condições assépticas - Cultivou células de embrião de aves por + de 30 anos Células dividiam indefinidamente extrato de embrião de galinha Alexis Carrel - 1913 1940 1940 - Surgimento dos antibióticos Avanços com alguns destaques 1ª linha celular contínua Células epiteliais humanas procedentes de carcinoma cervical células HeLa George Gey - 1952 - Utilizou meios indefinidos e complexos Plasma de aves Extrato de embrião bovino Cordão umbilical humano Dificuldade para analisar a composição específica para cada tipo celular se desenvolver e funcionar normalmente Fator de crescimento nervoso estimula o crescimento dos axónios em cultura de tecidos Stanley Cohen - 1954 Harry Eagle – 1955 Investigou os requerimentos nutritivos das células em cultivo Sais Glicose Aminoácidos Vitaminas + Soro de proteínas Células cultivadas em condições experimentais definidas Meio Basal de Eagle (BME) aa essencias Meio Mínimo Essencial de Eagle (MEM) + aa Meio MEM modificado por Dulbecco (DMEM) 4x + aa Soro fetal bovino Células morrem após um número finito de divisões em cultura Leonard Hayflick e Paul Moorhead - 1961 Fibroblastos jovens Fibroblastos velhos Ham -1965 1º meio livre de soro capaz de manter algumas células de mamíferos em cultivo quimicamente definido Sais Glicose Vitaminas Pequenas moléculas Proteínas específicas Aminoácidos Possibilitou o estudo de moléculas sinalizadoras extracelulares Essenciais para sobrevivência, desenvolvimento e proliferação de tipos de células específicos Sobreviver e proliferar Transferrina Fatores de crescimento Harris e Watkins - 1965 1º heterocário de células de mamíferos pela fusão Humano Camundongo Mitose crs. no mesmo núcleo células híbridas Linhagens com composição cromossômica = Localizar genes no genoma e banco de DNA de crs. específicos + = Augusti- Tocco e Sato - 1969 1ª linhagem celular estável a partir de uma célula tumoral de nefroblastoma de camumdongo eletricamente excitáveis 1975 1ª linhagem celular produtora de anticorpos monoclonais hibridomas Cesar Milstein George Kohler Linfócitos B do baço com antígeno do anticorpo desejado inoculado + Células de mieloma que se reproduzem em cultura indefinitamente Células produzindo o anticorpo desejado Hayashi e Sato – 1976 Trabalhos demonstrando: = linhagens celulares = misturas de hormônios e fatores de crescimento Células crescerem em meios livres de soro 1977 1º introduzir genes de cópias únicas de mamíferos in vitro Michael Wigler Richard Axel Gene que codifica a enzima timidina quinase em células com esse gene deficiente Avanço na cultura celular pela possibilidade de produzir proteínas terapêuticas em grande escala Martin Evans -1986 Isolou e cultivou células totipotentes de ratos James Thomson e John Gearhart – 1998 Isolaram e mantiveram vivas in vitro células embrionárias humanas Bactéria X Cultivadas em suspensão Duplicação em 30 min. Células de tecido Cultivadas em superfície sólida Duplicação em 18 - 24 hrs Células Componentes específicos da Matriz Extracelular Colágeno Laminina Tipos de cultura celular Cultura primária – preparada diretamente do tecido de um organismo, com ou sem fracionamento inicial das células Cultura secundária – a partir de células retiradas da placa de cultura primária Subcultivos Promove nova fonte de nutrientes e espaço para o crescimento contínuo de linhagens celulares Linhagem de células Células morrem após um nº finito de divisões em cultura Mutação Células imortais – proliferam indefinidamente linhagem de células Podem ser armazenadas em N líquido e continuarem viáveis Linhagem de células podem ser preparadas a partir de células de câncer Proliferam-se em altas densidades Crescem sem se fixarem a uma superfície • Linhagem de células normais transformadas Vírus indutor Substâncias químicas Linhagens celulares são importantes na pesquisa celular alta quantidade de células de um determinado tipo Não são idênticas Clonagem celular • Uma célula isolada origina a cultura • Células geneticamente idênticas Importância = linhagens de células mutantes com defeito em um gene específico Função da proteína em células normais Aplicações Reproduzir fenômenos que ocorrem in vivo mas que são inacessíveis adicionar ou remover moléculas específicas Estudo da fisiologia e metabolismo de células específicas Estudar interações entre vários tipos de células – culturas mistas Estudo de neoplasias Testar drogas ou compostos químicos Possibilidade de gerar tecidos artificiais Produção de proteínas terapêuticas Vantagens Reprodutibilidade dos resultados -Linhagem de células clonais -Controle das condições ambientais Possibilidade de selecionar uma população de células específicas Conhecimento do comportamento e função das células selecionadas Desvantagens Perda das características – cultivo longo Necessidade de marcadores Confiabilidade dos resultados in vivo – ex: drogas Contaminação Cuidados Biossegurança Sala separada especial Esterilizar todos os materiais e equipamentos com álcool 70 Luz UV Usar: luvas estéreis, máscara... Não reutilizar materiais Material biológico lixo separado Protocolo para cultivo celular Cultivo de celulas de câncer de mama • Biopsia do tecido • meio de congelamento meio de cultura + DMSO + antibiótico • 2 horas em geladeira • 30 min a 5 cm do N liquido (p congelar aos poucos) • armazenar em N Liquido Protocolo para cultivo celular Cultivo de células de câncer de mama Biópsia do tecido Coletada e armazenada em meio de transporte - 100 ml meio RPMI - 1 ml de antibiótico 3 ml -Tubo falcon Preparação inicial limpeza com álcool e UV 20 min Meio de cultura, PBS, tripsina – banho maria a 37ºC Preparo do meio de cultura 20 ml soro fetal bovino 1 ml antibiótico/antimicótico 1 ml L-glutamina 100 ml de meio de cultura RPMI 1640 Processamento do fragmento tumoral Lavar o tumor com PBS (4x – 2 min) Tesoura ou bisturi 1 ml de meio RPMI 1640 no frasco T-25 Estufa 37ºC – 5% CO2 1 ou 2 dias depois adicionar 1ml de meio lentamente para não soltar as células Trocar o meio de cultura a cada 2 dias Retirar o meio com a pipeta 4ml de meio – frasco T-25 8 ml de meio – frasco T-75 O meio deve ser descartado com hipoclororito Subculturas Retirar o meio de cultura Lavar com PBS 1X Retirar o PBS Adicionar 2 ml de tripsina Aguardar 4 –10 min o desprendimento das células Passar todo conteúdo do frasco para outro frasco Adicionar 2 ml de meio de cultura Colocar na estufa 37ºC – 5% CO2 Capela de fluxo para cultura celular Placa six-wells Congelamento de células Tripsinizar Colocar em tubo falcon Centrifugar a 1600 rpm – 5 min Desprezar o sobrenadante e ressuspender o pellet em 900 ul de meio e 100 ul de DMSO Passar para criotubo Geladeira por 30 min Frezeer – 80ºC – 24 hrs Nitrogênio líquido Descongelamento das células Retirar o criotubo do N líquido Banho maria a 37ºC – 90 seg. Transferir para tubo falcon 15ml contendo: 10 ml de meio Centrifugar – 5min Retirar o sobrenadante e ressuspender o pellet de células em meio de cultura Transferir para frasco T-25 Estufa Invertoscópio 4x 10x 10 40x Fungo 4x e 10x Obrigada
Baixar