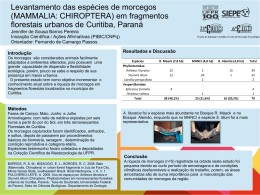
Mastozoología Neotropical, 22(1):55-62, Mendoza, 2015 Versión impresa ISSN 0327-9383 Versión on-line ISSN 1666-0536 Copyright ©SAREM, 2015 http://www.sarem.org.ar Artículo ASSEMBLEIA DE MORCEGOS EM REMANESCENTE DE FLORESTA OMBRÓFILA MISTA NO PLANALTO DE GUARAPUAVA, PARANÁ, BRASIL João M. D. Miranda1 e Luciana Zago2 Departamento de Biologia. Universidade Estadual do Centro-Oeste do Paraná. Campus CEDETEG. Rua: Simeão Camargo Varela de Sá, 03. Vila Carli. Guarapuava, Paraná, Brasil. CEP 85040-080. [Correspondência: João M. D. Miranda <[email protected]>] 2 Programa de Pós-graduação em Ecologia e Conservação. Universidade Federal do Paraná. Campus Centro Politécnico. Setor de Ciências Biológicas. Jardim das Américas, Curitiba, Paraná, Brasil. Caixa Postal: 19031. CEP 81531-990. 1 RESUMO. A Mata Atlântica é um dos ecossistemas mais ameaçados e ricos do mundo, contando com cerca de 113 espécies de morcegos. O objetivo do presente estudo foi caracterizar a assembléia de morcegos de um remanescente de Floresta Ombrófila Mista a 1100 metros de altitude, no planalto de Guarapuava, estado do Paraná, Brasil. Os morcegos foram capturados com dez redes de neblina instaladas acima do solo em 24 noites de amostragem durante 12 meses. Um total de 160 capturas de 144 indivíduos foi realizado, sendo estes distribuídos em dez espécies, com a família Vespertilionidae sendo a mais representativa. A riqueza estimada (Chao2) foi de 12.75 ± 4.14 espécies. Sturnira lilium e Molossus molossus foram as espécies mais abundantes, com 36 capturas cada. Os morcegos insetívoros dominaram a assembléia tanto em número de espécies quanto em número de indivíduos capturados. Sugerimos que essa assembléia possa ser caracterizada como uma fauna tipicamente subtropical de altitude e pode ser relacionada aos ambientes de Floresta Ombrófila Mista, em especial acima dos 1000 metros de altitude. ABSTRACT. Bat assemblage in a remnant of Araucaria Pine Forest at Guarapuava Highlands, Paraná State, Brazil. The Atlantic Forest is one of the most rich and threatened ecosystems in the world, and has about 113 bat species. The aim of this study was to characterize the bat assemblage in a remnant of Araucaria Pine Forest at 1100 meters of altitude, at Guarapuava Highlands, Paraná State, Brazil. Bats were caught with ten mist nets installed above ground in 24 night sampling distributed in 12 months. A total of 160 catches of 144 individuals was performed, these being allotted to ten species, and the Vespertilionidae family being the most represented. The estimated richness (Chao2) was 12.75 ± 4.14 species. Sturnira lilium and Molossus molossus were the most abundant species with 36 catches to each. The insectivore bats dominate the assemblage both in number of species and number of individuals captured. We suggest that this assemblage can be characterized as a typical subtropical highland fauna and be related to environments of Araucaria Pine Forest, especially above 1000 meters of altitude. Palavras-chave: Chiroptera. Inventário de morcegos. Mata Atlântica. Vespertilionidae. Key words: Atlantic rainforest. Bat inventory. Chiroptera. Vespertilionidae. Recibido 17 febrero 2014. Aceptado 10 febrero 2015. Editor asociado: D Astúa de Moraes 56 Mastozoología Neotropical, 22(1):55-62, Mendoza, 2015 http://www.sarem.org.ar INTRODUÇÃO A Mata Atlântica foi uma das maiores florestas tropicais do mundo, abrigando uma das maiores biodiversidades conhecidas e contando com um grande número de endemismos (Fonseca, 1985). Atualmente esse bioma conta com uma área remanescente estimada dentre 11 e 16% de sua área original (Ribeiro et al., 2009) e consta entre os 25 hotspots ou áreas prioritárias para a conservação do mundo (Myers et al., 2000). Esse status é conferido principalmente em função do número de endemismos e de seu atual quadro de destruição (Myers et al., 2000). Existem cerca de 300 espécies de mamíferos ocorrentes na Mata Atlântica, sendo que 30% dessas são endêmicas (Paglia et al., 2012). Atualmente no Brasil são registradas 178 espécies de morcegos, das quais ao menos 113 espécies ocorrem na Mata Atlântica (Nogueira et al., 2014). Porém, a despeito da grande riqueza de morcegos na Mata Atlântica, dados sobre a biologia e a ecologia desses animais permanecem insuficientemente conhecidos (Bernard et al., 2010). Embora a Mata Atlântica seja o bioma mais estudado e conhecido do Brasil (Chiarello et al., 2008; Bernard et al., 2010), poucos são os estudos que caracterizam as estruturas de suas assembléias (e.g., Bianconi et al., 2004; Arnone e Passos, 2007; Bernardi e Passos, 2012; Carvalho et al., 2013). A maior parte do conhecimento sobre os morcegos da Mata Atlântica se concentra nas regiões próximas às grandes cidades das regiões Sul e Sudeste do Brasil (Bernard et al., 2010), especialmente nas fisionomias da Floresta Ombrófila Densa (Floresta Atlântica stritcu sensu) e na Floresta Estacional Semidicidual (Floresta Atlântica de Interior), sendo raros os estudos na Floresta Ombrófila Mista (Floresta com Araucária) (Miretzki, 2003; Pacheco et al., 2007) assim como também são raros os estudos em regiões mais altas (>1000 metros de altitude) (e.g., Nobre et al., 2009, 2013; Moras et al., 2013). A Floresta Ombrófila Mista ocorre principalmente na região subtropical do Brasil e tipicamente acima dos 800 metros de altitude (Maack, 2010). Essa formação florestal é onde se encontram os climas mais frios do Brasil JMD Miranda e L Zago com invernos severos e com geadas freqüentes (Maack, 2010; IAPAR, 2013). O objetivo do presente trabalho foi descrever uma assembleia de morcegos ocorrente em um remanescente de Floresta Ombrófila Mista localizado no Planalto de Guarapuava a 1100 metros de altitude, no estado do Paraná, sul do Brasil. MATERIAIS E MÉTODOS O estudo foi realizado no Parque Municipal das Araucárias (PMA) localizado no Município de Guarapuava, no estado do Paraná (25º21’16”S; 51º28’58”W). O PMA está inserido no bioma da Mata Atlântica e possui uma área total de 104 ha com 41 ha ocupados pela formação fitofisionômica Floresta Ombrófila Mista ou Floresta de Araucária (Cordeiro e Rodrigues, 2007). Além da Floresta Ombrófila Mista, o PMA também possui áreas de Campos Naturais e Várzeas (Cordeiro e Rodrigues, 2007; Hiert e Moura, 2007). O PMA encontra-se no limite entre a zona urbana e rural de Guarapuava e está inserido em uma matriz agro-florestal, sendo que suas áreas naturais podem ser consideradas contínuas a outras áreas incluindo a Área de Proteção Ambiental Serra da Esperança com 206.555ha (IAP, 2009). O clima da região pode ser classificado como Cfb ou Subtropical Úmido Mesotérmico sem estação seca definida (Cordeiro e Rodrigues, 2007). A temperatura média mensal é de 17.1 oC, sendo a média do mês mais quente (janeiro) de 20.8oC e do mês mais frio (julho) de 12.8oC com uma precipitação anual média entre 1800 e 2000 mm (IAPAR, 2013). Foram realizadas 12 fases de campo mensais entre setembro de 2012 e agosto de 2013. Foram amostradas duas noites consecutivas por mês, totalizando 24 noites. A cada noite foram armadas dez redes de neblina, sendo seis redes de 6x3 m e quatro de 9x3 m. Essas redes foram armadas a aproximados 50 cm da altura do solo em trilhas já existentes, clareiras, próximo a riachos, potenciais fontes alimentares e possíveis abrigos, visando amostrar uma maior variedade de habitats. As redes permaneceram abertas por seis horas após o pôr-do-sol, sendo revisadas em intervalos de 30 minutos a 1 hora, totalizando um esforço de 31104 m².h (segundo o proposto por Straube e Bianconi, 2002). Os morcegos capturados foram acondicionados em sacos de algodão e levados à base de campo para triagem. A triagem constituiu na identificação e marcação com anilhas metálicas numeradas para cada indivíduo. Os morcegos foram identificados segundo as chaves de Gardner (2008) e Miranda et al. (2011). Os primeiros exemplares capturados de 57 MORCEGOS DO PARQUE MUNICIPAL DAS ARAUCÁRIAS cada espécie foram coletados e tombados na Coleção Científica de Mastozoologia da Universidade Federal do Paraná como material testemunho do trabalho segundo a licença 34884-1 (ICMBio). As capturas, o manejo e os procedimentos dos animais seguiram as indicações da American Society of Mammalogists (Sikes et al., 2011). O sucesso de captura foi calculado a partir da divisão do número total de capturas pelo esforço amostral e foi representado em número de capturas/m2.h. A riqueza estimada de morcegos foi calculada através do estimador não paramétrico Chao de segunda ordem (Chao2) através de 1000 re-amostragens (bootstraping) dos dados originais. A avaliação do esforço amostral foi feita através da análise de complementariedade, dada pela percentagem das espécies registradas em relação ao número estimado de espécies. Além disso, também foi construída uma curva de rarefação baseada em um algoritmo de função γ-log para aleatorizações das amostras (Krebs, 1989). Cada espécie de morcego registrada foi avaliada quanto à guilda trófica (GT), número de indivíduos capturados (N), taxa de recaptura (REC), abundância relativa (AR) e índice de constância (IC). As GTs foram baseados em Gardner (1977) e Simmons e Voss (1998). A REC foi dada pela percentagem de indivíduos recapturados em relação ao total de capturas de uma dada espécie. A AR foi dada pela percentagem de indivíduos capturados de cada espécie em relação ao total de morcegos capturado. O IC foi calculado pela frequência (percentagem) de fases de campo em que cada espécie foi registrada (Bianconi et al., 2004; Carvalho et al., 2013). Baseando-se no IC as espécies foram classificadas como: Comum (IC≥50%), Intermediária (25%≤IC<50%) ou Rara (IC<25%). Todas as análises foram desenvolvidas no Software PAST® versão 2.14 (Hammer, 2012) e o nível de significância considerado foi de p < 0.05. RESULTADOS Foram realizadas 160 capturas (incluindo 16 recapturas de cinco espécies), sendo registrados 144 indivíduos e uma taxa de 10% de recapturas. O sucesso de captura foi de 0.0051 capturas/m2.h. Foram registradas dez espécies pertencentes a oito gêneros e três famílias (Tabela 1). A riqueza estimada para o PMA foi de 12.75 ± 4.14 espécies (Chao2), indicando que a presente amostragem foi de 78.4% da riqueza estimada. A análise de rarefação indica que 90% das espécies amostradas seriam atingidas Tabela 1 Morcegos registrados no Parque Municipal das Araucárias, Guarapuava, Paraná, seguidos por seus respectivos: guildas tróficas (GT), número de indivíduos capturados (N) (número de recapturas entre parênteses), taxa de recapturas (REC), abundância aelativa (AR) e índice de constância (C). FRU = Frugívoros; INS = Insetívoros Aéreos; CO = comum; INT = intermediária; RA = rara. Táxon GT N REC AR IC Artibeus fimbriatus Gray, 1838 FRU 2 - 1.4% RA Pygoderma bilabiatum (Wagner, 1843) FRU 1 - 0.7% RA Sturnira lilium (É. Geoffroy, 1810) FRU 36 (5) 12.2% 25% CO INS 36 (7) 16.3% 25% CO Eptesicus furinalis (d’Orbigny, 1847) INS 12 - 8.3% CO Eptesicus taddeii Miranda, Bernardi & Passos, 2006 INS 13 - 9% CO Histiotus velatus (I. Geoffroy, 1824) INS 14 (2) 12.5% 9.7% CO Lasiurus blossevillii (Lesson & Garnot, 1826) INS 1 - 0.7% RA Myotis izecksohni Moratelli, Peracchi, Dias & Oliveira, 2011 INS 16 (1) 5.9% 11.1% INT Myotis ruber (É. Geoffroy, 1806) INS 13 (1) 7.1% 9% CO Família Phyllostomidae Família Molossidae Molossus molossus (Pallas, 1766) Familia Vespertilionidae 58 Mastozoología Neotropical, 22(1):55-62, Mendoza, 2015 http://www.sarem.org.ar com 85 indivíduos capturados. A curva de rarefação indica uma estabilização a partir de 20 capturas, porém, permanece subindo até o final das amostragens (Fig. 1). As espécies mais abundantes foram Sturnira lilium e Molossus molossus que somadas representaram 50% do total de capturas (Fig. 2A). A assembléia apresentou mais espécies comuns que espécies raras ou intermediárias (Fig. 2B; Tabela 1). Sturnira lilium, M. molossus e H. velatus apresentaram as maiores taxas de recapturas (>12%). Por outro lado, P. bilabiatum, L. blossevillii e A. fimbriatus foram as espécies com menores abundâncias relativas e foram consideradas raras. A guilda trófica mais representada em número de espécies e em número de indivíduos capturados foi de morcegos insetívoros, contando com sete espécies e 65.3% dos indivíduos (Tabela 1). DISCUSSÃO O esforço utilizado no presente trabalho foi suficiente para amostrar quase 80% da riqueza estimada de morcegos do PMA, embora a curva de rarefação não tenha apontado uma estabilização no aumento da riqueza. O valor de sucesso de captura foi baixo comparado a outros estudos realizados na Mata Atlântica (e.g., Bernardi e Passos, 2009; Nobre et al., 2009; Carvalho et al., 2009; 2013), porém foi maior ou similar outros estudos (e.g., Bianconi et al., 2004; Arnone e Passos, 2007; Moras et JMD Miranda e L Zago al., 2013; Nobre et al., 2013). Comparativamente a outros estudos na mata Atlântica brasileira a riqueza foi baixa (e.g., Bianconi et al., 2004; Arnone e Passos, 2007; Bernardi e Passos, 2009; Carvalho et al., 2013), porém foi similar a outras áreas de montanhas ou em planaltos (e.g., Modesto et al., 2008; Nobre et al., 2009; Moras et al., 2013). Esses baixos valores parecem ser relativos à altitude e ao clima subtropical encontrado na área de estudo. De fato, Patterson et al. (1996) apontaram que existe uma relação negativa entre a altitude e a riqueza e também em relação ao número de capturas. Além disso, Stevens (2013) apontou que a latitude e a altitude seriam os principais fatores afetando a riqueza das assembléias de morcegos de Mata Atlântica. Bergallo et al. (2003) basearam-se em dados da região sudeste do Brasil e sugeriram que um esforço entre 750 e 1000 capturas seria capaz de avaliar adequadamente assembleias de morcegos da Mata Atlântica. Por outro lado, em altas latitudes ou altitudes (ambos os fatores caracterizando ambientes mais frios) torna-se muito difícil atingir esse total de capturas, sendo necessários vários anos de amostragens para tal (extrapolando com base em nossa taxa de captura). Assim é possível que em regiões com menor riqueza de espécies como no sul do Brasil (Passos et al., 2010; Stevens, 2013) um menor esforço de capturas seja capaz de amostrar adequadamente a riqueza de morcegos de uma determinada localidade. A riqueza registrada no presente trabalho representa 5.6% das 178 espécies de morcegos registradas para o Brasil (Nogueira et al., 2014), 8.8% daquelas registradas para a Mata Atlântica Fig. 1. Curva de rarefação de espécies (±95%; intervalo de confiança) morcegos em função no número de indivíduos capturados no Parque Municipal das Araucárias, Guarapuava, Paraná, Brasil. MORCEGOS DO PARQUE MUNICIPAL DAS ARAUCÁRIAS 59 Fig. 2. (A) Abundância relativa e (B) Índice de constância de cada espécie registrada no Parque Municipal das Araucárias, Guarapuava, Paraná, Brasil. (Paglia et al., 2012), 15.6% daquelas registradas para o Paraná (Passos et al., 2010) e 30% das espécies registradas para a formação da Floresta Ombrófila Mista (Miretzki, 2003; Marques et al., 2011). Além disso, o presente estudo acrescenta cinco novas espécies (A. fimbriatus, P. bilabiatum, E. taddeii, E. furinalis e M. izecksohni) à lista de mamíferos do Município de Guarapuava (Valle et al., 2011), considerado parte de uma região prioritária para inventários de morcegos (Miretzki, 2003; Bernard et al., 2010). Em conformidade com outros estudos realizados no sul do Brasil, S. lilium consta como a espécie mais abundante ou entre as mais abundantes das assembléias de morcegos, incluindo áreas urbanas (e.g., Reis et al., 2000; Arnone e Passos, 2007; Zanon e Reis, 2007; Miranda et al., 2008, 2009; Bernardi e Passos, 2012; Pires e Fabián, 2013). Já a abundância relativa de M. molossus encontrada no presente trabalho pode ser explicada pelo grande número de capturas realizadas próximas a um abrigo (oco de árvore-imbuia, Ocotea porosa). Além disso, M. molossus é considerada uma espécie bastante comum e apresenta uma ampla distribuição geográfica, ocorrendo em uma grande variedade de habitats, incluindo áreas alteradas e urbanas (Fábian e Gregorin, 2007; Gardner, 2008; Bernardi et al., 2009; Passos et al., 2009; Pacheco et al., 2010). Essas duas espécies comuns sendo as mais abundantes na assembléia do PMA podem indicar as alterações do ambiente bem como sua proximidade com a área urbana de Guarapuava. A assembleia de morcegos do PMA apresentou mais espécies comuns que espécies intermediárias e raras, assim como foi encontrado também por Bianconi et al. (2004). Quatro dessas espécies comuns estavam entre as que apresentam alguma recaptura (Tabela 1). Tanto a constância quanto a presença de recapturas podem indicar que essas espécies possuem áreas de vida mais restritas e podem ser fiéis à área (Flemming et al., 1972; Kaku-Oliveira et al., 2011). Os morcegos que apresentam abrigos permanentes tendem a apresentar fidelidade à área do abrigo (Kunz e Lumsden, 2003), como foi para M. molossus e possivelmente também para S. lilium, H. velatus, M. izecksohni e M. ruber no presente estudo. Ao contrário do que ocorre de maneira geral na Mata Atlântica onde os morcegos frugívoros dominam as assembléias (e.g., Reis et al., 2000; Bianconi et al., 2004; Faria et al., 2006; Bernardi e Passos, 2012), no presente estudo os morcegos insetívoros dominaram a comunidade. A família Vespertilionidae foi a mais representativa contando com o maior número de espécies (6) e também de indivíduos capturados (45.1% 60 Mastozoología Neotropical, 22(1):55-62, Mendoza, 2015 http://www.sarem.org.ar dos indivíduos). Em outras localidades amostradas de Floresta Ombrófila Mista, a família Verpertilionidae também apresentou a maior riqueza (Miranda et al., 2008; Pulchério-Leite, 2008; Marques et al., 2011). Além disso, outras formações fitofisionômicas da Mata Atlântica amostradas em maiores altitudes ou latitudes também mostram uma maior riqueza de morcegos vespertilionídeos em detrimento de morcegos de outras famílias (Bernardi et al., 2009; Bracamonte, 2010; Mohr et al., 2011; Bernardi e Passos, 2012). A substituição de morcegos filostomídeos por vespertilionídeos em regiões de maiores altitudes e/ou latitudes parece ligada às limitações impostas pela temperatura sobre os primeiros, uma vez que a família Phyllostomidae em geral possui uma distribuição tipicamente tropical com poucas espécies alcançando os subtrópicos (Willig e Secler, 1989; Willig et al. 2000; Stevens 2004). Por outro lado, as espécies da família Vespertilionidae ocorrem tanto nos trópicos quanto nos subtropicos além de regiões temperadas (Willig e Selcer 1989; Willig et al. 2000). Essa maior riqueza de morcegos vespertilionídeos também parece ser uma característica das assembleias de morcegos subtropicais (Willig e Selcer, 1989), como observado no presente trabalho. Miretzki (2003) apontou que a região centrosul do Paraná é prioritária para estudos com morcegos. O presente trabalho, além de aumentar a lista de espécies de morcegos do município (Valle et al., 2011) em cinco espécies, registra algumas espécies relativamente incomuns e recém descritas como M. ruber, M. izekshoni e E. taddeii. Trabalhos de levantamentos possuem uma importância ligada ao fornecimento de dados sobre a ocorrência e a distribuição de espécies, bem como sobre a caracterização de suas assembléias. Assim, trabalhos como este são essenciais para a elaboração de estratégias de conservação e políticas públicas voltadas à conservação da natureza (Bernard et al., 2010; 2013). AGRADECIMENTOS Agradecemos à CAPES pela bolsa de estudos concedida à Luciana Zago. Agradecemos também o valoroso auxílio em campo das seguintes pessoas: Sidnei Pressinate Júnior, Keyti JMD Miranda e L Zago Lílian da Silva, Luana Almeida Pereira, Sabrina Marchioro Gonçalves e Katrin Goede. LITERATURA CITADA ARNONE IS e FC PASSOS. 2007. Estrutura de comunidade da quiropterofauna (Mammalia, Chiroptera) do Parque Estadual de Campinhos, Paraná, Brasil. Revista Brasileira de Zoologia 24(3):573-581. BERGALLO HG,CEL ESBÉRARD, MA MELLO, V LINS, GGS MELO e M BAPTISTA. 2003. Bat species richness in Atlantic Forest: What is the minimum effort? Biotropica 35:278-288. BERNARD E, LMS AGUIAR e RB MACHADO. 2010. Discovering the Brazilian bat fauna: A task for two centuries? Mammal Review 2010:1-17. BERNARD E, JL NASCIMENTO e LMS AGUIAR. 2013. Flagging a species as threatned: The case of Eptesicus taddeii, an endemic bat from the Brazilian Atlantic Forest. Biota Neotropica 13(2):314-318. BERNARDI IP e FC PASSOS. 2012. Estrutura de comunidade de morcegos em relictos de Floresta Estacional Decidual no sul do Brasil. Mastozoologia Neotropical 19(1):1-12. BERNARDI IP, JMD MIRANDA, J SPONCHIADO, E G ROTTO, FF JACOMASSA, EM TEIXEIRA, SH ROANI e FC PASSOS. 2009. Morcegos de Frederico Westphalen, Rio Grande do Sul, Brasil (Mammalia: Chiroptera); riqueza e utilização de abrigos. Biota Neotropica 9(3):349-354. BIANCONI GV, SB MIKICH e WA PEDRO. 2004. Diversidade de morcegos (Mammalia, Chiroptera) em remanescentes florestais do município de Fênix, noroeste do Paraná, Brasil. Revista Brasileira de Zoologia 21(4):943-954. BRACAMONTE JC. 2010. Murciélagos de bosque montano del Parque Provincial Potrero de Yala, Jujuy, Argentina. Mastozoologia Neotropical 17(2):361-366. CARVALHO F, JJ ZOCCHE e RA MENDONÇA. 2009. Morcegos (Mammalia, Chiroptera) em restinga no município de Jaguaruna, sul de Santa Catarina, Brasil. Biotemas 22(3):193-201. CARVALHO F, ME FABIÁN e JO MENEGHETI. 2013. Vertical structure of an assemblage of bats (Mammalia: Chiroptera) in a fragment of Atlantic Forest in Southern Brazil. Zoologia 30(5):491-498. CHIARELLO AG, LMS AGUIAR, R CERQUEIRA, FR MELO, FHG RODRIGUES e VMF SILVA. 2008. Mamíferos ameaçados de extinção no Brasil. Pp. 681874, em: Livro Vermelho da fauna brasileira ameaçada de extinção (A Machado, GM Drummond e AP Paglia, eds.). FNMA/Fundação Biodiversitas, Belo Horizonte. CORDEIRO J e WA RODRIGUES. 2007. Caracterização fitossociológica de um remanescente de Floresta Ombrófila Mista em Guarapuava, PR. Revista Árvore 31(3):545-554. FABIÁN ME e R GREGORIN. 2007. Família Molossidae. Pp. 149-165, em: Morcegos do Brasil (NR Reis, AL Peracchi, WA Pedro e IP Lima, eds.). Nélio R. dos Reis, Londrina. MORCEGOS DO PARQUE MUNICIPAL DAS ARAUCÁRIAS FARIA D, B SOARES-SANTOS e E SAMPAIO. 2006. Bats from the Atlantic rainforest of Southern Bahia, Brazil. Biota Neotropica 6(2):1-13. FLEMING TH, ET HOOPER e DE WILSON. 1972. Three Central American communities: Structure, reproductive cycles, and movement patterns. Ecology 53(4):556-569. FONSECA GAB. 1985. The vanishing Brazilian Atlantic Forest. Biological Conservation 34:17-34. GARDNER AL. 1977. Feeding habits. Pp. 293-350, em: Biology of bats of the New World family Phyllostomidae, part II (RJ Baker, JK Jones Jr e DC Carter, eds.). Special Publications of Texas Tech University 13. GARDNER AL. 2008. Mammals of South America. Volume 1. Marsupials, Xenarthrans, Schrews and Bats. The University of Chicago Press, Chicago. HAMMER Ø. 2012. PAST. Paleontological Statistic. Version 2.14. Reference Manual. Natural History Museum University of Oslo, Oslo. HIERT C e MO MOURA. 2007. Anfíbios do Parque Municipal das Araucárias, Guarapuava, Paraná. UNICENTRO, Guarapuava. INSTITUTO AGRONÔMICO DO PARANÁ. 2013. Cartas Climáticas do Paraná: Estação Guarapuava: Médias Históricas. IAPAR, Curitiba. http://www.iapar.br/ arquivos/Image/monitoramento/Medias_Historicas/ Guarapuava.htm INSTITUTO AMBIENTAL DO PARANÁ. 2009. Plano de Manejo da Área de Proteção Ambiental da Serra da Esperança. IAP, Curitiba. http://www.iap.pr.gov. br/arquivos/File/Plano_de_Manejo/APA_Serra_da_ Esperanca/capaPM.pdf KAKU-OLIVEIRA NY, LC MUNSTER e FC PASSOS. 2011. Dinâmica populacional de morcegos filostomídeos na Reserva Natural do Salto Morato, Guaraqueçaba, Estado do Paraná, Brasil. Chiroptera Neotropical 17 (supl.):53-57. KREBS CJ. 1989. Ecological Methodology. Harper & Row, Nova Yorque. KUNZ TH e LF LUMSDEN. 2003. Ecology of cavity and foliage roosting bats. Pp. 3-89, em: Bat Ecology (TH Kunz e MB Fenton, eds.). The University of Chicago Press, Chicago. MAACK R. 2010. Geografia física do Estado do Paraná. 3ª ed. UEPG, Ponta Grossa. MARQUES RV, CV CADEMARTORI e SM PACHECO. 2011. Mastofauna no Planalto das Araucárias, Rio Grande do Sul, Brasil. Revista Brasileira de Biociências 9(3):278-288. MIRANDA JMD, IP BERNARDI e FC PASSOS. 2011. Chave ilustrada para determinação dos morcegos da Região Sul do Brasil. João M.D. Miranda, Curitiba. MIRANDA JMD, RF MORO-RIOS e FC PASSOS. 2008. Contribuição ao conhecimento dos mamíferos dos Campos de Palmas, Paraná, Brasil. Biotemas 21(2):97-103. MIRANDA JMD, RF MORO-RIOS, JE SILVA-PEREIRA e FC PASSOS. 2009. Mamíferos da Serra de São Luiz do Purunã, Paraná, Brasil. USEB, Pelotas. MIRETZKI M. 2003. Morcegos do Estado do Paraná, Brasil (Mammalia, Chiroptera): riqueza de espécies, 61 distribuição e síntese do conhecimento atual. Papéis Avulsos de Zoologia 43(6):101-138. MODE STO TC , FS PE S S ÔA, MC E N RIC I , N ATTIAS, T JORDÃO-NOGUEIRA, LM COSTA, HG A LBUQUERQUE e HG BERGALLO. 2008. Mamíferos do Parque Estadual do Desengano, Rio de Janeiro, Brasil. Check List 4:341-348. MORAS LM, E BERNARD e R GREGORIN. 2013. Bat assemblage at a high-altitude área in the Atlantic Forest of southeastern Brazil. Mastozoologia Neotropical 20(2):269-278. MOHR H, EF ABREU JÚNIOR, PF KUESTER e A KÖHLER. 2011. Levantamento de morcegos do município de Santa Cruz do Sul, Rio Grande do Sul, Brasil. Chiroptera Neotropical 17 (supl.):122-125. MYERS N, RA MITTERMEIER, CG MITTERMEIER, GAB FONSECA e J KENT. 2000. Biodiversity hotspots for conservation priorities. Nature 403:853-858. NOBRE PH, AS RODRIGUES, IA COSTA, AES MOREIRA e HH MOREIRA. 2009. Similaridade da fauna de Chiroptera (Mammalia), da Serra Negra, monicípios de Rio Preto e Santa Bárbara do Monte Verde, Minas Gerais, com outras localidades da Mata Atlântica. Biota Neotropica 9(3):151-156. NOBRE PH, MA MANHÃES, OJ BASTOS NETO, AC R EZENDE e AS RODRIGUES. 2013. Bat assemblages from moutain forest areas in the Serra Negra region, southeastern Brazil. Mastozoologia Neotropical 20(2):279-287. NOGUEIRA MR, IP LIMA, R MORATELLI,VC TAVARES, R GREGORIN e AL PERACCHI. 2014. Checklist of Brazilian bats, with comments on original records. Check List 10(4):808-821. PACHECO SM, ML SEKIAMA, KPA OLIVEIRA, F Q UINTELA, MM WEBER, RV MARQUES e DD SILVEIRA. 2007. Biogeografia de quirópteros da Região Sul do Brasil. Ciência e Ambiente 35:181-202. PACHECO SM, M SODRÉ, AR GAMA, A BREDT, EM CAVALLINI-SANCHES, RV MARQUES, MM GUIMARÃES e GV BIANCONI. 2010. Morcegos urbanos: status do conhecimento e plano de ação para conservação no Brasil. Chiroptera Neotropical 16(1):629-647. PAG L IA A P, G A B F ON SE C A , A B RY L A N D S , G HERRMANN, LMS AGUIAR, AG CHIARELLO, YLR LEITE, LP COSTA, S SICILIANO, MCM KIERULFF, SL MENDES, VC TAVARES, RA MITTERMEIER e JL PATTON. 2012. Lista Anotada dos Mamíferos do Brasil - 2ª Edição. Occasional Papers in Conservation Biology 6:1-76. PASSOS FC, NY KAKU-OLIVEIRA, LC MUNSTER, MFM A ZEVEDO-BARROS e JMD MIRANDA. 2009. Ordem Chiroptera. Pp.103-148, em: Mamíferos da Serra de São Luiz do Purunã, Paraná, Brasil (JMD Miranda, RF Moro-Rios, JE Silva-Pereira e FC Passos, eds.). USEB, Pelotas. PASSOS FC, JMD MIRANDA, IP BERNARDI, NY KAKU-OLIVEIRA e LC MUNSTER. 2010. Morcegos da região sul do Brasil: análise comparativa da riqueza de espécies, novos registros e atualizações nomenclaturais (Mammalia, Chiroptera). Iheringia, Série Zoologia 100(1):25-34. 62 Mastozoología Neotropical, 22(1):55-62, Mendoza, 2015 http://www.sarem.org.ar PATTERSON BD, V PACHECO e S SOLARI. 1996. Distributions of bats along an elevational gradient in the Andes of south-eastern Peru. Journal of Zoology 240:637-658. PIRES DPS e ME FABIÁN. 2013. Diversidade, riqueza e estratificação vertical de espécies de morcegos em um remanescente de Mata Atlântica no Sul do Brasil. Biotemas 26(4):121-131. PULCHÉRIO-LEITE A. 2008. Uso do espaço por Artibeus lituratus e Sturnira lilium (Chiroptera: Phyllostomidae) em fragmentos florestais urbanos de Curitiba, Paraná. Tese de doutorado inédita. Pós-Graduação em Zoologia, Universidade Federal do Paraná, Curitiba, Brasil. REIS NR, AL PERACCHI, ML SEKIAMA e IP LIMA. 2000. Diversidade de morcegos (Chiroptera, Mammalia) em fragmentos florestais no estado do Paraná, Brasil. Revista Brasileira de Zoologia 17 (3): 697-704. RIBEIRO MC, JP METZGER, AC MARTENSEN, F PONZONI e M HIROTA. 2009. Brazilian Atlantic forest: How much is left and how is the remaining forest distributed? Implications for conservation. Biological Conservation 142:1141-1153 SIKES RS, WL GANNON e THE ANIMAL CARE AND USE COMMITTEE OF THE AMERICAN SOCIETY OF MAMMALOGISTS. 2011. Guidelines of the American Society of Mammalogists for the use of wild mammals in research. Journal of Mammalogy 92(1):235-253. SIMMONS NB e RS VOSS. 1998. The mammals of Paracou, French Guiana: a neotropical lowland rainforest fauna part 1. Bats. Bulletin of the American Museum of Natural History 237: 1-279. JMD Miranda e L Zago STEVENS RD. 2004. Untangling latitudinal richness gradients at higher taxonomic levels: Familial perspectives on the diversity of New World bat communities. Journal of Biogeography 31:665-674. STEVENS RD. 2013. Gradients of bat diversity in Atlantic Forest of South America: Environmental seasonality, sampling effort and spatial autocorrelation. Biotropica 45(6):764-770 STRAUBE FC e GV BIANCONI. 2002. Sobre a grandeza e a unidade utilizada para estimar o esforço de captura com utilização de redes-de-neblina. Chiroptera Neotropical 8:150-152. VALLE LGE, HF VOGEL, BM SUGAYAMA, R METRI, J GAZARINI e CH ZAWADZKI. 2011. Mamíferos de Guarapuava, Paraná, Brasil. Revista Brasileira de Zoociências 13(1, 2, 3):151-162. WILLIG MR e KW SELCER. 1989. Bat species density gradients in the New World: A statistical assessment. Journal of Biogeography 16:189-195. WILLIG MR, SJ PRESLEY, RD OWEN e C LÓPEZGONZÁLEZ. 2000. Composition and structure of bat assemblages in Paraguay: A subtropicaltemperate interface. Journal of Mammalog y 81(2):386-401. ZANON CMV e NR REIS. 2007. Bats (Mammalia, Chiroptera) in the Ponta Grossa region, Campos Gerais, Paraná, Brazil. Revista Brasileira de Zoologia 24(2):327-332.
Baixar