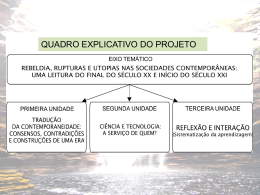
REORIENTAÇÃO CURRICULAR QUÍMICA Materiais Didáticos REORIENTAÇÃO CURRICULAR - EQUIPE UFRJ Direção Geral Profª. Ângela Rocha Doutora em Matemática – Instituto de Matemática da UFRJ Coordenação Geral Profª. Maria Cristina Rigoni Costa Doutora em Língua Portuguesa – Faculdade de Letras da UFRJ Coordenação de Química Isabella Ribeiro Faria Coordenadora de Programa de Extensão da Fundação CECIERJ/ Consórcio CEDERJ da Secretaria de Ciência e Tecnologia do Estado do Rio de Janeiro e Profª Especialista em Ensino de Química para Ensino Médio pela PUC-RJ Professores Orientadores José Guilherme da Silva Mestre em Educação pela Faculdade de Educação da Universidade Federal do Rio de Janeiro e Professor de Química do Colégio Estadual Antônio Prado Júnior Isabella Ribeiro Faria Coordenadora de Programa de Extensão em Química da Fundação CECIERJ/ Consórcio CEDERJ da Secretaria de Ciência e Tecnologia do Estado do Rio de Janeiro e Profª. Especialista em Ensino de Química para Ensino médio pela PUC-RJ Professores Autores Adriana Cardoso Franco Adriano Alves Passos Alita Mara Pereira Cleber Luciano Silva Nascimento C.E. Carlos Magno E.E.E.S. Chile C.E. Bangu C.I.E.P. 225 Mario Quintana Elaine Antunes Bobeda Elza dos Santos Coelho Francisco José da Silva Ferreira Jackson Ramualdo Machado Lucia T. Oliveira de Menezes Maria Aparecida Cordas Soares Mary Lucia da Silva Monique F. Petrucci Conceição Nilsa Maria Aureliano Marconsin Rosana Gós Vasconcellos Sandra Maria Lírio de Almeida Sandro Paulo Assumpção Oliveira C.E. Irmã Dulce C.E. Conselheiro Macedo Soares C.E. Frederico Azevedo C.I.E.P. 165 Brigadeiro Sergio Carvalho C.E. Professor Antonio Maria Teixeira Filho C.E. Marechal Souza Dantas C.E. João Alfredo C.E. Professor Antonio Maria Teixeira Filho C.I.E.P. 435 Helio Pellegrino E.E. Francisco Fontes Torres C.E. Jacintho Xavier Martins C.E. Olavo Josino de Salles Design da Capa Duplo Design www.duplodesign.com.br Diagramação Aline Santiago Ferreira Marcelo Mazzini Coelho Teixeira Thomás Baptista Oliveira Cavalcanti Duplo Design - www.duplodesign.com.br Duplo Design - www.duplodesign.com.br Tipostudio - www.tipostudio.com.br Prezados (as) Professores (as) Visando promover a melhoria da qualidade do ensino, a Secretaria de Estado de Educação do Rio de Janeiro realizou, ao longo de 2005, em parceria com a UFRJ, curso para os professores docentes de diferentes disciplinas onde foram apropriados os conceitos e diretrizes propostos na Reorientação Curricular. A partir de subsídios teóricos, os professores produziram materiais de práticas pedagógicas para utilização em sala de aula que integram este fascículo. O produto elaborado pelos próprios professores da Rede consiste em materiais orientadores para que cada disciplina possa trabalhar a nova proposta curricular, no dia a dia da sala de aula. Pode ser considerado um roteiro com sugestões para que os professores regentes, de todas as escolas, possam trabalhar a sua disciplina com os diferentes recursos disponibilizados na escola. O material produzido representa a consolidação da proposta de Reorientação Curricular, amadurecida durante dois anos (2004-2005), na perspectiva da relação teoria-prática. Cabe ressaltar que a Reorientação Curricular é uma proposta que ganha contornos diferentes face à contextualização de cada escola. Assim apresentamos, nestes volumes, sugestões que serão redimensionadas de acordo com os valores e práticas de cada docente. Esta ação objetiva propiciar a implementação de um currículo que, em sintonia com as novas demandas sociais, busque o enfrentamento da complexidade que caracteriza este novo século. Nesta perspectiva, é necessário envolver toda escola no importante trabalho de construção de práticas pedagógicas voltadas para a formação de alunos cidadãos, compromissados com a ordem democrática. Certos de que cada um imprimirá a sua marca pessoal, esperamos estar contribuindo para que os docentes busquem novos horizontes e consolidem novos saberes e expressamos os agradecimentos da SEE/RJ aos professores da rede pública estadual de ensino do Rio de Janeiro e a todo corpo docente da UFRJ envolvidos neste projeto. Claudio Mendonça Secretário de Estado de Educação SUMÁRIO 15 Arpresentação 17 1ª série do Ensino Médio 19 Construção de um densímetro Item curricular: Propriedades da matéria Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 22 Classificando substâncias Item curricular: Substâncias puras simples e compostas e misturas – Modelo de Bolas Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 25 Experiência de Rutherford Item curricular: Modelo atômico Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 28 Alquimia cósmica Item curricular: Radioatividade Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 35 Conhecendo a Química Item curricular: Teoria de Dalton; Evolução dos modelos atômicos; Constante de Avogadro; Linguagem química Nilsa Maria Aureliano Marcosin 41 2ª série do Ensino Médio 43 Atividade de Química orgânica Item curricular: Funções orgânicas Adriana Cardoso Franco, Cleber Luciano Silva Nascimento, Elaine Antunes Bobeda 46 Condutibilidade Item curricular: Comportamento químico das substâncias Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 50 Modelo atômico – estudo do carbono Item curricular: Ligações químicas de compostos orgânicos Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 55 Polaridade da água Item curricular: Ligações químicas Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 58 Reações químicas Item curricular: Reações químicas Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 61 3ª série do Ensino Médio 63 Cinética química Item curricular: Cinética química Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 66 Combustão Item curricular: Termoquímica Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 70 Combustão da vela Item curricular: Termoquímica Alita Mara Pereira, Sandra Maria Lírio de Almeida 73 Eletrólise em solução aquosa com eletrodos inertes Item curricular: Eletroquímica Sandro Paulo Assumpção Oliveira 76 Equilíbrio químico Item curricular: Equilíbrio químico Adriano Alves Passos, Francisco José da Silva Ferreira, Jackson Ramualdo Machado 81 Fabricação do papel indicador de repolho roxo Item curricular: Comportamento químico das substâncias Adriano Alves Passos, Francisco José da Silva Ferreira, Jackson Ramualdo Machado 87 Endotérmico ou exotérmico Item curricular: Termoquímica Elza dos Santos Coelho, Lucia T. Oliveira de Menezes, Mary Lucia da Silva, Monique F. Petrucci Conceição, Rosana Gós Vasconcellos 90 Termoquímica Item curricular: Termoquímica Maria Aparecida Cordas Soares Química APRESENTAÇÃO O trabalho aqui apresentado pretende se constituir em uma contribuição na aproximação dos conteúdos do ensino de Química no nível médio e a realidade escolar de alunos e professores da Rede Estadual de Ensino do Rio de Janeiro. Para tal, descreve, orientando os professores para o uso, uma série de atividades práticas relacionadas aos conteúdos do ensino de Química, todas elas de baixo custo e a serem desenvolvidas com materiais facilmente encontráveis no dia-a-dia de professores e alunos das escolas estaduais. Pretende-se, com essa aproximação, superar o formalismo que vinha presidindo os currículos do ensino de Química e que vinha gerando dificuldades de toda ordem para a aprendizagem dos conteúdos, na medida em que dificultava aos alunos a associação com qualquer elemento de suas vidas reais, mantendo-se no mero campo da abstração – o que, sabe-se hoje, constitui entrave à aprendizagem. Nesse sentido, pretende-se, com este trabalho, permitir aos educandos o entendimento a respeito da presença da química na sua vida cotidiana e, com isso, tornar mais efetiva a necessária integração da escola com a vida, dos conhecimentos escolares com os conhecimentos do senso comum, tornando a atividade escolar mais do que uma mera obrigação voltada à conquista de um diploma. A escola e seus saberes integrados à vida efetivam uma abertura para o desenvolvimento das formas de interação dos sujeitos sociais com o mundo, na medida em que permite, por meio dos conhecimentos escolares, que os educandos melhor compreendam o mundo à sua volta, ampliando, desse modo, suas possibilidades de intervenção. A ruptura com o formalismo e a introdução de atividades práticas e relacionadas à vida cotidiana dos alunos constitui, assim, mais uma forma de permitir à escola o cumprimento de uma de suas mais importantes funções socialmente reconhecidas e preconizadas em lei, a da formação para o exercício consciente da cidadania. Romper com as barreiras historicamente constituídas entre a vida escolar e a vida cidadã é, hoje, uma dimensão relevante das obrigações do educador que pretende ser mais do que um mero reprodutor da estrutura social vigente ou um elo na corrente de perpetuação das desigualdades sociais. Apresentação 15 Assim sendo, através da apresentação e orientação para o uso, de atividades práticas relacionadas aos conteúdos mínimos do ensino de química no nível médio da Rede Estadual de ensino, o presente trabalho volta-se para a correção dos rumos da escolarização dos adolescentes do nosso Estado, tornando-a mais adequada aos anseios e necessidades dos seus usuários e, por isso, uma escola de melhor qualidade, porque comprometida com interesses e necessidades da população. Isabella Ribeiro Faria José Guilherme da Silva QUÍMICA 1ª SÉRIE Ensino Médio Janeiro de 2006 Química CONSTRUÇÃO DE UM DENSÍMETRO Item curricular Propriedades da Matéria Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO O ponto de fusão (PF) e o ponto de ebulição (PE) são propriedades que podem ser utilizadas para caracterizar e identificar as substâncias; bem como a densidade. Densidade (d) é definida como a razão entre a massa (m) de um material e o volume (V) por ele ocupado. d = m/V , onde d é geralmente expressa em: g/cm³ ou g/L ou Kg/m³. OBJETIVOS DE APRENDIZADO É importante que o aluno perceba que uma substância é melhor caracterizada quanto maior for o número de propriedades conhecidas referentes a ela. A densidade é um conceito um pouco difícil de ser assimilado. A finalidade deste simples experimento é auxiliar o aluno a melhor compreendê-lo. O densímetro é um aparelho utilizado para determinar a densidade de líquidos, por exemplo, em indústrias de bebidas alcoólicas (vinho, pinga, cerveja etc.). É, também, utilizado em postos de gasolina para determinar a densidade dos combustíveis (álcool ou gasolina), indicando se estão de acordo com os padrões estabelecidos por lei. Quando o densímetro é colocado em um líquido, ele indica a densidade do líquido pela graduação existente na haste superior do aparelho. Construção de um Densímetro 19 RECURSOS NECESSÁRIOS - Massa de modelar - 1/2 canudo de refrigerante - 4 copos - Água - Óleo - Solução de água salgada - Álcool comum - Caneta de retroprojetor de cores diferentes ROTEIRO DA ATIVIDADE - Com a massa de modelar, faça uma bolinha de, aproximadamente, 1 cm de diâmetro e fixe-a numa das extremidades do (1/2) canudo; - Coloque o densímetro num copo com água e marque (com a caneta de retroprojetor) com cuidado o nível que a água atinge no canudo. Com isso, você terá a marca da densidade da água. - A seguir, coloque o densímetro nos outros 3 (três) copos contendo, respectivamente, água salgada, óleo e álcool comum. - Para cada líquido, faça uma marca, utilizando canetas de cores diferentes. - No final do experimento, o professor poderá fazer uma comprovação dos resultados obtidos adicionando em um copo, lentamente, água + óleo + álcool, nesta ordem, tomando cuidado para não deixar o álcool se misturar com a água. QUESTÕES SUGERIDAS Sabendo que quanto menor a densidade do líquido, mais submerso ficará o densímetro, responda as seguintes perguntas: 1) Qual desses líquidos é o mais denso? 2) E qual é o menos denso? Cite apenas um. 3) Qual a ordem crescente (do menor para o maior) dos líquidos analisados? 4) Qual deles é mais denso que a água? 5) Se repetirmos as mesmas experiências utilizando volumes diferentes de líquidos, as densidades também serão diferentes? Por quê? REFERÊNCIA BIBLIOGRÁFICA USBERCO & SALVADOR. Química. Vol. 1. São Paulo: Saraiva, 2000. 20 1ª série do Ensino Médio Química PARA O PROFESSOR Conhecimentos prévios É importante que o aluno conheça bem: - As unidades de medida, utilizadas em Química, para quantificar massa e volume; - Como determinar a massa de um corpo em laboratório (uso da balança); - Como determinar o volume de um corpo, em laboratório (uso da proveta). Resultados esperados - O líquido mais denso é a água salgada. - Um dos líquidos menos denso é o álcool. - Álcool < óleo < água < água salgada. - Não. Pois a razão (relação) entre a massa e o volume (m/V) permanecerá constante. Construção de um Densímetro 21 CLASSIFICANDO SUBSTÂNCIAS Item curricular Substâncias Puras Simples e Compostas e Misturas – Modelo de Bolas Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO O foco de estudo de um cientista é chamado de sistema. Para os químicos, os sistemas são classificados em homogêneos ou heterogêneos. Os sistemas homogêneos podem ser formados por: Substância Pura: formado por uma única substância. Sistemas Homogêneos Mistura Homogênea: formado por mais de uma substância numa mesma fase. As substâncias podem ser classificadas em substâncias simples (formadas por um único elemento químico) ou em substâncias compostas (formadas por vários elementos químicos). OBJETIVOS DE APRENDIZADO - Compreender o conceito de modelo. - Caracterizar diferentes sistemas materiais, a fim de conceituar substâncias puras e misturas. - Distinguir substâncias simples de substâncias compostas. - Compreender a diferença entre elemento químico e átomo. - Observar que moléculas iguais caracterizam uma substância, seja ela simples ou composta. 22 1ª série do Ensino Médio Química RECURSOS NECESSÁRIOS - Contas ou miçangas, com no mínimo 0,5cm de diâmetro, em três cores diferentes. Sugestão: 40 contas de uma cor, 25 de outra e mais 5 de uma terceira cor. - Linha de costura ou fio de nylon. ROTEIRO DA ATIVIDADE Misturar todas as “moléculas” e colocar em cima de uma superfície plana (pode ser a mesa do professor) e pedir para os alunos se aproximarem. Poderão vir em grupos ou todos ao mesmo tempo, dependendo do total de alunos na turma. CONTEÚDOS A SEREM TRABALHADOS Depois dos alunos observarem os conjuntos, perguntar: a) Quantos átomos temos ao todo? b) Quantos elementos químicos diferentes estão ali representados? c) Quantas moléculas? d) Quantas substâncias temos ao todo representadas nos modelos? e) Separar os conjuntos iguais e classificar esses sistemas. f) Identificar as substâncias simples e as compostas. g) Misturar dois conjuntos e classificar o sistema separado. h) Conceituar misturas e substâncias puras. REFERÊNCIAS BIBLIOGRÁFICAS OLIVEIRA, Edson Albuquerque de. Aulas Práticas de Química - volume único. São Paulo: Moderna. 1986. SILVA, Ronaldo Henriques da e SILVA, Edson Braga da. Curso de Química - vol.1. São Paulo: Harbra, 1992. FELTRE, Ricardo. Química - vol.1. São Paulo: Moderna, 1995. NOVAIS, Vera Lúcia Duarte de. Química – vol.1. São Paulo: Atual, 1993. LEMBO, Antônio. Química – Realidade e contexto – volume 1. São Paulo: Ática, 2004. Classificando Substâncias 23 PARA O PROFESSOR Conhecimentos prévios Átomos, moléculas, elementos químicos. Modelo de bolas. Atividades a serem realizadas antes do uso do material Professor, nesta atividade cada conta representa um átomo. Contas de cores diferentes representam elementos químicos diferentes. Cada conjunto de contas está representando uma molécula de uma substância. Conjuntos iguais, moléculas da mesma substância química. Montar conjuntos amarrando as contas e com a linha ou fio de nylon conforme os esquemas apresentados a seguir: Devem ser montados pelo menos cinco conjuntos de cada. Resultados esperados a) 65 átomos (65 contas ao todo). b) 3 elementos químicos (3 cores diferentes de contas). c) 25 moléculas (25 conjuntos). d) 5 substâncias (5 conjuntos diferentes, cada um representando uma substância). e) Serão separados 5 grupos de moléculas de iguais e identificar esses sistemas como substâncias puras. f) Temos três substâncias simples (conjuntos formados por contas da mesma cor) e duas substâncias compostas (conjuntos formados por contas de cores diferentes). g) Ao misturarmos dois conjuntos de substâncias simples, mostrar que agora temos uma mistura. h) Classificamos um sistema em substância pura quando ele é formado por uma substância somente. Temos uma mistura se o sistema for formado por mais de uma substância. Equívocos do senso comum É importante mostrar ao aluno que moléculas iguais representam uma substância. Que átomos iguais representam o mesmo elemento químico. O aluno deve perceber que uma substância composta é uma substância pura. E que podemos ter uma mistura de substâncias simples. 24 1ª série do Ensino Médio Química EXPERIÊNCIA DE RUTHERFORD Item curricular Modelo Atômico Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO Em 1896, Becquerel, físico francês, iniciou o estudo de compostos de urânio e percebeu que estes manchavam filmes fotográficos. Ele explicou tais acontecimentos levantando a hipótese de que o urânio deveria emitir radiações de maneira espontânea. Pouco tempo depois destas descobertas, o físico neozelandês E. Rutherford e o físico francês P. Villard descobriram a existência de três tipos de radiações que foram denominadas alfa (α), beta (β) e gama (γ). Anos mais tarde Ernest Rutherford realizou a experiência com a lâmina de ouro sendo bombardeada por partículas alfa. A análise dos resultados dessa experiência levou a um novo modelo atômico. OBJETIVOS DE APRENDIZADO - Compreender que a radioatividade é um fenômeno natural que, uma vez conhecido, vem sendo utilizado com diferentes finalidades; - Relacionar a atividade com a experiência do bombardeamento por partículas α em uma placa de ouro para a proposta do modelo atômico de Rutherford. RECURSOS NECESSÁRIOS - Pedaço de tela ou peneira com malha de tamanho suficiente para a passagem do grão utilizado. - Grãos de arroz, milho ou feijão (de acordo com o tamanho malha da tela utilizada). Experiência de Rutherford 25 ROTEIRO DA ATIVIDADE Pegar um punhado de grãos e arremessar em direção à tela. Deve-se, primeiramente, verificar se o tamanho da malha da tela permite a passagem do grão escolhido. É necessário que os grãos ultrapassem, porém alguns irão se chocar com os fios da tela e não ultrapassarão o obstáculo. QUESTÕES SUGERIDAS 1- O que acontece quando atiramos os grãos em direção à tela? 2- Por que alguns grãos não conseguem atravessar? 3- O que este experimento tem a ver com a experiência de Rutherford? REFERÊNCIAS BIBLIOGRÁFICAS LEMBO, Antônio. Química – Realidade e contexto. São Paulo: Ática, 2004. 26 1ª série do Ensino Médio Química PARA O PROFESSOR Conhecimentos prévios - Modelo atômico de Dalton. Atividades a serem realizadas antes do uso do material Caso utilize tela, fazer um bastidor ou prendê-la em algum suporte para que possa ser segurada com alguma firmeza. Resultados esperados 1- Alguns grãos atravessam a tela e outros não. 2- Porque eles se chocam com a malha que forma a tela, ou seja, existe um obstáculo para que o grão não atravesse. 3- Quando Rutherford bomboardeou uma fina placa de ouro com partículas alfa (+), algumas destas partículas colidiram com o núcleo do átomo, retornando, outras partículas foram repelidas pelo núcleo, desviando sua trajetória, e muitas passaram sem nenhum problema. Com isso, o cientista identificou a eletrosfera e o núcleo do átomo Explorações adicionais Podem ser explorados os malefícios e benefícios da radiação, a utilização do carbono 14 para determinação da idade de rochas, fósseis e objetos arqueológicos, os reatores nucleares, as bombas atômicas e os acidentes nucleares por meio de textos informativos ou reportagens de jornais ou revistas. Transdisciplinaridade - Efeitos biológicos da radiação (biologia). - Determinação de datas com carbono 14 (biologia, geografia e história). - Usinas nucleares (química, biologia e geografia). - Bombas atômicas (química e história). Experiência de Rutherford 27 ALQUIMIA CÓSMICA Item curricular Radioatividade Roteiro para Aula Prática de Química INTRODUÇÃO As reações químicas que comumente são estudadas envolvem as mudanças na estrutura eletrônica externa das espécies químicas. Por outro lado, reações nucleares resultam de uma mudança que ocorre no núcleo do átomo. Um núcleo instável sofre uma reação denominada decomposição radioativa ou decaimento. Se o fenômeno ocorrer espontaneamente, a decomposição é denominada radioatividade natural; se for provocado em laboratório, radioatividade artificial. As radiações emitidas pelas reações nucleares naturais podem ser desviadas por um campo elétrico ou magnético e separadas, caracteristicamente, por três tipos: 1) emissão alfa (α): sofrem pequeno desvio em direção à placa carregada negativamente, apresentam baixo poder de penetração. 2) emissão beta (β): sofrem grande desvio em direção à placa carregada positivamente, apresentam moderado poder de penetração. 3) emissão gama (γ): não sofrem desvio em sua trajetória e atravessam a chapa fotográfica, apresentam alto poder de penetração. Para concluir, cabe ainda mencionar três conceitos fundamentais desse tema: transmutação - transformação de um elemento químico em outro, por emissão espontânea ou por bombardeamento de núcleos com partículas α, β etc.; fissão nuclear - ocorre quando núcleos instáveis são bombardeados, originando 2 núcleos atômicos médios; e fusão nuclear - junção de 2 ou mais núcleos leves originando um único núcleo e grande liberação de energia. OBJETIVOS DO APRENDIZADO - Compreender que a radioatividade é um fenômeno natural que, uma vez conhecido, vem sendo utilizado com diferentes finalidades. - Compreender os conceitos de fissão e fusão nucleares, reconhecendo algumas de suas aplicações. 28 1ª série do Ensino Médio Química RECURSOS NECESSÁRIOS Texto proposto para a atividade - A ALQUIMIA CÓSMICA - Marcelo Gleiser Alquimia Cósmica Marcelo Gleiser Durante a Idade Média e até o início do século 18, alquimistas tentaram um feito impossível: a transmutação de elementos químicos, em particular chumbo, em ouro, usando reações químicas comuns. O impossível aqui, como foi descoberto bem mais tarde, não é a transmutação dos elementos em si, mas fazê-lo usando reações com energias típicas de reações químicas, baseadas na troca de elétrons entre elementos. O problema é que a identidade de um elemento químico, se é hidrogênio, carbono ou manganês, não vem do número de elétrons circulando em torno de seu núcleo, mas do de prótons no núcleo. Hidrogênio, o elemento mais simples e mais comum no Universo, tem apenas um próton no núcleo. Hélio, o próximo, tem dois. Leitores familiarizados com a Tabela Periódica sabem que os elementos são arranjados (da esquerda para direita) de acordo com o seu “número atômico”, o número de prótons no núcleo. Ouro tem 79 e chumbo, 82. Transmutação só é possível quando muda o número de prótons no núcleo. Para isso, são necessárias reações nucleares com energia milhões de vezes maiores do que as energias típicas das reações químicas. Não dá para aquecer chumbo com um foguinho, misturá-lo com outros compostos e obter ouro. O que não significa que a alquimia não tenha sido importante para o desenvolvimento da química, especialmente devido à identificação de vários elementos. Mas a verdadeira alquimia precisa da física nuclear. Bem antes de existirem alquimistas humanos, uns 13 bilhões de anos antes, o Universo já realizava o suposto milagre da transmutação no coração das estrelas. É impossível olhar o mundo à nossa volta e não se perguntar de onde vieram os elementos químicos que compõem as coisas da natureza. Pedras, plantas, água, animais, carros, poluição, tudo é composto por 92 elementos, do hidrogênio ao urânio, combinados em moléculas. A origem desses elementos está profundamente ligada à história cósmica. E nós também, já que somos feitos desses elementos. Durante o primeiro minuto de sua existência, o Universo não tinha átomos. Apenas prótons, nêutrons (outra partícula que compõe o núcleo) elétrons viajavam pelo espaço, interagindo violentamente entre si e com a radiação, como pedaços de legume em uma sopa em ebulição (a água, nessa analogia, é a radiação.) Quando a temperatura da sopa cósmica caiu abaixo das equivalentes às energias nucleares, os núcleos dos três elementos mais simples (hidrogênio, hélio e lítio) foram formados. Alquimia Cósmica 29 Os primeiros átomos só surgiram 400 mil anos mais tarde, quando elétrons juntaram-se aos prótons para formar hidrogênio e hélio. Com eles, estrelas puderam nascer. Delas, surgiram os elementos mais pesados. No coração das estrelas ocorre a fusão do hidrogênio em outros elementos. As enormes pressões geram temperaturas de dezenas de milhares de graus, que causam reações capazes de fundir prótons com prótons, formando, como num jogo de lego, outros elementos. Nas estrelas como o Sol, a fusão vai até o carbono e oxigênio. Nas mais pesadas, até o ferro. São elas as fornalhas alquímicas do cosmo. Quando morrem, explodem com tal força que os elementos mais pesados que o ferro podem ser formados, até urânio. O oxigênio da água, o sódio e o cloro do sal, o carbono da sua pele e das plantas, todos foram forjados em estrelas, os grandes laboratórios alquímicos do cosmo. Pense nisso na próxima vez em que colocar sal no feijão. Marcelo Gleiser é professor de física teórica do Dartmouth College, em Hanover (EUA), e autor do livro ”O Fim da Terra e do Céu”. Folha de São Paulo, Caderno Mais, 18/09/2005. QUESTÕES SUGERIDAS 1) Fazer uma comparação entre reação química e reação nuclear. 2) Caracterização do elemento pelo número atômico (consultando o texto, defina número atômico). 3) Segundo o texto, o que vem a ser transmutação? 4) Em que se baseia uma reação química? 5) Localize os elementos citados no texto na sua Tabela Periódica? Identifique suas famílias e períodos. 6) Escreva o símbolo e a massa atômica dos elementos citados no texto. 7) Quais elementos devem formar o sol? 8) Comparar os diferentes significados em química para “fusão”. 9) Pesquisar a idade do planeta Terra e do homem. REFERÊNCIAS BIBLIOGRÁFICAS LEE, J.D. Química Inorgânica não tão concisa. 4 ed. São Paulo, Edgard Blücher, 1996. MASTERTON, W.L., SLOWINSKI, E.J., STANITSKI, C.L. Princípios de Química. 6 ed. Rio de Janeiro: LTC, 1990. Título original: Chemical Principles. REIS, M. Completamente Química V. I e II. São Paulo: FTD, 2001. 30 1ª série do Ensino Médio Química PARA O PROFESSOR Conhecimento prévio Estrutura da matéria, elementos químicos. Equívocos do senso comum A energia nuclear é um mal para a humanidade. Desfaz-se essa idéia apresentando as aplicações nos diversos setores. Explorações adicionais Visita técnica a instituições – IRD (Instituto de Radioproteção e Dosimetria), Angra. Leituras complementares O acidente de Goiânia Era 13 de setembro de 1987. Um aparelho de radioterapia contendo Césio 137 encontrava-se abandonado no prédio do Instituto Goiano de Radioterapia, desativado há cerca de 2 anos. Dois homens à procura de sucata invadiram o local e encontraram o aparelho, que foi levado e vendido a um ferro velho. Durante a desmontagem do aparelho, foram expostos ao ambiente 19,26g de Cloreto de Césio – 137 – (137CsCl2), pó branco semelhante ao sal de cozinha, que, no entanto, brilha no escuro com uma coloração azulada e muito bonita. Encantado com o brilho do pó, o dono do ferro velho passou a mostrá-lo e até distribuí-lo aos amigos e parentes. Os primeiros sintomas da contaminação foram tonturas, vômitos e diarréias, algumas horas depois que as pessoas tiveram contacto com o pó, levando-as a procurar farmácias e hospitais. Foram medicadas como portadoras de alguma doença contagiosa. Os sintomas só foram caracterizados como contaminação radioativa em 29 de setembro, depois que a esposa do dono do ferro-velho levou parte do aparelho desmontado até a sede da Vigilância Sanitária. Quatro pessoas morreram. Segundo a Comissão Nacional de Energia Nuclear (CNEM), das 112.800 pessoas que foram monitoradas, 129 apresentaram contaminação corporal interna e externa. Destas, 49 foram internadas e 21 exigiram tratamento médico intensivo. A propagação do Césio-137 para as vizinhanças da casa onde o aparelho foi desmontado se deu por diversas formas. Merece destaque o fato de o CsCl ser higroscópio, isto é absorve água da atmosfera, isso faz com que ele fique úmido e assim passe a aderir com facilidade à Alquimia Cósmica 31 pele, nas roupas e nos calçados. Levar as mãos ou alimentos contaminados à boca resulta em contaminação interna do organismo. Os trabalhos de descontaminação dos locais afetados produziram 13,4 toneladas de lixo com Césio-137 entre roupas, utensílios, plantas, restos de solo, materiais de construção etc... O lixo do maior acidente radiológico do país está armazenado em 1200 caixas, 2900 tambores e quatorze containers em um depósito construído na Cidade de Abadia de Goiás, vizinha a Goiânia, onde deverá ficar por mais de 180 anos. A tragédia de Goiânia deu origem a um processo judicial de 14 volumes, envolvendo os donos do Instituto Goiano de Radioterapia, que chegou ao final em março de 1996. Carlos de Figueiredo Bezerril, Criseide Castro Dourado, Orlando Alves Teixeira e o físico hospitalar Flamarion Barbosa Goulart foram condenados a 3 anos e 2 meses de pena em regime aberto (trabalhando normalmente e pernoitando em albergue). O acidente de Chernobyl Na manhã de 26 de abril de 1986, como resultado de uma série de falhas de engenharia e controle ocorreu um superaquecimento do reator de número quatro (4) da usina nuclear de Chernobyl, próxima a cidade de Kiev, na Ucrânia (país da antiga União Soviética). O superaquecimento provocou uma explosão que deslocou a tampa do reator de duas mil toneladas, lançando na atmosfera uma nuvem contendo isótopos radioativos. Tal nuvem subiu até cerca de 5 km de altitude e se alastrou por vários países da Europa, sendo detectada a muitos quilômetros de distância. Esse foi o mais grave acidente nuclear da história. Muitos dos operários e bombeiros que tentaram apagar o incêndio nas instalações morreram pouco depois, por terem sido expostos à radiação. O fogo só foi controlado quando helicópteros jogaram cinco mil toneladas de areia no topo do reator. Controlado o perigo mais imediato, veículos-robôs foram usados na tentativa de limpar a usina e eliminar os resíduos radioativos. Esses robôs apresentaram falhas de funcionamento, provavelmente devido aos altos níveis de radiação no local. Finalmente, homens foram enviados para fazer tal limpezas (muitos deles também morreram). Mais de 115 mil pessoas foram evacuadas das regiões vizinhas. A Ucrânia e a Bielorrússia (atual Belarus) enfrentaram problemas de longo prazo. Muitos de seus habitantes não podem beber a água do local ou ingerir vegetais, carne e leite ali produzidos. Cerca de 15% de florestas e 20% do solo agriculturável de Belarus não poderão ser ocupados por mais de 100 anos, devido aos altos índices de radioatividade. Especialistas afirmam que oito mil ucranianos já tenham morrido em conseqüência da tragédia. Há previsões de que até 17.000 pessoas poderão morrer de câncer nos próximos setenta anos devido à radiação espalhada no acidente. 32 1ª série do Ensino Médio Química Mudança no programa nuclear beneficia a saúde As dores voltaram fortes ao peito do aposentado J.F.M, de 71 anos. A vida regrada, livre do cigarro, da bebida e dos alimentos gordurosos, e ausência de antecedentes de doenças cardíacas na família não o pouparam da difícil experiência do enfarte, em dezembro. O bom estado de saúde garantiu ao aposentado uma rápida recuperação, mas a volta das dores trouxe suspeitas de novas complicações – angina ou estreitamento de uma artéria, entre outras possibilidades. Para tirar todas as dúvidas dos médicos, JFM aguardava apreensivo, na semana passada, um exame na câmara de cintilação tomográfica do Instituto do Coração (Incor), em São Paulo, que diagnosticaria com precisão as causas das dores e permitiria aos médicos adotar o procedimento correto para eliminá-las. O aposentado recebeu, na corrente sanguínea, uma substância irradiada, cujo deslocamento no coração permitiria à câmara de cintilação uma avaliação do funcionamento do órgão. Novo rumo – JFM não sabe, mas está sendo beneficiado, indiretamente por uma revisão nos rumos do programa nuclear brasileiro que vem ocorrendo, sem muito alarde, desde o início da primeira gestão de FHC (Fernando Henrique Cardoso). O produto injetado em suas veias, o tálio-201, é um dos radiofármacos – substâncias na maioria das vezes orgânicas irradiadas por radioisótopos – produzidos pelo Instituto de Pesquisas Energéticas e Nucleares (IPEN). O órgão, que esteve atrelado profundamente ao projeto do submarino nuclear nacional, vem nos últimos cinco anos, direcionando suas atividades principalmente para a saúde. O mecanismo que permite, com uso de radiofármacos, diagnosticar ou tratar uma enfermidade é simples. Os radiofármacos são produtos obtidos a partir de substâncias em sua maior parte compostos orgânicos irradiados por radioisótopos. Os níveis de radioatividade adquiridos pela substância orgânica são insignificantes e não afetam o organismo, mas essa radioatividade é detectada nas câmaras de cintilação, ocorrendo um resultado positivo para o seu objetivo. Essas substâncias agem como mísseis teleguiados, ou seja, como são normalmente absorvidas por determinados órgãos do corpo humano, acabam levando consigo a radioatividade para partes específicas do corpo que se quer examinar. As câmaras de cintilação tomográfica fazem a leitura do deslocamento da radioatividade através de imagens, reproduzindo um retrato do metabolismo do órgão examinado. Os radioisótopos – a matéria-prima para a fabricação dos radiofármacos – são elementos que emitem energia para desintegração de seus núcleos. Dos trinta (30) isótopos utilizados pelo Ipen para irradiação de radiofármacos, o principal é o tecnécio- 99, cuja radiação está presente em mais de 80% dos exames. Pode ser irradiado, em substâncias como o enxofre coloidal, que leva sua radioatividade ao fígado, ou pertecnetato, que vai para as glândulas salivares. A produção de radiofármacos tem crescido à ordem de 15% ao ano, desde que se iniciou a desmilitarização do IPEN. As atividades referentes ao desenvolvimento de um reator nuclear para a propulsão de submarinos foram separadas – até mesmo fisicamente – do Instituto e concentradas sob administração exclusiva da Marinha. Alquimia Cósmica 33 Atualmente, de acordo com os cálculos do superintendente do órgão, Cláudio Rodrigues, são atendidas anualmente 1,5 milhões de pessoas com uma oferta atual de 30 produtos diferentes, a maior parte dirigida a diagnósticos de extrema precisão. Mais de 300 hospitais utilizam os radiofármacos em exames em câmaras de cintilografia. Espaço – “Há muito espaço para o crescimento nesse atendimento”, avalia Rodrigues. Segundo ele, o número de procedimentos médicos envolvendo a Medicina Nuclear nos Estados Unidos atinge a 20 milhões de pessoas por ano. Esta expansão do Instituto é fruto de investimentos calculados em cerca de US$ 10 milhões, efetuados entre o início de 1995 até o fim de 1998. Desse total, US$ 2 milhões foram investidos na ampliação da produção de radiofármacos. O restante foi empregado na ampliação da capacidade do reator do IPEN, de 2 para 5 megawatts (mw), e na aquisição de uma novo acelerador de partículas Cicloton . Os dois equipamentos permitem a ampliação da produção de radioisótopos e a redução das importações dessa matéria- prima. Eugênio Melloni., O Estado de São Paulo, 04 set. 1999 (www. estadao-escola.com.br) Interdisciplinaridade - Física: Eletromagnetismo e Física atômica e subatômica - Biologia: Anatomia e Botânica - História Geral - Educação Ambiental 34 1ª série do Ensino Médio Química CONHECENDO A QUÍMICA Item curricular: Teoria de Dalton; Evolução dos modelos atômicos; Constante de Avogadro; Linguagem Química Roteiro para Aula Prática de Química OBJETIVO DE APRENDIZADO Conhecer a evolução histórica do conhecimento da Química entendo assim fatos que levaram ao estabelecimento de determinados conceitos científicos. RECURSOS NECESSÁRIOS Atividade, caça palavras. ROTEIRO DA ATIVIDADE 1: CAÇA-PALAVRAS Encontrar os nomes dos cientistas que participaram da história e do desenvolvimento da química. Viajando na história No caça palavras você vai encontrar os nomes de filósofos e cientistas que tiveram participação na história e no desenvolvimento da química, como ciência, desde, aproximadamente, 500 a.C. até o século XX. Cabe a você descobri-los, e associar, a cada um deles, um fato relevante, uma experiência ou uma descoberta que teve importância do decorrer da história. Um deles já está marcado para servir de exemplo: Conhecendo a Química 35 AVOGRADO = Por volta de 1811, introduziu o termo molécula para designar uma partícula elementar um pouco maior que o átomo, e melhor explicar os experimentos com gases e corrigir as incoerências cometidas por DALTON. R I B U N S E N R T D N E L P O H R I I S O R T I M A R U I H O O R S U S L E C A R A P E O R B B O D M A V D I R R E R B R A Z D A T L O V I O C E R E I R A I S H H L A U R O L E Nomes que constam nessa atividade: 1- Avogrado 2- Aristóteles 3- Robert Boyle 4- Becquerel 5- Bohr 6- Dalton 7- Demócrito 8- Lavoisier 9- Linus Pauling 10- Pierre e Marie curie 11- Proust 12- Rutherford 13- Paracelsus 14- Planck 15- Bunsen 16- Volta 36 1ª série do Ensino Médio C P I D A L T O N S I A L Y E Q I S E C A A R T A M B I O M U L T M A K I V S A V A R B A E I O O L A C A O I T R E T R R I T C A N O N R I B E I R I E A E R M E R C A I S E T E E L U L I O O E T C L A I O B C A T E T S I B A O I P L E O U I R S O D R O F R E H T U R R L I N U S P A U L I N G A R I A O D A R G O V A M E L I N E Química ROTEIRO DA ATIVIDADE 2: CONHECENDO O ÁTOMO Objetivo de aprendizado Compreender o conceito de átomo e sua aplicação. Recursos necessários - Um quadrado 20 x 20cm de cortiça ou de EVA - Alfinetes pretos ou azuis = elétrons – pequenos, carga negativa. - Bolinhas vermelhas = prótons – grandes, carga positiva. - Bolinhas brancas = nêutrons – grandes, sem carga. - Papel impresso = com as quatro primeiras órbitas, segundo modelo a seguir. Conhecendo a Química 37 Procedimento - Coloque o desenho das órbitas em cima da placa de EVA; - Coloque no meio das órbitas uma tampa de plástico; - Consulte a tabela periódica para montar o modelo de cada elemento. • O número de prótons (bolinhas vermelhas) corresponde ao número atômico dos elementos; • O número de nêutrons (bolinhas brancas) é o resultado da diminuição do número de massa atômica do número atômico. • O número de elétrons (alfinetes azuis) vem assinalado no alto de cada casa, à direita. • Para facilitar sua distribuição, as órbitas impressas vêm assinaladas com seu número máximo de elétrons. Exemplos 1) Hidrogênio Veja na tabela que o hidrogênio tem um próton. Então coloque na tampa uma bolinha vermelha. Veja na tabela que ele tem um elétron. Espete na primeira órbita um alfinete. Observe se o número de massa é igual ou diferente do número atômico. O hidrogênio tem nêutrons? 2) Hélio A tabela nos mostra que o hélio tem 2 prótons. Coloque na tampa 2 bolinhas vermelhas. Como a massa atômica é 4 e o número atômico é 2, fazendo a diminuição vemos que ele tem 2 nêutrons. Coloque na tampa 2 bolinhas brancas. Veja na tabela que ele tem 2 elétrons. Espete 2 alfinetes na primeira órbita. 3) Lítio Observe a tabela e monte seu modelo. Coloque na tampa 3 bolinhas vermelhas e 4 bolinhas brancas. O número de alfinetes vem assinalado no alto de cada casa, à direita. Espete 2 alfinetes na primeira órbita e um na segunda . Obs.: Este modelo pode ser utilizado: 38 1ª série do Ensino Médio Química - para explicar a formação de íons. - para falar sobre radioatividade. - para ligações químicas. MONTE O MODELO DOS OUTROS ELEMENTOS QUÍMICOS SEMPRE CONSULTANDO A TABELA Segue em anexo uma tabela que poderá ser utilizada. EXPLORAÇÕES ADICIONAIS Conhecendo os elementos Atividade Bingo dos Símbolos O bingo é constituído de 48 cartelas com símbolos de elementos químicos da tabela periódica e 90 fichas com os nomes dos elementos que se encontram nas cartelas. Para marcar nas cartelas é preciso de alguns marcadores, que podem ser sementes, pedaços pequenos de papel etc. O bingo dos símbolos é um jogo para ser realizado com toda a turma. Conhecendo a Química 39 REFERÊNCIAS BIBLIOGRÁFICAS Projeto ciência no dia a dia – Profª Marly Veiga, UERJ/IBRAG/DBAV/setor de ciências e biologia – CEBIO. Jogos didáticos – Márcia Borin da Cunha, Santa Maria, 2000. Caça-palavras – Prof. Julio dos Santos Silva. 40 1ª série do Ensino Médio QUÍMICA 2ª SÉRIE Ensino Médio Janeiro de 2006 Química ATIVIDADE DE QUÍMICA ORGÂNICA Item curricular Funções Orgânicas Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO A celulose é um polímero natural e é a matéria prima química mais comum na superfície da terra, pois é o constituinte principal de quase todos os tipos de vegetais. Entretanto, as fontes comerciais de celulose se limitam ao linter de algodão e à polpa de madeira. Os linters de algodão são as fibras curtas que ficam como resíduo das sementes de algodão depois que as fibras longas foram removidas pelo processo conhecido como desfibramento e se constituem na forma mais pura de celulose natural que se conhece. Acetato de celulose tem flexibilidade que não permite que ele quebre, fica entre poliestireno (plásticos quebráveis) e o polimetacrilato de metila (o acrílico) tanto em preço como em qualidade. O acetato de celulose é usado na fabricação de caixas de flores, caixas de bombons, filmes fotográficos, filmes cinematográficos etc. OBJETIVO Diferenciar celulose e acetato de celulose RECURSOS NECESSÁRIOS - 4 tubos de ensaio - Bico de Bunsen ou lamparina - 1 pregador de madeira Atividade de Química Orgânica 43 ROTEIRO DA ATIVIDADE 1. Numere os 4 tubos e coloque nos tubos da seguinte forma: Tubo 1: uma porção de algodão Tubo 2: um pedaço de filme fotográfico Tubo 3: um pedaço de papel Tubo 4: um pedaço de madeira (palitos de dente) 2. Aqueça os tubos, observe e anote o que aconteceu. REFERÊNCIAS BIBLIOGRÁFICAS FELTRE, Ricardo. Química - Volume 3 “Química Orgânica” São Paulo: Editora Moderna. 6ª edição, 2004. 44 2ª série do Ensino Médio Química PARA O PROFESSOR Resultados esperados Tubo 1: Carboniza sem fundir.. Tubo 2: Carboniza e funde (cola nas paredes do tubo de ensaio). Tubo 3: Carboniza sem fundir. Tubo 4: Carboniza sem fundir. Conclusão A celulose carboniza sem fundir (se colocarmos nos tubo de ensaio e aquecermos não cola nas paredes do tubo). Já o acetato de celulose é um produto sintético, portanto carboniza e funde. Curiosidade O acetato de celulose usado para filmes cinematográficos, também chamados de filmes de segurança, antigamente era feito de nitrato de celulose por isso é que ocorriam incêndios freqüentes nos cinemas (retratado no filme “Cinema Paradiso”). Atividade de Química Orgânica 45 CONDUTIBILIDADE Item curricular Comportamento Químico das Substâncias Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO Arrhenius, químico sueco, realizou vários experimentos relacionados à passagem de corrente elétrica em soluções aquosas. Por meio de observação, ele pôde concluir que existiam soluções eletrolíticas e soluções não eletrolíticas. As soluções eletrolíticas conduzem corrente elétrica, pois nelas existem íons livres. Esses íons provêm de compostos iônicos que sofrem dissociação iônica ou de compostos moleculares que, em presença de água, sofrem ionização (ácidos e amônia). OBJETIVOS DE APRENDIZADO - Verificar a diferença de comportamento de não-eletrólitos, eletrólitos fortes e eletrólitos fracos no que diz respeito à condutibilidade elétrica. - Agrupar substâncias segundo o critério de comportamento na dissolução em água. - Conceituar, segundo Arrhenius, ácidos e bases. CONHECIMENTOS PRÉVIOS - Ionização e dissociação iônica. - Ligações iônicas e covalentes. - Conceito de eletrólito. 46 2ª série do Ensino Médio Química RECURSOS NECESSÁRIOS - Circuito elétrico. - Béqueres ou recipientes transparentes para o preparo das soluções. - Soluções aquosas diversas, como, por exemplo, água com sal (salmoura), água pura (destilada), água da torneira, água com açúcar, solução de ácido acético (vinagre), água com amônia, solução aquosa de hidróxido de sódio (soda cáustica), café, sucos, álcool etc. CUIDADO! Não encoste na parte do fio que está desencapado, risco de choque elétrico. ROTEIRO DA ATIVIDADE Ligar o circuito à bateria (ou rede elétrica), encostar as pontas desencapadas dos fios uma na outra e verificar se a lâmpada está acendendo. Afastá-los novamente. Agora podemos começar a experimentar as soluções preparadas. Testar a condutibilidade elétrica de cada solução colocando as duas pontas desencapadas dos fios dentro de cada recipiente e tomando cuidado para que os fios nunca se encostem. Antes de testar outra solução, mergulhar as pontas em um Béquer contendo água pura (de preferência destilada), para limpar os contatos. Anote, na tabela, o que ocorre com a lâmpada em cada solução testada. Condutibilidade 47 Solução testada A lâmpada acende? SIM NÃO Observações Salmoura Água pura Água da torneira Água com açúcar Vinagre QUESTÕES SUGERIDAS 1- Por que a lâmpada acende em algumas soluções e, em outras, se mantém apagada? 2- A intensidade (brilho) da lâmpada é sempre o mesmo? Por quê? 3- De acordo com Arrhenius, por que as soluções eletrolíticas conduzem eletricidade? 4- Faça um paralelo entre as soluções eletrolíticas e não-eletrolíticas e a relação entre ligação iônica e covalente? REFERÊNCIAS BIBLIOGRÁFICAS OLIVEIRA, Edson Albuquerque de. Aulas Práticas de Química - volume único.São Paulo: Moderna. 1986. SILVA, Ronaldo Henriques da e SILVA, Edson Braga da. Curso de Química - vol.2. São Paulo: Harbra, 1992. FELTRE, Ricardo. Química - vol.2. São Paulo: Moderna, 1995. NOVAIS, Vera Lúcia Duarte de. Química – vol.2. São Paulo: Atual, 1993. LEMBO, Antônio. Química – Realidade e contexto – volume 2. São Paulo: Ática, 2004. 48 2ª série do Ensino Médio Química PARA O PROFESSOR Conhecimentos prévios - Ionização e dissociação iônica. - Ligações iônicas e covalentes. - Conceito de eletrólito. Atividades a serem realizadas antes do uso do material Montar o circuito utilizando bateria (9V), lâmpada transparente (cristal), soquete para lâmpada e fio de cobre conforme o esquema, ou utilizar o segundo modelo caso prefira trabalhar com a rede elétrica local (110/220V). Resultados esperados 1- Porque existem soluções eletrolíticas e soluções não eletrolíticas. 2- Não, em algumas soluções a quantidade de íons é maior que em outras. 3- Porque existem íons livres e estes se encarregam de conduzir a corrente elétrica. 4- As soluções eletrolíticas são formadas por compostos iônicos (ligações iônicas) e por compostos moleculares que, em presença de água, sofrem ionização (ligações covalentes) e as soluções não eletrolíticas são formadas por compostos moleculares que não sofrem ionização. Transdisciplinaridade ELETRICIDADE (Física) Condutibilidade 49 MODELO ATÔMICO - ESTUDO DO CARBONO Item curricular Ligações Químicas de Compostos Orgânicos Roteiro para Aula Prática de Química INTRODUÇÃO Com o rápido desenvolvimento da Química Orgânica e a conseqüente obtenção de novas substâncias, verificou-se que não se conseguia explicar algumas propriedades verificadas nessas novas substâncias a partir da Teoria de Kekulé (1858), que pode ser resumida em três itens: 1. O carbono é tetravalente. 2. As quatro valências do carbono são iguais entre si. 3. Os átomos de carbono podem ligar-se entre si ou com outros elementos originando cadeias. Em 1874, Van’t Hoff e Le Bel criaram um modelo espacial para o carbono. Nesse modelo, o átomo de carbono ocupa o centro de um tetraedro regular imaginário e dirige suas valências para os quatros vértices do tetraedro. 50 2ª série do Ensino Médio Química OBJETIVOS DE APRENDIZADO - Fazer com que os alunos se familiarizem com uma visão tridimensional. - Entender a visão espacial de ligação simples, dupla e tripla realizadas pelo átomo do elemento químico carbono, que é o principal responsável pela formação dos compostos orgânicos. - Proporcionar noções sobre fórmula espacial, estrutural e ângulos de ligação. CONHECIMENTOS PRÉVIOS - Noções sobre Ligações Químicas, basicamente a covalente. - Introdução à Química Orgânica (alcano, alceno, alcino). ATIVIDADE 1: CONSTRUINDO O TETRAEDRO Recursos necessários - Cartolina - Tesoura - Cola - Papel A4 com o desenho a ser recortado Roteiro da atividade Obs.: Este procedimento poderá ser realizado, por exemplo, na aula de Educação Artística. - Recortar, com atenção, os desenhos dos dois triângulos maiores, seguindo sempre as linhas externas contínuas. - Recortar 2 (dois) pedaços de cartolina de modo a caber o desenho do triângulo que foi recortado no item anterior. - Colar em cada pedaço de cartolina o desenho do triângulo. - Fazer a dobradura, seguindo as linhas pontilhadas, de modo a formar um tetraedro para cada desenho recortado. Os dois tetraedros formados devem estar bem colados, de maneira a permitir o manuseio. Modelo Atômico - Estudo do Carbono 51 52 2ª série do Ensino Médio Química Questões sugeridas para os alunos - Desenhar as fórmulas espaciais de alguns compostos orgânicos, como, por exemplo: 1,2 dibromo etano, cloro eteno, cloro etino etc. - Levando em conta a interdisciplinaridade, é possível trabalhar com a Geometria: • Identificar as partes do tetraedro, como, por exemplo, o vértice, aresta e face. • Calcular o perímetro, a área e o volume de figuras geométricas como, por exemplo, triângulo, losango etc. ATIVIDADE 2: POR DENTRO DO TETRAEDRO Recursos necessários - Canudos de suco (diâmetro ≥ 5,0 mm) - Tesoura - Barbante (aproximadamente 2,0 m de comprimento) - Um pote vazio de sorvete - Detergente líquido - Glicerina Procedimento - Pegue 3 (três) canudos, corte-os em 2 (duas) partes iguais, desprezando aquela que, porventura, contenha “sanfona”. Os 6 (seis) pedaços deverão ter as mesmas dimensões, para que o experimento fique mais bonito. - Em um pedaço de barbante de aproximadamente 1,0 m de comprimento, enfie 3 (três) pedaços de canudos. - Una as 2 (duas) pontas do barbante e enfie o 40 (quarto) pedaço do canudo. - Depois separe as pontas desse barbante e introduza o 50 (quinto) pedaço do canudo em uma das pontas e o 60 (sexto) pedaço na outra ponta. - Passe esta última ponta do barbante através do canudo que constitui a base do triângulo. - Una esta ponta do barbante com a outra que contém o 50 pedaço do canudo e dê um nó, de modo a formar um tetraedro regular. - Repita essas 6 (seis) etapas do Procedimento para montar um outro tetraedro regular. Caso o experimento seja feito em dupla não é preciso que cada aluno faça 2 (dois) tetraedros. - Pegue o pote plástico, encha-o com água (pode ser da torneira) até uma altura de aproximadamente 10,0 cm. Adicione 3 (três) colheres de sopa do detergente e 1 (uma) de glicerina. Agite, lentamente, até formar uma solução sem espumas. - Mergulhe os tetraedros nesta solução. Modelo Atômico - Estudo do Carbono 53 - Após alguns segundos, retire-os e observe o que aconteceu. Obs.: Os tetraedros da Atividade 2 podem ser considerados como a parte interna dos tetraedros da Atividade 1, sendo que no Baricentro (centro de gravidade da figura geométrica) de cada tetraedro está localizado um átomo do elemento químico Carbono. Questões sugeridas para os alunos - Escrever quaisquer fórmulas espaciais e estruturais de compostos orgânicos contendo 2 (dois) átomos de carbono ligados através de uma simples, dupla e tripla ligação, lembrando que, para isto, os tetraedros devem estar unidos pelos vértices, arestas e faces, respectivamente. - Levando em conta a interdisciplinaridade, o aluno poderá fazer uma pesquisa sobre Baricentro, o que é e como o mesmo é determinado em uma figura geométrica. REFERÊNCIAS BIBLIOGRÁFICAS REIS, Martha. Química Integral - vol.U. São Paulo: FTD, 2004. SARDELLA, Antônio. Curso Completo de Química – vol.U. São Paulo: Ática, 2000. TITO & CANTO. Química na Abordagem do Cotidiano - vol.U. São Paulo: Moderna, 2002. USBERCO & SALVADOR. Química – vol.U. São Paulo: Saraiva, 2002. FELTRE, Ricardo. Química – vol.U. São Paulo: Moderna, 2000. NOVAIS, Vera. Química - vol.U. São Paulo: Atual, 1998. 54 2ª série do Ensino Médio Química POLARIDADE DA ÁGUA Item curricular Ligações Químicas Roteiro para Aula Prática de Química INTRODUÇÃO Substâncias iônicas são aquelas formadas por íons, isto é, são compostos que apresentam partículas com carga elétrica positiva (cátions) e partículas com carga elétrica negativa (ânions), ligadas entre si por forças de natureza elétrica (forças eletrostáticas). Nas substâncias moleculares ou covalentes, tal fato não ocorre. As moléculas não são partículas com cargas elétricas. Apesar disso, as moléculas podem apresentar pólos elétricos devido a sua geometria molecular, por isso são chamadas moléculas polares. Algumas moléculas, por serem simétricas, não apresentarão pólos positivos e negativos, por isso são chamadas moléculas apolares. OBJETIVOS DE APRENDIZADO - Observar um evidência de que algumas substâncias são formadas por moléculas polares. - Reconhecer a geometria da molécula da água. CONHECIMENTOS PRÉVIOS - Ligações Covalente. RECURSOS NECESSÁRIOS - Uma garrafa de água mineral de pequena (300 mL) com tampa. - Uma carga vazia de caneta. - Um prego. - Água. Polaridade da Água 55 - Caneta esferográfica. - Flanela. ATIVIDADES A SEREM REALIZADAS ANTES DO USO DO MATERIAL - Fazer um furo com o prego aquecido na garrafa a dois dedos da base para encaixar sem folga o tubo da caneta. Conforma figura: ROTEIRO DA ATIVIDADE Encher totalmente a garrafa com água. Aproveite esse momento para mostrar a seus alunos que, mesmo com o furo, a água não sai quando a garra se encontra totalmente fechada, pois há um equilíbrio de pressão. Ao começarmos a abrir a tampa da garrafa, devido à entrada de ar, a água começa a sair pelo tuba da carga da caneta. Abra um pouco a tampa para que saia um fio fino, mas contínuo, de água. Atrite a caneta de plástico na flanela ou no próprio cabelo. Aproxime do filete de água sem encostar e observe o que ocorre. 56 2ª série do Ensino Médio Química RESULTADOS ESPERADOS Devido à polaridade das moléculas de água, o filete irá sofrer um desvio na sua trajetória. Nesse momento, deve-se apresentar a geometria angular da molécula da água e conseqüentemente seus pólos positivo e negativo. Um modelo feito com bolinhas de massa de modelar e palito de dente pode ser utilizado para melhor ilustrar a forma geométrica da molécula da água. REFERÊNCIAS BIBLIOGRÁFICAS USBERCO & SALVADOR. Química. Vol. 1. São Paulo: Saraiva, 2000. Polaridade da Água 57 REAÇÕES QUÍMICAS Item curricular Reações Químicas Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO Reação química é a transformação de uma ou mais substâncias em outras através da redistribuição dos átomos e/ou radicais. OBJETIVOS DE APRENDIZADO Entender que as massas dos reagentes são consumidas progressivamente (antes da seta) e que as massas dos produtos (substâncias escritas após a seta) são aumentadas da mesma maneira. CONHECIMENTOS PRÉVIOS - Estudo das funções químicas, principalmente os sais. - Estudo de reações químicas (teoria). RECURSOS NECESSÁRIOS - Água. - Um frasco transparente ou tubo de ensaio. - Solução de sulfato de cobre (CuSO4) (comprado em loja de material de piscina). - Um pedaço de esponja de aço (ou pedaço de zinco). - Um bastão de vidro ou canudo de plástico. 58 2ª série do Ensino Médio Química ROTEIRO DA ATIVIDADE Em um frasco, coloque uma colher (de chá) de CuSO4 em água e agite até a completa dissolução do sal. Pegue um pedaço da esponja de aço e coloque na solução azul de sulfato de cobre. QUESTÕES SUGERIDAS 1) O que aconteceu com o pedaço de da esponja de aço? 2) Que metal se depositou sobre o mesmo? 3) Que aconteceu com a cor da solução de sulfato de cobre? 4) Quais os reagentes e os produtos da reação? 5) Escreva a equação da reação química observada. REFERÊNCIAS BIBLIOGRÁFICAS OLIVEIRA, Edson Albuquerque de. Aulas Práticas de Química - volume único. São Paulo: Moderna. 1986. SARDELLA, Antônio. Curso Completo de Química – vol.U. São Paulo: Ática, 2000. TITO & CANTO. Química na Abordagem do Cotidiano – vol.U. São Paulo: Moderna, 2002. Reações Químicas 59 PARA O PROFESSOR Roteiro da Atividade Em um frasco, coloque uma colher (de chá) de CuSO4 em água e agite até a completa dissolução do sal. Pegue um pedaço da esponja de aço e coloque na solução azul de sulfato de cobre. Após algum tempo a solução tenderá a ficar incolor e o a esponja de aço ficará revestida por uma camada avermelhada de cobre. Resultados esperados 1) Ficou vermelho, com a deposição do cobre. 2) O Cobre. 3) Ficou mais clara com o tempo de reação. 4) Reagentes Ferro e sulfato de cobre. Produtos – sulfato ferroso e cobre metálico. 5) Fe + CuSO4 → FeSO4 + Cu Explorações adicionais - Esta atividade pode ser trabalhada no 3° ano do Ensino Médio, para introdução dos conceitos envolvidos numa reação de óxido-redução (oxidante, redutor). - Recomenda-se realizar visita a uma siderúrgica, se houver próxima à cidade. 60 2ª série do Ensino Médio QUÍMICA 3ª SÉRIE Ensino Médio Janeiro de 2006 Química CINÉTICA QUÍMICA Item curricular Cinética Química Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO Toda reação química leva um certo tempo para se completar. Algumas reações ocorrem muito rapidamente enquanto outras ocorrem muito devagar. A velocidade de uma reação pode ser entendida como sendo a maior ou menor rapidez com que ela se processa. Em 1867, Guldberg e Waage, através de fatos experimentais, enunciaram a Lei da Ação das Massas: a velocidade de uma reação química, a uma dada temperatura, é diretamente proporcional ao produto das concentrações molares dos reagentes. Para uma reação genérica: A + B → M + N a expressão da velocidade é dada por v = K [A]ª [B] , em que a e b são valores numéricos determinados experimentalmente. Alguns fatores afetam a velocidade de uma reação. São eles: - o estado de agregação; - a concentração dos reagentes; - a temperatura; - catalisadores. OBJETIVOS DE APRENDIZADO - Observar a ocorrência de uma reação química com desprendimento de gás. - Verificar a influência da temperatura e do estado de agregação na velocidade de uma reação. Cinética Química 63 RECURSOS NECESSÁRIOS - 3 copos transparentes, de vidro ou plástico - 5 comprimidos efervescentes, tipo Sonrisal - água (gelada, quente e na temperatura ambiente) - relógio com marcador de segundos ou cronômetro ROTEIRO DA ATIVIDADE 1 a) Numerar os 3 copos. b) No copo 1, colocar 100mL de água gelada; no copo 2, colocar 100mL de água na temperatura ambiente; e, no copo 3, 100mL de água quente. c) Colocar, no mesmo instante, um comprimido em cada copo e anotar o tempo que cada comprimido leva para finalizar sua efervescência. ROTEIRO DA ATIVIDADE 2 a) Colocar nos copos 1 e 2, depois de lavados, 100mL de água na temperatura ambiente. b) Triturar um comprimido e deixar o outro inteiro. c) Colocar, ao mesmo tempo, o comprimido triturado no copo 1 e o comprimido inteiro no copo 2 e anotar o tempo que cada um leva para finalizar sua efervescência. QUESTÕES SUGERIDAS a) Na atividade 1, em qual dos copos a reação ocorreu com maior velocidade? b) De que maneira a temperatura influencia em uma reação química? c) Na atividade 2, qual comprimido reagiu mais rapidamente, o triturado ou o inteiro? d) O que podemos concluir ao observar a atividade 2? REFERÊNCIAS BIBLIOGRÁFICAS OLIVEIRA, Edson Albuquerque de. Aulas Práticas de Química - volume único. São Paulo: Moderna. 1986. SILVA, Ronaldo Henriques da e SILVA, Edson Braga da. Curso de Química - vol.2. São Paulo: Harbra, 1992. FELTRE, Ricardo. Química - vol.2. São Paulo: Moderna, 1995. NOVAIS, Vera Lúcia Duarte de. Química – vol.2. São Paulo: Atual, 1993. LEMBO, Antônio. Química – Realidade e contexto – volume 2. São Paulo: Ática, 2004. 64 3ª série do Ensino Médio Química PARA O PROFESSOR Conhecimentos prévios O aluno já deverá ter estudado: reações químicas; concentração de soluções; funções inorgânicas, principalmente sais. Conteúdos a serem trabalhados Após a observação das atividades 1 e 2, o professor deverá observar com os alunos que a reação ocorreu mais rapidamente na água quente e que o comprimido triturado reagiu mais rapidamente que o inteiro, comprovando que, na maioria das vezes, a velocidade da reação aumenta com o aumento da temperatura e que quanto maior a superfície de contato entre os reagentes mais rapidamente se processará a reação. Resultados esperados 1) No copo com água quente. 2) Quanto maior a temperatura, maior a velocidade da reação. 3) No copo com o comprimido triturado a reação ocorreu mais rapidamente. 4) Podemos concluir que quanto maior a superfície de contato dos reagentes, maior a velocidade da reação. Equívocos do senso comum Neste momento, deve-se mostrar ao aluno a diferença entre misturar e reagir, mostrando que são dois fenômenos completamente distintos, portanto o termo dissolver não se aplica ao experimento acima. Explorações adicionais Pode-se levar o aluno a identificar a composição do comprimido e abordar diversos conteúdos de outras séries como: - Funções Químicas (2ª série): ao identificar o principal componente do comprimido, pode-se verificar qual a sua função inorgânica. - Cálculo Estequiométrico (1ª série): com a composição do comprimido, pode-se propor ao aluno algumas questões de cálculo estequiométrico. Interdisciplinaridade Com Biologia, ressaltando que o AAS não deve ser tomado quando houver sintoma de dengue. Cinética Química 65 COMBUSTÃO Item curricular Termoquímica Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO O Sol é a fonte primária de energia do nosso planeta. Ele transfere energia em forma de luz e calor. A luz, nos vegetais, é responsável pela fotossíntese, processo pelo qual os vegetais transformam água, gás carbônico e sais minerais em reservas energéticas. Podemos citar, como exemplo de fonte de energia, o álcool, proveniente da cana-de-açúcar, que é formado por carbono, oxigênio e hidrogênio. Este, quando reage com o gás oxigênio, realiza um processo de combustão, em que as ligações da cadeia carbônica são quebradas formando vapor de água, gás carbônico e liberando calor. Um outro combustível conhecido é a parafina, um hidrocarboneto, que também sofre combustão, porém a queima da parafina não é completa. Observe as equações abaixo: ÁLCOOL PARAFINA C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(v) Combustão completa + energia C18H38(s) + 19/2O2(g) → 18C(s) + 19H2O(v) Combustão incompleta + energia OBJETIVOS DE APRENDIZADO - Diferenciar combustão completa de combustão incompleta. RECURSOS NECESSÁRIOS - 2 estacas de giz para quadro negro (de preferência da cor branca) 66 3ª série do Ensino Médio Química - vela - lamparina a álcool - fósforo ROTEIRO DA ATIVIDADE Acender a vela e a lamparina. Colocar a ponta de um giz sobre a chama da vela e a ponta do outro sobre a chama da lamparina por aproximadamente 3 segundos. Observar. QUESTÕES SUGERIDAS 1- O que você visualizou? 2- Como pode explicar a diferença? 3- O que é combustível? 4- Qual o combustível da lamparina? 5- E da vela? 6- Quem é o comburente? REFERÊNCIAS BIBLIOGRÁFICAS FELTRE, Ricardo. Química - vol.U. São Paulo: Moderna, 1995. NOVAIS, Vera Lúcia Duarte de. Química – vol.3. São Paulo: Atual, 1993. LEMBO, Antônio. Química – Realidade e contexto – volume U. São Paulo: Ática, 2004. TITO & CANTO. Química na Abordagem do Cotidiano - vol.U. São Paulo: Moderna, 2002. Combustão 67 PARA O PROFESSOR Conhecimentos prévios - Funções da Química Orgânica. Atividades a serem realizadas antes do uso do material Pode-se confeccionar uma lamparina utilizando produtos de uso cotidiano, para isto basta pegar um frasco de vidro pequeno, de remédio, por exemplo, utilizar um pequeno pedaço de aviamento conhecido por rabo de rato (de algodão) e um pedaço de papel alumínio que servirá como tampa. Faça um furo central no papel alumínio para passar o cordão rabo de rato deixando um centímetro para fora e o restante do cordão deverá ser colocado dentro do frasco. Coloque um pouco de álcool no recipiente (frasco), mergulhe o cordão e tampe com o papel alumínio, espere um pouco até que o cordão esteja úmido, já pode acender a lamparina. Resultados esperados 1. Uma estaca ficou com a ponta preta e a outra praticamente nada sofreu. 2. A cor escura se deve ao elemento carbono, produzido na combustão incompleta. 3. É a substância responsável pela combustão. 4. O álcool. 5. A parafina. 6. O oxigênio. 68 3ª série do Ensino Médio Química Explorações adicionais - Efeito estufa - Combustíveis fósseis - Emissão de gases poluentes - Chuva ácida Transdisciplinaridade - Fotossíntese (biologia) - Combustíveis alternativos (química, biologia e geografia) Combustão 69 COMBUSTÃO DA VELA Item curricular Termoquímica Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO A combustão da vela consome o oxigênio contido no ar. Supondo que a vela seja constituída apenas por pentacosano (na verdade, a vela é uma mistura de vários hidrocarbonetos sólidos), a reação de combustão poderia ser representada pela equação: C25H52 (s) + 38 O2(g) → 25 CO2 (g) + 26H2O(g) Como podemos ver pela equação sugerida, os produtos da combustão são gás carbônico e vapor d’água. A pressuposição fundamental do método é que o vapor d’água se condensa e o gás carbônico, por ser muito solúvel em água, dissolve-se rapidamente. Como conseqüência da remoção do gás oxigênio, a pressão dentro do cilindro diminui e a água da bacia sobe pelo cilindro até uma altura que corresponde ao volume ocupado pelo gás oxigênio. Comparando-se este volume com o volume total do cilindro, calcula-se o teor de oxigênio total do cilindro. Observação d ar (livre CO2) = 1,293 g/dm3 d CO2 = 1,977 g/dm3 OBJETIVOS DE APRENDIZADO - Identificar a combustão da vela e suas propriedades. 70 3ª série do Ensino Médio Química RECURSOS NECESSÁRIOS - Uma bacia (uma lata de goiabada). - Um toco de vela - Um copo. - Um cilindro. ROTEIRO DA ATIVIDADE 1 - Fixe um toco de vela sobre uma vasilha redonda de lata de goiabada, acenda a vela e espere a chama ficar bem forte. Emborque um copo sobre a vela. QUESTÕES SUGERIDAS PARA O ROTEIRO DE ATIVIDADE 1 1. O que aconteceu com a chama da vela? 2. Por que não houve mais combustão? ROTEIRO DA ATIVIDADE 2 - Fixe um toco de vela sobre uma vasilha redonda de lata de goiabada, acenda a vela e espere que a chama fique bem forte. Adicione água na vasilha redonda. Emborque o copo sobre a vela. Espere. QUESTÕES SUGERIDAS PARA O ROTEIRO DE ATIVIDADE 2 1) O que aconteceu com a chama da vela? 2) Por que não houve mais combustão? 3) O que aconteceu com a água que estava na vasilha depois de algum tempo. REFERÊNCIAS BIBLIOGRÁFICAS Revista Química Nova na Escola nº12. Seção: Experimentação no Ensino de Química : Desfazendo o Mito. Artigo Christian Braathen. Gepeq - Grupo de pesquisa em educação química. Livro de laboratório – Módulos III e IV – Interações e transformações I. 5ª ed. São Paulo: Editora da USP, 1999. Combustão da Vela 71 PARA O PROFESSOR Resultados esperados do roteiro de atividade 1 1) A chama da vela apagou. 2) Não houve mais combustão devido à formação de gás carbônico da combustão completa da vela, sendo o gás carbônico mais denso do que a densidade do ar livre de CO2. Resultados esperados do roteiro de atividade 2 1) A chama da vela apagou. 2) Não houve mais combustão devido à queima da vela fornecer uma combustão completa, liberando CO2 e a densidade do gás carbônico é 1,997g/dm3 , enquanto a densidade do ar livre de CO2 é igual a 1,293 g/dm3. Sendo a densidade do gás carbônico maior do que a do ar livre, e tendo o gás carbônico a função de não alimentar a combustão da maioria das substâncias, a chama apaga. 3) Na combustão completa, há formação de gás carbônico e vapor d’água. A pressuposição fundamental do método é que o vapor d’água se condensa e o gás carbônico, por ser muito solúvel em água, dissolve-se rapidamente. Como conseqüência da remoção do gás oxigênio, a pressão dentro do cilindro diminui e a água da bacia sobe pelo copo até uma altura que corresponde ao volume ocupado pelo gás oxigênio. 72 3ª série do Ensino Médio Química ELETRÓLISE EM SOLUÇÃO AQUOSA COM ELETRODOS INERTES Item curricular Eletroquímica Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO A eletrólise é um processo que separa os elementos químicos de um composto através do uso da eletricidade. De maneira sumária, procede-se primeiro à decomposição (ionização ou dissociação) do composto em íons e, posteriormente com a passagem de uma corrente contínua através destes íons, são obtidos os elementos químicos. Em muitos casos, dependendo da substância a ser eletrolisada e do meio em que ela ocorre, além de formar elementos, ocorre também a formação de novos compostos. O processo da eletrólise é uma reação de óxidoredução oposta àquela que ocorre numa célula eletrolítica sendo, portanto, um fenômeno físico-químico não espontâneo. A palavra eletrólise é originária dos radicais eletro (eletricidade) e isis (decomposição). Em eletrólise aquosa com eletrodos inertes, os eletrólitos têm seus íons gerados ou dissociados pela interferência do caráter polar da água. Como a água também se ioniza, ocorre, nos eletrodos, uma competição na descarga dos elétrons entre os íons do eletrólito e os da água. Pela eletrólise, pode-se decompor a água em hidrogênio e oxigênio. Esse procedimento foi descoberto pela primeira vez pelo químico inglês William Nicholson, em 1800 e, posteriormente, por Faraday, em 1820. OBJETIVOS DE APRENDIZADO - Definir e reconhecer eletrólise, eletrólito, solução eletrolítica, eletródios, catodo e anodo, exemplificando com a eletrólise do NaCl em solução aquosa. RECURSOS NECESSÁRIOS - Cuba de vidro ou copo de geléia. - Fonte de corrente contínua ou três pilhas grandes. Eletrólise em Solução Aquosa com Eletrodos Inertes 73 - Suporte universal. - Solução de fenolftaleína. - 2 tubos de ensaio. - Uma colher das de sopa de sal de cozinha. ROTEIRO DA ATIVIDADE - Colocar água no copo de geléia até preencher 2/3 de sua altura. - Encher completamente os dois tubos de ensaio com água. - Tapar, com o dedo, um tubo de cada vez e emborca-lo dentro da água do copo; retirar o dedo somente quando a boca do tubo estiver abaixo do nível da água, para evitar formação de bolhas de ar no seu interior. - Montar as pilhas nos porta-pilhas e fazer conexões necessárias para ligação sem série. - Descascar cerca de 2 cm das extremidades de cada um dos fios. - Prender uma das extremidades de cada pedaço de 50 cm ao orifício das lâminas de cobre. - Introduzir as lâminas em cada um dos tubos de ensaio, de forma que as partes descobertas dos fios não fiquem fora dos tubos. - Adicionar uma colher das de sopa de sal de cozinha (cloreto de sódio). - Após fechar o circuito, observar durante 30 minutos o nível do líquido nos tubos de ensaio. - Retirar da solução o tubo que contiver mais gás, mantendo-o de boca para baixo. - Acender um fósforo, aproximá-lo da boca do tubo e observar o que acontece. - Pingar gotas de fenolftaleína na solução e verificar o que acontece. QUESTÕES SUGERIDAS - Identificar o cátodo e o ânodo. - Escrever as semi-reações de oxidação e redução. - Escrever a equação global do processo, identificando os produtos. REFERÊNCIAS BIBLIOGRÁFICAS LEMBO, Antônio. Química – Realidade e contexto – volume 2. São Paulo: Ática, 2004. OLIVEIRA, Edson Albuquerque de. Aulas Práticas de Química - volume único. São Paulo: Moderna. 1986. 74 3ª série do Ensino Médio Química PARA O PROFESSOR Resultados esperados - Em dissolução ocorre a liberação dos íons do sal e da água: 2 NaCl + 2 H2O → 2 Na+ + 2 Cl- + 2 H+ + 2 OH- Para o eletrodo positivo (ânodo) se dirigem os ânions 2 Cl- e 2 OH-. Como a facilidade do íon Cl- em perder elétrons é maior que o do OH-, ocorre a descarga dos íons Cl-: 2 Cl- - 2 elétrons → Cl2 - Para o eletrodo negativo (cátodo) se dirigem os cátions 2 Na+ e 2 H+. Como a facilidade do íon H+ em ganhar elétrons é maior que o do Na+, ocorre a descarga dos íons H+ da água. Como a ionização da água é muito baixa ocorre a descarga da própria água: 2 H2O + 2 elétrons → H2 + 2 OHEssa eletrólise obteve hidrogênio e cloro e, como subproduto, a soda caustica - NaOH (Na+ do catodo e OH- do ânodo). 2 NaCl + 2 H2O → H2 + Cl2 + 2 NaOH Eletrólise A eletrólise é o processo químico que ocorre devido à passagem de uma corrente elétrica através de um eletrólito. Nesse processo, são utilizados dois eletrodos mergulhados numa solução eletrolítica ligados a um circuito externo que contém uma fonte de corrente elétrica. Esses eletrodos permitem uma troca de elétrons entre os eletrodos e a solução eletrolítica. Dependendo do sentido em que ocorre a transferência de elétrons, o eletrodo é denominado catodo ou ânodo: Ânodo ou pólo positivo - É o eletrodo que recebe os elétrons dos ânions da solução (oxidação). No sentido convencional, é aquele que apresenta o maior potencial elétrico dos dois eletrodos, portanto, conduz a corrente elétrica para a solução. Catodo ou pólo negativo - É o eletrodo que entrega os elétrons para os cátions da solução eletrolítica (redução). Entre os dois eletrodos é o que apresenta o menor potencial, conseqüentemente, é através dele que a corrente elétrica sai da solução. Eletrólise em Solução Aquosa com Eletrodos Inertes 75 EQUILÍBRIO QUÍMICO Item curricular Equilíbrio Químico Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO Uma das razões pelas quais as propriedades dos sistemas em equilíbrio são muito importantes é que todas as reações químicas tendem a alcançar um equilíbrio. Às vezes diz-se que a reação “foi completada”, mas, a rigor, não existem reações que consumam todos os reagentes. Todos os sistemas que reagem alcançam um estado de equilíbrio, no qual permanecem pequenas quantidades de reagentes que estão sendo consumidas até que seja quase impossível de se medir. Por exemplo, na explosão de uma mistura 2:1 mol por mol de gases H2 e O2, a reação parece ter reagido totalmente, porque não são destacadas quantidades remanescentes de hidrogênio e oxigênio. 2H2(g) + O2(g) → 2H2O(g) Na realidade, a reação se processa rapidamente para um estado de equilíbrio, no qual permanecem ínfimas quantidades de H2 e O2. Assim, a expressão “a reação foi completada”, significa que o equilíbrio foi estabilizado. Reagentes Sentido direto: v1 Produto 2H2(g) + O2(g) H2O(g)* Sentido indireto: v2 E o que é Estado de Equilíbrio? Bem, você pode imaginar uma situação real que acontece no seu dia-a-dia. 76 3ª série do Ensino Médio Química OBJETIVOS DE APRENDIZADO Enunciar, reconhecer e aplicar ao deslocamento do equilíbrio o princípio de Le Chatelier. Prever o deslocamento do equilíbrio, numa reação, quando houver: variação da concentração dos reagentes, variação de temperatura, variação de pressão e presença de catalisadores. RECURSOS NECESSÁRIOS - 1 bacia pequena. - 1 garrafa de cerveja ou 1 garrafa d’água. - 1 geladeira. - 1 garrafa de refrigerante. - 1 óculos com lente fotocromática. - 1 garrafa de refrigerante fechada. ROTEIRO DA ATIVIDADE 1 • Colocar dentro de uma bacia pequena uma garrafa cheia de cerveja ou uma garrafa cheia d’água, no congelador de uma geladeira. • Aguarde até o dia seguinte. • Retire a bacia com a garrafa. • Observe. O que aconteceu? • Como justificamos o ocorrido quimicamente? ROTEIRO DA ATIVIDADE 2 • Colocar um óculos fotocromático no sol. • O que ocorreu com as lentes? • Agora, leve o óculos para um local sem intensidade de luz solar. • Que mudança ocorreu com as lentes? • Como você explica o que aconteceu? Equilíbrio Químico 77 ROTEIRO DA ATIVIDADE 3 • Abra um refrigerante (guaraná, coca-cola etc.). • Observe o que aconteceu? • Como explicamos tal fenômeno. REFERÊNCIAS BIBLIOGRÁFICAS TITO & CANTO. Química na Abordagem do Cotidiano vol 2. São Paulo: Editora Moderna. 3ªedição, 2003. HESS, Sônia. Experimentos de Química com materiais domésticos. São Paulo: Editora Moderna.1ªedição, 1997. 78 3ª série do Ensino Médio Química PARA O PROFESSOR Resultados esperados da atividade 1 Imagine uma garrafa de cerveja. Quando a colocamos em um congelador ou freezer e esquecemos de retirá-la após um determinado tempo, possivelmente a garrafa teria estourado, mas muitas vezes isso não ocorre. O fenômeno é denominado de supercongelamento, isto é, quando o líquido, no caso a cerveja, “esquece” de congelar, pois o processo de resfriamento foi muito rápido e as moléculas do líquido estão em um estado de equilíbrio. No entanto, quando retiramos a garrafa do congelador e a abrimos, ela estoura, pois diminuímos a pressão no interior da garrafa, ou seja, diminuímos a pressão dentro do sistema, o que provoca uma perturbação no estado de equilíbrio que se estabelecia dentro da garrafa. Estados de Equilíbrio estão muito presentes no nosso dia-a-dia, seja em fenômenos físicos, biológicos e até mesmo fenômenos químicos. Resultados esperados da atividade 2 Você, possivelmente, já viu ou ouviu falar dos óculos fotocromáticos. Talvez não os conheça por este nome, mas deve conhecê-los. Óculos fotocromáticos são aqueles óculos que possuem lentes que mudam de cor, conforme a intensidade luminosa, ou seja, quando uma pessoa que usa este tipo de óculos está dentro de uma residência, as lentes são praticamente incolores, mas quando esta pessoa fica exposta à luz solar, as lentes tendem a ficar com uma coloração escura. Isso é devido a uma reação química que ocorre nos óculos. A reação que ocorre nas lentes dos óculos é a seguinte: AgCl + Energia ↔ Ag + Cl O cloreto de prata (AgCl), quando na lente, dá uma aparência clara para a mesma, já a prata metálica (Ag), quando é formada na lente, dá uma aparência escura à lente. Esta reação é um caso em que, se aumentar a energia na lente, no caso, a claridade, o equilíbrio deslocará para o lado da formação do Ag elementar que é escuro (na lente). Quando se diminui a intensidade luminosa na lente ocorre o favorecimento da reação inversa, ou seja, a diminuição da sensação escura. Este exemplo é abrangido pelo princípio de Le Chatelier, que diz: “Quando um sistema está em equilíbrio e sofre alguma perturbação, seja ela por variação de pressão, de concentração de algum dos reagentes ou dos produtos, ou pela variação da temperatura, o sistema tenderá a retornar o estado de equilíbrio, a partir da diminuição do efeito provocado pela perturbação.” Este princípio pode ser enunciado de uma maneira mais simplificada: quando se aplica uma perturbação a um sistema em equilíbrio, o sistema tende a provocar um reajuste para diminuir as influências da perturbação. Equilíbrio Químico 79 Resultados esperados da atividade 3 Dentro de uma garrafa de refrigerante, ocorrem várias reações, mas um destaque pode ser dado para o ácido carbônico (H2CO3), que se decompõe em H2O e CO2: H2CO3 (aq) → H2O(l) + CO2 (g) Esta é a reação de decomposição do ácido carbônico, sendo que ela está em equilíbrio químico, pois à medida que ocorre a decomposição, também ocorre a formação de ácido carbônico, sendo assim pode-se dizer que esta é uma reação que representa um estado de equilíbrio, que sofre influência pela variação de temperatura, de pressão e também da concentração das substâncias envolvidas. Quando abrimos uma garrafa de refrigerante, ocorre uma diminuição da pressão no interior do sistema (garrafa de refrigerante), ocorrendo um deslocamento do equilíbrio para o lado de maior número de mols gasosos, ou seja, o lado dos produtos. Isto é mostrado pelo princípio de Le Chatelier. O estado de equilíbrio também pode ser deslocado pelo aumento da temperatura, ou seja, caso coloquemos um pouco de refrigerante para aquecer em um recipiente adequado, ocorrerá a liberação de gases (esta reação é endotérmica), assim como no caso em que abrimos a garrafa de refrigerante, ou seja, o gás liberado é o gás carbônico, CO2. Neste exemplo, nas duas situações, estaremos provocando um deslocamento de equilíbrio químico, o que provocará no refrigerante uma modificação no seu gosto. Isto você já deve ter percebido, quando um resto de refrigerante fica muito tempo dentro da geladeira, ele fica com um gosto diferente, isto ocorre devido ao fato de ter ocorrido perda de CO2, logo, perda de H2CO3. 80 3ª série do Ensino Médio Química FABRICAÇÃO DO PAPEL INDICADOR DE REPOLHO ROXO Item curricular Comportamento Químico das Substâncias Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO Indicadores visuais são substâncias capazes de mudar de cor dependendo das características físico-químicas da solução na qual estão contidos, em função de diversos fatores, tais como pH, potencial elétrico, complexação com íons metálicos e adsorção em sólidos. Podem ser classificados de acordo com o mecanismo de mudança de cor ou os tipos de titulação nos quais são aplicados. Os indicadores ácido-base ou indicadores de pH são substâncias orgânicas fracamente ácidas (indicadores ácidos) ou fracamente básicas (indicadores básicos) que apresentam cores diferentes para suas formas protonadas e desprotonadas; isto significa que mudam de cor em função do pH. OBJETIVOS DE APRENDIZADO O trabalho visa disseminar a aplicação do extrato de repolho roxo e acesso imediato ao princípio ativo (antocianinas) deste nos estudos de acidez-basicidade, que fazem parte do programa de Química do Ensino Médio. Desenvolvemos, assim, o papel indicador de pH com esse extrato aquoso. Objetivou-se também a conservação do extrato aquoso de repolho roxo com substâncias tidas na literatura como conservantes (cloreto mercúrico, ácido cítrico e formol). RECURSOS NECESSÁRIOS - Repolho-roxo - Papel de filtro - Vinagre - Água com sabão - Água sanitária Fabricação do Papel Indicador de Repolho Roxo 81 - Leite de Magnésio (ou outro anti-ácido estomacal) - Comprimido de AAS (ácido acetilsalicílico) - Papel de filtro - Recipiente de vidro - Peneira - 4 tubos de ensaio ROTEIRO DA ATIVIDADE Preparo do extrato e do papel de pH - Ferva por 15 minutos 30g de repolho roxo picado em 150 mL de água destilada. Deixe decantar por 10 minutos e filtre. O filtrado deve ser concentrado a 10 mL e, em seguida, emergir tiras de papel de filtro no concentrado e secar ao ar. Para conservar o extrato por longo período convém adicionar 2 gotas de formol após seu esfriamento. - Em tubos de ensaio com soluções de pH exatamente conhecido nas faixas de 1 a 14, foram inseridos tiras do papel indicador que apresentaram variação apreciável de cor nas faixas de pH. O papel passa a cor para a solução em que for inserido apresentando um colorido atrativo. - Foram também realizados experimentos com o extrato aquoso de repolho roxo com formol nas soluções tampão (pH 1 - 14) cujo comportamento não apresentou modificação. As mudanças de cores nas faixas de pH foram observadas: pH Cor Atividade 1-3 4-6 7-10 > 12 vermelho muito ácida violeta ác. moderado azul-verde neutro-básica amarelo muito básica QUESTÕES SUGERIDAS Com a fabricação do papel indicador repolho roxo, identifique com uma tira de papel indicador roxo a acidez ou basicidade das substâncias e preencha o quadro: SUBSTÂNCIA Sabão em pó com água Vinagre Leite de Magnésia Comprimido de AAS 82 3ª série do Ensino Médio ÁCIDO BASE Química REFERÊNCIAS BIBLIOGRÁFICAS Química & Sociedade. PEQUIS (Pesquisa de Ensino de Química e Sociedade). Wildson Luiz Pereira dos Santos, Gerson de Souza Mol (coordenadores) e outros. São Paulo: Editora Nova Geração, 2005. SILVA, Eduardo Roberto, NÓBREGA, Olímpio Salgado e SILVA, Ruth Hashimoto. Química Conceitos Básicos. São Paulo: Editora Ática, 2001. Fabricação do Papel Indicador de Repolho Roxo 83 PARA O PROFESSOR Resultados Esperados O estudo da estabilidade do extrato de repolho roxo com os conservantes foi acompanhado através da espectroscopia no visível. A amostra com formol foi a única que não apresentou alteração dos espectros de absorção, enquanto que os demais apresentaram alteração imediatamente. Os estudos espectrocópicos do extrato com formol ao longo de 3 semanas evidenciaram a não decomposição do mesmo e o seu comportamento frente às soluções tampão foi o mesmo. A partir dos resultados, será possível utilizar o papel de pH com o pigmento cianina do repolho roxo bem como estocar o extrato aquoso com formol. Ressaltamos que as tiras de papel de pH apresentam uma excelente durabilidade. Foi feita a determinação do pH de alguns produtos de uso doméstico, utilizando-se os indicadores desenvolvidos em papel e em solução. Os resultados podem ser comparados com medidas realizadas com indicadores comerciais de pH (fita indicadora universal de pH, Merck, e papel indicador universal de pH, Reagen). Explorações adicionais Um pouco mais sobre indicadores O uso de indicadores de pH é uma prática bem antiga que foi introduzida no século XVII por Robert Boyle. Ele preparou um licor de violeta e observou que o extrato desta flor tornavase vermelho em solução ácida e verde em solução básica. Gotejando o licor de violeta sobre um papel branco e, em seguida, algumas gotas de vinagre, observou que o papel tornava-se vermelho. Assim foram obtidos os primeiros indicadores de pH em ambas as formas: solução e papel. Nessa época, o conceito de ácidos e bases ainda não estava formalizado. Isto só veio a ocorrer numa primeira tentativa cientificamente reconhecida, no século XIX, por iniciativa do químico sueco Svante Arrhenius. Entretanto, ainda no século XVII, Boyle empregava a seguinte descrição: “Ácido é qualquer substância que torna vermelhos os extratos de plantas”. 84 3ª série do Ensino Médio Química A partir dos trabalhos de Boyle, publicações sobre o uso de extratos de plantas como indicadores tornaram-se freqüentes. Os extratos mais utilizados nessa época eram os de violeta e de um líquen, Heliotropium tricoccum, chamado em inglês de “litmus” e em francês “tournesol”. Durante o século XVIII, notou-se que nem todos os indicadores apresentavam as mesmas mudanças de cor. Em 1775, Bergman escreveu que extratos de plantas azuis são mais sensíveis aos ácidos, ou seja, possuem uma variação gradual de cor, que pode diferenciar ácidos fortes de fracos. Por exemplo, ácido nítrico torna o extrato vermelho, já o vinagre não. E quando se trabalha com extrato de litmus, esta mudança gradual de cor para ácidos de diferentes forças não é observada. Em 1767, Willian Lewis usou, pela primeira vez, extratos de plantas para a determinação do ponto final em titulações de neutralização. Antes disso, os extratos obtidos a partir de diversas espécies de plantas só tinham aplicação para a análise qualitativa de águas minerais mencionadas por Boyle, Iorden e duClos. Em 1835, Marquat, realizando estudos com diversas espécies vegetais, propôs o termo antocianinas (do grego: anthos=flores; kianos=azul) para se referir aos pigmentos azuis encontrados em flores. Somente no início do século XX, Willstätter e Robinson relacionaram as antocianinas como sendo os pigmentos responsáveis pela coloração de diversas flores e que seus extratos apresentavam cores que variavam em função da acidez ou alcalinidade do meio. Foi notado que as antocianinas possuem coloração avermelhada em meio ácido, violeta em meio neutro e azul em condições alcalinas. Esse estudo explicou as mudanças de cores de extratos vegetais observadas por Boyle. Atualmente, sabe-se que as antocianinas, pigmentos da classe dos flavonóides, são responsáveis pelas cores: azul, violeta, vermelho e rosa de flores e frutas. Antocianinas são compostos derivados das antocianidinas, cuja estrutura genérica ilustrada na Figura 1 é o cátion flavílico. Nas antocianinas, uma ou mais hidroxilas das posições 3, 5 e 7 estão ligadas a açúcares, aos quais podem estar ligados ácidos fenólicos. Os diferentes grupos R e R’ e açúcares ligados nas posições 3, 5 e 7, assim como os ácidos a eles ligados, caracterizam os diferentes tipos de antocianinas, sendo que as mais comuns são apresentadas na Tabela 1. Fabricação do Papel Indicador de Repolho Roxo 85 As diferentes cores exibidas pelos vegetais que contêm antocianinas dependem da influência de diversos fatores, como a presença de outros pigmentos, a presença de quelatos com cátions metálicos e o pH do fluído da célula vegetal. A propriedade das antocianinas apresentarem cores diferentes, dependendo do pH do meio em que elas se encontram, faz com que estes pigmentos possam ser utilizados como indicadores naturais de pH. As mudanças estruturais que ocorrem com a variação do pH e são responsáveis pelo aparecimento das espécies com colorações diferentes, incluindo o amarelo em meio fortemente alcalino, podem ser explicadas pelo esquema das principais transformações ilustradas na Figura 2. 86 3ª série do Ensino Médio Química ENDOTÉRMICO OU EXOTÉRMICO? Item curricular Termoquímica Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO O funcionamento do corpo humano está associado a reações químicas, como, por exemplo, a produção de energia através do metabolismo de alimentos na digestão. Termoquímica é a parte da ciência que estuda as transferências de calor associadas a fenômenos físicos e químicos. OBJETIVOS DO APRENDIZADO - Identificar fenômenos em que ocorram trocas de calor. - Classificar os fenômenos em processos endotérmicos ou exotérmicos. CONHECIMENTOS PRÉVIOS Identificar os componentes de uma reação química: reagentes e produtos. RECURSOS NECESSÁRIOS - Placa de petri ou tampa de metal de uma lata de leite ou azulejo. - Permanganato de potássio (KMnO4) (comprado em farmácias). - Glicerina (comprada em farmácias). - Algodão. - Salitre do Chile (KNO3) (comprado em lojas de plantas e animais). - Água. - Frasco de Vidro. Endotérmico ou Exotérmico? 87 ROTEIRO DAS ATIVIDADES Atividade 1 Coloque primeiramente uma placa de petri ou tampa de leite em pó (sem ser de plástico) em cima da mesa de trabalho. Pegue um pedaço de algodão bem “fofo” aerado e coloque sobre ele uma colher (de café) de permanganato de potássio. Adicione aproximadamente 9 gotas de glicerina sobre o permanganato. Aguarde cerca de 8 minutos para que se inicie a queima do algodão. Obs: Esta reação também pode ser feita sem o algodão, só que haverá necessidade de maior quantidade de permanganato (uma colher de sopa). A reação química que descreve o fenômeno observado é: 14KMnO4(s) + 4C3H5(OH)3() → 7K2CO3(s) + 7Mn2O3(s) + 5CO2(g) + 16H2O(v) + calor Atividade 2 Dissolva um pouco de KNO3 em água e peça para um aluno tocar na parede externa do frasco de vidro ou meça a temperatura da solução com um termômetro para comprovar a diminuição da temperatura. Questões sugeridas 1) O que pode ser observado na reação do permanganato de potássio com glicerina? 2) O que pose ser observado na dissolução do nitrato de potássio em água? 3) Classifique esses fenômenos em endotérmico ou exotérmico. 4) Cite um exemplo do cotidiano de um processo que envolva liberação ou absorção de calor. REFERÊNCIAS BIBLIOGRÁFICAS TITO & CANTO – Química na abordagem do cotidiano. São Paulo: Moderna, 2000. FELTRE, Ricardo. Química - vol.1. São Paulo: Moderna, 1995. 88 3ª série do Ensino Médio Química PARA O PROFESSOR Resultados esperados - A liberação de grande quantidade de calor. - A temperatura do recipiente diminuiu bastante, ficou gelada. - A reação do permanganato de potássio com glicerina é um processo exotérmico e a dissolução do nitrato de potássio em água é endotérmico. - Liberação de calor: combustão de madeira, gás de cozinha etc. - Absorção de calor: éter em contato com a pele que ao vaporizar utiliza o calor de seu corpo. Explorações adicionais Essa reação, pelo seu visual, pode ser utilizada como demonstração de fenômeno químico sem preocupação com a reação química. Em Biologia, pode ser citada na formação do ATP e mitocôndria (respiração celular), Em física - Calorimetria. Endotérmico ou Exotérmico? 89 TERMOQUÍMICA Item curricular Termoquímica Roteiro do Aluno para Aula Prática de Química INTRODUÇÃO O tema proposto está voltado à compreensão de situações em que reações químicas e fenômenos físicos provocam mudanças na temperatura ambiente, por exemplo, quando a chama do fogão é acesa, ela fornece calor necessário para aquecer a água, fritar um bife ou, então, assar um frango no forno; a reação entre o combustível e oxigênio do ar, que ocorre no interior do motor dos aviões, ônibus, caminhões e automóveis, fornece a energia necessária para movimentá-los. É possível decompor a água em oxigênio e hidrogênio, à custa do fornecimento de energia. Nosso principal interesse está voltado para dois tipos de trocas energéticas: a transferência de calor associado a uma reação química e as transferências de calor associadas às mudanças de estado físico, como: Por que ao sair molhado após um banho de piscina ou de mar, ao vento, sentimos uma sensação de frio? OBJETIVOS DE APRENDIZADO - Entender a classificação das transformações físicas e químicas com relação ao calor trocado com o ambiente. - Conhecer o conceito de variação de entalpia. - Saber prever valores de variação de entalpia de uma reação utilizando a Lei de Hess. 90 3ª série do Ensino Médio Química RECURSOS NECESSÁRIOS - Lamparina. - Copos de vidro, resistente ao calor. - Algodão. - Álcool. - Água. - Cadinho de porcelana. - Palito de fósforo. - Lata de refrigerante. - Óleo comestível. - Amendoim. - Balança (digital). ROTEIRO DA ATIVIDADE 1 Calculando as calorias Coloque 200ml de água numa lata de refrigerante, limpa e vazia. Anote a temperatura da água, com o termômetro. Com uma balança digital, determine e anote a massa de um amendoim (ou grão de soja, pedaço de gordura animal, de bife, de pão seco etc.).Coloque o amendoim num recipiente para ser queimado, a uns 2cm do fundo da lata. Ateie fogo no amendoim. Quando terminar a queima, agite a água com o termômetro, verifique e anote a nova temperatura da água. Determine a massa final do amendoim e anote. Calcule o poder calorífero do amendoim em kcal/g e em kJ/g. ROTEIRO DA ATIVIDADE 2 Transferindo calor Coloque 1ml de óleo numa cápsula de porcelana (cadinho). Introduza uma cabeça de um palito de fósforo dentro da cápsula. Aqueça o sistema usando lamparina. Observe o que acontece. Escreva uma explicação para o que foi observado. Termoquímica 91 ROTEIRO DA ATIVIDADE 3 Umedeça um chumaço de algodão no álcool comum, coloque-o sobre uma tela de amianto. Queime o algodão e observe o que acontece. Prepare uma solução de água e álcool. Umedeça outro pedaço de algodão e coloque-o sobre a tela de amianto. Queime-o e observe o que acontece. Escreva uma explicação para o que foi observado. QUESTÕES SUGERIDAS Para fixar os conteúdos, pode-se preparar palavras cruzadas, caça-palavras, textos para serem corrigidos, textos para serem completados os espaços vazios etc. CALOR ENDOTÉRMICO QUILOJOULES ENERGIA TERMOQUÍMICA CALORIA 1000 < JOULE > 4,18 H PRODUTOS REAGENTES QUILOCALORIA ABSORÇÃO EXOTÉRMICO LIBERAÇÃO 1) Complete as lacunas do texto a seguir com as palavras destacadas nos retângulos “Os fenômenos que nos rodeiam envolvem trocas de ______, na forma de _____com o meio ambiente. Estas trocas são estudadas por uma ciência denominada _____________. São dois os processos de trocas com o meio ambiente que a química estuda: o processo __________ que é aquele que ocorre com ________ e o _________ que é aquele que ocorre com ___________ de calor. Não se consegue determinar o conteúdo de energia de uma substância. Na prática,o que se mede é a variação de entalpia ( ____ ). A variação de entalpia é igual à diferença entre a entalpia dos ________ e a entalpia dos __________. Nas reações exotérmicas ∆___ 0, já nas reações endotérmicas ∆ ___ 0. As quantidades de energia são expressas em _______ (cal),em ________ (Kca l) ou ainda em _______(J) e _________(KJ); O Kcal equivale a ________ e 1 cal equivale a _______ J.” 92 3ª série do Ensino Médio Química 2) Caça-palavras M A R A V I L H A S T E E I M P O R T A N T E S N I E A T E R O L A C I E T T V M E N O R I N E R O X E I O R X E R N A G R U A S T E R M O Q U I M I C A T I R I L U T A O I B O L A O M A E S S E L U O J J M O C I C E X O R D I D O B P M O A T S U B M O C C E A A N E N T A L P I A A M S E N D O T E R M I C O L O H S R J E S U S R I O S Palavras a serem encontradas Energia - Maior - Menor - Calor - Entalpia - Joules - Caloria - Termoquímica - Endotérmica - Exotérmica - Combustão - Queima Obs: As palavras podem estar na vertical, na horizontal ou na diagonal. REFERÊNCIAS BIBLIOGRÁFICAS UTIMURA, Teruko Y. Química. Livro único. São Paulo: FTD, 1998. USBERCO, João. Química Essencial. São Paulo: Saraiva, 2001. SARDELLA, Antônio. Química. São Paulo: Ática, 2004. HARTWIG & SOUZA & MOTA. Química 2. São Paulo: Ed.Scipione, 1999. CAMARGO,Geraldo. Química Moderna 2. São Paulo: Ed.Scipione, 1995. FONSECA,Martha Reis. Química Integral. São Paulo: FTD, 1993. TITO & CANTO. Química. São Paulo: Ed.Moderna, 1999. Termoquímica 93 PARA O PROFESSOR Conhecimentos prévios A partir de exemplos vivenciados pelo aluno, mostrar-lhe que mudanças de estado físico e reações químicas são transformações que trocam (perdem ou ganham) calor com o ambiente; fazer referência ao conteúdo calorífero de alimentos listados em rótulos e embalagens; relembrar mudança de estado físico da matéria; relembrar ligações químicas. Resultado esperado da atividade 1 Sendo um processo semelhante ao experimento anterior, observa-se que a queima do amendoim provoca um aumento na temperatura da água – processo exotérmico. Este experimento nos permite calcular as quantidades de energia dos alimentos (poder calórico), sem muita precisão é claro, usando um “calorímetro doméstico”. O cálculo do poder calórico do amendoim é calculado da seguinte forma: Utilizamos 200ml de água, como sua densidade é igual a 1g/ml, 200ml=200g. A quantidade de calor necessário para elevar em 1ºC a temperatura de 1,0g de água é equivalente a 1 caloria (cal). Suponhamos que a variação de temperatura observada foi de 5°C, então para elevar em 5°C a temperatura de 1g de água são necessários 5 cal, então: 1g de água 200g 5 cal x x= 1000 cal (= a energia liberada) Suponhamos que a diferença entre a massa inicial e a massa final do amendoim tenha sido de 0,2g, então: 0,2g de amendoim 1,0g de amendoim 5 cal x x= 1000 cal (= a energia liberada) Então, o poder calórico do amendoim é de 5000 cal/g ou 5 Kcal/g, ou ainda 20.900 J/g (pois 1 caloria = 4,18 Joules ). Resultado esperado da atividade 2 Quando se fornece calor ao óleo, pouco tempo depois a cabeça do palito de fósforo entra em combustão (queima). A cabeça do palito de fósforo é formada por uma mistura de clorato de potássio, enxofre etc. embebidos em um banho de parafina. Para que ocorra a combustão do palito de fósforo, é necessário que os reagentes adquiram energia de ativação. No presente experimento, essa energia é conseguida através do calor do óleo. 94 3ª série do Ensino Médio Química Obs: Muitas cozinheiras utilizam este experimento para verificar o momento certo em que a temperatura do óleo é ideal para a fritura. Não se utiliza a água porque ocorreria a dissolução dos componentes do palito. Resultado esperado da atividade 3 O algodão embebido na solução de álcool e água não queima, porque o calor liberado na combustão do álcool (processo exotérmico) é usado na vaporização do álcool e da água e liberado para o ambiente, não sobrando energia suficiente para a queima do algodão. A água também tem um papel refrigerante, absorvendo parte do calor gerado na queima do álcool. Obs: Este experimento também poderia ser feito utilizando-se um copo de papel no lugar do chumaço de algodão. Respostas esperadas Para fixar os conteúdos, pode-se preparar palavras cruzadas, caça-palavras, textos para serem corrigidos, textos para serem completados os espaços vazios etc. 1) Complete as lacunas do texto a seguir com as palavras destacadas nos retângulos “Os fenômenos que nos rodeiam envolvem trocas de energia, na forma de calor com o meio ambiente. Estas trocas são estudadas por uma ciência denominada termoquímica. São dois os processos de trocas com o meio ambiente que a química estuda: o processo exotérmico que é aquele que ocorre com liberação e o endotérmico que é aquele que ocorre com absorção de calor. Não se consegue determinar o conteúdo de energia de uma substância. Na prática,o que se mede é a variação de entalpia (∆H). A variação de entalpia é igual a diferença entre a entalpia dos produtos e a entalpia dos reagentes. Nas reações exotérmicas ∆ < 0, já nas reações endotérmicas ∆ > 0. As quantidades de energia são expressas em caloria (cal), em quilocaloria (Kca l) ou ainda em Joule (J) e quilojoule (KJ); O Kcal equivale a 1000 cal e 1 cal equivale a 4,18 J.” Obs: Sublinhadas estão as respostas do exercício. Outras atividades sugeridas Pode-se trabalhar com pesquisas que envolvam a utilização do tema abordado (contextualização) no cotidiano, como por exemplo: 1) Tabelar as quantidades de energia (valor energético) de um determinado alimento quando aproveitado pelo nosso corpo - expresso em quilocalorias (Kcal) ou quilojoules (KJ). Termoquímica 95 2) Tabelar as necessidades diárias de calorias, por sexo e idade. 3) Tabelar o consumo metabólico aproximado (gasto de energia) em diversas atividades para uma pessoa (depende do peso e da altura) como: dormindo, caminhando lentamente, dançando, jogando futebol, nadando, correndo etc. 4) Documentários que explorem o tema, como por exemplo: - A autodefesa do Besouro-Bombardeiro é uma reação exotérmica. 5) As bolsas plásticas utilizadas como primeiros-socorros (compressas) para atletas que sofreram problemas musculares durante competições utiliza os processos endotérmico e exotérmico. Para compressas quentes usa-se Cloreto de Cálcio ou Sulfato de Magnésio e, para compressas frias, Nitrato de Amônio. As reações são: CaCl2(s) + H2O → Ca2+(aq) + 2 Cl-(aq) ∆H = - 82,8 KJ NH4NO3(s) + H2O → NH4+(aq) + NO3-(aq) ∆H= + 26,2 KJ Estas experiências podem ser realizadas em sala de aula também. Tais bolsas atuam por 20 minutos, aproximadamente. 6) Avaliar e comparar o poder energético das principais fontes de energia (combustíveis) utilizadas pelo homem – por exemplo: etanol, hidrogênio, gás metano etc. 7) Pesquisar sobre formas de armazenar quantidades enormes de energia nas ligações químicas – o melhor exemplo são os explosivos. Obs: Para se ter uma reação muito exotérmica, um explosivo deve ter ligações químicas muito fracas, e sua decomposição deve produzir substâncias com ligações químicas muito fortes. Analisando as energias de ligação observamos que as ligações N=N, C=O e C=O são muito fortes, e os explosivos são fabricados para produzir N2(g), CO(g) e CO2(g). 4 C3H5N3O9 (l) → 6 N2(g) + 12 CO2(g) + 10 H2O(v) + O2(g) (Reação de decomposição da nitroglicerina) 8) Pesquisar sobre as fontes de energia disponíveis no planeta (renováveis e não-renováveis), como por exemplo: energia solar (do sol), energia eólica (dos ventos), energia hidráulica (da água), nuclear (de núcleos atômicos), biomassa, petróleo, carvão mineral etc. 9) Pode-se aproveitar o assunto e pesquisar sobre: Efeito estufa, Chuva ácida, Protocolo de Kyoto etc. 96 3ª série do Ensino Médio
Download