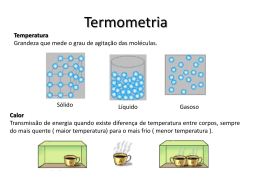
Tecnologia em Processos Químicos Referência: Halliday, R. Fundamentos de Física. Volume2. Capítulo 19: Temperatura, Calor e a Primeira Lei da Termodinâmica 19.1 Termodinâmica A termodinâmica estuda a energia térmica (freqüentemente chamada de energia interna) de sistemas. O conceito central da termodinâmica é a temperatura. Em um dia frio temos a sensação que um corrimão de ferro é mais frio que um corrimão de madeira sujeito a mesma temperatura. Este erro na nossa percepção ocorre porque o ferro remove energia dos nossos dedos mais rapidamente que a madeira. Neste capítulo definiremos temperatura a partir de seus fundamentos e não a partir da sensação de temperatura. A temperatura é uma das sete grandezas básicas do Sistema Internacional (SI). Físicos medem temperaturas na escala Kelvin , que é marcada em unidades chamadas kelvins. O limite inferior da temperatura de um corpo é tomado com zero da escala de temperatura Kelvin. A o temperatura ambiente (20 C) é equivalente a 293 k. Temperatura: é a medida de agitação das partículas que compõem um determinado material. Se considerarmos as moléculas de um gás, quanto maior a sua temperatura, maior a energia cinética dessas moléculas. Equilíbrio Térmico: dois corpos em contato físico estão em equilíbrio térmico quando param de trocar energia, isto é, quando o fluxo de energia entre eles é nulo. Quando isso acontece, a temperatura dos dois corpos é a mesma. 19.2 A lei Zero da Termodinâmica As propriedades de muitos corpos variam quando alteramos as suas temperaturas. Por exemplo, quando suas temperaturas aumentam, a pressão exercida por um gás confinado aumenta e o volume de um líquido também aumenta. Quando um termômetro e algum outro objeto são colocados em contato um com o outro, ao final de algum tempo eles alcançam equilíbrio térmico. A leitura do termômetro é considerada como a temperatura do outro objeto. O processo fornece medições de temperatura consistentes e úteis devido à lei zero da termodinâmica: Se os corpos A e B estiverem cada um em equilíbrio térmico com um terceiro corpo C (o termômetro), então A e B estarão em equilíbrio térmico um com o outro. 19.3 Medindo temperatura Através de substâncias termométricas são realizadas as medidas de temperatura de outros corpos e a relação entre elas. A temperatura é medida através de um termômetro, que contém uma substância de trabalho com uma propriedade mensurável de um material. Entre essas propriedades estão: o volume de um líquido, o comprimento de uma barra, a resistência elétrica de um material e o volume de um gás mantido a pressão constante. Para definir um termômetro é necessário: • Estabelecer uma escala termométrica, através da escolha de uma substância termométrica e da propriedade termométrica dessa substância; • Definir uma escala específica; • Calibrar o termômetro através de um ponto fixo padrão , atribuindo-lhe uma temperatura. 1 A Escala de Temperatura Kelvin: No sistema SI, a temperatura é medida na escala Kelvin, que se baseia no ponto tríplice da água (273,16 K). Outras temperaturas são então definidas pelo uso de um termômetro de gás a volume constante, no qual uma amostra de gás é mantida a volume constante de modo que a sua pressão seja proporcional à sua temperatura. Definimos a temperatura Tk medida com o termômetro a gás como: Tk = 273,16. p p3 Nesta equação, Tk é medido em kelvin e p3 e p são as pressões do gás a 273,16 K e na temperatura medida, respectivamente. 19.4 As escalas Celsius e Fahrenheit A escala Celsius foi escolhida para uso comercial e popular e possui o mesmo tamanho da escala Kelvin. O zero da escala Celsius está deslocado para um valor mais conveniente. É definida por: TC = TK − 273,15 o Nesta equação, TC é a temperatura em Celsius, TK é a temperatura em Kelvin. o Ponto de ebulição da água: 100 C = 373,15 K o Ponto de congelamento da água: 0 C = 273,15 K A escala Fahrenheit é definida por: 9 TF = TC + 32 o 5 Nesta equação, TF é a temperatura em Fahrenheit e TC é a temperatura em Celsius. 1 O ponto fixo padrão pode ser, por exemplo, o ponto de ebulição da água, o ponto de fusão da água, o ponto tríplice da água. Comparação entre as escalas de temperatura Kelvin, Celsius e Fahrenheit 19.5 Expansão Térmica Todos os objetos variam de tamanho com a variação da temperatura. Para uma variação de temperatura T = Tf - Ti, uma variação L em qualquer dimensão linear L é dada por: ∆L = L.α .∆T onde α é o coeficiente de expansão linear . A variação V no volume V de um sólido ou líquido é: ∆V = V .β .∆T Nesta equação, β = 3. α. é o coeficiente de expansão volumétrica do material. 19.6 Temperatura e Calor Calor: O calor Q é a energia que é transferida entre um sistema e o seu ambiente por causa de uma diferença de temperatura entre eles. Ele pode ser medido em joules (J), calorias (cal), quilocalorias (kcal) ou em unidades térmicas britânicas (Btu), com: -3 1 cal = 3,969.10 Btu = 4,1860 J Sendo TS (temperatura do sistema) e TA (temperatura ambiente) haverá transferência de energia térmica (calor) do sistema para o ambiente ou do ambiente para o sistema até ocorrer o equilíbrio térmico. Calor (Q) Temperatura (T) Tipo de transferência de calor Q>0 TS < TA Calor absorvido pelo sistema Q<0 TS > TA Calor perdido ou liberado pelo sistema Q=0 TS=TA Não há transferência de calor Tanto o Calor quanto o trabalho não são propriedades intrínsecas de um sistema. Eles descrevem a transferência de energia para dentro ou para fora do sistema. 19.7 A absorção de Calor por Sólidos e Líquidos Capacidade Calorífica e Calor Específico: Se o calor Q for absorvido por um objeto, a variação de temperatura do objeto Tf - Ti, está relacionada por Q por: Q = C.(Tf − Ti ) onde C pe a capacidade calorífica do objeto. Se o objeto possuir massa m, então Q = m.c.(Tf − Ti ) onde c é o calor específico do material que compõe o objeto. O calor específico molar de um 23 material é a capacidade calorífica por mol, ou por 6,02.10 unidades elementares do material. Calor de transformação: O calor absorvido por uma material pode mudar o estado físico ou fase do material- por exemplo, de sólido para líquido ou de líquido para gás. A quantidade de energia necessária por unidade de massa m para mudar a fase (mas não a temperatura) de um material particular é o seu calor de transformação L. Assim, Q = L.m O calor de vaporização Lv é a quantidade de energia por unidade de massa que deve se acrescentada para vaporizar um líquido ou que deve ser removida para condensar um gás. O calor de fusão LF é a quantidade de energia por unidade de massa que deve ser adicionada para derreter um sólido ou que deve ser removida para congelar um líquido. Para a água temos: LF = 79,5 cal/g = 6,01 kJ/mol = 333 kJ/kg LV = 539 cal/g = 40,7kJ/mol = 2256 kJ/kg 19.8 Um olhar mais de perto sobre Calor e Trabalho Trabalho Associado com a Mudança de Volume: Um gás pode trocar energia com seus arredores por meio de trabalho. A quantidade de trabalho W realizado por um gás quando ele se expande ou se contrai de um volume inicial Vi até um volume final Vf é dado por: Vf W= p.dV Vi A integração é necessária porque a pressão p pode variar durante a mudança de volume. Caso a pressão seja constante: W = p.∆V Na figura 17.6 observamos que o trabalho realizado é dado pela área embaixo da curva do diagrama pV. Processo termodinâmico: modifica o estado inicial de um sistema (gás) que estava com um determinado valor de pressão, volume e temperatura. Maneiras de variar o estado de um gás: A figura abaixo mostra três caminhos diferentes entre o estado 1 e o estado 2 (b) – (d). O trabalho realizado pelo sistema durante uma transição entre dois estados depende do caminho escolhido. O calor e o trabalho envolvidos dependem da trajetória escolhida. 19.9 Primeira Lei da Termodinâmica Define-se uma grandeza, chamada energia interna E , caracterizada pelos diversos tipos de energia possíveis de existir em uma substância quando ela está em determinado estado. Se tivéssemos um gás diatômico, a energia interna desse gás em determinado estado teria uma parte associada ao seu movimento (energia cinética de translação), outra parte associada a rotação de um átomo em torno do outro (energia cinética de rotação), outra parte associada à oscilação de um átomo em relação ao outro (energia potencial elástica), e outros tipos de energia, de acordo com o modelo usado para descrever a molécula e o gás a que ela pertence. No caso, mais simples, de um gás ideal monoatômico, a energia interna depende apenas do movimento dos átomos. A diferença de energia interna entre os estados inicial e final ∆EInt = Ef - Ei é uma grandeza de grande importância na termodinâmica, porque independente do percurso usado para ir de um estado para o outro, teremos sempre que: A diferença entre a quantidade de calor Q e o trabalho envolvidos em um percurso entre os estados inicial e final, depende apenas dos estados, e fornece o mesmo valor independente do percurso escolhido. O princípio da conservação da energia para um processo termodinâmico é expresso pela primeira lei da termodinâmica, que pode assumir uma das duas formas: ∆Eint = Eint, f − Eint .i = Q − W (primeira lei) Observações: • Eint representa a energia interna do material, que depende apenas do seu estado (temperatura, pressão e volume). • Q representa a energia trocada sob a forma de calor entre o sistema e o ambiente que o cerca. Q é positivo se o sistema absorver calor Q é negativo se o sistema perder calor • W é o trabalho realizado pelo sistema. W é positivo se o sistema se expandir se opondo a alguma força externa exercida pelo ambiente ao redor. W é negativo se o sistema se contrair devido a alguma força externa. • Tanto Q quanto W dependem da trajetória. • ∆E int independe do processo. Exemplos1: Exemplo 2: O trabalho total realizado pelo sistema no processo aba é igual a –500J. Qual seria o trabalho se o processo termodinâmico fosse realizado no sentido horário neste diagrama pV? 19.10 Aplicações da Primeira Lei da Termodinâmica A primeira lei da termodinâmica encontra aplicações em vários casos especiais: Casos Especiais Particularidade Primeira Lei da termodinâmica Processos Adiabáticos Q= 0 ∆Eint = −W Processos a Volume W = 0 ∆Eint = Q constante Processos cíclicos ∆Eint = 0 Expansões Livres ∆Eint = W = Q = 0 Q=W Processos Adiabáticos: É um processo em que não existe troca de calor entre o sistema e a sua vizinhança, ou seja: o sistema está muito bem isolado termicamente. Na Natureza existem processos que podemos aproximar como adiabáticos. São aqueles que ocorrem tão rapidamente que o sistema chega ao seu estado final antes que possa trocar calos com a vizinhança. Num processo adiabático, Q = 0 e de acordo com a Primeira Lei da Termodinâmica: ∆Eint = −W Processos a volume constante: São os chamados processos isométricos. Usando a definição de trabalho executado pelo sistema entre os estados inicial e final, encontramos que W = 0 porque não aconteceu variação de volume. Através da Primeira Lei da Termodinâmica encontramos que: ∆Eint = Q Processos cíclicos: Num processo cíclico o sistema passa por várias transformações, mas ao final do processo ele retorna ao estado inicial. Desse modo, temos que EI = EF e portanto não existe variação de energia interna, logo: Q=W 19.11 Mecanismos de transferência de calor A transferência de calor de um ponto a outro de um meio se dá através de três processos diferentes: convecção, radiação e condução. A convecção ocorre tipicamente num fluido, e se caracteriza pelo fato de que o calor é transferido pelo movimento do próprio fluido, que constitui uma corrente de convecção. Um fluido aquecido localmente em geral diminui de densidade e por conseguinte tende a subir sob o efeito gravitacional, sendo substituído por um fluido mais frio, o que gera naturalmente correntes de convecção. O borbulhar da água fervente em uma panela é o resultado de correntes de convecção. A radiação transfere calor de um ponto a outro através da radiação eletromagnética. A radiação térmica é emitida de um corpo aquecido e ao ser absorvida por outro corpo pode aquecêlo, convertendo-se em calor. O aquecimento solar é uma forma de aproveitamento da radiação solar para a produção de calor. Um ferro em brasa emite radiação térmica e aquece a região que o rodeia. A condução de calor só pode acontecer através de um meio material, sem que haja movimento do próprio meio. Ocorre tanto em fluidos quanto em meios sólidos sob o efeito de diferenças de temperatura. Condução, Convecção e Radiação: A taxa Pcond com que se conduz energia através de uma parede cujas faces são mantidas às temperaturas TQ (reservatório quente) e TF (reservatório frio) é Pcond = TQ − TF Q = k . A. t L onde A e L são a área da face e a espessura da parede, e k é a condutividade térmica do material. A convecção ocorre quando diferenças de temperaturas provocam uma transferência de energia pelo movimento no interior de um fluido. A radiação é uma transferência de energia por meio da emissão de energia eletromagnética. A taxa Prad com que um objeto emite energia por meio de radiação térmica é Prad = σ .ε . A.T 4 onde σ . (=5,6703.10-8 2 4 W/m .K ) é a constante de Stefan-Boltzmann, ε. é a emissividade da superfície do objeto, A é a área da superfície e T é a temperatura da sua superfície (em Kelvins). A taxa Pabs com com que um objeto absorve energia por meio de uma radiação térmica do seu ambiente, que está a uma temperatura uniforme Tamb (em Kelvins) é Pabs = σ .ε . A.Tamb 4 Exercícios sobre o capítulo: 1. Comparação entre escalas de temperatura: A que temperatura na escala Fahrenheit uma o temperatura T = -98 Z corresponderia? Suponha que a escala Z é linear. Z F o o 65 Z 212 F o 32 F Ebulição da água o -14 Z o - 98 Z Congelamento da água TF = ? 2. Comparação entre escalas de temperatura: Classifique em ordem crescente as seguintes o o o temperaturas, 50 X, 50 W, 50 Y. X W o o 70 X 120 W o 30 W o 90 Y o - 20 X Ebulição da água o 0 Y Congelamento da água 3. Expansão térmica: Em um dia quente um caminhão tanque foi carregado com 37000 litros de óleo diesel. Ele viajou para uma cidade com uma diferença de temperatura de –23 K, onde ele entregou todo o carregamento. Quantos litros ele entregou? -4 o diesel = 9,50.10 / C tanque = 11. 10 / C -6 o 4. A absorção de calor por Sólidos e Líquidos: Que quantidade de calor deve ser absorvido por o o uma massa de gelo m=720g a –10 C para leva-la ao estado líquido a 15 C. c água = 1,00 cal/g.K = 4190 J/Kg.K c gelo (-10o C) = 0,530 cal/g.K = 2220 J/Kg.K o 5. Primeira lei da termodinâmica: Faça 1,00 kg de água líquida a 100 C ser convertida para o 5 vapor d’água a 100 C fervendo-a à pressão atmosférica padrão ( 1,00 atm ou 1,01.10 Pa) . O -3 3 3 volume dessa água varia de um valor inicial de 1,00.10 m como um líquido para 1,671 m como vapor d’água. (a) Qual o trabalho realizado pelo sistema durante este processo? (b) Qual a energia transferida sob a forma de calor durante o processo? (c) Qual a variação da energia interna do sistema durante o processo? (W=169kJ, Q=2260 kJ, ∆Eint = 2090kJ ) Lv = 2256 kJ/kg Exercícios para entregar no dia da avaliação 1. A absorção de calor por Sólidos e Líquidos: O álcool etílico possui um ponto de ebulição de o o 78 C, um ponto de congelamento de –114 C, um calor de vaporização de 879kJ/kg, um calor de fusão de 109 kJ/kg e um calor específico de 2,43 kJ/kg.K. Quanta eenergia deve ser removida de o 0,510 kg de álcool etílico, que é inicialmente um gás a 78 C, de modo que ele se torne sólido a --o -114 C? 2. Equilíbrio térmico: Uma moeda de cobre, cuja massa mc é 75g é aquecida em um forno de o laboratório até uma temperatura de 312 C. A moeda é largada em um béquer de vidro contendo uma massa ma=220g de água. A capacidade térmica do béquer é C=45 cal/K. A temperatura o inicial da água e do béquer é 12 C. Suponha um sistema isolado, determine a temperatura final Tf do sistema em equilíbrio térmico. c água = 1,00 cal/g.K = 4190 J/Kg.K c cobre = 0,0923 cal/g.K = 386 J/Kg.K 3. Trabalho termodinâmico: Calcule o trabalho realizado pelo gás para ir do estado inicial a para o estado final d, utilizando o caminho abd e utilizando o caminho acd.
Baixar