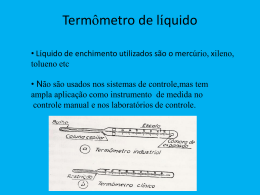
Termodinâmica A Termodinâmica é o ramo da Física que estuda as causas e os efeitos de mudanças na temperatura, pressão e volume em sistemas físicos em escala macroscópica. Calor significa "energia" em trânsito, e dinâmica se relaciona com “movimento". Por isso, em essência, a Termodinâmica estuda o movimento da energia e como a energia cria movimento. Denominamos estado de equilíbrio de um sistema quando as variáveis macroscópicas pressão (p), volume (V), e temperatura (T), não variam. O estado de equilíbrio é dinâmico no sentido de que os constituintes do sistema se movem continuamente. O estado do sistema é representado por um ponto em um diagrama (p – V). Podemos levar o sistema desde um estado inicial a outro final através de uma sucessão de estados de equilíbrio. Se denomina equação de estado a relação que existe entre as variáveis P, V, e T. A equação de estado mais simples é a de um gás ideal, onde n representa o número de moléculas, e R a constante dos gases. Se denomina energia interna do sistema a soma das energias de todas as suas partículas. Em um gás ideal as moléculas somente tem energia cinética, os choques entre as moléculas são supostos perfeitamente elásticos, a energia interna somente depende da temperatura.. Considerações Históricas: Projetos posteriores incluíram uma válvula de alívio para o vapor, evitando que o recipiente explodisse devido à alta pressão. Observando o movimento rítmico da válvula de alívio para cima e para baixo, Papin concebeu a idéia de uma máquina constituída de um pistão e um cilindro.Mas Papin não seguiu adiante com a idéia. Foi somente em 1697, baseado nas idéias de Papin, que o engenheiro Thomas Savery construiu a primeira máquina a vapor. Consideremos dois blocos de cobre, um quente e outro frio, cada um dos blocos está em contato com um termômetro de mercúrio. Colocando os dois blocos em contato térmico vemos variações nas propriedades do corpo, como a resistência elétrica que decresce com o tempo no bloco quente, e cresce com o tempo no bloco frio, notamos que após certo período essa variação não é mais observada, ficando assim em equilíbrio. Da mesma forma, colocando os dois blocos em contato térmico, o comprimento de um dos lados do bloco quente diminui com o tempo e o comprimento de um dos lados do bloco frio aumenta com o tempo, até que após certo momento eles permanecem constantes, pois entram em equilíbrio. Vemos que a coluna de mercúrio de um termômetro posto no corpo quente irá diminuir com o tempo e a coluna de mercúrio de um termômetro posto no corpo frio irá aumentar com o tempo, até que após certo momento irá permanecer constante, pois atingem o equilíbrio. Quando todas essas propriedades mensuráveis atingirem o equilíbrio, podemos dizer que os dois corpos em contato estão com a mesma temperatura. A temperatura é a medida do movimento aleatório das moléculas do sistema.Este sistema descrito é isolado, portanto não efetua trocas terminas com o meio externo de forma que se houver qualquer mudança de temperatura a troca de calor é feita entre os dois blocos do sistema. Após mensurarmos os dois blocos acima individualmente com um termômetro de mercúrio, notamos que o nível da coluna de mercúrio marca a mesma temperatura para os dois corpos. Assim podemos dizer que os dois blocos estão em equilíbrio térmico com o termômetro citado. Dessa forma enunciamos a lei zero da termodinâmica da seguinte forma: “quando dois corpos têm igualdade de temperatura com um terceiro corpo, eles terão igualdade de temperatura entre si”. Está lei é bastante obvia e muito simples de observar no dia-a-dia, ela recebo este nome por anteceder a primeira e a segunda lei da termodinâmica. A importância dessa lei é o fato dela ser a base para a medição de temperatura, pois quando colocamos um termômetro em um corpo podemos dizer que sua temperatura é a indicado no termômetro, já que eles estão em equilíbrio térmico. O equilíbrio térmico entre corpos materiais só é atingido quando os mesmos se encontram na mesma temperatura. Dessa definição pode ser concluída a Lei Zero da Termodinâmica: Se três sistemas apresentam-se isolados de qualquer outro universo externo, e, dois sistemas consecutivos estiverem em equilíbrio térmico com o terceiro, então os dois sistemas consecutivos estarão em equilíbrio térmico entre si. Para que seja perfeitamente compreendido o conceito da Lei Zero da Termodinâmica, devem ser esclarecidas as definições de: sistemas termodinâmicos (abertos, fechados e isolados), sistema limitado e vizinhança. Um sistema termodinâmico encontra-se aberto quando consegue trocar matéria (massa) e energia (calor e trabalho) com o meio; encontra-se fechado quando apenas pode trocar energia, uma vez que o trânsito de matéria é impedido por alguma obstrução; e, por fim, um sistema Termodinâmico é isolado (adiabático) quando não troca matéria e nem energia com o meio. Valendo-se da Lei Zero da Termodinâmica, muitos cientistas tentaram construir aparelhos que revelassem a temperatura de algum corpo. Mas, como a Lei Zero poderia auxiliá-los? Imagine o seguinte, baseando-se num termômetro de mercúrio e em um experimento de medida de temperatura da água em algum recipiente: o sistema é composto pela água contida no recipiente, pelo material no qual o termômetro é construído e pelo mercúrio (material indicador). Após algum tempo, mantendo-se o mercúrio em contado com a água, o mercúrio dilata ou contrai e indica a temperatura da água a cada instante. Ou seja, o recipiente está em equilíbrio térmico com a água, que está em equilíbrio térmico com o material no qual o termômetro é feito (geralmente vidro). E, como o mercúrio está em equilíbrio com o vidro, segundo a Lei Zero, também está em equilíbrio térmico com a água, e assim demonstra a sua temperatura. Chamamos de 1ª Lei da Termodinâmica, o princípio da conservação de energia aplicada à termodinâmica, o que torna possível prever o comportamento de um sistema gasoso ao sofrer uma transformação termodinâmica. Analisando o princípio da conservação de energia ao contexto da termodinâmica: Um sistema não pode criar ou consumir energia, mas apenas armazená-la ou transferi-la ao meio onde se encontra, como trabalho, ou ambas as situações simultaneamente, então, ao receber uma quantidade Q de calor, esta poderá realizar um trabalho e aumentar a energia interna do sistema ΔU, ou seja, expressando matematicamente: Sendo todas as unidades medidas em Joule (J). Conhecendo esta lei, podemos observar seu comportamento para cada uma das grandezas apresentadas: Dentre as duas leis da termodinâmica, a segunda é a que tem maior aplicação na construção de máquinas e utilização na indústria, pois trata diretamente do rendimento das máquinas térmicas. Dois enunciados, aparentemente diferentes ilustram a 2ª Lei da Termodinâmica, os enunciados de Clausius e Kelvin-Planck: Enunciado de Clausius: O calor não pode fluir, de forma espontânea, de um corpo de temperatura menor, para um outro corpo de temperatura mais alta. Tendo como conseqüência que o sentido natural do fluxo de calor é da temperatura mais alta para a mais baixa, e que para que o fluxo seja inverso é necessário que um agente externo realize um trabalho sobre este sistema. Enunciado de Kelvin-Planck: É impossível a construção de uma máquina que, operando em um ciclo termodinâmico, converta toda a quantidade de calor recebido em trabalho. Este enunciado implica que, não é possível que um dispositivo térmico tenha um rendimento de 100%, ou seja, por menor que seja, sempre há uma quantidade de calor que não se transforma em trabalho efetivo. Maquinas térmicas As máquinas térmicas foram os primeiros dispositivos mecânicos a serem utilizados em larga escala na indústria, por volta do século XVIII. Na forma mais primitiva, era usado o aquecimento para transformar água em vapor, capaz de movimentar um pistão, que por sua vez, movimentava um eixo que tornava a energia mecânica utilizável para as indústrias da época. Chamamos máquina térmica o dispositivo que, utilizando duas fontes térmicas, faz com que a energia térmica se converta em energia mecânica (trabalho). A fonte térmica fornece uma quantidade de calor que no dispositivo transforma-se em trabalho mais uma quantidade de calor que não é capaz de ser utilizado como trabalho . Assim é válido que: Utiliza-se o valor absolutos das quantidade de calor pois, em uma máquina que tem como objetivo o resfriamento, por exemplo, estes valores serão negativos. Neste caso, o fluxo de calor acontece da temperatura menor para o a maior. Mas conforme a 2ª Lei da Termodinâmica, este fluxo não acontece espontaneamente, logo é necessário que haja um trabalho externo, assim: Rendimento das máquinas térmicas Podemos chamar de rendimento de uma máquina a relação entre a energia utilizada como forma de trabalho e a energia fornecida: Considerando: =rendimento; = trabalho convertido através da energia térmica fornecida; =quantidade de calor fornecida pela fonte de aquecimento; =quantidade de calor não transformada em trabalho. Mas como constatado: logo, podemos expressar o rendimento como: O valor mínimo para o rendimento é 0 se a máquina não realizar nenhum trabalho, e o máximo 1, se fosse possível que a máquina transformasse todo o calor recebido em trabalho, mas como visto, isto não é possível. Para sabermos este rendimento em percentual, multiplica-se o resultado obtido por 100%. Exemplo: Um motor à vapor realiza um trabalho de 12kJ quando lhe é fornecido uma quantidade de calor igual a 23kJ. Qual a capacidade percentual que o motor tem de transformar energia térmica em trabalho? calor Trabalho Energia Interna Recebe Realiza Aumenta >0 Cede Recebe Diminui <0 Troca Não realiza e nem recebe Não varia =0 Exemplo: Q/ /ΔU (1) Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna do sistema antes de receber calor era U=100J, qual será esta energia após o recebimento? Q/ /ΔU 50=12+(U-100) 50=12-100+U U=138J O calor é a nomenclatura atribuída à energia sendo transferida de um sistema a outro exclusivamente em virtude da diferença de temperaturas entre eles. Não é correto se afirmar que um corpo possui mais calor que outro, e tão pouco é correto afirmar que um corpo possui calor; os corpos (ou sistemas) possuem energia interna e o conceito de energia interna não deve jamais ser confundido com o conceito de calor. O calor é geralmente simbolizado pela letra Q na física. A unidade do Sistema Internacional (SI) para o calor é o joule (J), embora seja usualmente utilizada a caloria (cal; 1 cal = 4,18 J). Tipos de calor: Provoca apenas a variação da temperatura do corpo. A quantidade de calor sensível (Q) que um corpo de massa (m) recebe é diretamente proporcional ao seu aumento de temperatura. Logo, é possível calcular a quantidade de calor sensível usando a seguinte fórmula: Q = m . c . ∆t Q = 3800 cal ∆t = 25ºC – 110ºC c = 0,42 cal/gºC m = ?? 3800 = m . 0,42 . 85 3800 = 35,7m 35,7m = 3800 m = 3800/35,7 m = 106,4 g Provoca algum tipo de alteração na estrutura física do corpo. É a quantidade de calor que a substância troca por grama de massa durante a mudança de estado físico. É representado pela letra L. É medido em caloria por grama (cal/g). Para calcular o calor latente é necessário utilizar a seguinte expressão: Q=m.l Q = 2400 cal m = 300 g l = ?? 2400 = 300 . L 300l = 2400 l = 2400/300 l = 80 cal/g é uma grandeza física que define a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. É constante para cada substância em cada estado físico. Pode-se dizer que o calor específico caracteriza uma substância (em determinado estado físico). A unidade no SI é J/(kg.K) (joule por quilogramas por Kelvin). Uma outra unidade mais usual para calor específico é cal/(g.°C) (caloria por grama por grau Celsius). Ocorre em sólidos e depende do coeficiente de condutividade térmica; não é difícil perceber que plásticos e madeira não conduzem tão bem o calor quanto outros materiais como os metais, por exemplo. Fatores que implicam na maior ou menor condutividade térmica: as características físico-químicas, a espessura do material, a área de contato entre materiais, o tempo que o material fica em contato com o outro e, logicamente, a diferença de temperatura entre as extremidades do material condutor.. Irradiação térmica ou radiação térmica é a radiação eletromagnética emitida por um corpo em equilíbrio térmico causada pela temperatura do mesmo. A irradiação térmica é uma forma de transmissão de calor. Ou seja, um segundo corpo pode absorver as ondas caloríficas que se propagam pelo espaço em forma de energia eletromagnética aumentando assim sua temperatura, pois os dois corpos têm entre si um intercâmbio de energia. A maior parte da irradiação ocorre ao redor de um comprimento de onda específico, chamado de comprimento de onda principal de irradiação, que depende da temperatura do corpo. Quanto maior a temperatura, maior é a frequência da radiação e menor é o comprimento de onda. Em outras palavras, objetos com temperaturas altas produzem uma luz mais "azul", enquanto objetos com temperaturas não tão altas podem produzir uma luz mais "vermelha". Explicada pelo movimento de fluxos ascendentes e descentes em fluídos (líquidos e gases), elevando massas aquecidas e rebaixando massas resfriadas destes mesmos fluídos; essa elevação se dá pelo fato de que o fluído mais aquecido é menos denso que o mesmo fluído resfriado, ou seja, possui menos massa (kg) ocupando um certo volume (litro, m³, ...). Por este motivo, quando se instala um ar condicionado refrigerador em uma residência o equipamento é colocado na parte superior da parede. Com isso, a massa de ar "frio" circula pelo ambiente até as regiões mais próximas do chão, climatizando o ambiente de forma mais eficaz do que se fosse instalado junto ao chão (nossos pés ficariam gelados e o resto do ambiente estaria quente!!!). Grandeza física que determina a variação na quantidade de energia térmica em um corpo, ou seja, determina a energia térmica que transitou para outro corpo ou que mudou de natureza. A unidade do SIU para quantidade de calor é o J (Joulle), mas é comum usar cal (Caloria) ou Cal (Caloria lateral). É possível calcular o calor específico de uma substância (c) a partir da capacidade térmica de um corpo composto por ela (C) e da massa desse corpo (M). Também é possível determinar o calor específico de uma substância a partir da quantidade de calor cedida a um corpo dessa substância (Qc), da massa desse corpo, e da variação térmica (∆T) que ele sofre (temperatura final - temperatura inicial). Também é possível calcular a quantidade de calor a partir da massa da substância que sofre variação térmica (m), do calor específico dela (c) e da variação térmica que o corpo sofre (t). Transformação isobárica é uma transformação termodinâmica na qual a pressão permanece constante. Quando um gás perfeito evolui isobaricamente de um estado A para um estado B, a temperatura e o volume evoluem conforme a lei de Charles: onde e representam a temperatura e o volume do estado A e representam a temperatura e o volume do estado B. A lei de Charles é um caso particular da lei dos gases perfeitos. Transformação isocórica é uma transformação termodinâmica que preserva o volume. O termo deriva da língua grega, ISO, "igual" e Khora, "lugar". Quando um gás sofre uma transformação isocórica, levando-o de um estado A para um estado B, a temperatura e a pressão evoluem conforme a Lei de Gay-Lussac: Onde PA e Ta representam a temperatura e a pressão do estado A e Tb e PB representam a temperatura e a pressão do estado B. Uma transformação isotérmica é uma transformação termodinâmica na qual a temperatura é mantida constante. Quando um gás perfeito evolui isotermicamente de um estado A até um estado B, a pressão e o volume variam conforme a Lei de BoyleMariotte: Onde Pa e Va representam a pressão e o volume do estado A e e representam a pressão e o volume do estado B. Transformação adiabática é um processo de transformação termodinâmica na qual não há trocas de calor com o ambiente, apesar de haver variação térmica. A energia interna se transforma em trabalho diretamente (ΔU =Q - W, Q=0 Logo ΔU= -W) . Com a perda de energia interna, há diminuição da temperatura e realização de trabalho (aumento de volume). Com o ganho de energia interna, há aumento de temperatura e sofrimento de trabalho (diminuição de volume). É o processo básico do Ciclo de Brayton, que explica o funcionamento da turbina a gás. A equação que pode ser utilizada no estudo básico de transformações adiabáticas é a Lei de Laplace Poisson: p.v^γ = p'.v'^γ, onde γ= Cp/Cv (coeficiente de Poisson), tendo Cp como calor específico a pressão constante e Cv como calor específico a volume constante. "O calor específico a pressão constante Cp é empregado em processos que realizam trabalho. "O calor específico a volume constante Cv é adotado quando não existem troca de trabalho entre o sistema e a vizinhança. Fórmulas de conversão de temperatura Celsius Conversão de para Fórmula grau Celsius grau Fahrenheit °F = °C × 1,8 + 32 grau Fahrenheit grau Celsius °C = (°F − 32) / 1,8 grau Celsius kelvin K = °C + 273,15 kelvin grau Celsius °C = K − 273,15 grau celsius rankine °R = (°C + 273,15) × 1,8 rankine grau celsius °C = (°R ÷ 1,8) – 273,15 Como passar 30ºC para ºF ? Fórmula que usamos: °F = °C × 1,8 + 32 Resolução: ºF= 30 ºC x 1,8 +32 ºF= 54+32 ºF= 86 Material Necessários: Dois recipientes de plástico pequenos, 1/2 xícara de água, 1/2 xícara de areia ou terra, um termômetro. Procedimento: Coloque a água em um recipiente e a areia em outro. Deixe os dois na geladeira até esfriar. Depois leve os dois recipientes para o sol por 15 minutos. Meça, com o termômetro, a temperatura de cada um deles. O que acontece? A temperatura da areia fica maior que a temperatura da água. Por que acontece? Porque o calor específico da água é maior que o da areia. Isso explica porque, pela manhã, em regiões litorâneas a areia está mais quente que a água, pois a água necessita de maior quantidade de calor para sofrer a mesma variação de temperatura. Brislainy, Juliana, Leonardo, Maria Isabel, Rayla e Thamara. Turma : 2011-063
Baixar