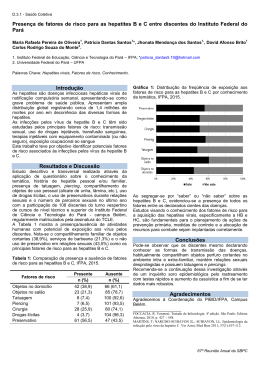
UNIVERSIDADE ESTÁCIO DE SÁ LUCIANA OLIVEIRA DE REZENDE MELO Estimativa da Prevalência de Hepatite C na População Adscrita no Programa de Saúde da Família da Lapa Rio de Janeiro 2007 LUCIANA OLIVEIRA DE REZENDE DE MELO Estimativa da Prevalência de Hepatite C na População Adscrita no Programa de Saúde da Família da Lapa Dissertação apresentada à Universidade Estácio de Sá como requisito parcial para a obtenção do grau de Mestre em Saúde da Família. Orientador: Haroldo José de Matos. Rio de Janeiro 2007 Dados Internacionais de Catalogação-na-Publicação (CIP) M528 Melo, Luciana Oliveira de Rezende. Estimativa da prevalência de Hepatite C na população adscrita no Programa de Saúde da Família da Lapa / Luciana Oliveira de Rezende Melo – Rio de Janeiro, 2007. 90 f.; 30 cm. Dissertação (Mestrado em Saúde da Família) – Universidade Estácio de Sá, 2007. Bibliografia: f. 76-86 1. Hepatite viral. 2. Saúde da família. I. Título CDD 616.3623 LUCIANA OLIVEIRA DE REZENDE DE MELO Estimativa da Prevalência de Hepatite C na População Adscrita no Programa de Saúde da Família da Lapa Dissertação apresentada à Universidade Estácio de Sá como requisito parcial para a obtenção do grau de Mestre em Saúde da Família. Orientador: Haroldo José de Matos. Aprovada em BANCA EXAMINADORA __________________________________________________________________ Profª. Drª. Ana Maria Pittella de Souza Leite Universidade do Grande Rio __________________________________________________________________ Profª. Drª. Valeria Ferreira Romano Universidade Estácio de Sá __________________________________________________________________ Prof. Dr. Haroldo José de Matos Universidade Estácio de Sá DEDICATÓRIA A minha família, inspiração da minha vida. AGRADECIMENTOS Ao meu orientador, Haroldo José de Matos, pela sabedoria e incentivo à pesquisa. À Ana Maria Pittella, pelo incentivo à execução do mestrado e pelas oportunidades profissionais oferecidas. A Camilla Dias Decott, técnica do Laboratório Central De Virologia Do Hospital Dos Servidores do Estado do Rio de Janeiro, pela realização dos exames. Ao Roberto Fuchs, coordenador do PSF Lapa, por sua paciência e colaboração. Ao meu marido Julio, que não mediu esforços para me ajudar a concluir esta dissertação. EPÍGRAFE “Realidade é apenas uma ilusão, ainda que muito persistente”. Albert Einstein RESUMO As hepatites virais são um grave problema de saúde pública no mundo e no Brasil. Segundo estimativas, bilhões de pessoas já tiveram contato com vírus das hepatites e milhões são portadores crônicos. O vírus da hepatite C (VHC) é a maior causa de doença hepática crônica mundial, com altas taxas de mortalidade e morbidade. Pelas estimativas da OMS, calcula-se que cerca de 3% da população mundial esteja infectada pelo VHC, perfazendo um total superior a 170 milhões de pessoas. O objetivo principal do estudo foi estimar a prevalência da infecção pelo VHC e, além disso, foi estudada a distribuição das infecções pelo vírus da hepatite A e vírus da hepatite B, na população adscrita no PSF-Lapa. O estudo foi um inquérito epidemiológico transversal. Foi feita uma amostra sistemática de todos os pacientes que foram até o PSF-Lapa para realizarem coleta de sangue habitual, sendo aplicados 142 questionários e coletados 142 exames, no período de agosto de 2006 a dezembro de 2006. As variáveis estudadas foram: idade, sexo, raça, grau de escolaridade, vacinação contra hepatite A e B, saneamento básico e marcadores sorológicos para hepatite A, B e C. Deste total de pacientes, tivemos 60 amostras perdidas e obtivemos resultados de 82. Com relação à hepatite A, houve 0% de antiHAVIgM reagentes e 70 pacientes (92,8%) com anti-HAVIgG reagentes. Nos exames realizados para hepatite B, houve positividade para o anti-HBS em 25 pacientes (32,5%), 13 casos de anti-HBc total reagentes (15,8%) e nenhum caso do marcador HBsAg, anti-HBcIgM e HBeAg reagentes. O anti-HBe foi reagente em 33,3% dos casos. Observamos que 2 pacientes (2,9%) apresentaram anti-HCV reagente. O tema hepatites virais no contexto do PSF é bastante relevante, pois, o PSF com práticas voltadas para ações de promoção à saúde e prevenção, além da responsabilidade sanitária, permite uma maior aproximação com as atividades de vigilância epidemiológica. A vigilância epidemiológica das hepatites virais tem como objetivos conhecer a amplitude, a tendência e a distribuição por faixa etária e áreas geográficas destas infecções, além da notificação, investigação e encaminhamento dos casos para tratamento adequado. Palavras-chave: Hepatite C, Hepatite A, Hepatite B, Programa de Saúde da Família, Prevalência. ABSTRACT Viral hepatites are a serious problem of public health in the world and Brazil. According to estimates, billions of people have already had contact with viruses of hepatites and millions are chronic carriers of the disease. The virus of the C hepatitis (VHC) is the most important cause of world-wide chronic liver diseases, with high rates of mortality and morbidity. According to the WHO estimates, about 3% of the world-wide population is infected with the VHC, totalizing 170 million people. The main objective of the present study was to estimate the prevalence of the infection with the VHC. The distribution of the infections with the virus of the hepatitis A and the virus of hepatitis B was also studied in the registered population of the PSF-Lapa. The study was an inquiry transversal epidemiologist. A systematic sample was taken of all the patients who came to the PSF-Lapa (Family Healh Program of Lapa, Rio de Janeiro), for routine blood tests. 142 questionnaires were applied and 142 samples were collected, in the period from August, 2006 to December, 2006. The studied variables were: age, sex, race, level of education, vaccination against hepatitis A and B, basic sanitation and serologic markers for hepatitis A, B and C. Of the total number of samples collected, 60 were lost and 82 were studied. With relation to hepatitis A, 0% was reactive to anti-HAVIgM and 70 patients (92.8%) to anti-HAVIgG. In the tests carried out for hepatitis B, 25 patients (32.5%) were positive for anti-HBs, 13 cases of anti-HBc total reactive (15.8%). No cases of the HBsAg marker, antiHBcIgM and HBeAg reactive were found. Anti-HBe was reactive in 33.3% of the cases. We observed that 2 patients (2.9%) presented anti-HCV reaction. The subject of viral hepatitis in the context of the PSF is, therefore, quite relevant since the PSF aims at the promotion of public health and prevention, as well as sanitary responsibility, allowing to a closer approach with the activities of epidemiological monitoring. The objective of epidemiological monitoring of the viral hepatites is to know the range, the trend and their distribution in age groups and geographic areas of these infections, as well as the notification, inquiry and guidance for adequate treatment. Word-key: Hepatitis C, Hepatitis, Hepatitis B, Program of Health of the Family, Prevalence. LISTA DE TABELAS Tabela 1 – Características sócio-demográficas da população adscrita no PSF-Lapa. Tabela 2 – Resultados dos marcadores sorológicos das Hepatites A, B e C da população adscrita no PSF-Lapa. Tabela 3 – Associação entre os marcadores sorológicos Anti-HBs e Anti-HBc Total, entre Reagentes e Não Reagentes. Tabela 4 – Histórico de vacinação declarado pelos pacientes entrevistados. LISTA DE FIGURAS Figura 1 – Prevalência da infecção pelo VHA. Figura 2 – Prevalência da infecção pelo VHB. Figura 3 - Prevalência da infecção pelo VHC em doadores de sangue. LISTA DE QUADROS Quadro 1: Distribuição dos casos confirmados de Hepatite C por Unidade Federada. Brasil, 1994 - 2003 Quadro 2 Distribuição dos casos confirmados de Hepatite C por Região. Brasil, 1994 - 2003 LISTA DE SIGLAS ALT – aspartato aminotransferase Anti- HAVIgG - anticorpos contra o vírus da hepatite A- infecção passada Anti- HAVIgM - anticorpos contra o vírus da hepatite A- infecção atual Anti- HBc total - marcador de infecção antiga pelo vírus da hepatite B Anti- HBcIgM - marcador de infecção recente pelo vírus da hepatite B Anti- HBe – anticorpo contra a antígeno E da hepatite B Anti- HBs – Anticorpo contra o Antígeno de Superfície do vírus da hepatite B Anti -HCV – Anticorpo contra hepatite C CNPq - Conselho Nacional de Desenvolvimento Científico e Tecnológico CTA – Centro de Testagem e Aconselhamento HA – Hepatite A HB – Hepatite B HbeAg - antígeno que indica replicação pelo vírus da hepatite B HbsAg - antígeno de superfície do vírus da hepatite B HC – Hepatite C HIV – Vírus da Imunodeficiência Humana MEIA - imunoensaio enzimático de micropartículas NOAS – Norma Operacional de Assistência à Saúde OMS – Organização Mundial da Saúde PCR – Reação em Cadeia da Polimerase PSF- Programa de Saúde da Família SINAN – Sistema de Informação de Agravos de Notificação SUS – Sistema Único de Saúde SVS – Secretaria de Vigilância em Saúde UF –Unidade Federada VHA – Vírus da hepatite A VHB – Vírus da Hepatite B VHC – Vírus da hepatite C SUMÁRIO 1 INTRODUÇÃO 1.1 CONSIDERAÇÕES INICIAIS 1.2 EPIDEMIOLOGIA DAS HEPATITES VIRAIS 1.2.1 Hepatite A 1.2.2 Hepatite B 1.2.3 Hepatite C 1.3 PROGRAMA DE SAÚDE DA FAMÍLIA E HEPATITES VIRAIS 1.4 JUSTIFICATIVA 1.5 OBJETIVOS 1.5.1 Objetivo Geral 1.5.2 Objetivos Específicos 2 METODOLOGIA 2.1 TIPO DE PESQUISA 2.2 COLETA DE DADOS 2.2.1 Pacientes 2.2.2 Laboratório 2.2.3 PSF da Lapa 2.2.4 Considerações Éticas 2.3 ANÁLISE DOS DADOS 3 RESULTADOS 4 DISCUSSÃO 5 CONCLUSÃO REFERÊNCIAS BIBLIOGRÁFICAS ANEXO A - Ficha de investigação de hepatites virais do SINAN ANEXO B - Questionário ANEXO C - Termo de Consentimento Livre e Esclarecido 1. INTRODUÇÃO 1.1 CONSIDERAÇÕES INICIAIS As hepatites virais constituem um relevante problema de saúde pública no Brasil e no mundo. Têm elevada proporção de infecções assintomáticas e alto custo de diagnóstico etiológico, o que dificulta a realização de estudos que permitam conhecer sua magnitude e monitorar sua ocorrência para subsidiar estratégias de prevenção e controle (WORLD HEALTH ORGANIZATION, 2002). São doenças causadas por diferentes agentes etiológicos, de distribuição universal, que têm em comum o tropismo primário pelo tecido hepático. Apresentam semelhanças do ponto de vista clínico-laboratorial, mas possuem importantes diferenças epidemiológicas e quanto à sua evolução (MINISTÉRIO DA SAÚDE, 2005). Os últimos 50 anos foram de notáveis conquistas no que se refere à prevenção e ao controle das hepatites virais. Os mais significativos progressos foram a identificação dos agentes virais, o desenvolvimento de testes laboratoriais específicos, o rastreamento dos indivíduos infectados e o surgimento de vacinas protetoras (MINISTÉRIO DA SAÚDE, 2005). O comportamento epidemiológico das hepatites virais tem sofrido grandes mudanças nos últimos anos, no nosso país e no mundo. A expansão da cobertura vacinal no que se refere à hepatite B, a mais efetiva detecção por parte dos Bancos de Sangue do vírus C da hepatite, e a substancial melhoria das condições sanitárias, entre outros, foram fatores decisivos que muito contribuíram para esta modificação (MINISTÉRIO DA SAÚDE, 2005). 15 A distribuição das hepatites virais é universal, sendo que a amplitude dos diferentes tipos varia de região para região. No Brasil, também há grande variação regional na prevalência de cada um dos agentes etiológicos. As hepatites virais têm grande importância pelo número de indivíduos infectados e pela possibilidade de complicações das formas agudas e crônicas (MINISTÉRIO DA SAÚDE, 2005). As hepatites virais são doenças de notificação compulsória. O ato de notificar deve ser entendido como apenas uma ação no processo da Vigilância Epidemiológica, que permite acompanhar, em termos coletivos, a tendência da doença, permitindo avaliar as medidas de prevenção que estão sendo executadas, além de rastrear as fontes de infecção e, do ponto de vista do indivíduo, identificar novos casos entre os comunicantes (MINISTÉRIO DA SAÚDE, 2005). O número de notificações no Brasil não reflete a real incidência das hepatites virais, pois a grande maioria dos acometidos apresenta formas assintomáticas ou oligossintomáticas, sendo dificilmente captados. Estados e municípios estão em diferentes estágios de implantação das equipes de vigilância epidemiológica, refletindo diferentes níveis de sensibilidade e de capacitação (PORTAL da saúde, 2006). A rede de assistência às hepatites virais no SUS está dividida em três níveis: atenção básica, média e alta complexidade. De acordo com a orientação da NOASSUS 01/2002, o planejamento regional da atenção deve ser feito de modo integrado, para que os serviços não fiquem restritos ao âmbito municipal, garantindo o acesso do paciente aos recursos necessários para resolução de seu problema (MINISTÉRIO DA SAÚDE, 2005). No nível de atenção básica se encontra o Programa de Saúde da Família, que tem como competências a promoção à saúde, a prevenção, a triagem sorológica, o 16 acompanhamento de pacientes e o referenciamento dos mesmos para os serviços de média e alta complexidade, quando necessário. Observa-se, assim, o importante papel do Programa de Saúde da Família na prevenção e diagnóstico das hepatites virais (MINISTÉRIO DA SAÚDE, 2005). A partir da estimativa da prevalência das hepatites virais da população adscrita no Programa de Saúde da Família da Lapa, poderemos traçar o perfil desta comunidade e, então, promover as ações pertinentes ao nível de atenção básica, acima descritos. 1.2 EPIDEMIOLOGIA DAS HEPATITES VIRAIS 1.2.1 Hepatite A A hepatite A (HA) é conhecida desde as antigas civilizações chinesa, grega e romana, mas o primeiro relato escrito ocorreu no século 18. Posteriormente foi denominada por Virchow de icterícia catarral. Essa denominação foi utilizada até a década de 40 (MINISTÉRIO DA SAÚDE, 2005). É uma doença infecciosa comum em países em desenvolvimento. Costuma ser assintomática e apenas cerca de 20% dos casos desenvolve uma doença clínica manifesta, com graus variáveis de gravidade. Com o aumento da faixa etária, a doença se torna mais sintomática, com maior risco de gravidade. Ela ocorre esporadicamente ou de forma epidêmica. A disseminação acontece, sobretudo, em ambientes de precárias condições sócio-higiênicas (POOVORAWAN, 1993, p. 250254). 17 O período de incubação desta infecção varia entre 15 a 49 dias, sendo seu curso clínico caracteristicamente autolimitado, não ocorrendo a cronificação (MARTIN, 2006, p. 164-172,). O vírus da hepatite A (VHA) é a causa mais freqüente de hepatite aguda viral no mundo. Conforme estimativas da Organização Panamericana de Saúde, anualmente ocorrem no Brasil cerca de 130 novos casos por 100.000 habitantes, e o país é considerado área de risco para a doença (MINISTÉRIO DA SAÚDE, 2005). A principal forma de transmissão da doença é por via fecal-oral, por contato pessoa-pessoa ou através da água e alimentos contaminados (KOOPMANS, 2002, p.187-205,). A estabilidade do VHA no meio ambiente e a grande quantidade de vírus presente nas fezes dos indivíduos infectados contribuem para a transmissão desta doença. A transmissão parenteral é rara, mas pode ocorrer se o doador estiver na fase de viremia do período de incubação. A disseminação está relacionada com o nível sócio-econômico da população, existindo variações regionais de endemicidade de acordo com o grau de saneamento básico, de educação sanitária e das condições de higiene da população. Em regiões menos desenvolvidas, as pessoas são expostas ao VHA em idades mais precoces, apresentando formas subclínicas ou anictéricas, que ocorrem, mais freqüentemente, em crianças em idade préescolar. A doença é autolimitada e de caráter benigno. Menos de 1% dos casos pode evoluir para hepatite fulminante. Este percentual é maior em pacientes acima dos 65 anos. Pessoas que já tiveram hepatite A apresentam imunidade para esse tipo de doença, mas permanecem susceptíveis às outras hepatites (MINISTÉRIO DA SAUDE, 2005) (LEUNG Ak, 2005, p. 578-586). 18 Distribuição Geográfica da Infecção pelo VHA Alta Alta/Intermediária Intermediária Baixa Muito Baixa Fonte: Centers for Disease Control and Prevention (CDC), Atlanta, USA/2000 Figura 1 – Prevalência da infecção pelo VHA. A HA tem distribuição universal, sendo endêmica em muitas regiões, mas a prevalência da infecção varia muito com o grau de higiene e com as condições sanitárias das diferentes populações (JACOBSEN, 2004, p. 1005-1022). As áreas de alta prevalência são encontradas nos países pouco desenvolvidos, principalmente nos continentes africano e asiático e em partes da América Latina. Nesses locais, as epidemias são comuns e a maioria dos casos costuma ocorrer precocemente na infância, sendo, em geral assintomáticos (REGEV, 2000, p.47-71). Nos países em desenvolvimento e em certas áreas dos países industrializados, incluindo o leste europeu e a Rússia, existe padrão de 19 endemicidade intermediária. Nesses locais, a maior parte das ocorrências surge entre adolescentes e adultos jovens, quase sempre sob forma de epidemias veiculadas por água contaminada ou contato interpessoal (MANNUCCI, 1994, p.1-5). Os Estados Unidos e a Europa Ocidental são áreas de baixa endemicidade para HA. Nesses locais, a doença costuma atingir adultos com mais de 20 anos, pertencentes a grupos de risco bem definidos, incluindo pacientes com relato de contato interpessoal com casos comprovados de hepatite A, viajantes para áreas endêmicas, homossexuais masculinos e usuários de drogas injetáveis (KOFF, 1998, p. 1643-1649). O diagnóstico da HA baseia-se na detecção de anticorpos contra o VHA (antiHAV). O marcador sorológico anti- HAVIgM indica infecção atual ou muito recente e desaparece em menos de 6 meses. O anti-HAVIgG, persiste por toda a vida, conferindo imunidade e servindo de marcador para infecção prévia curada ou vacinação (LEMON, 1997, p. 196-201). Clemens e colaboradores analisaram a soroprevalência de HA em aproximadamente 3.700 indivíduos, entre 1 e 40 anos de idade, em quatro regiões do país (Norte, Nordeste, Sul e Sudeste), e obtiveram uma soroprevalência geral de 64,7%. O padrão foi muito heterogêneo, sendo alto na região Norte (92,8%) e Nordeste (76,5%), enquanto endemicidades menores foram observadas nas regiões Sul e Sudeste (55,7%). O grupo de classe socio-econômica mais baixa foi, nas quatro regiões, o de maior soroprevalência. Na região Norte, houve alta soroprevalência de anticorpos contra o vírus da hepatite A na infância, tanto na classe socio-econômica baixa quanto na alta. Essa diversidade de soroprevalência de anticorpos contra o VHA na população representa um problema importante de saúde pública (CLEMENS, 2000, p. 1-10). 20 A prevenção da HA se faz com melhoria das condições sanitárias e também através da vacinação (MINISTÉRIO DA SAUDE, 2005). A vacina contra o VHA foi introduzida em 1995. Ela é altamente imunogênica e possui grande eficácia, induzindo soro-conversão em 90 a 98%, após uma dose, e 100%, após duas doses (BRUNDAGE, 2006, p. 2162-2168). 1.2.2 Hepatite B A Organização Mundial de Saúde (OMS) estima que cerca de 2 bilhões de pessoas já tiveram contato com o vírus da hepatite B (VHB), contabilizando mais de 350 milhões de portadores crônicos. Estes pacientes cronicamente infectados têm um alto risco de desenvolver cirrose hepática e carcinoma hepatocelular, doenças que levam ao óbito em torno de 1 milhão de pessoas a cada ano (WORLD HEALTH ORGANIZATION, 2002). De acordo com o CDC (Centers of Disease Control and Prevention), a prevalência de hepatite B (HB) apresenta amplas variações geográficas, entre 0,1% a 20%, em áreas de diferentes características endêmicas. Por isso, elas são divididas em regiões de alta, média e baixa endemicidade (CENTERS OF DISEASE CONTROL AND PREVENTION, 2003) (LEE, 1997, p. 1733-1745). 21 Distribuição geográfica da infecção crônica pelo VHB Prevalência do HBsAg ≥8% - Alta 2-7% - Intermediária <2% - Baixa Fonte: Centers for Disease Control and Prevention (CDC), Atlanta, USA/2000 Figura 2 – Prevalência da infecção pelo VHB. Em áreas de baixa endemicidade, a prevalência de portadores crônicos é menor que 2%. O risco de infecção durante toda a vida é de 20%. Dentro dessas áreas são encontrados grupos étnicos com taxas de infecção pelo VHB maiores que na população geral, como os esquimós, no Alasca e no Canadá, e os maoris na Nova Zelândia. São regiões de baixa endemicidade para a infecção pelo VHB a América do Norte, a Europa Ocidental, a Austrália, a Nova Zelândia e o sudeste da América do Sul (CENTERS OF DISEASE CONTROL AND PREVENTION, 2003) (LEE, 1997, p. 1733-1745). Em áreas de endemicidade intermediária, a prevalência de portadores crônicos do VHB varia de 2% a 7% e e infecção é de 20% a 50% da população. As 22 taxas mais altas de infecção estão entre as crianças mais velhas, adolescentes e adultos jovens. As regiões de prevalência intermediária se encontram nos países do Leste Europeu, na Rússia, nos países da bacia mediterrânea, no sudoeste da Ásia, no Japão e no norte da América Latina (CENTERS OF DISEASE CONTROL AND PREVENTION, 2003) , (LEE,1997, p. 1733-1745). Em áreas de alta endemicidade, o risco de infecção pelo VHB é acima de 60% e a maioria das infecções ocorre ao nascimento ou, precocemente, na infância. Todas as crianças dessas populações têm risco muito grande de adquirir infecção crônica antes dos 5 anos. Nessas áreas, a taxa de portadores crônicos varia entre 8 e 25% (CENTERS OF DISEASE CONTROL AND PREVENTION, 2003) (LEE, 1997, p. 1733-1745). No Brasil, segundo dados da Secretaria de Vigilância em Saúde (SVS) do Ministério da Saúde, a taxa média de prevalência do antígeno de superfície do VHB (HBSAg) em doadores de sangue situa-se em 0,7% (PORTAL da saúde, 2006) O período de incubação da doença varia de 15 dias a 6 meses, provavelmente dependendo da quantidade de vírus no inoculo (LOK, 2001, p.12251241). A transmissão do VHB ocorre por via sexual (pelas práticas homossexuais ou heterossexuais desprotegidas), parenteral (por injeções e transfusões contaminadas), vertical (perinatal, com transmissão, ao nascimento, da mãe portadora ao neonato) (LOK, 2001, p.1225-1241). Por sua forma de transmissão, o VHB delimita grupos de maior exposição, destacando-se os homossexuais e heterossexuais com variações freqüentes de parceiros sexuais sem uso de preservativos, usuários de drogas injetáveis que 23 compartilham seringas, indivíduos politransfundidos e profissionais da área de saúde (VEGMENT, 1992, p.188-191). O principal modo de transmissão nos países de elevada prevalência do VHB é a transmissão vertical. O risco de se tornar um portador crônico está ligado à idade em que se adquire a infecção. Cerca de 90% dos indivíduos infectados ao nascimento, 25 a 50% das crianças entre 1 e 5 anos e apenas 5% dos indivíduos infectados na idade adulta se tornarão portadores crônicos do VHB (VEGMENT, 1992, p.188-191). O VHB pode ser transmitido por vários líqüidos corporais, como o sangue, sêmen e saliva, através do contacto com mucosas ou ferimentos na pele. As maiores concentrações são observadas no sangue e em exsudatos serosos. Estimase que o risco de transmissão do VHB através de um único episódio de ferimento com agulha contaminada seja de 30%, comparado com 3% em relação ao vírus da Hepatite C (VHC) e 0,3% em relação ao HIV. É ainda discutível a possibilidade de transmissão pelo leite materno, pois, durante o aleitamento, pode acontecer, devido às repetidas sucções do mamilo, rachaduras e pequenos sangramentos, causadores de transmissão (CENTER FOR DISEASE CONTROL AND PREVENTION, 1991). O diagnóstico sorológico da hepatite B é feito com base na detecção sérica de dois antígenos (HBsAg; HBeAg), e quatro anticorpos (anti- HBcIgM; anti- HBc total; anti- HBe; anti- HBs) (SERVOSS, 2004, p. 267-281). O HBsAg é o antígeno de superfície e significa infecção pelo VHB – a persistência dele por mais de 6 meses indica infecção crônica. O HBeAg é o antígeno que indica replicação pelo HBV, ou seja, infecção em atividade (SERVOSS, 2004, p. 267-281). 24 O anti- HBcIgM é um marcador de infecção recente, encontrado no soro até 6 meses após a infecção. O anti- HBc total está presente nas infecções agudas e crônicas e costuma persistir por toda a vida, indicando contato prévio com o VHB (SERVOSS, 2004, p. 267-281). O anti- HBe é o anticorpo que surge após o desaparecimento do HBeAg. Sua identificação na fase aguda indica que a infecção está em resolução. Na fase crônica, seu surgimento indica término da replicação viral (SERVOSS, 2004, p. 267281). O anti-HBs é o último anticorpo a surgir na hepatite aguda B está presente no soro, após o desaparecimento do HbsAg, indicando cura e imunidade contra nova infecção pelo VHB. Está presente isoladamente nas pessoas vacinadas contra o VHB (SERVOSS, 2004, p. 267-281). A infecção aguda é resolvida em mais de 95% dos adultos jovens imunocompetentes, com desaparecimento do antígeno de superfície do VHB (HbsAg) e surgimento, algum tempo depois, do anti-HBs. A infecção pelo VHB pode, pois, evoluir para a recuperação em 95% dos adultos jovens, para hepatite fulminante em menos de 1% dos casos, para o estado de portador crônico ou portador inativo em até 5% dos casos. O risco de infecção crônica pelo VHB está inversamente relacionado à idade da infecção aguda. Nos casos de infecção aguda, adquirida no período perinatal, a cronificação ocorre em 90% dos indivíduos (BEASLEY, 1982 p.198), (STEVENS, 1985, p.1740). Menos de 5% dos adultos com infecção aguda pelo VHB evoluem à forma crônica da doença (TASSOPOULOS, 1987, p.1844). A co-infecção com o HIV e VHB é freqüente, devido às semelhanças epidemiológicas e de transmissão compartilhadas por ambos. A prevalência da 25 infecção pelo HIV em homossexuais masculinos, usuários de drogas ilícitas injetáveis e hemofílicos é da ordem de 70 a 90%. Desse modo, o Centers for Disease Control and Prevention admite que 10% de todos os indivíduos infectados pelo HIV também estejam infectados pelo VHB (CENTER FOR DISEASE CONTROL AND PREVENTION, 1992 p.1-19). Aproximadamente um milhão e 200 mil pessoas nos Estados Unidos têm HB crônica e são fontes de transmissão para outros indivíduos. A incidência de infecção aguda pelo VHB tem sido reduzida desde 1990 (de 8,5 para 2,8 casos por 100000 habitantes). Este fato se deve à vacinação de rotina entre crianças e adolescentes. Já na população adulta, esta incidência tem aumentado desde 1999, em virtude da atividade sexual sem a utilização de preservativos e do uso de drogas injetáveis (DODD, 1992, p.419). Pelas estimativas da OMS é provável que surjam mais de cinco milhões de casos novos de HB a cada ano (MARGOLIS, 1991, p.84). Alguns estudos do final da década de 80 e início dos anos 90 sugeriram uma tendência crescente do VHB em direção às Regiões Sul e Norte do Brasil. Assim, considerava-se que ocorriam três padrões de distribuição da HB: alta endemicidade, com prevalência superior a 7%, presente na Região Amazônica, alguns locais do Espírito Santo e oeste de Santa Catarina; endemicidade intermediária, com prevalência entre 2% e 7% nas Regiões Nordeste, Centro-Oeste e Sudeste; e baixa endemicidade, com prevalência abaixo de 2%, na Região Sul do País. No entanto, esta infecção é muito dinâmica e variável (PORTAL da saúde, 2006). Dados atuais indicam que a Região Sudeste apresenta baixa endemicidade, com exceção do sul do Espírito Santo e do nordeste de Minas Gerais, onde ainda são encontradas altas prevalências. A Região Centro-Oeste é de baixa 26 endemicidade, com exceção do norte de Mato-Grosso, com prevalência moderada. O Nordeste está em situação de baixa endemicidade (PORTAL da saúde, 2006). O estudo de soroprevalência da hepatite B realizado por Clemens et al em quatro capitais brasileiras, mostrou uma taxa geral de 7,9% de anti-HBc positivo. A mais alta prevalência foi observada na região Norte (21,4%), e a menor na região Nordeste (1,2%) (CLEMENS, 2000, p. 1-10). A vacina contra a hepatite B é utilizada desde o início do ano de 1980. Considerada o maior avanço no controle da doença, foi aclamada como a primeira vacina capaz de reduzir a incidência, não apenas de uma doença infecciosa, mas também de uma neoplasia maligna, o carcinoma hepatocelular (KEATING; NOBLE, 2003, p.1021). A vacina é capaz de induzir soroproteção em 90 a 95% dos adultos sadios e em mais de 98% das crianças e adolescentes (ASSAD; FRANCIS, 2000, p.57). Com a implementação de campanhas de vacinação contra hepatite B em algumas regiões do Estado do Amazonas, desde 1989, e a implantação da vacina em menores de 1 ano e em menores de 15 anos nos anos de 1991 e 1996 respectivamente, este padrão vem se modificando na região, como atestam estudos mais recentes. Na região de Lábrea, Estado do Amazonas, a taxa de portadores do VHB passou de 15,3% em 1988 para 3,7% em 1998. Na região de Ipixuna, a queda foi de 18% para 7%. No ano de 1992 implantou-se a vacinação no Estado do Acre para as mesmas faixas etárias e em 1993, para o restante da Amazônia Legal. Esta ação também teve impacto naquele estado, que em estudo de base populacional em 12 de seus 24 municípios apresentou a taxa de HBsAg de 3,4%. Outros trabalhos também classificam a Região Norte como de baixa ou moderada endemicidade, 27 permanecendo com alta endemicidade a região sudeste do Pará (PORTAL da saúde, 2006). Em 1993, foi implantada a vacinação para menores de 4 anos, nos estados de Santa Catarina, Espírito Santo e Paraná, redefinida em 1996 para menores de 15 anos e, no mesmo ano, no restante do País, para menores de 1 ano. A Região Sul, categorizada como de baixa endemicidade, permanece com prevalência moderada na região oeste de Santa Catarina, e com alta endemicidade, no oeste do Paraná, que teve a faixa etária para a vacinação estendida para menores de 15 anos em 1998 (PORTAL da saúde, 2006). Com o objetivo de reduzir os níveis de infecção pelo VHB, a imunização contra a hepatite B foi estendida em todo o território para a faixa de até 19 anos (PORTAL da saúde, 2006). As campanhas de vacinação, além das campanhas de informação e de prevenção, diminuem significativamente as taxas de infecção pelo VHB. Ademais, a melhoria das condições de controle do sangue reflete na melhor qualidade do sangue transfundido. Por outro lado, mudanças de comportamento sexual, após as campanhas de educação sobre o vírus HIV, também podem ter influenciado a redução da prevalência (KANE, 1995, p.47-49). 1.2.3 Hepatite C A hepatite C (HC) é um sério problema mundial de saúde pública. O vírus da hepatite C (VHC) é a maior causa de doença hepática crônica no mundo, com altas taxas de mortalidade e morbidade (SHEPARD C, 2005, p. 558-567). 28 A descoberta do VHC aconteceu na década de 70, mas sua identificação ocorreu em 1989, através da inoculação, em chipanzés, de plasma ou soro de pacientes com hepatite viral (CHOO, 1989, p. 359-362). A historia natural da hepatite C é difícil de ser determinada, pois a infecção aguda pelo VHC é, em geral, assintomática, e as suas complicações se desenvolvem em torno de 30 anos depois da infecção (ALBERTI, CHEMELLO, 1999, p. 17-24). A infecção pelo VHC pode levar à hepatite crônica, cirrose hepática, carcinoma hepatocelular, além da necessidade de transplante hepático (ALBERTI, CHEMELLO, 1999, p. 17-24). É uma doença de curso assintomático; na maioria dos pacientes, de progressão lenta e silenciosa (ALBERTI, CHEMELLO, 1999, p. 17-24). A maioria dos estudos sobre epidemiologia da hepatite C é de soroprevalência. Estes estudos são tipicamente transversais, sendo observadas populações especiais, entre elas: doadores de sangue, portadores de doença hepática crônica, pacientes em hemodiálise. Pelas estimativas da OMS, calcula-se que cerca de 3% da população mundial esteja infectada pelo VHC, perfazendo um total superior a 170 milhões de pessoas (WORLD HEALTH ORGANIZATION, 2002). Apesar de a HC ser considerada uma endemia mundial, há uma grande variação em sua distribuição geográfica (WORLD HEALTH ORGANIZATION, 2002). 29 Distribuição geográfica da infecção crônica pelo VHC em doadores de sangue Prevalência do Anti-HCV >5% - Alta 1,1-5% - Intermediária 0,2-1% - Baixa >0,1% - Muito Baixa Desconhecido Fonte: Centers for Disease Control and Prevention (CDC), Atlanta, USA/2000 Figura 3 - Prevalência da infecção pelo VHC em doadores de sangue. Nos Estados Unidos, anualmente, a HC mata entre 8.000 a 10.000 pessoas (WASLEY, ALTER, 2000, p. 1-16). A incidência da HC varia de menos 1% na população da Europa e Estados Unidos para até mais de 10% em regiões da Ásia e África (HWANG, 2001, p. 227234). Os países mais desenvolvidos têm a menor taxa de prevalência da hepatite C incluindo a Alemanha, com aproximadamente 0,6%, o Canadá, com 0,8%, a França, em torno de 1,1% e a Austrália, com 1,1%. Nos Estados Unidos, estima-se que a prevalência seja em torno de 1,8%, no Japão, 1,5-2,3% e, na Itália, 2,2% 30 (SHEPARD, 2005, p. 558-567), (WASLEY, ALTER, 2000, p. 1-16), (HWANG, 2001, p. 227-234). A África é um continente com alta prevalência em HC, em torno de 5,3%. A África Saudita tem prevalência em torno de 3%. A África Central tem a mais alta prevalência, 6%, e, na África Ocidental, estima-se que a prevalência seja de 2,4%. A África do Sul e a África oriental têm a mais baixa prevalência, estimada em 1,6% (MADHAVA, BURGESS, DRUCKER, 2002, p. 293-302), (OSOBA, 2002, p. 7-12). Segundo a OMS as taxas de prevalência de Hepatite C no Egito chegam a 20% (WORLD HEALTH ORGANIZATION, 2002). Não se conhece, com precisão, a prevalência do VHC no nosso país; há registros feitos em diversas áreas, sugerindo que a prevalência esteja em torno de 2% da população em geral (PORTAL da saúde, 2006). No Quadro 1 podemos observar os dados do SINAN (sistema de informação de agravos de notificação) sobre a distribuição dos casos confirmados de Hepatite C por Unidade Federada, no Brasil, de 1994 à 2003. No período anterior à 1994, não havia sistema de notificação. 31 Quadro 1: Distribuição dos casos confirmados de Hepatite C por Unidade Federada. Brasil, 1994 – 2003 UF 1994 1995 1996 1997 1998 1999 2000 Rondônia 0 0 0 0 0 27 31 Acre 0 0 0 0 0 0 111 Amazonas 0 0 0 0 0 1 6 Roraima 0 0 0 0 0 0 0 Pará 0 0 0 0 0 13 5 Amapá 0 0 0 0 0 0 0 Tocantins 0 0 0 0 0 0 15 Maranhão 0 0 0 0 0 2 11 Piauí 0 0 0 0 0 1 15 Ceará 0 0 0 0 0 0 2 Rio Grande do 0 0 0 0 0 13 17 Norte Paraíba 0 0 0 0 0 3 12 Pernambuco 0 0 0 0 0 82 244 Alagoas 0 0 0 0 27 21 9 Sergipe 0 4 3 22 15 2 5 Bahia 0 0 0 0 0 0 93 Minas Gerais 0 0 0 0 0 13 11 Espírito Santo 0 0 0 0 0 22 16 Rio de Janeiro 0 0 0 71 79 36 1817 São Paulo 0 0 0 1 111 347 536 Paraná 0 0 0 1 3 11 45 Santa 130 262 342 312 363 294 308 Catarina Rio Grande do 0 0 0 0 0 1555 1375 Sul Mato Grosso 0 0 0 0 0 87 80 do Sul Mato Grosso 0 0 0 0 0 0 2 Goiás 0 0 0 0 1 0 207 Distrito 0 0 0 0 0 0 199 Federal Ignorado 0 0 0 0 0 15 19 Total 130 266 345 407 607 2545 5191 2001 2002 2003 65 42 42 103 86 16 2 17 7 0 30 3 3 18 35 0 10 1 14 22 17 22 25 37 36 4 7 46 112 5 4 5 3 1 19 11 103 73 78 18 27 18 1 7 25 75 97 47 79 69 133 38 42 141 1243 838 554 616 1038 1864 138 113 405 298 236 152 1543 1402 680 121 154 136 3 222 82 12 244 67 38 133 53 6 3 2 4882 4812 4643 Fonte: MS/SVS – Sistema de Informação de Agravos de Notificação – SINAN – 2000 a 2003. (Adaptado) 32 No Quadro 2 podemos observar os dados do SINAN sobre a distribuição dos casos confirmados de Hepatite C, por região brasileira, de 1994 à 2003. Quadro 2 Distribuição dos casos confirmados de Hepatite C por Região. Brasil, 1994 – 2003 REGIÕES 1994 1995 1996 1997 1998 1999 2000 Norte 0 0 0 0 8 41 168 Nordeste 0 4 3 22 42 124 408 Sudeste 0 0 0 72 190 418 2380 Sul 130 262 342 313 366 1860 1728 Centro-oeste 0 0 0 0 1 87 488 Total 130 266 345 407 607 2545 5191 2001 187 306 1976 1979 428 4882 2002 225 369 1987 1751 477 4812 2003 121 231 2692 1237 360 4643 Fonte: MS/SVS – Sistema de Informação de Agravos de Notificação – SINAN – 2000 a 2003. (Adaptado) Com base em dados da rede de hemocentros de pré-doadores de sangue, em 2002, a distribuição do vírus variou entre as regiões brasileiras: 0,62% no Norte, 0,55% no Nordeste, 0,28% no Centro-Oeste, 0,43% no Sudeste e 0,46% no Sul. Um dos poucos estudos de base populacional realizados no país revelou 1,42% de portadores de Anti-HCV (anticorpo contra o VHC) na cidade de São Paulo. Resultado semelhante foi obtido em um estudo de soroprevalência realizado em Salvador, com 1,5% de portadores de Anti-HCV (MEDEIROS, 2004, p. 38). Patinõ-Sarcinelli F et al investigaram a prevalência de anticorpos anti-HCV, em doadores de sangue voluntários no Rio de Janeiro, e obtiveram uma taxa de 2,89% fortemente associada ao sexo masculino, etnia não-branca e idades mais avançadas (PATINO-SARCINELLI, HYMAN, 1994, p. 138-141). Em 1992, Cristiano et al, desenvolveram o teste de PCR (Reação em Cadeia de Polimerase), através do qual o RNA viral passou a ser determinado no soro e no fígado. A aplicação de testes diagnósticos veio a confirmar preliminares observações clínicas e epidemiológicas de que o vírus da VHC era o agente responsável pela vasta maioria dos casos de hepatite não-A não-B pós-transfusional . Assim, todas as 33 pessoas que receberam transfusão de sangue ou hemocomponentes até o início dos anos 90, com ou sem história de hepatite pós-transfusional, devem ser avaliadas para provável contaminação com o VHC. No Brasil, a partir de 1993, há a obrigatoriedade dos testes sorológicos (anti HCV) em candidatos a doadores de sangue (CRISTIANO, 1992, p. 172-178). O diagnóstico da HC é determinado pela presença, no soro, dos anticorpos contra o VHC (anti-HCV) e pela pesquisa do HCV-RNA, através da técnica de PCR. A presença do anti-HCV não diferencia infecção atual e contato prévio que evoluiu para cura, portanto, é necessário que os indivíduos reagentes sejam confirmados pela pesquisa do HCV-RNA. A presença de RNA indica replicação, ou seja, infecção ativa, no paciente com hepatite aguda ou crônica (BERNARD, 2005, p. 7-14). O tempo de incubação da HC mostra-se bastante variável, de 14 a 160 dias, com média de 50 dias. Tanto a infecção aguda quanto a infecção crônica pelo VHC são, na maioria das vezes, assintomáticas. Logo após a contaminação, o melhor marcador e único disponível, até o presente, é a determinação do HCV-RNA, já que os anticorpos surgem apenas 4 a 10 semanas após o contágio. A técnica de biologia molecular mais adequada para a detecção do HCV-RNA é o PCR qualitativo, capaz de detectar baixas quantidades de vírus (BERNARD, 2005, p. 7-14). Como as formas anictéricas da HC correspondem a cerca de 70% dos casos, os indivíduos contaminados evoluem para a cronicidade totalmente assintomáticos, sem terem conhecimento da presença do anti-HCV ou mesmo do aumento de enzimas hepáticas, como a ALT (aspartato aminotransferase) (ALBERTI, CHEMELLO, 1999, p. 17-24). As principais formas de transmissão da HC são a transfusão de sangue, antes de 1992, e o uso de drogas ilícitas injetáveis. O risco de transmissão vertical gira em 34 torno de 5 % a 7%, dependendo dos títulos de HCV-RNA: quanto maior a carga viral da genitora, maior o risco de transmissão da hepatite C (ROBERTS, YEUNG, 2002, p. 106-113). Se houver a co-infecção com HIV, o risco de transmissão aumenta em quatro a cinco vezes. (DODIG, TAVILL, 2001, p. 367-374). Diferentemente da hepatite B, não existe profilaxia para o recém-nascido, que terá o anti-HCV da mãe nos primeiros 6 a 12 meses de vida. Em diferentes estudos, os anticorpos do neonato costumam desaparecer nesse período, podendo haver verdadeira contaminação com permanência do HCV-RNA em raros casos, principalmente quando houver co-infecção com HIV. A gravidez não é contra- indicada e a amamentação não é proibida (HARDIKAR, 2002, p. 476-481), (JONAS, 2002, p. 173-178). A prevalência da infecção pelo VHC é mais alta em pacientes submetidos à hemodiálise do que na população em geral, possivelmente refletindo maior exposição a situações de risco. O principal modo de transmissão ocorre pela transfusão de sangue contaminado, embora a via nosocomial tenha sido freqüentemente observada. Isto tem levado a questionamentos sobre os possíveis fatores de risco e a discussões a respeito de medidas profiláticas. Alguns autores defendem a separação dos pacientes com anticorpos contra o VHC em uma sala de hemodiálise específica. Outros advogam que a transmissão nosocomial se deve à não observância das precauções universais. Este assunto permanece controverso (CENDEROGLO, 1995, P. 251-255), (DE LAMBALLERIE, 1996, p. 296-302), (GILLI, 1995, P. 301-306). 35 Há vários estudos sobre transmissão de HC em populações de pacientes hemodialisados. Em Salvador, a prevalência varia entre 23,8% a 42,2% (SANTANA, 2001, p.38-42); em Fortaleza, em torno de 52% (MEDEIROS, 2004, p. 38) e 35,3% em Goiânia (NAGHETTINI, 1997, P. 113-117). Há relatos de transmissão do VHC através de acupuntura, tatuagens e piercings (BERGK, BERG, NEUMANN, 2005, p. 7-14). A taxa de transmissão por via sexual entre casais monogâmicos é em torno de 1% (BERGK, BERG, NEUMANN, 2005, p. 7-14). Como o VHC e o HIV compartilham a mesma forma de transmissão, a coinfecção é comum. É estimado que 30% a 50% dos pacientes com HIV sejam coinfectados pelo VHC. Os estudos mostram que a hepatite C é uma doença mais grave em pacientes co-infectados por HIV, ocorrendo rápida progressão de hepatite crônica para cirrose hepática e pior índice de resposta ao tratamento (DODIG, TAVILL, 2001, p. 367-374), (MENDES-CORREA, BARONE, 2005, p. 59-64). Outra situação freqüente é a do acidente com agulha, em profissionais da área de saúde, ao lidar com enfermos contaminados pelo VHC. Os vários estudos demonstram que as possibilidades de adquirir hepatite C nesses casos mostram-se inferior a 10%, sendo desejável determinar o HCV-RNA entre 15 e 30 dias após o acidente profissional, pois não há vacina protetora até o momento (BERGK, BERG, NEUMANN, 2005, p. 7-14). Em resumo, os grupos de risco para contrair a infecção pelo VHC são: pacientes que receberam transfusão de sangue ou hemoderivados (antes de 1993), usuários de drogas injetáveis que compartilham seringas, parceiros sexuais de portadores de hepatite C, pacientes em hemodiálise, profissionais da área de saúde e filhos de pacientes infectadas pelo VHC, pacientes portadores de HIV e pacientes 36 portadores de aminotransferases (enzimas hepáticas) elevadas (PORTAL da saúde, 2006). Estudos mostram que os pacientes que adquiriram HC por hemotransfusão evoluem para hepatite crônica em 80% a 90% dos casos e desse total, 20% a 30% evoluem para cirrose hepática em 20 a 30 anos (COLOMBO, DONATO, 2005, p. 155-161). Nos pacientes que desenvolverem cirrose hepática, o risco de evoluir, em 5 anos, para descompensação hepática é de 15% a 20% de progredir para carcinoma hepatocelular é de 10%. Esse quadro, entretanto, passa a influenciar no curso natural da hepatite C, com evolução mais rápida para cirrose, às vezes em período inferior a 10 anos, quando comorbidades associam-se à infecção viral: alcoolismo (mecanismos não bem elucidados, envolvem aumento de carga viral induzida pelo álcool, assim como lesões imunomediadas e hepatotóxicas) co-infecção com o HIV, vírus B da hepatite e estados de imunodepressão (C. LEUNG, 2002, p. 146-154). O VHC tem alta heterogeneidade genética. A análise filogenética das seqüências genômicas permitiu a caracterização de seis genótipos principais(1 a 6) e 52 subtipos. Dentro de um mesmo genótipo e subtipo podemos ainda ter variações do VHC, que são denominadas quasispécies. Isto é possível devido à replicação imperfeita do vírus, com o surgimento de pequenas e constantes mutações. As quasispécies, portanto, são formas mutantes virais, aleatórias, surgidas da seqüência genômica, caracteristicamente dominante, ou seja, o genótipo e o subtipo (SIMMONDS, p.517-524, 1996), (DUSHEIKO, p. 13-18,1994). As implicações dos genótipos, na evolução clínica da doença, foram avaliadas por vários autores. Alguns sugeriram que pacientes com genótipo 1b poderiam progredir com maior gravidade, havendo associação mais freqüente com o 37 desenvolvimento de carcinoma hepatocelular. Entretanto, outros trabalhos não confirmaram esses resultados; o assunto, portanto, permanece controverso. Por outro lado, já está bem definido, na hepatite crônica, que indivíduos que apresentam o vírus com genótipo 1 obtêm uma resposta ao tratamento com interferon alfa, isolado ou em associação com a ribavirina, menos favorável do que indivíduos que se infectaram com o genótipo 2 (SHEPARD J, 2000, p. 1-67). A distribuição dos genótipos é variável segundo as regiões geográficas. Os genótipos 1a, 1b, 2a, 2b, 2c e 3 são mais encontrados nas Américas do Sul e do Norte, Europa, Rússia, China, Japão, Nova Zelândia e Austrália; o genótipo 4a, no Egito e na África Central; o genótipo 5a, na África do Sul; o genótipo 6a, no sudeste da Ásia (OSOBA, 2002, p. 7-12). No Brasil, há predominância do genótipo tipo 1 em cerca de 70% dos pacientes (FONSECA, LUNGER, IKUTA, 1998, p. 62-64). Em adição a diferentes genótipos e substancial freqüência de mutação, pouca evidência temos a favor de que a infecção pelo vírus da hepatite C confira imunidade à reinfecção por cepa homóloga. Os genótipos devem ser considerados em futuros desenhos diagnósticos, terapêuticos e na produção de vacinas. Anticorpo gerado de um genótipo pode não proteger a reinfecção por outras variantes. Co-infecção com dois ou mais genótipos foi observada entre hemofílicos, porém infecções por múltiplos genótipos, em um mesmo paciente, não são comuns (JOO, HABN, 200, p. 167-177). A grande dificuldade de estudo da HC reside no fato deste vírus ser um patógeno humano, não havendo animal de experimentação ou meios de cultura que se adaptem à pesquisa, exceto o chipanzé, de custos proibitivos. Nas poucas investigações experimentais recentes, estudos demonstram que chipanzés se 38 reinfectam com vírus homólogos e heterólogos, mesmo na presença de anticorpos neutralizantes. Ratos transgênicos que conseguem expressar a proteína do core desenvolveram esteatose hepática, no início da infecção pela hepatite C, evoluindo posteriormente para carcinoma hepatocelular (câncer de fígado). Já as proteínas E1/E2, nesse mesmo modelo animal, provocaram o desenvolvimento de manifestações extra-hepáticas, em glândulas salivares e lacrimais, semelhantes à síndrome de Sjögren (HWANG, 2001, p. 227-234). O tratamento da HC objetiva deter a progressão da doença hepática pela inibição da replicação viral. A redução da atividade inflamatória costuma impedir a evolução para cirrose e carcinoma hepatocelular, havendo, também melhora na qualidade de vida dos pacientes.Outras justificativas para o tratamento de HC são: a prevalência de 1 a 2% de portadores de HC no Brasil, causa mais freqüente de hepatopatia crônica; indicação mais freqüente de transplante hepático; tratamento custo-efetivo; benefício (bioquímico, virológico, histológico) em curto prazo de tempo; benefício (virológico) em longo prazo de tratamento; desaparecimento de manifestações extra-hepáticas e diminuição do risco de contaminação. Diante das drogas disponíveis, devem ser submetidos a tratamento pacientes com hepatite crônica C em estágio de doença hepática compensada. Indivíduos com doença hepática avançada não têm indicação de tratamento devido à exacerbação dos efeitos colaterais do interferon e ribavirina, além de registrarem baixa resposta à terapêutica (KRAWITT, 2005, p. 243-249), (LEGRAND, 2005, p. 66-69). Os genótipos 1 e 4 têm menor percentual de resposta ao tratamento quando comparado aos genótipos 2 e 3 (KRAWITT, 2005, p. 243-249), (LEGRAND, 2005, p. 66-69). 39 O tratamento de HC com terapia combinada com interferon alfa e ribavirina é superior à monoterapia com interferon alfa (SHEPARD J, 2000, p. 1-67). Atualmente, melhores percentuais de resposta terapêutica são adquiridos através do tratamento combinado de interferon peguilado com ribavirina (KRAWITT, 2005, p. 243-249). A precocidade do diagnóstico nos permite tratar, quando indicado, pacientes freqüentemente assintomáticos, impedindo que evoluam para fases sintomáticas da doença hepática, de mais difícil controle (KRAWITT, 2005, p. 243-249), (LEGRAND, 2005, p. 66-69). Os medicamentos atualmente disponíveis podem provocar efeitos colaterais significativos. Estes medicamentos devem ser administrados por período de tempo prolongado, exigindo constante monitorização médica especializada (KRAWITT, 2005, p. 243-249), (LEGRAND, 2005, p. 66-69). Outro aspecto a ser considerado é o elevado custo do tratamento, tanto para os indivíduos acometidos quanto para a sociedade, já que em nosso país, existe a política de distribuição gratuita desses medicamentos pelo SUS. Até o momento não existe vacina para a prevenção da transmissão do VHC (MINISTÉRIO DA SAUDE, 2005). 1.3 PROGRAMA DE SAÚDE DA FAMÍLIA E HEPATITES VIRAIS A Constituição de 1988 foi o marco regulador para a implementação de uma política de saúde que fortalecesse a atenção primária, privilegiando ações de promoção, prevenção, tratamento e reabilitação, com ênfase no indivíduo e na 40 inserção deste na sua família e na sua comunidade, de uma maneira eqüitativa, universal, descentralizada, integral, humanizada e participativa. Assim, surge, em 1994, o Programa Saúde da Família (PSF) como política pública de saúde, inaugurando um novo modelo de atenção à saúde e contribuindo para a consolidação de uma nova perspectiva de gestão da saúde no Brasil. O PSF é entendido como uma estratégia de reorientação do modelo assistencial, operacionalizada mediante a implantação de equipes multiprofissionais em unidades básicas de saúde. Estas equipes são responsáveis pelo acompanhamento de um número definido de famílias, localizadas em uma área geográfica delimitada. As equipes atuam com ações de promoção da saúde, prevenção, recuperação, reabilitação de doenças e agravos mais freqüentes e manutenção da saúde desta comunidade. A responsabilidade pelo acompanhamento das famílias coloca, para as equipes de saúde da família, a necessidade de ultrapassar os limites classicamente definidos para a atenção básica no Brasil, especialmente no contexto do SUS (PORTAL da saúde, 2006). O PSF, como estratégia estruturante dos sistemas municipais de saúde, tem provocado um importante movimento com o intuito de reordenar o modelo de atenção no SUS. Busca maior racionalidade na utilização dos demais níveis assistenciais e tem produzido resultados positivos nos principais indicadores de saúde das populações assistidas pelas equipes de saúde da família (PORTAL da saúde, 2006). O trabalho em equipe no PSF é o elemento-chave para a busca permanente de comunicação e troca de experiências e conhecimentos, entre os integrantes da equipe, e desses com o saber popular das pessoas da comunidade. As equipes são 41 compostas, no mínimo, por um médico de família, um enfermeiro, um auxiliar de enfermagem e 6 agentes comunitários de saúde. Quando ampliada, conta, ainda, com: um dentista, um auxiliar de consultório dentário e um técnico em higiene dental (PORTAL da saúde, 2006). Cada equipe se responsabiliza pelo acompanhamento de cerca de 3 mil a 4 mil e 500 pessoas ou de 1000 famílias de uma determinada área, e estas passam a ter co-responsabilidade no cuidado à saúde. A atuação das equipes ocorre, principalmente, nas unidades básicas de saúde e nas residências. O PSF tem as seguintes características: é a porta de entrada de um sistema hierarquizado e regionalizado de saúde; apresenta território definido, com uma população delimitada, sob a sua responsabilidade; intervenção sobre os fatores de risco aos quais a comunidade está exposta; prestar assistência integral, permanente e de qualidade; realiza atividades de educação e promoção da saúde (PORTAL da saúde, 2006). A estratégia do PSF visa, ainda: estabelecer vínculos de compromisso e de co-responsabilidade com a população; estimular a organização das comunidades para exercer o controle social das ações e serviços de saúde; utilizar sistemas de informação para o monitoramento e a tomada de decisões; atuar, de forma intersetorial, por meio de parcerias estabelecidas com diferentes segmentos sociais e institucionais, de forma a intervir em situações que transcendem a especificidade do setor saúde e que têm efeitos determinantes sobre as condições de vida e saúde dos indivíduos-famílias-comunidade (PORTAL da saúde, 2006). As hepatites virais constituem um grave problema de saúde pública no Brasil e no mundo. A maioria das pessoas infectadas desconhece seu estado de portador e constitui elo importante na cadeia de transmissão do vírus da hepatite B (HBV) ou 42 do vírus da hepatite C (HCV), o que ajuda a perpetuar o ciclo de transmissão dessas infecções (MINISTÉRIO DA SAÚDE, 2006). A rede de serviços de Atenção Básica do SUS é formada pelas Unidades Básicas de Saúde, pelas equipes do PSF, pelos Centros de Testagem e Aconselhamento (CTA) e pelos serviços da média e alta complexidade (MINISTÉRIO DA SAÚDE, 2005). A Atenção Básica à Saúde, como o nome preconiza, deve ser o ponto de partida de um atendimento à Saúde Pública eficiente e eficaz. Cabe a esse nível de atenção o papel de informar a população quanto às ações de prevenção de doenças e de promoção à saúde, assisti-la de forma contínua e resolutiva e encaminhar os doentes, quando necessário, aos serviços de referência, com agilidade e precisão (MINISTÉRIO DA SAÚDE, 2006). As equipes de atenção básica têm papel relevante na promoção à saúde, na prevenção, no diagnóstico e no acompanhamento das pessoas portadoras – sintomáticas ou não – de hepatites (MINISTÉRIO DA SAÚDE, 2005). A inserção do aconselhamento e testagem das hepatites virais na atenção básica requer conhecimento prévio de conteúdos sobre esses agravos, como também das principais vulnerabilidades para essas infecções e das necessidades particulares dos usuários. Há grupos que historicamente são excluídos dos serviços de saúde, seja por estilo de vida, seja por hábitos de consumo e orientação sexual, tais como usuários de drogas, travestis, prostitutas e moradores de rua. Também por essas condições tornam-se mais vulneráveis às hepatites, sendo importante ampliar o acesso desses grupos aos serviços, respeitando suas especificidades (MINISTÉRIO DA SAÚDE, 2006). 43 A testagem das hepatites B e C poderá ser estimulada por meio de ações educativas, quando serão informados os seus modos de transmissão, o que possibilitará às pessoas a percepção de sua exposição ao risco de infecção (MINISTÉRIO DA SAÚDE, 2006). O aconselhamento consiste em um processo educativo e pode se desenvolver através de um diálogo interativo, baseado em uma relação de confiança. Tem um papel importante na promoção da saúde, pois visa proporcionar à pessoa condições para que avalie seus próprios riscos e tome decisões realistas quanto à sua prevenção e aos problemas que possam estar relacionados às hepatites virais, levando o indivíduo a reconhecer-se como sujeito na prevenção e manutenção da sua saúde. Este processo precisa ser desenvolvido, levando-se em consideração o contexto de vida e os aspectos sócio-culturais nos quais os sujeitos estão inseridos (MINISTÉRIO DA SAÚDE, 2006). 1.4 JUSTIFICATIVA As hepatites virais são um grave problema de saúde pública no mundo e no Brasil. Segundo estimativas, bilhões de pessoas já tiveram contato com vírus das hepatites e milhões são portadores crônicos (MINISTÉRIO DA SAÚDE, 2006). A grande importância das hepatites não se limita ao enorme número de pessoas infectadas, estende-se, também, às complicações das formas agudas e crônicas. Os vírus causadores das hepatites determinam uma ampla variedade de apresentações clínicas, de portador assintomático ou hepatite aguda ou crônica, até cirrose e carcinoma hepatocelular. Considerando que as conseqüências das infecções são diversas, na dependência do tipo de vírus, o diagnóstico de hepatite, 44 nos dias atuais, será incompleto, a menos que o agente etiológico fique esclarecido (MINISTÉRIO DA SAÚDE, 2006). Para se definirem estratégias no controle das hepatites virais é importante que a amplitude do problema seja conhecida. As principais questões a serem investigadas, e que podem contribuir para o melhor controle das hepatites, estão relacionadas à definição dos diferentes tipos de vírus e das doenças que eles determinam. Não há dúvida de que o diagnóstico precoce de infecção pelos VHB ou VHC traz benefícios para os pacientes, permitindo-lhes escolher o momento mais adequado para iniciar um eventual tratamento da forma crônica da doença. No entanto, é sabido que a identificação de portadores assintomáticos de doenças infecciosas crônicas é muito difícil e onerosa. Por outro lado, a incorporação de técnicas novas para auxiliar na propedêutica e terapêutica das hepatites virais elevou muito o custo da assistência médica. Em relação à hepatite A, está bem demonstrado que a doença pode ser erradicada através de melhores condições de saneamento e de vacinação em massa e, que para se organizar adequadamente o conjunto das ações de saúde, é necessário ampliar a notificação e melhorar a vigilância dos casos (MINISTÉRIO DA SAÚDE, 2006). O diagnóstico precoce das hepatites B e C é essencial para que a progressão da doença seja evitada (C. LEUNG, 2002, p. 146-154). A identificação de pessoas com infecção crônica pelo VHB, através de um diagnóstico precoce, pode reduzir a transmissão continuada da infecção (MINISTÉRIO DA SAÚDE, 2006). Apesar das múltiplas tentativas, ainda não há vacina contra a hepatite C e tampouco, uma profilaxia eficaz pós-exposição. A redução da infecção (e das 45 doenças a ela relacionadas) requer a implementação de atividades de prevenção primárias e secundárias. As primeiras, para reduzir a incidência da infecção; as secundárias, para diminuir o risco de hepatopatia e carcinoma hepatocelular (COLOMBO, DONATO, 2005, p. 155-161). As hepatites A, B e C são doenças de notificação compulsória. Porém, o número de notificações não reflete a real incidência dessa infecção, pois a maioria dos casos acometidos apresenta formas assintomáticas ou oligossintomáticas (MINISTÉRIO DA SAÚDE, 2006). A prevenção primária tem como alvo a diminuição da incidência da infecção pelo VHA, VHB e VHC. Para que se iniciem atividades de prevenção secundária e terciária é necessário a identificação dos indivíduos infectados, pois elas se destinam a reduzir o risco de transmissão e a evolução para hepatopatia crônica. A prevenção deve focalizar o aconselhamento de pessoas que usam drogas, ou que estão em risco de uso, e aquelas com práticas sexuais também consideradas de risco (MINISTÉRIO DA SAÚDE, 2006). Neste contexto, está inserido o PSF, pois é importante que, no âmbito da atenção básica, o atendimento seja, desde o início, voltado para ações simples que reduzam a chance de progressão para cirrose ou câncer de fígado, modificando ou desacelerando a história natural da doença. Nesse sentido, a orientação para o não consumo de bebidas alcoólicas, prevenção da co-infecção com HIV, controle de distúrbios metabólicos, como a hiperlipidemia, obesidade e diabetes são essenciais (MINISTÉRIO DA SAÚDE, 2006). 46 A promoção da saúde envolve prevenção, educação e a participação de diferentes setores da sociedade na elaboração de estratégias que permitam a efetividade da educação para a saúde. Dessa forma, a promoção transcende as atividades e as decisões individuais para tornar-se uma atividade coletiva (SOUZA, 2004). No âmbito do PSF, a educação em saúde figura como uma prática prevista e atribuída a todos os profissionais que compõem a equipe de saúde da família. Espera-se que esta equipe esteja capacitada para dar assistência integral e contínua às famílias da área adscrita, identificando situações de risco à saúde na comunidade assistida, enfrentando, em parceria com a comunidade, os determinantes do processo saúde-doença e desenvolvendo processos educativos para a saúde, voltados à melhoria do auto-cuidado dos indivíduos (ALVES,2005 p.39-52). Educar para a saúde implica ir além da assistência curativa, significa dar prioridade a intervenções preventivas e promocionais. Deste modo, o desenvolvimento de práticas educativas no âmbito do PSF, seja em espaços convencionais, a exemplo dos grupos educativos, seja em espaços informais, seja em forma de consulta médica na residência das famílias em ocasião da visita domiciliar, se torna expressão da assimilação do princípio da integralidade pelas equipes de saúde da família (ALVES, 2005, p.39-52). As ações do PSF, com relação às hepatites virais, devem incluir: a) atividades educativas para promoção à saúde e prevenção; b) aconselhamento para os testes diagnósticos e para adesão à terapia instituída e às recomendações da assistência; c) diagnóstico precoce das hepatites; d) tratamento adequado; 47 e) encaminhamento dos casos que não competem a esse nível de atenção, realizando acompanhamento conjunto (referência e contra-referência); f) manejo adequado dos indivíduos em uso indevido de drogas (MINISTÉRIO DA SAÚDE, 2006). Para que todas essas ações sejam realizadas no âmbito do PSF-Lapa, é necessário, primeiro, estimar a prevalência das hepatites virais. A partir daí, traçamos o perfil da população adscrita e podemos realizar o planejamento, a elaboração de estratégias, e o desenvolvimento de ações para atuar naquela área. O PSF-Lapa é um cenário de integração de docentes com a área assistencial, ou seja, há professores e alunos da graduação, oferecendo, portanto, um bom campo para que esta pesquisa pudesse ser realizada. 48 1.5 OBJETIVOS 1.5.1 Objetivo Geral Estimar a prevalência da infecção pelo VHC na população adscrita no PSF- Lapa. 1.5.2 Objetivos Específicos A) Estudar a distribuição das infecções pelo VHA e VHB na população adscrita no PSF-Lapa. B) Realizar notificação dos casos de hepatites virais A, B e C. C) Realizar a investigação epidemiológica das infecções por VHA, VHB, VHC. D) Caracterização de co-infecção entre VHB e VHC na população adscrita no PSFLapa. E) Informar a população do PSF-Lapa, o perfil de prevalência das hepatites virais da sua comunidade. F) Estimular a realização dos exames para o diagnóstico precoce das hepatites virais. G) Permitir aos pacientes que suspeitam que foram expostos aos vírus poder conhecer seu status sorológico. Se o resultado for positivo, a detecção precoce permitirá um acompanhamento da doença, com tratamento adequado quando necessário, evitando, assim, que o portador chegue ao serviço de saúde apenas quando os sintomas forem manifestos e apresentando quadro hepático mais grave; permitirá, também, o aconselhamento para a adoção de cuidados que possam reduzir a possibilidade de transmissão para outras pessoas. Se o resultado for 49 negativo, haverá a oportunidade de trabalhar as questões relativas à vulnerabilidade do indivíduo à infecção. H) Disseminação de informações sobre o perfil sorológico das hepatites virais A, B e C entre os profissionais de saúde. I) Realizar o aconselhamento dos pacientes com sorologia positiva. O aconselhamento consiste em um processo educativo e pode se desenvolver através de um diálogo interativo, baseado em uma relação de confiança. Tem um papel importante na promoção da saúde, pois visa proporcionar à pessoa condições para que avalie seus próprios riscos, assim como tomar decisões realistas quanto à sua prevenção e aos problemas que possam estar relacionados às hepatites virais, levando o indivíduo a reconhecer-se como sujeito na prevenção e manutenção da sua saúde. Este processo precisa ser desenvolvido levando-se em consideração o contexto de vida e os aspectos sócio-culturais nos quais os sujeitos estão inseridos. J) Priorizar as ações preventivas no sentido de divulgar informações sobre as hepatites virais entre os profissionais de saúde e para a população. K) Utilizar o sistema de referência e contra-referência, orientando a população contaminada para referenciamento médico capacitado. L) Fazer o acompanhamento conjunto desses pacientes com sorologia positiva – contra-referência Atuando, desta forma, de maneira integrada com os profissionais dos serviços especializados, contribuindo, assim, para melhorar a adesão e as recomendações ao tratamento. M) Realizar palestras educativas para a população adscrita com informações sobre os modos de transmissão das hepatites virais, o que possibilitará às pessoas a percepção de sua exposição ao risco de infecção. 50 N) Investigação dos contactantes dos pacientes com sorologia positiva para o VHB, pois este vírus sobrevive fora do corpo humano por um período prolongado, e sua transmissão pode ocorrer através de artigos intra-domiciliares (escovas de dente, tesouras, alicates de unhas e brinquedos compartilhados) ou por meio de via sexual, considerada uma importante forma de disseminação do VHB. 51 2. METODOLOGIA 2.1 TIPO DE PESQUISA O estudo foi um inquérito soro epidemiológico transversal. 2.2 COLETA DE DADOS 2.2.1 - Pacientes A pesquisa de campo foi realizada com pacientes adscritos no Programa de Saúde da Família da Lapa, no Rio de Janeiro. Foi feita uma amostra sistemática de todos os pacientes que foram até o PSF - Lapa para realizarem coleta de sangue e concordaram em participar da pesquisa, assinando o Termo de Consentimento Livre e Esclarecido. A coleta de sangue foi realizada no próprio PSF, em seus dias habituais, às segundas e quintas-feiras. No período de agosto de 2006 a dezembro de 2006, foi aplicado um questionário por membros participantes da pesquisa, alunas de medicina que faziam parte do projeto de iniciação científica do CNPq. Foi aplicado um questionário estruturado, que usou como modelo a ficha de investigação de hepatites virais do SINAN. Neste questionário, foram englobadas variáveis, tais como: identificação, idade, sexo, raça, grau de escolaridade, vacinação contra hepatite A e hepatite B, antecedentes de alcoolismo e icterícia, fatores de risco, sintomas clínicos, abastecimento de água, destino dos dejetos humanos e marcadores sorológicos. A ficha de investigação de hepatites virais do SINAN encontra-se no anexo A e o questionário aplicado no anexo B. 52 2.2.2 - Laboratório A maior parte do material coletado foi enviado para o Laboratório de Virologia do Laboratório Central do Hospital dos Servidores do Estado do Rio de Janeiro. A detecção do anti-HCV no soro foi incluída na rotina dos exames periódicos da população adscrita do PSF da Lapa. Nesta população, também foram estudados os marcadores sorológicos para hepatite B (HBsAg, anti-HBs, anti-HBc IgM, anti-HBC total, anti-HBe, HBeAg ) e para hepatite A (anti-HAV IgM e anti-HAV IgG). Algumas amostras, no total de 13, foram enviadas para o Centro de Diagnósticos e pesquisa Dr. Raymundo Brito (Apae-Rio), através de um convênio com o posto de assistência medica Oswaldo Cruz (POC). Neste laboratório foram realizados exames para detecção de marcadores sorológicos para hepatite B: HBsAg, anti-HBs e anti-HBc. A técnica utilizada para determinação do anti-HCV, HBsAg, anti-HBs titulado, anti-HBcIgM, anti-HBC total, anti-HBe, HBeAg, anti-HAV IgM e anti-HAV IgG foi a de imunoensaio enzimático de micropartículas (MEIA). O MEIA é uma variação do princípio do imunoensaio enzimático (EIA). A fase sólida do EIA, primeiramente descrito no início dos anos 70, utiliza antígenos e/ou anticorpos adsorvidos na superfície para a ligação de antígenos complementares. O antígeno ligado é detectado por uma série de reações antígeno-anticorpo. EIAs estão disponíveis para identificar diversos antígenos e anticorpos relacionados com infecção da hepatite viral. Na reação final do AxSYM, um anticorpo ligado a uma enzima ativa sob um substrato para produzir um produto final fluorescente. A fluorescência produzida pela reação enzimática é medida e é proporcional à 53 quantidade de anticorpos e/ou antígenos ligados (ABBOTT AxSYM system, p.2, 2004). O kit utilizado foi o da marca Abbott Laboratórios do Brasil LTDA. A sensibilidade referida do teste para a detecção do anti-HCV é de 100% e a especificidade, de 99,84% (ABBOTT AxSYM system HCV3. 0, p.8, 2002); para a detecção do HBsAg, a sensibilidade é de 99,70% e a especificidade, de 99,60% (ABBOTT AxSYM system HbsAg(V2), p.8, 2002); para a detecção do anti-HBs titulado, a sensibilidade é de 100% e a especificidade, de 100% (ABBOTT AxSYM system AUSAB, p.8-9, 2004); para a detecção do anti-HBc, a sensibilidade é de 98,60% e especificidade, de 100% (ABBOTT AxSYM system CORE, p.7, 2002); para a detecção do anti-HBs para a detecção do anti-HBs para a detecção do anti-HAV IgM, a sensibilidade é de 99,59% e a especificidade, de 100% (ABBOTT AxSYM system HAVAB-M2.0, p.7-8, 2002); para a detecção do anti-HAV IgG a sensibilidade é de 99,74% e a especificidade, de 98,96% (ABBOTT AxSYM system HAVAB 2.0, p.8, 2002). 2.2.3 - PSF da Lapa O bairro da Lapa começou a ser ocupado no século XVIII e, desde seu início, foi um lugar de tradição boêmia, como se mantém até hoje. Situada na Lapa, a insalubre Lagoa do Boqueirão era passagem obrigatória para quem circulava do Engenho del Rey, na região que hoje é a Lagoa Rodrigues de Freitas, para o Engenho Velho, hoje Tijuca. O seu nome teve origem na Igreja de Nossa Senhora do Carmo da Lapa do Desterro (MOREIRA J. 2006). 54 Os famosos cafés, restaurantes, leiterias, que foram ponto de encontro de músicos, sambistas, artistas, intelectuais, mas também da malandragem, foram desapropriados e demolidos para surgir a fisionomia atual do bairro (MOREIRA J. 2006). O Grande Hotel, edificado em 1896, pelo Comendador Guilherme Porto, e que hoje abriga a Sala Cecília Meireles, foi um hotel importante e luxuoso, porque era utilizado por figuras importantes da República, graças à sua proximidade com o Senado Federal no Palácio Monroe (MOREIRA J. 2006). Este bairro, conhecido como berço da boemia carioca, também é famoso pela arquitetura, a começar pelos Arcos - conhecidos como Arcos da Lapa, construídos para funcionarem como aquedutos nos tempos do Brasil Colonial e que, agora, servem como via para os bondinhos que circulam até o bairro de Santa Teresa. Ponto de referência para os amantes da vida noturna, uma das características marcantes do bairro é a harmonia com que convivem as mais diversas tribos musicais. Desde os nos 50, quando era chamado de "Montmartre Carioca",a Lapa é palco de encontro de intelectuais, artistas, políticos e, principalmente, do povo carioca, que ali se reúne para celebrar o samba, o forró, a MPB, o choro e, mais recentemente, a música eletrônica e o rock (WIKIPÉDIA, 2006). A Rua do Passeio, embora já existente desde o século XVII, ganhou este nome depois da criação do Passeio Público. Nela, nasceu o primeiro jornal brasileiro, a Gazeta do Rio, em 1808. Passaram também pela Rua do Passeio: a Academia Brasileira de Letras, sob a Presidência de Machado de Assis; o Clube dos Diários, que ficava no prédio do Automóvel Clube do Brasil, onde, até 1930, eram apresentados os candidatos à Presidência da República e, até, a Biblioteca 55 Nacional, que funcionou onde hoje é a Escola de Música da UFRJ, antes de ocupar o prédio da Cinelândia, em 1910 (MOREIRA J. 2006). A Rua Senador Dantas foi aberta em 1886, para ligar o Largo da Carioca à Rua do Passeio e facilitar a movimentação para a zona sul da cidade pelos bondes puxados a burro. Seu nome foi uma homenagem ao Senador e Conselheiro Manoel Pinto de Souza Dantas (MOREIRA J. 2006). Pelas principais vias do bairro, Mem de Sá, Rua do Riachuelo e Lavradio, espalham-se atrações como a Sala Cecília Meireles, que é considerada a melhor casa para concertos de música de câmara existente no Rio. O Passeio Público, a Escola Nacional de Música e a Igreja de Nossa Senhora da Lapa são referências para o turista que quer ver uma boa amostra da arquitetura do Rio antigo. A Prefeitura do Rio já restaurou boa parte do bairro, que manteve quase intacta a arquitetura original dos prédios do início do século, a principal característica do lugar ( WIKIPÉDIA, 2006). A Lapa, é hoje, uma importante área de preservação do patrimônio cultural e arquitetônico e, ao mesmo tempo, uma área de crescente revitalização e reconversão de edificações, antes residenciais, que agora abrigam atividades culturais diversas ( WIKIPÉDIA, 2006). Através de um convênio entre a Universidade Estácio de Sá e a Secretaria Municipal de Saúde, em 2001, foi criado o PSF-Lapa, unidade destinada ao atendimento da comunidade que reside no entorno do campus do curso de medicina e ao campo de prática dos estudantes do curso de graduação em medicina e, mais recentemente, a partir de uma abordagem multiprofissional, estudantes dos cursos 56 de graduação da área de saúde, como, por exemplo, psicologia, nutrição, odontologia, enfermagem, fisioterapia e fonoaudiologia. O PSF-Lapa teve seu início em 2001, com uma cobertura de 2.233 pessoas, distribuídas em 861 famílias. No ano de 2005, a cobertura foi ampliada para 3.648 pessoas, distribuídas em 1.414 famílias (SECRETARIA MUNICIPAL DE SAÚDE, 2006). A Unidade de Saúde do PSF-Lapa faz parte da Policlínica Ronaldo Gazolla e é composta de treze ambulatórios, uma sala de ginecologia, uma farmácia, uma sala de procedimentos de enfermagem e uma de pré-consulta, uma recepção e uma sala de aula. Os medicamentos são oferecidos gratuitamente à população adscrita, e a unidade conta, ainda, com o suporte de especialidades clínicas e cirúrgicas, onde os exames e referências aos especialistas, quando necessárias, são absorvidas pelas unidades do Município e pela Policlínica Ronaldo Gazolla, mediante fluxo acordado previamente. O PSF-Lapa, diferentemente do modelo proposto pelo Ministério da Saúde, tem sua equipe formada por seis médicos, duas enfermeiras, três auxiliares de enfermagem, um odontólogo e seis agentes comunitários de saúde. Possui seis microáreas adstritas, compreendendo partes das ruas do Riachuelo, Lavradio, Mem de Sá, Gomes Freire, Resende e da Praça João Pessoa (SECRETARIA MUNICIPAL DE SAÚDE, 2006). A comunidade tem características próprias, como, por exemplo, o baixo número de menores de um ano, o número de mulheres em idade fértil e uma população maior de sessenta anos (SECRETARIA MUNICIPAL DE SAÚDE, 2006). Há também um grande número de profissionais do sexo: prostitutas e travestis. 57 Há vários grupos de educação em saúde no PSF-Lapa: Jovens da 3ª Idade, Coral, Caminhada, Saúde em Movimento, Planejamento Familiar, Adolescentes, Gestantes, Travestis, Saboreando Saúde e Educação Psicomotora. Grande parte destes grupos tem uma atuação multiprofissional, ou seja, há participação de estudantes e professores de diferentes cursos da área da saúde. Atualmente, a equipe do PSF-Lapa é composta por 7 médicos: 6 médicos com formação em Saúde da Família, 1 médico com formação em Pediatria. Há, ainda, 2 enfermeiras, 2 auxiliares de enfermagem, 5 agentes comunitários de saúde e 01 recepcionista. As equipes interdisciplinares são compostas por: 1 dentista, 1 fonoaudiólogo, 2 fisioterapeutas, 2 enfermeiras e uma nutricionista, todos com formação em Saúde Pública. Neste PSF estão inseridos alunos da graduação da Universidade Estácio de Sá. 2.2.4 Considerações Éticas Os sujeitos da pesquisa receberam toda a informação sobre sua participação no estudo por escrito, em um documento: o Termo de Consentimento Livre e Esclarecido (anexo C). Neste documento, estão descritos os objetivos do estudo, o projeto em questão, a responsável pelo estudo e os benefícios da pesquisa. Todos os pacientes receberam a garantia de que as informações prestadas seriam sigilosas. Através deste documento, ficou claro que a participação do indivíduo na pesquisa era voluntária e que, a qualquer momento, poderia ser retirado o seu consentimento e ele deixaria de ser parte do estudo. Todos os sujeitos da pesquisa assinaram esse documento autorizando a utilização de seus dados. 58 O projeto foi analisado e aprovado pelo Comitê de Ética em Pesquisa da Universidade Estácio de Sá. Este parecer consubstanciado sobre o projeto de pesquisa tem o protocolo de nº 336. 2.3 ANÁLISE DOS DADOS Os dados foram armazenados em bancos de dados, utilizando o programa Epi Info. O Epi Info é um software de domínio público desenvolvido pelo CDC para auxiliar no melhor acompanhamento de pesquisas. É uma série de programas para o sistema operacional Windows para uso de profissionais de saúde pública que administram investigações de epidemias, gerenciam bancos de dados de vigilância epidemiológica e outras tarefas, incluindo bancos de dados gerais e análises estatísticas. Com o Epi Info e um computador, médicos epidemiologistas, profissionais em saúde pública, ciências sociais e outros, podem desenvolver rapidamente um questionário ou formulário, padronizar o processo de entrada de dados, alimentar o banco e analisar dados. A idéia é utilizar um conjunto de pequenos aplicativos para escrever textos e relatórios, armazenar informações e fazer o cruzamento das mesmas, buscando inferir idéias e descobrir dados que se escondem em outros, auxiliando, assim, no desenvolvimento de planos estratégicos no controle de endemias (CENTER FOR DISEASE CONTROL AND PREVENTION, 2007). O tamanho amostral calculado foi de 69 pacientes, tendo como base 4000 habitantes do PSF, com margem de erro de 4%, freqüência estimada de hepatite C de 3%, nível de confiança de 95%, baseado na fórmula: 59 S = Z*Z(P(1-P))/(D*D) Onde: D = metade da amplitude do intervalo de confiança. Z = percentil da distribuição normal padrão, determinada pelo nível de confiança especificado (95% de confiança – 1,96). P = proporção estimada 60 3. RESULTADOS Para esta dissertação foram aplicados 142 questionários nos pacientes que foram até o PSF da Lapa para realizarem coleta de sangue e concordaram em participar da pesquisa, assinando o Termo de Consentimento Livre e Esclarecido. Foram realizadas coletas de sangue e solicitadas sorologias para as hepatites virais A, B e C para os 142 pacientes. Deste total de pacientes, tivemos 60 amostras perdidas, tendo obtido resultados de 82 amostras. Desse total de 82, 69 exames foram realizados no Laboratório de Virologia do Laboratório Central do Hospital dos Servidores do Estado do Rio de Janeiro e 13 exames foram realizados no Centro de Diagnósticos e Pesquisa Dr. Raymundo Brito (Apae-Rio), através de um convênio com o posto de assistência médica Oswaldo Cruz (POC). Na tabela 1, apresentamos os resultados referentes às características sóciodemográficas da população estudada. 61 Tabela 1 – Características sócio-demográficas da população adscrita no PSFLapa. Características Resultados Mínima Máxima Média Aritmética Desvio Padrão Mediana % 8 84 47,50 17,63 49 N Feminino Masculino 63,4 36,6 90 52 Branca Preta Outras 57,7 16,2 26,1 82 23 37 Escolaridade Ensino Fundamental Ensino Médio Ensino Superior Sem Escolaridade/Ignorado Total 52,8 30,7 12,7 4,2 100,0 75 43 18 6 142 Idade Sexo Raça Fonte: Dados do autor A idade mínima foi 8 anos e a máxima, 84, com média aritmética das idades de 47,5 anos, desvio padrão de 17,63 anos e mediana de 49 anos. .Nos 142 pacientes, houve predomínio do sexo feminino, num total de 90 pacientes, equivalentes a 63,4%. Havia 52 pacientes do sexo masculino, perfazendo 36,6%. Com relação à raça, houve predomínio da branca, com 82 pacientes, perfazendo 57,7%. No que diz respeito à preta, 23 pacientes participaram da pesquisa. Na categoria “outros”, estão incluídos: 2 da raça amarela (1,4%); 32 da parda (22,5 %); 1 da indígena (0,7%) e 2 com raça ignorada (1,4%), formando total de 37 pacientes (26,1%). 62 A maioria dos pacientes, 75 (52,8%), tinha nível de escolaridade com ensino fundamental completo. Em segundo lugar estão os que completaram o ensino médio, 30,7% dos casos (43 pacientes), seguidos dos que possuíam nível superior completo – 18 (12,7%); 3 (2,1%) não tinham nenhuma escolaridade. Identificamos saneamento básico favorecendo 100% dos pacientes. Na tabela 2, estão demonstradas as distribuições de freqüências simples e percentuais quanto aos marcadores sorológicos das Hepatites A, B e C. 63 Tabela 2 – Resultados dos marcadores sorológicos das Hepatites A, B e C da população adscrita no PSF-Lapa. Hepatites Marcadores Sorológicos % N 92,8 7,2 100,0 65 5 70 0,0 100,0 100,0 0 70 70 32,5 67,5 100,0 25 52 77 15,8 48,6 100,0 13 69 82 0,0 100,0 100,0 0 82 82 2,9 97,1 100,0 2 67 69 Hepatite A Anti- HAVIgG Reagente Não Reagente Total Anti- HAVIgM Reagente Não Reagente Total Hepatite B Anti -HBs Reagente Não Reagente Total Anti-HBc Total Reagente Não Reagente Total HBsAg Reagente Não Reagente Total Hepatite C Anti- HCV Reagente Não Reagente Total Fonte: Dados do autor Com relação à hepatite A, não identificamos nenhum caso de infecção aguda, ou seja, 0% de anti-HAVIgM reagentes. Avaliamos a presença de 70 pacientes (92,8%) com marcador sorológico anti HAV IgG reagentes. Nos exames realizados para hepatite B, houve positividade para o anti-HBs em 25 pacientes (32,5%), 13 casos de anti-HBc total reagentes (15,8%) e nenhum caso do marcador HBsAg, anti -HBcIgM . 64 Observamos que 2 pacientes (2,9%) apresentaram sorologia positiva (antiHCV reagente) para hepatite C. Na tabela 3, apresentamos a associação entre os marcadores sorológicos anti-HBs e anti- HBc total. Tabela 3 – Associação entre os marcadores sorológicos Anti-HBs e Anti-HBc Total, entre Reagentes e Não Reagentes. Anti-HBc Total Anti-HBs Reagente Não Reagente Total Reagente % N 14,3 11 2,6 2 16,9 13 Não Reagente % N 18,2 14 64,9 50 83,1 64 Total % 32,5 67,5 100,0 N 25 52 77 Fonte: Dados do autor Encontramos 11 pacientes (14,3%) com os marcadores sorológicos anti-HBS e anti-HBC total reagentes; 14 pacientes (18,2%) anti-HBs isolados reagentes. Na tabela 4, apresentamos a informação sobre vacinação para hepatite A e B. Tabela 4 – Histórico de vacinação declarado pelos pacientes entrevistados Vacinação Completa Incompleta Não vacinado Ignorado Total Hepatite A % 6,3 1,4 71,1 21,1 100,0 Hepatite B N 9 2 101 30 142 % 14,1 2,8 62,0 21,1 100,0 N 20 4 88 30 142 Fonte: Dados do autor . 65 Evidenciamos que 11 pacientes informaram terem sidos vacinados contra hepatite A, sendo que 9 (6,3%) com vacinação completa, e 2 (1,4%), com incompleta. Com relação à hepatite B, observamos que 20 pacientes (14,1%) relataram vacinação completa e 4 (2,8%) incompleta, num total de 24 pacientes vacinados. No presente estudo foram utilizadas: a) médias aritméticas, desvios padrões, medianas, valor mínimo e valor máximo; b) distribuições de freqüências simples e percentuais; c) tabelas ; d) teste não-paramétrico de X2 (qui-quadrado), para associação das variáveis em estudo. Adotou-se o nível de significância de 5% de probabilidade, (P≤0.05) (RODRIGUES,1992, p.329). 66 4. DISCUSSÃO Esta dissertação traz à tona varias indagações que merecem ser motivo de reflexão: Qual o âmbito de ações das equipes de atenção básica com relação às hepatites virais? Qual a importância do desenvolvimento de ações referentes às hepatites virais na atenção básica de saúde? Fazer um estudo sobre hepatites virais na atenção básica tem relevância? Será que a estrutura da atenção básica está preparada para a pesquisa? Na tentativa de responder a todos estes questionamentos, partimos para o trabalho de campo. .Como entrevistar tantos pacientes? Como lidar com as dificuldades habituais do dia a dia em pesquisa: o preenchimento de questionários, a orientação aos pacientes, as dificuldades da coleta e transporte do material e tantas outras? A primeira constatação foi a importância da participação dos alunos da graduação, participantes do projeto de iniciação científica, para o desenvolvimento de um trabalho de pesquisa. O auxílio dos alunos, no caso desta dissertação, as alunas, foi imprescindível para o preenchimento dos questionários e a montagem do banco de dados, entre tantas outras atribuições. Foram realizadas várias reuniões com o grupo para discutir a pesquisa em andamento. O tema das hepatites virais no PSF é novo e promissor No âmbito de ações destas equipes, devem fazer parte as atividades educativas para promoção à saúde e prevenção, o aconselhamento para os testes diagnósticos e para adesão à terapia, o diagnóstico precoce das hepatites, encaminhamento dos casos que não 67 competem a esse nível de atenção, realizando acompanhamento conjunto, manejo adequado dos indivíduos em uso indevido de drogas. A atenção integral a essas infecções necessita não apenas da implementação de ações básicas de prevenção e assistência, mas também o fortalecimento da integração entre os diferentes níveis de atenção à saúde existentes no município/ região, cuja resolubilidade varia de acordo com os recursos financeiros, técnicos, humanos e de infra-estrutura do serviço. É fundamental que a organização dos serviços de saúde promovam um melhor acesso àqueles que buscam o atendimento e que cada profissional incorpore em sua rotina a preocupação de identificar os pacientes em situação de maior vulnerabilidade, garantindo-lhes atendimento humanizado e resolutivo. Também se faz necessário o desenvolvimento de ações na comunidade que promovam o aumento da percepção de risco para esses agravos, além de estimular a adoção de práticas seguras para a saúde (MINISTÉRIO DA SAÚDE, 2006). A Atenção Básica, por meio das ações informativas /educativas desenvolvidas na comunidade e no PSF, promoverá maior conscientização da população com relação às hepatites virais. Conseqüentemente, haverá uma busca mais precoce dos serviços de saúde pelos indivíduos com suspeita destas infecções, tornando o PSF a porta de entrada para esses pacientes, reduzindo, assim, a automedicação e a procura da resolução do problema em farmácias (MINISTÉRIO DA SAÚDE, 2006). As hepatites virais são um grave problema de saúde pública, com elevada freqüência de infecções inaparentes e alto custo de diagnóstico etiológico, o que dificulta a realização de estudos que permitam conhecer sua magnitude e monitorar sua ocorrência, para subsidiar estratégias de prevenção e controle (MINISTÉRIO DA SAÚDE, 2006). 68 Buscando a integração da pesquisa com a comunidade estudada, realizamos palestras sobre as hepatites virais para a população adscrita no PSF-Lapa. A idéia era fazer um trabalho de educação em saúde. Entendemos que esta deve oferecer condições para que as pessoas desenvolvam o senso de responsabilidade, tanto por sua própria saúde, como pela da comunidade, merecendo consideração como um dos mais importantes elos entre as perspectivas dos indivíduos, os projetos governamentais e as práticas de saúde. Kawamoto (1993) e Levy (2000) ressaltam que as ações educativas em saúde são processos que objetivam capacitar indivíduos e/ou grupos, de modo que possam assumir ou ajudar na melhoria das condições de saúde da população, ou seja, a educação em saúde visa capacitar os indivíduos a agir conscientemente diante da realidade cotidiana, com aproveitamento de experiências anteriores, formais e informais, tendo sempre em vista a integração, continuidade, democratização do conhecimento e o progresso no âmbito social. Realizamos, também, um evento de capacitação sobre as hepatites virais para os profissionais de saúde da unidade PSF-Lapa, visando o aprimoramento do tema em questão, a troca de informações e experiências, além de sensibilizá-los para a pesquisa em andamento e explicitação da necessidade da notificação. Devemos lembrar que as hepatites virais são doenças de notificação compulsória e o ato de notificar deve ser entendido como apenas uma ação no processo da Vigilância Epidemiológica, que permite acompanhar, em termos coletivos, a tendência da doença, permitindo avaliar as medidas de prevenção que estão sendo executadas, além de rastrear as fontes de infecção e permitir, do ponto de vista do indivíduo, que sejam identificados novos casos entre os comunicantes. 69 A hepatite A (HA), uma das mais antigas doenças conhecidas pelo homem, representa um problema de extrema importância para os países em desenvolvimento, devido aos altos coeficientes de incidência, quanto aos países desenvolvidos, devido à melhoria das condições sanitárias e de higiene pessoal, tem se observado um declínio da incidência da moléstia e um aumento na idade de aquisição da infecção, resultando numa proporção considerável de adolescentes e adultos jovens susceptíveis ao vírus da hepatite. As medidas preventivas inespecíficas para se evitar a exposição ao VHA, tais como higiene pessoal meticulosa, melhoria dos padrões sanitários da comunidade e ausência de aglomeração humana, têm respondido pela diminuição da incidência da HA nos países desenvolvidos. Sabe-se que o desenvolvimento de estratégias de controle de determinada doença depende das condições epidemiológicas do local onde tais medidas serão implantadas. A epidemiologia da HA está em fase de mudança. A doença ocorre em todo o mundo, mas a verdadeira incidência é desconhecida, pois a maioria das infecções é assintomática ou apresenta sintomatologia leve, não sendo diagnosticadas nem notificadas. Por esses motivos, a epidemiologia da HA é melhor definida por estudos de soroprevalência, ou seja, pela freqüência de anticorpos contra o VHA (anti-HAVIgG) em determinada população. Em nossa pesquisa encontramos uma freqüência de anti-HAVIgG de 92,8%, significando alta prevalência de anticorpos contra hepatite A na população estudada, apesar disso 100% dos pacientes referiram possuir sistema de saneamento básico.. De acordo com Gaze et al, a prevalência de anticorpos anti-HAV IgG é de 88,8% em Macaé e foi compatível com estudos em regiões semelhantes à área estudada. Miranda et al. (1998) encontraram 88,3% em Ribeirão Preto, São Paulo; 70 Abuzwaida et al. (1987), 74,5% em subúrbio de Niterói, Rio de Janeiro e 90,0% em Nova Iguaçu, Rio de Janeiro; e Yoshida et al. (1987), 97,0% em doadores de sangue no Rio de Janeiro (GAZE, 2002, p. 1251 – 1259). Segundo Clemens (2000), no Brasil, embora o número de notificações não reflita a incidência verdadeira da infecção, estudos de soroprevalência para HA mostram que a média nacional está situada em torno de 65%. Dentre as hepatites virais notificadas aos serviços de saúde, aproximadamente metade dos casos é devida ao VHA. Dos 142 pacientes entrevistados, 9 (6,3 %) relataram esquema de vacinação completo contra o VHA e 2 (1,4%) referiram esquema vacinal incompleto. A média de idade foi de 49 anos, sendo a mínima de 16 anos e a máxima de 72 anos. O conhecimento adequado sobre a freqüência do VHB e a implementação de estratégias indicadas para a sua prevenção exigem métodos complexos de vigilância epidemiológica. O primeiro passo é fazer uma estimativa da prevalência geral da população estudada. Quando analisamos os marcadores virais para hepatite B, observamos que 13 pacientes (15,8%) são reagentes para o anti-HBC total, significando contato prévio com o VHB. No estudo em 4 capitais brasileiras realizado por Clemens et al, a soroprevalência geral de anticorpos anti-HBc no Brasil foi de 7,9 %. Porém, o Ministério da Saúde estima que, no Brasil, pelo menos 15% da população já esteve em contato com o VHB. Isto significa que estimativa realizada na população estudada está de acordo com os dados do Ministério da Saúde (MINISTÈRIO DA SAÙDE, 2005). A infecção aguda pelo VHB é resolvida em mais de 95% dos casos, com desaparecimento do antígeno de superfície do VHB (HBSAg) e surgimento, algum 71 tempo depois, do anti-HBs. A infecção aguda pelo VHB pode evoluir para o estado de portador crônico em até 5% dos casos . Em nosso estudo não encontramos nenhum caso de infecção aguda e, também, nenhum caso de infecção crônica pelo VHB. O marcador anti-HBS foi positivo em 32,5% dos casos. Encontramos 11 pacientes (14,3%) com os marcadores sorológicos anti-HBS e anti-HBC total reagentes, significando contato prévio com o VHB. Em nosso estudo percebemos que 20 pacientes (14,1%) informaram ter vacinação completa contra o VHB, porém, a positividade isolada para o anti-HBs foi de 18,2% (14 pacientes). Uma possibilidade é presença de um viés de memória entre alguns pacientes vacinados que afirmaram não vacinação prévia. Observamos que 4 pacientes (2,8%) referiram vacinação incompleta contra o VHB, isso nos leva a afirmar a importância de esclarecimento da população, sobre a necessidade do esquema vacinal completo, para adquirir imunidade duradoura contra o VHB. . A média de idade foi de 42 anos, sendo a mínima de 16 anos e a máxima de 72 anos. Através da monitorização dos indivíduos recentemente infectados, pode-se ter informações críticas para identificar com segurança surtos de Hepatite B. Em nosso estudo não foi encontrada positividade para o marcador sorológico anti-HBCIgM (0% de reagentes); este marcador, em conjunto com o HBSAg, significa infecção recente pelo VHB. No que se refere à vigilância de hepatopatias crônicas, o HBSAg tem grande valor, pois ele é o primeiro marcador a surgir no curso da infecção pelo VHB e, além disso, sua presença, por mais de seis meses, é indicativo de hepatite crônica. A sua identificação resulta no encaminhamento do paciente para centros de referência de diagnóstico e tratamento e, ainda, possibilita a imunização de contactantes. 72 A hepatite C é a principal causa de doença hepática que leva à hepatite crônica, cirrose e ao carcinoma hepatocelular. Muitas pessoas desconhecem seu estado de portador do VHC, pois esta infecção cursa, na maioria dos casos, de forma assintomática e com progressão lenta. Grande esforço tem sido feito por profissionais de saúde, órgãos públicos, organizações não-governamentais e indústria farmacêutica na tentativa de evitar-se a disseminação do VHC, otimizar seu tratamento e impedir a progressão da doença hepática, diminuindo as complicações e melhorando a qualidade de vida dos portadores. A hepatite C é considerada uma endemia mundial, e tem uma grande variação em sua distribuição geográfica. De modo geral, considera-se que a prevalência da infecção pelo VHC alcance 1 a 3% da população mundial. Não se conhece, com precisão, a prevalência do VHC no nosso país; há registros feitos em diversas áreas, sugerindo que a prevalência esteja em torno de 2% da população em geral. Em nosso estudo, a prevalência do anti-HCV foi de 2,9%, em concordância com a prevalência mundial. Não encontramos nenhum caso de co-infecção entre VHC e VHB na amostra estudada. 73 5. CONCLUSÃO Observamos que a situação epidemiológica da população adscrita no PSFLapa é semelhante à da população geral. Em relação à Hepatite C, a taxa de prevalência estimada, a partir do resultado do anti-HCV foi de 2,89% (IC 95% pelo método quadrático de Fleiss = 0,5-11 %). Em relação à Hepatite B, a taxa de prevalência estimada, pelo resultado do Anti-HBc total foi de 15,8% (IC 95% pelo método quadrático de Fleiss = 9,03-25,95 %). Em relação à Hepatite A, a taxa pela prevalência, estimada com base no resultado do Anti-HAV IgG foi de 92,85% (IC 95% pelo método quadrático de Fleiss = 83,43-97,34 %). Com base na pesquisa realizada nesta dissertação, podemos concluir que o tema hepatites virais no contexto do PSF é bastante relevante, pois este programa baseado em práticas voltadas para ações de promoção à saúde e prevenção, além da responsabilidade sanitária, permite uma maior aproximação com as atividades de vigilância epidemiológica. A vigilância epidemiológica das hepatites virais tem como objetivos conhecer a amplitude, a tendência e a distribuição por faixa etária e áreas geográficas destas infecções. Deve ser realizada a investigação dos casos suspeitos, o encaminhamento dos casos confirmados, além de deverem ser adotadas medidas de controle. Estas medidas incluem a notificação e a investigação de todos os casos suspeitos e confirmados. A notificação é importante para que se desencadeie a investigação e o controle das fontes de transmissão. Os dados encontrados sobre hepatite B e hepatite C estão de acordo com a literatura, além de corroborarem com a tradição de boemia do bairro da Lapa. 74 No caso da nossa dissertação, todos os pacientes com sorologia positiva serão encaminhados para o ambulatório de hepatologia do Hospital dos Servidores do Estado do Rio de Janeiro. A partir desta pesquisa, percebemos a necessidade de criar estratégias de intervenção no PSF-Lapa, principalmente no que concerne à hepatite A, pois, observamos que houve uma alta prevalência de anticorpos contra este tipo de hepatite, apesar disso, 100% dos entrevistados referiram ter sistema de saneamento básico. Quando correlacionamos este dado com nível de escolaridade, percebemos que a maior parte da população estudada tem apenas o ensino fundamental, isto indica a promoção da saúde como uma saída para prevenção contra a hepatite A. Uma proposta interessante, a nosso ver, seria que a vacinação contra hepatite A fizesse parte do calendário vacinal, o que não ocorre nos dias atuais, para que, desta forma, pudéssemos modificar a história natural da doença. Além disso, é importante também vacinar contra hepatite A e contra hepatite B os portadores de hepatite C, pelo risco de piorarem sua doença. Gostaríamos de ressaltar que esta dissertação foi apenas o primeiro passo para mostrar a importância da estimativa da prevalência das hepatites virais no PSFLapa. A partir deste perfil, buscamos criar um vínculo com a comunidade e os profissionais de saúde, no sentido de alertar sobre a relevância do tema hepatites virais, fazendo a investigação epidemiológica destas infecções, encaminhando os casos com sorologia positiva, priorizando sempre as ações preventivas. 75 REFERÊNCIAS BIBLIOGRÁFICAS 1. ABBOTT Laboratórios do Brasil LTDA, divisão de diagnósticos ABBOTT AxSYM system HbsAg(V2), p.8, 2002. 2. ABBOTT Laboratórios do Brasil LTDA, divisão de diagnósticos ABBOTT AxSYM system AUSAB, p.8-9, 2004. 3. ABBOTT Laboratórios do Brasil LTDA, divisão de diagnósticos ABBOTT AxSYM system CORE, p.7, 2002 4. ABBOTT Laboratórios do Brasil LTDA, divisão de diagnósticos ABBOTT AxSYM system HAVAB-M2.0, p.7-8, 2002 5. ABBOTT Laboratórios do Brasil LTDA, divisão de diagnósticos ABBOTT AxSYM system HAVAB-2.0, p.8, 2002 6. ABBOTT Laboratórios do Brasil LTDA, divisão de diagnósticos, ABBOTT AxSYM system HCV3.0, p.8, 2002 7. ALBERTI A; CHEMELLO L; BENVEGNU L.Natural history of hepatitis C. J Hepatol. 31 Suppl 1, Review, p.17-24. 1999. 76 8. ALVES V. M. Um modelo de educação em saúde para o Programa Saúde da Família: pela integralidade da atenção e reorientação do modelo assistencial. Interface (Botucatu), p.39-52, fev. 2005. 9. ASSAD, S.; FRANCIS, A. Over a decade of experience in a yeast recombinant hepatitis B vaccine. Vaccine, v.18, p.57, 2000. 10. BEASLEY, R.P. et al. Incidence of hepatitis B virus infections in preschool children in Taiwan. J Infect Dis, v.146, p.198, 1982. 11. BERGK A; BERG T; NEUMANN UP. Risk factors for the acquisition of hepatitis C, Minerva Gastroenterol Dietol. p.7-14, 2005. 12. BERNARD PH. Hepatitis B and C virological tests: interpretation and practical results in women.Gynecol Obstet Fertil. Jun; 33(6), p: 423-428, 2005. 13. Brasil. Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de Atenção Básica. HIV/Aids, hepatites e outras DST / Ministério da Saúde, Secretaria de Atenção à Saúde, Departamento de Atenção Básica. – Brasília: Ministério da Saúde, 2006.196 p. il. - (Cadernos de Atenção Básica, n. 18) (Série A. Normas e Manuais Técnicos). 14. BRASIL. MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Hepatites Virais: O Brasil está atento, 2005. 77 15. BRUNDAGE SC, Fitzpatrick AN; Hepatitis A., Am Fam Physician, 15;73(12):p. 2162-2168, Jun, 2006. 16. C. LEUNG NW. Management of viral hepatitis J Gastroenterol Hepatol. Feb; 17 Suppl:S, p.146-154, 2002. 17. CENDOROGLO NETO M; et al. Environmental transmission of hepatitis B and hepatitis C viruses within the hemodialysis unit. Artif Organs . v.19, p.251255, 1995. 18. CENTER FOR DISEASE CONTROL AND PREVENTION (2005). Disponível em < http: //www.cdc.gov/epiinfo>. Acesso em 15 jan, 2007. 19. CENTER FOR DISEASE CONTROL AND PREVENTION. Center for Disease Control: 1993 revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescent and adults. MMWR, v.41, p.1-19, 1992. 20. CENTER FOR DISEASE CONTROL AND PREVENTION. Hepatitis B virus: a comprehensive strategy for eliminating transmission in the United States through universal childhood vaccination: recommendations of the Advisory Committee on Immunization Pratices (ACIP). MMWR, v.40, n.13, p.1-19, 1991. 78 21. CENTER FOR DISEASE CONTROL AND PREVENTION. Prevention and control of infections with hepatitis viruses in correctional settings. MMWR, v.50, p.1-36, 2003. 22. CHOO QL; et al. Isolation of a CDNA clone derived from a blood born non-A, non-B viral hepatitis genome. Science; 244 p. 359-362, 1989. 23. CLEMENS SAC, et al. Hepatitis A and Hepatitis B seroprevalence in 4 centers in Brazil. Rev Soc Bras Med Trop, 33(1): p.1-10, 2000. 24. COLOMBO M; DONATO MF. Prevention of hepatocellular carcinoma. Semin. Liver Dis., v. 25, p. 155-161, 2005. 25. COON J. T>, et al. Case finding for hepatitis C in primary care: a cost utility analysis. Family Practice—an international journal, p.393-406, 2006. 26. CRISTIANO K; et al. Hepatitis C viral RNA in serum of patients with chronic non-A, non-B hepatitis: detection by the polymerase chain reaction using multiple primer sets. .Arch Virol Suppl; 4, p. 172-178, 1992 27. DE LAMBALLERIE X; et al. Nosocomial transmission of hepatitis C virus in haemodialysis patients. J Med Virol, 49: p. 296-302, 1996. 28. DODD, R.Y. The risk of transfusion-transmited infection (editorial). N Engl J Med, v.327, p.419, 1992. 79 29. DODIG M; TAVILL AS. Hepatitis C and human immunodeficiency virus coinfections. J Clin Gastroenterol, Nov-Dec;33(5):, p. 367-374, ., 2001. 30. DUSHEIKO,G.;et al . Hepatitis C virus genotype: na investigation of type – specific differences in geographic origin and disease. Hepatology, v. 19, p.1318,1994. 31. FONSECA ASK; et al. Prevalência de genótipos do vírus da Hepatite C no Estado do Rio Grande do Sul. Newslab, 27, p. 62-64, 1998. 32. GAZE R. et al. Soroprevalência das infecções pelos vírus das hepatites A e B em Macaé, Rio de Janeiro, Brasil. Cad. Saúde Pública, Rio de Janeiro, 18(5): p. 1251-1259, 2002. 33. GILLI P; et al. Prevention of hepatitis C virus in dialysis units. Nephron; 70: p. 301-306, 1995. 34. HARDIKAR W. J Hepatitis C in childhood, Gastroenterol Hepatol., Apr;17(4), :p. 476-481, 2002. 35. HWANG SJ Hepatitis C virus infection: an overview, J Microbiol Immunol Infect., Dec;34(4): p. 227-234, 2001. 80 36. JACOBSEN KH, KOOPMAN JS. Declining hepatitis A seroprevalence: a global review and analysis. Epidemiol Infect, 132(6):p.1005-1022, dec.,2004. 37. JONAS MM. Children with hepatitis C. Hepatology. Nov; (5 Suppl 1):p.173178, 2002. 38. JOO M; HABN YS. Animal models for immune defects caused by hepatitis C virus. Molecular Medicine Today 6:p. 167-177, 2000. 39. KAWAMOTO, E. E. Educação em saúde. Enfermagem Comunitária, p. 29-33, São Paulo: E. P. U. 1993. 40. KEATING, G.M.; NOBLE, S. Recombinant hepatitis B vaccine (Engerix B®): A review of its immunogenicity and protective efficacy against hepatitis B. Drugs, v.63, p.1021, 2003. 41. KOFF, R. S. Hepatitis A, Lancet, v. 351, p. 1643-1649, 1998. 42. KOOPMANS M, et. al. Foodborne viruses. Microbiol Rev, 26 (2), p. 187-205, jun., 2005. 43. KRAWITT EL, et al. Peginterferon alfa-2b and ribavirin for treatment-refractory chronic hepatitis C. J Hepatol, Aug; 43 (2): p. 243-249, 2005. 44. LEE, W. M. Hepatitis B vírus infection. , N Engl J Med, v. 337, p. 1733-1745, 1997. 81 45. LEGRAND A, et al. Pegylated interferon and ribavirin therapy for chronics hepatitis C virus genotype 4 infection. J Med. Virol. Sep; 77(1): p. 66-69, 2005. 46. LEMON, S.; MARTIN, A. Hepatitis A virus. Clinical course and sorology. In: AMERICAN ASSOCIATION FOR THE STUDY OF LIVER DISEASES. Viral hepatitis A to F: an uptodate. Chicago: AASLD, p. 43-53, 1994. 47. LEVY, S. Programa Educação em Saúde. Outubro 2000. 48. LEUNG AK; KELLNER JD; DAVIES HD . Adv Ther. Hepatitis A: a preventable threat, Nov-Dec; 22(6): p. 578-586, 2005. 49. LOK, ASF, Chronic hepatitis B. , N Engl J Med ,p. 1682-1683, 2002. 50. MADHAVA V; BURGESS C; DRUCKER E. Epidemiology of chronic hepatitis C virus infection in sub-Saharan Africa. Lancet Infect Dis. May;2(5): p. 293302, 2002. 51. MANNUCCI, P. M.; GDOVIN, S; GRIGERI,A. Transmission Of hepatitis A to patients whith hemophilia by factor VIII concentrates treated with organic solvent and detergent to inactivate viruses. The italian Collaborative Group. Ann. inter. Med. v.120, p1-5,1994. 82 52. MARGOLIS, H.; ALTER, M.; ADLER, S. Hepatitis B: Evolving epidemiology and implications for control. Semin Liver Dis, v.11, p.84, 1991. 53. MEDEIROS MT; et al. Prevalência e fatores associados à hepatite C em pacientes em hemodiálise. Rev. Saúde Pública v.38 n.2 São Paulo, abr,.2004. 54. MENDES-CORREA MC, BARONE. A Hepatitis C in patients co-infected with human immunodeficiency virus. A review and experience of a Brazilian ambulatory. Rev Inst Med Trop São Paulo. Mar-Apr; 47(2)p. 59-64. Epub 2005 May 4, 2005. 55. MOREIRA J. Rio de janeiro cidade maravilhosa (2006). Disponível em <http: //www.marcillio.com/rio>. Acesso em 15 jan 2007. 56. MORRILL et al. Barriers to the treatment of hepatitis C. JGIM, 2005. 57. NAGHETTINI AV; et al. Soroprevalência do vírus da hepatite C na população em diálise de Goiânia, GO. Rev Soc Bras Med Trop, 30:113-117, 1997. 58. OSOBA AO Hepatitis C virus genotypes in Saudi Arabia. Saudi Med J. Jan; 23(1): p.7-1, 2002. 83 59. PATIÑO-SARCINELLI F; HYMAN J. Prevalence and risk factors for hepatitis C antibodies in volunteer blood donors in Brazil. Transfusion; 34:p.138-141, 1994. 60. POOVORAWAN, Y.; THEAMBOONIERS, A.; CHURNDER, S. Changing seroepidemiology of hepatitis A virus infection in Thailand. Southeast Asian J. Of Trop. Med. Public Health, v. 24, p. 250-254, 1993. 61. PORTAL da saúde. Disponível em: http: //portal.saude.gov.br/saude/. Acesso em: 20 dez. 2006. 62. REGEV, A; SCHIFF, E. R. Viral hepatitis A, B and C, Clin. Liv. Dis. v.4, p. 4771, 2000. 63. ROBERTS EA, YEUNG L.Maternal-infant transmission of hepatitis C virus infection. Hepatology. Nov; 36(5 Suppl 1):p. 106-113, 2002. 64. RODRIGUES PC. Bioestatística. 3ª Edição, EDUFF, UFF, Niterói, RJ, p.329,1992. 65. SANTANA GO, et al. Anticorpo contra o vírus C da hepatite em pacientes sob programa de hemodiálise em Salvador. Arq. Gastroenterol. v 38 n 2 São Paulo jan/mar, 2001. 84 66. SECRETARIA MUNICIPAL DE SAUDE.(2006). Disponível em <http: //www.saude.rio.rj.gov.br/>. Acesso em 15 jan 2007. 67. SERVOSS, J. C.; FRIEDMAN, L. S. Serologic and molecular diagnosis of hepatitis B virus. Clin.Liv. Dis. v.8, p. 267-281,2004. 68. SHEPARD C, et al. Global epidemiology of hepatitis C virus infection. Lancet Infect. Dis. 5:p. 558-567, 2005. 69. SHEPARD J., et al. Combination therapy (interferon alfa and ribavirin) in the treatment of chronics hepatitis C: a rapid and systematis review. Health Technol. Assess. 4(33):p. 1-67, 2000. 70. SILVA LK, et al. Prevalência da infecção pelo vírus da hepatite C e genótipos entre hemofílicos do estado da Bahia, nordeste do Brasil: análise de parâmetros sorológicos e virológicos. Rev. Soc. Bras. Med. Trop. nov/dez. vol. 38, n 6, p. 496-502, 2005. 71. SIMMONDS, P; et al. Epidemiological, clinical and therapeutic associations of hepatitis C types in western european patientis. Journal of Hepatology, v. 5, p.517-524, 1996. 85 72. SOUZA E. M., Promoção da saúde, epidemiologia social e capital social: interrelações e perspectivas para a saúde pública. Cad. Saúde Pública, Rio de Janeiro, 20(5): p.1354-1360, set-out, 2004. 73. STEVENS, C.E. et al. Vertical transmission of hepatitis B antigen in Taiwan. N Eng J Med, v.292, p.292-771, 1975. 74. TASSOPOULOS, N.C. et al. Natural history of acute hepatitis B surface antigen-positive hepatitis in Greek adults. Gastroenterology, v.92, p.1844, 1987. 75. VEGMENT, a; IORO, r.; s. et al. Chronicity rate of hepatitis B virus infection in the families of 60 hepatitis B surface antigen positive chronic carrier children: role of horizontal tranmission. European Journal of Pediatrics, v. 151, p. 188191, 1992. 76. WASLEY A, ALTER MJ. Epidemiology of hepatitis C: geographic differences and temporal trends. Seminars in Liver Diseases 20: p. 1-16, 2000. 77. WIKPEDIA A ENCICLOPÉDIA LIVRE (2007). Disponível em <http: www.pt.wikipedia.org>. Acesso em 15 jan 2007. 78. WORLD HEALTH ORGANIZATION. Global prevalece (update). Wkly Epidemiol Rec, 2002,75: 17-28. Disponível em www.who.int. acesso em 28 nov 2006. 86 ANEXO A 87 88 Nº : Análise da Prevalência de Hepatite C na População Adscrita no PSF da Lapa Nome do Paciente 1 2 Data de Nascimento | | | | | 3 (ou) Idade | 4 Sexo D - dias M - meses A - anos | | | 6 Escolaridade (em anos de estudo concluídos) 5 Raça/Cor M - Masculino F - Feminino I - Ignorado 1-Nenhuma 2-De 1 a 3 3-De 4 a 7 4-De 8 a 11 5-De 12 e mais 6- Não se aplica 9-Ignorado 1-Branca 2-Preta 3-Amarela 4-Parda 5-Indígena 9-Ignorado 7 Nome da Mãe 8 Logradouro (rua, avenida,...) 9 Número 11 Ponto de Referência 10 Complemento (apto., casa, ...) 12 UF | 13 Bairro 14 CEP | | | | - | | 15 (DDD) Telefone | | | | | | | | | Dados Complementares do Caso 16 Data da Investigação | | | | | 17 (DDD)Ocupação / Ramo de Atividade Econômica | | 18 Tem vacinação contra 1 - Completa Hepatite A 2 - Incompleta Hepatite B 3 - Não vacinado 9 - Ignorado 19 Paciente Tem História Anterior 1 - Sim 2 - Não Icterícia Alcoolismo 9 - Ignorado 20 O Paciente foi submetido ou exposto a: Transfusão de Sangue / Derivados Hemodiálise Medicamentos Injetáveis Acupuntura Exposição a Sangue/Secreções Tatuagem Drogas Injetáveis Tratamento Cirúrgico Piercing Drogas Inaláveis Tratamento Dentário Acidente Percutâneo Três ou mais parceiros sexuais Parto normal Transplante Doença sexualmente transmissível (DST) 21 Local/Município da exposição 22 Data da Exposição | | | | | 23 Suspeita de: 1 - Hepatite A 2- Hepatite B/C por Hemodiálise/Transfusional 4- Não especificada 3- Hepatite B/C por outros motivos 24 Gestante 1-Sim 2-Não 9-Ignorado 25 Contato com Paciente de Hepatite B ou C, ou com Portador dos VHB ou VHC Sexual Ocupacional Domiciliar (não sexual) 1-Sim, há menos de seis meses 2-Sim, há mais de seis meses 3-Não 9-Ignorado 26 Se Sim, Nome do Contato 27 (DDD) Telefone | | | | | | | | | 28 Endereço do contato (Rua, Av., Apto., Bairro, Localidade, etc) 29 Marcadores Sorológicos 1 - Reagente 2 - Não Reagente 3 - Inconclusivo 4 - Não Realizado 9 - Ignorado 30 Sinais e Sintomas AgHBs 1 - Sim Anti -HBc (Total) 2 - Não Anti-HCV 9 - Ignorado Febre Fezes Esbranquiçadas Fraqueza/ indisposição Alteração de consciência Urina Escura Fígado aumentado Prurido (coceira) generalizado Dor de cabeça Inapetência Vômitos com sangue Manchas vermelhas na pele Náuseas / vômitos 32 Abastecimento de Água 1 - Rede pública contínua 4 - Outros 2 - Poço 3 - Rio Especificar:________________________________ Icterícia 31 Data da Icterícia | | | | | 33 Destino dos dejetos humanos 3 - Fossa Negra 1 - Rede pública de esgoto 2 - Fossa seca 4 - Fossa séptica 5 - Céu aberto 6 - Outros Especificar:____________ 7 - Rio 9 - Ignorado ANEXO C MODELO TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO( OU ESCLARECIMENTO DO RESPONSÁVEL) Nome do entrevistado: __________________________________________Idade: _______ Responsável legal: ___________________________________________ RG: __________ Projeto:___________________________________________________________________ _________________________________________________________________________ Responsável:______________________________________________________________ Eu,________________________________________________________________, abaixo assinado, (responsável pelo meu presente próximo _______________________________ ________________) , declaro ter pleno conhecimento do que se segue: 1. Objetivo da Pesquisa: ____________________________________________________ 2. Benefícios que possam ser obtidos:__________________________________________ 3. Receberei resposta ou esclarecimento a qualquer dúvida acerca de assuntos relacionados com o objeto da pesquisa. 4. Tenho a liberdade de retirar o meu consentimento a qualquer momento e deixar de participar do estudo. 5. Obterei informações atualizadas durante o estudo, ainda que isto possa afetar minha vontade de continuar dele participando. 6. A pesquisa manterá o caracter oficial das informações relacionando-as com a minha privacidade. 7. Em caso de dúvidas, poderei esclarecê-las através de contato telefônico com o (a) pesquisador(a) pelos telefones ___________________________. Rio de Janeiro, _____de ___________________de 20 ____ __________________________________ Assinatura do Participante ou Responsável _________________________________ Assinatura do(a) Pesquisador(a) 90
Baixar