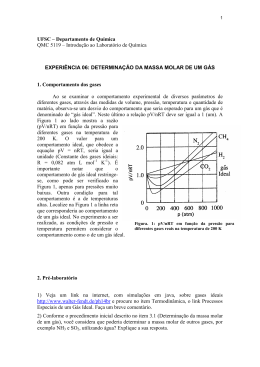
EXPERIÊNCIA 6 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: • Interpretar as leis que regem o comportamento dos gases ideais. • Utilizar a equação da lei do gás ideal, PV = nRT • Medir o volume e a massa de um gás • Utilizar a pressão de vapor no cálculo da pressão de um gás coletado sobre a água. 2. INTRODUÇÃO A maioria dos gases reais mostra um comportamento aproximado ao de um gás ideal, especialmente se a pressão não for muito alta e a temperatura não for muito baixa. Para uma amostra de gás constituída de certo número de mols de moléculas, há três grandezas mensuráveis, ou variáveis, que são matematicamente relacionadas entre si. Estas são: Volume, Pressão e Temperatura. Relação Pressão-Volume: Lei de Boyle O aumento da pressão diminui o volume de um gás de tal modo que o produto da pressão permanece constante. 1 𝑃𝑉 = 𝑘 ou 𝑃 = 𝑘 𝑉 Onde, P representa a pressão do gás, V é o seu volume e k é uma constante. Isto significa que se dobrarmos a pressão, o volume será dividido ao meio. Se triplicarmos a pressão, o volume ficará V/3 do seu valor original, etc... Efeitos da Temperatura: Lei de Charles 𝑉 = 𝛼 𝑇 Esta relação simples indica que o volume de uma quantidade determinada (número de mols) de um gás é diretamente proporcional a sua temperatura na escala Kelvin, se a pressão for mantida constante. V=αxT Combinando as duas expressões, a da Lei de Boyle e a da Lei de Charles, temos a lei combinada dos gases: 𝑃2 𝑉2 𝑃1 𝑉1 = 𝑇2 𝑇1 Outra relação importante é V α n, ou seja, o volume (V) de um gás é diretamente proporcional ao número de mols (n) desse gás. Avogadro, em 1811, sugeriu que volumes iguais de gases diferentes contêm a mesma quantidade de moléculas quando medidos nas mesmas condições de pressão e temperatura. Esta sugestão é agora conhecida como princípio de Avogadro. A lei do gás ideal: as leis de Boyle, de Charles e o Princípio de Avogadro podem ser resumidos como: 1 Lei de Boyle: 𝑉 𝛼 𝑃 Lei de Charles: 𝑉 𝛼 𝑇 Princípio de Avogadro: 𝑉 𝛼 𝑛 Pela combinação das três proporcionalidades, 1 𝑇 𝑃 𝑇, onde R é uma constante de proporcionalidade que vale 0,082 litros atm/Kelvin 𝑉𝛼 1 Ou seja: 𝑉 𝑅 𝑃 mol. Esta igualdade é escrita na forma PV = nRT e é conhecida como lei do gás ideal ou lei do gás perfeito. Mistura de gases: Lei de Dalton ou Lei das pressões parciais, que os gases exerceriam se cada um estivesse sozinho no recipiente. Ptotal = Pa + Pb + Pc + … Volume molar nas CNTP (condições normais de temperatura e pressão; 273,15 K e 1 atm). O volume ocupado por um mol, ou volume molar de um gás ideal nas CNTP é: 𝑉= 𝑛𝑅𝑇 𝑃 (1,00 𝑚𝑜𝑙)(0,082057 𝑙𝑖𝑡𝑟𝑜𝑠 𝑎𝑡𝑚 𝐾 −1 𝑚𝑜𝑙 −1 )(2,7315 𝐾) 𝑉= 1,00 𝑎𝑡𝑚 𝑉 = 22,4 𝑙𝑖𝑡𝑟𝑜𝑠 Um mol de gás ideal ocupa 22,4 litros nas CNTP. Gases coletados sobre água: É comum no laboratório coletar um gás pelo deslocamento da água. Nesta experiência o gás butano é coletado pelo deslocamento da água. Quando o nível da água dentro da proveta que coleta o gás é o mesmo que o nível do lado de fora, a pressão total (Ptotal) é igual à pressão atmosférica (Patm). Ptotal = Patm Medindo-se a temperatura da água, a pressão de vapor d'água, Págua, pode ser obtida e assim Pbutano pode ser calculada por subtração. Pbutano = Patm – Págua Ebulição: A tendência das moléculas escaparem da fase líquida para a gasosa é medida pela pressão de vapor. Quando se eleva a temperatura de um líquido, tal tendência aumenta até o ponto em que ocorre a ebulição. A ebulição consiste na formação de bolhas de vapor (gás) no meio líquido. Estas bolhas podem se formar quando a pressão de vapor torna-se igual à pressão exercida sobre o líquido. Lei de Graham de difusão e efusão: Difusão é o termo dado à passagem de uma substância através de outro meio. Efusão de um gás é sua passagem através de uma abertura de um buraco de agulha ou orifício. As duas leis em um só enunciado dizem: “A velocidade de difusão e efusão de um gás são inversamente proporcionais a raiz quadrada de sua densidade ou de seu peso molecular”. As leis de Graham fornecem outro modo para determinar pesos moleculares por medidas experimentais. 𝑉𝐴 𝑑𝐵 = √ 𝑉𝐵 𝑑𝐴 ou 𝑉𝐴 𝑀𝐵 = √ 𝑉𝐵 𝑀𝐴 3. MATERIAIS Balança Seringa Béquer Termômetro Tubo de borracha Isqueiro Bacia Proveta 4. PROCEDIMENTO A. Determinação da massa molecular de um gás: Uma proveta de 100 mL é preenchida com água e invertida numa bacia também com água. (figura) Uma das extremidades do tubo de borracha é colocada no interior da proveta e a outra extremidade é conectada a um isqueiro de gás (tipo bic). Quando a válvula do isqueiro é aberta pressionando o botão, o gás butano é liberado, deslocando a água do interior da proveta. Obs: Verifique se as janelas do laboratório estão abertas. Proceda da seguinte forma: 1. Pese o isqueiro com precisão de 0,01 g, utilizando a balança semi-analítica. Anote o peso na folha de dados. 2. Conecte o tubo de borracha na saída de gás do isqueiro. 3. Mergulhe a proveta dentro da bacia com água até 2/3 do seu volume, e inverta-a de modo a ficar completamente cheia de água. Esteja certo que a proveta não contém bolhas de ar. 4. Meça a temperatura da água e anote. 5. Enquanto um colega segura a proveta o outro coloca a extremidade da mangueirinha dentro da proveta, e segurando o isqueiro aperte o gatilho lentamente de modo a liberar o gás. Incline a proveta um pouco para não estrangular a mangueirinha. 6. Colete gás suficiente para deslocar aproximadamente 90 mL de água e feche o registro do isqueiro. Posicione a proveta de modo que o nível da água dentro e fora da mesma seja igual. Deste modo a pressão interna e externa será igual (figura). pbutano + págua 7. Leia o volume do gás direto na proveta. 8. Remova o tubo do isqueiro e pese-o novamente. Caso o isqueiro esteja patm Entrada do gás molhado, use uma toalha de papel para secá-lo. 9. Calcule a massa do gás pela diferença do peso do isqueiro nas duas pesagens. Note: se a conexão do tubo ao isqueiro vazar, seus resultados estarão errados. Libere o gás lentamente de modo a não congelar a saída do isqueiro. Figura 1. Esquema de coleta de gás sobre água B. O efeito da pressão no ponto de ebulição. Uma seringa é preenchida pela metade com água a uma temperatura de aproximadamente 80ºC. O bico da seringa é vedado. Quando o êmbolo é puxado um pouco, a pressão diminui, e a água entra em ebulição naquela temperatura. Proceda da seguinte forma: 1. A água é aquecida em uma chapa elétrica a ± 80 ºC. 2. Usando uma seringa plástica de 50 mL, sugue ± 10 mL de água quente. Devolva a água para o béquer e repita a operação de modo a aquecer a seringa. 3. Segure a seringa com o bico para cima e remova todo o gás do seu interior (figura). 4. Conecte um pequeno pedaço de tubo de borracha na extremidade da seringa e aperte com os dedos de modo a impedir a entrada de ar. Conserve o bico da seringa para baixo e puxe suavemente o êmbolo da seringa. 5. À medida que o êmbolo é puxado para fora, a pressão no interior da seringa diminui e a água entra em ebulição. Notas: 1. Não puxe o êmbolo com muita força. Faça-o devagar e com cuidado. 2. Segure sempre a seringa com o bico para baixo quando puxar o êmbolo. 3. Quando terminar, seque o seu local de trabalho e deixe o material organizado. 5. PRÉ-LABORATÓRIO 1. Por que é importante secar bem o isqueiro antes de pesá-lo novamente? 2. Na etapa 6, por que o nível da água dentro e fora da proveta devem ser os mesmos quando for ler o volume do gás? 3. Suponha de 10,0 litros de hidrogênio na CNTP (condições normais de temperatura e pressão; P = 1,00 atm, T = 273,15 K) são comprimidos a um volume de 1,88 litros a temperatura constante. Qual é a pressão final? 4. Uma amostra de dióxido de carbono ocupa um volume de 34,0 litros a 28,0ºC e 946 mmHg. Qual é o volume que o gás ocuparia nas CNTP? 5. Suponha que 5,00 g de gás oxigênio a 35ºC são encerradas em um recipiente com a capacidade de 6,00 litros. Considerando o comportamento do gás ideal, calcule a pressão do oxigênio em mmHg. Peso atômico: O = 16,0g/mol; O2 = 32g/mol. 6. Suponha que 0,500 g de gás oxigênio são coletadas a 30,0ºC. Calcule o volume em mililitros ocupado pelo gás se ele for coletado: a) seco, a 735 mmHg. b) sobre água a uma pressão (total) de 735 mmHg. 7. Suponha que 1,64 L de gás H2, medidos a 38ºC e 2,40 atm, são queimados em excesso de oxigênio para formar água. Quantos litros de oxigênios medidos a 38,0ºC e 1,20 atm são consumidos? 8. Por que numa panela de pressão o alimento cozinha mais rápido que em uma panela comum? 9. Qual a diferença entre difusão e efusão? Como as medidas destas propriedades podem ser usadas para obtenção de pesos moleculares dos gases? 10. Um certo gás, X, efunde através de um buraco de agulha, a velocidade de 4,73 x 10-4 mol s-1. Se o metano, CH4, efunde através do mesmo buraco de agulha sob condições comparáveis à velocidade de 1,43 x 10-3 mol s-1, qual o peso molecular de X? EXPERIÊNCIA 6 EQUIPE: DATA: TURMA: 1. Massa do isqueiro: _____________ 2. Temperatura da água: _____________ 3. Volume do gás: _____________ 4. Massa do isqueiro após a coleta do gás: _____________ 5. Pressão atmosférica: _____________ FOLHA DE DADOS EQUIPE: DATA: TURMA: 1. Massa do isqueiro: _____________ 2. Temperatura da água: _____________ 3. Volume do gás: _____________ 4. Massa do isqueiro após a coleta do gás: _____________ 5. Pressão atmosférica: _____________
Download