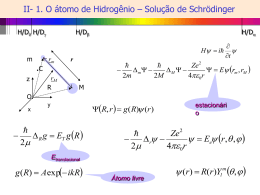
Física Atómica e Nuclear – Capítulo 7. Átomos Multilelectrónicos. 132 7.6. Acoplamento do Momento Angular. A informação dada através da distribuição electrónica no átomo não é suficiente para descrever completamente o estado do átomo, uma vez que não explica como o momento angular orbital e o momento angular de spin de cada electrão se combinam para determinar o momento angular total do átomo. Verifica-se experimentalmente que várias orbitais com a mesma configuração electrónica têm níveis de energia diferentes. Tínhamos visto anteriormente que num sistema de um electrão, combinamos momentos angulares L e S individualmente para obter um momento angular resultante J . Existe um acoplamento semelhante entre os momentos angulares dos diferentes electrões de um mesmo átomo. No cálculo do momento angular total de um átomo é necessário considerar somente o momento angular dos electrões de valência, nomeadamente àqueles electrões nas camadas incompletas, porque o momento angular total de uma camada completa é zero. Os momentos angulares dos electrões de valência vão combinar de acordo com regras específicas da mecânica quântica, a fim de determinar o momento angular total. O modelo vectorial, servirá para definir a composição do momento angular. Existirá dois casos limites de acoplamento do momento angular: o acoplamento LS ou acoplamento de Russel-Sunders e o acoplamento jj. 7.6.1 Acoplamento LS (ou acoplamento de Russel-Sunders) Se a interacção Si Li entre o momento angular orbital e de spin de electrões individuais i, forem menores do que as interacções mútuas do momento angular orbital e de spin, de diferentes electrões, como os acoplamentos do tipo Li L j ou Si S j , os momentos angulares orbitais Li , farão uma combinação vectorial a fim de obter o momento angular orbital total L , e os momentos angulares de spin S i se combinarão para obter um momento angular de spin total, S . O acoplamento L e S formará o momento angular total. Para um sistema de dois electrões, como é o caso do hélio, o comportamento resultante é apresentado na Figura 7.13. Figura 7.13. Momento angular orbital total L , que corresponde a soma do momento angular orbital de dois electrões, L1 e L2 . Notas de Aula 2004/05 Ana Rodrigues Física Atómica e Nuclear – Capítulo 7. Átomos Multilelectrónicos. 133 O momento angular orbital total do átomo L , é a soma do momento angular orbital dos dois electrões: L L1 L2 (7.36) L l l 1 (7.37) O valor absoluto de L , corresponde a: onde os valores possíveis de L são: l l1 l2 , l1 l2 1...l1 l2 para l1 l2 (7.38) O número quântico l determina as características do nível: l 0,1,2... indicam os níveis S , P, D... (7.39) Aqui, l=1, corresponde ao nível P, mas não significa necessariamente que a configuração de um dos electrões esteja individualmente num estado p. As transições ópticas obedecem as seguintes regras de selecção: l 1 para um só electrão l 0,1 para o sistema total. (7.40) l 0 , significa que os estados quânticos dos dois electrões variam simultaneamente, e em direcções opostas, o que só é possível quando o acoplamento é forte, como é o caso dos átomos pesados. O spin total é: S S1 S 2 com S ss 1 (7.41) O número quântico de spin total s pode ter os dois valores: s 1/ 2 1/ 2 s 1/ 2 1/ 2 , ou s=0 , porque s s1 s2 , s1 s2 s=1 (7.42) (7.43) A regra de selecção para a radiação de dipolo óptico é s 0 . Isto significa que a combinação entre estados com spins totais diferentes não são permitidos. Notas de Aula 2004/05 Ana Rodrigues Física Atómica e Nuclear – Capítulo 7. Átomos Multilelectrónicos. 134 Finalmente a interacção entre S (ou seu momento magnético associado s ), e o campo magnético interno Bl , que está relacionado com o momento angular orbital total L , resulta que o acoplamento do momento angular L e S corresponderá a um momento angular total J : J LS , com J j j 1 (7.44) O número quântico j pode ter os seguintes valores: para s=0, para s=1, j=l, nível singleto j l 1, l , l 1 e neste caso todos os níveis são tripletos (7.45) No caso geral de um sistema de muitos electrões, vão existir 2s+1 orientações possíveis de s, em relação a l, ou seja a multiplicidade de níveis é 2s+1 (se s<l). A Figura 7.14 mostra os possíveis acoplamentos no caso de s=1 e l=2. Figura 7.14. Combinação do momento angular de spin S e orbital para o momento angular total J A notação completa para os níveis de energia ou os estados de energia dos átomos, e que já tínhamos utilizado anteriormente para átomos de um electrão é: n 2 s 1 L j , onde n é o número quântico principal do electrão mais excitado, e que é chamado electrão de valência. 2s+1 é a multiplicidade. Para um sistema de muitos electrões teremos para: Dois electrões: Três electrões: Quatro electrões: Cinco electrões: s=0, singleto e s=1, tripleto s=1/2, dubleto e s=3/2, quarteto s=0, singleto, s=1, tripleto e s=2, quinteto s=1/2, dubleto, s=3/2, quarteto, s=5/2, sexteto etc. De acordo com estas regras de acoplamento do momento angular, todos os estados atómicos possíveis podem ser facilmente determinados a partir das suas configurações. Notas de Aula 2004/05 Ana Rodrigues Física Atómica e Nuclear – Capítulo 7. Átomos Multilelectrónicos. 135 7.6.2 Acoplamento jj O segundo caso limite de acoplamento do momento angular orbital e de spin do electrão é o chamado de acoplamento jj, que ocorre somente nos átomos mais pesados, porque neste caso o acoplamento spin-órbita para cada electrão individualmente aumenta rapidamente com a carga nuclear Z. No acoplamento jj, a interacção spin-órbita Li .S i de um electrão é maior que as interacções Li .L j e S i .S j entre diferentes electrões. Este tipo de acoplamento é apresentado na Figura 7.15b. Para comparar, o acoplamento LS é mostrado na Figura 7.15a. No acoplamento jj, o momento angular de cada electrão acopla de acordo com: L1 S1 J1 e L2 S2 J 2 (7.46) Assim, o momento angular total é: J J1 J 2 e J (7.47) j j 1 Figura 7.15. Temos dois tipos de acoplamento: a) LS e b) jj. Nesse tipo de acoplamento o número quântico j vem de uma generalização do modelo vectorial da mecânica quântica. O momento angular orbital L resultante não é definido, por isso neste caso não podemos utilizar a notação S, P, D, etc. Utilizaremos a notação: j1, j2 etc., onde os j correspondem aos número quânticos do momento angular de cada um dos electrões. O número de estados possíveis e os valores de j são os mesmos obtidos no acoplamento LS. O acoplamento puramente jj é encontrado somente em átomos muito pesados. Em muitos casos existem formas intermediárias de acoplamento, e assim, a intercombinação Notas de Aula 2004/05 Ana Rodrigues Física Atómica e Nuclear – Capítulo 7. Átomos Multilelectrónicos. 136 entre níveis de diferentes multiplicidades não são esquecidas. É o chamado acoplamento intermediário. 7.6.3 Momentos Magnéticos de Átomos Multielectrónicos Já calculamos o momento angular total em átomos multielectrónicos, e agora precisamos calcular momento magnético total para esses átomos. O tratamento é exactamente o mesmo que foi feito anteriormente para os átomos de um só electrão. No caso do acoplamento LS o momento magnético total corresponde à: l s j (7.48) O momento magnético l é anti-paralelo a L , e s é anti-paralelo a S , mas j não é anti- paralelo a J , porque os factores g do magnetismo orbital e de spin, são diferentes; temos então que j , precessa em torno de J . Teremos então para a componente na direcção de J , que é anti-paralela a J , j j que: j j j j 1 B (7.49) j j 1 l l 1 ss 1 2 j j 1 (7.50) gj com o factor de Landé: g j 1 Na direcção z, será possível somente orientações quantizadas e são descritos por valores inteiros ou semi-inteiros, do número quântico mj, dependendo do valor de j . j j m j g j B (7.51) com mj=j,j-1,...-j. Na presença do campo magnético, podemos determinar os números quânticos magnéticos dos estados para medir o desdobramento das linhas espectrais. As mesmas considerações que foram discutidas anteriormente para os átomos de um electrão num campo magnético são válidas para os átomos multielectrónicos. Aqui também os efeitos Zeeman o efeito Paschen-Back também são importantes. O acoplamento LS pode ser destruído num campo magnético suficientemente forte, enquanto o acoplamento jj, precisa de um campo magnético muito forte para que seja destruído. Notas de Aula 2004/05 Ana Rodrigues
Download