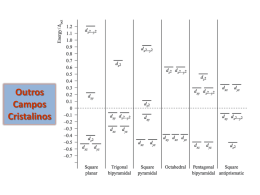
CQ133 – Química Inorgânica Fundamental Curso: Licenciatura em Química – CQ133 a Prof Giovana Gioppo Nunes 1 Semestre de 2015 1a Lista de Exercícios: Compostos de coordenação 1. De a configuração eletrônica de cada um dos íons a seguir: (a) Cr3+ (b) Ni2+ (c) V2+ (d) Cu+ (e) Cu2+ (f) Mn0 (g) Mn2+ (h) Mn3+ + 5+ 4+ 2+ 2+ 3+ 4+ (i) Au (j) V (k) Mo (l) Ru (m) Pd (n) Nb (o) Zr (p) Y3+ 2. Identifique um íon da primeira série de transição que seja isoeletrônico a cada um dos seguintes íons: (a) Fe3+ (c) Fe2+ (b) Zn2+ (d) Cr3+ 3. Explique o que é o fenômeno conhecido como contração dos lantanídeos; 4. As equações a seguir representam varias formas de se obter metais a partir de seus compostos. Balanceie cada equação. (a) Cr203(S) + Al(s) AI203(s) + Cr(s) (b) TiCI4(l) + Mg(s) Ti(s) + MgCI2(s) (c) [Ag(CN)2]-(aq) + Zn(s) Ag(s) + [Zn(CN)4]2-(aq) (d) Mn304(S) + Al(s) Mn(s) + AI203(s) 5. Quais dos seguintes ligantes você espera que sejam monodentados e quais podem ser polidentados? (a) CH3NH2 (b) CH3CN (c) N3(d) en (e) Br(f) phen (g) py CO326. De o número de oxidação do metal em cada um dos compostos a seguir: (a) [Mn(NH3)6]S04 (b) K3[Co(CN)6] (c) [Co(NH3)4Cl2]Cl (d) Cr(en)2Cl2 7. Para os íons complexos abaixo identifique os ligantes e suas cargas, a carga e o NC do íon central e o contra-íon. Desenhe as estruturas dos complexos. a) K2[Ni(CN)4] quadrática plana b) K[Cr(C2O4)2(H2O)2] c) [Pd(gly)2] quadrática plana (gly = glicina) d) [W(CO)2(py)2] tetraédrica e) [IrCl(CO)(PPh3)2] quadrática plana f) [Ni(NH3)2(en)2]SO4 g) [FeCl2(bipy)2]Cl h) Na[Fe(acac)3] 8. Dê a fórmula de um complexo construído a partir do íon Ni2+, um ligante etilenodiamina, três moléculas amônia e uma molécula de água. Esse complexo e neutro ou possui carga? Se apresentar carga, determinea. 9. O sólido de fórmula CoCl3·5NH3·H2O é rosa. Quando uma solução deste sólido é titulada com uma solução aquosa de AgNO3 são formados 3 mols de AgCl. Quando o sólido rosa é aquecido, 1 mol de H2O é perdido, formando-se um sólido púrpura. O sólido púrpura produz 2 mols de AgCl quando tratado com solução de AgNO3. Deduza a estrutura dos dois complexos octaédricos de cobalto e escreva seus nomes corretamente. 10. Desenhe todos os isômeros geométricos possíveis de: (a) [Co(NH3)3(N02)3 (N02 liga-se a Co3+ por meio de N) (b) Fe(NH3)4CI2 (c) fac-[Co(en)(H2O)Cl3 (d) Pt(NH3)2(SCN)(Br) (SCN- liga-se a Pt2+ por meio de S) (e) Fe(fen)32+ (f) trans-[Co(ox)2Br2] (g) Pt(NH3)(H20)(Cl)(N02) quadrática plana (h) Co(en)Cl4 (i) [Cu(H2NCH2C02)2(H2O)2] 11. A dietilenotrisamina é capaz de atuar como ligante tridentado: Desenhe a (a) estrutura do composto fac-Cr(dien)Cl3 e mer-Cr(dien)Cl3 (b) Existem dois isômeros geométricos possíveis para a mer-Cr(dien)Cl2Br. Desenhe a estrutura de ambos. (c) Existem três isômeros geométricos possíveis para [Cr(dien)2]3+. Dois possuem o ligante dien em configuração fac e um possui o ligante com a configurarção mer. Desenhe a estrutura de cada isômero. CQ133 – Química Inorgânica Fundamental Curso: Licenciatura em Química – CQ133 a Prof Giovana Gioppo Nunes 1 Semestre de 2015 a 2 Lista de Exercícios: Compostos de coordenação 1. As condutâncias molares são úteis na determinação dos tipos de eletrólitos presentes em solução. Por exemplo, as condutâncias molares (em mhocm2mol-1) dos complexos [Pt(NH3)6]Cl4, [Pt(NH3)5Cl]Cl3, [Pt(NH3)4Cl2]Cl2, [Pt(NH3)3Cl3]Cl e [Pt(NH3)2Cl4] são 523, 404, 228, 97 e zero, respectivamente. Sabendo-se que os complexos CrCl35H2O e PtCl42KCl apresentam condutividades molares ao redor de 250 mhocm2mol-1, quais seriam as estruturas possíveis para estes compostos? 2. Escreva a fórmula estrutural de cada isômero possível para [Co(NH3)2Cl2(en)]+ (onde en = etilenodiamina). 3. Qual o significado dos termos: (a) esteroisômeos, (b) enatiômeros, (c) diasteroisômeros, (d) assimetria, (e) quiralidade. 4. Quais das configurações do CH3-CH3 tem um eixo S6, a eclipsada ou a estrelada? 5. Identifique os eixos C3 na molécula de NH4+. Quantos destes eixos há no íon? 6. Identifique os seguintes elementos de simetria a) Eixo C3 e v na molécula de NH3. b) Eixo C4 e h na molécula de [PtCl4]2- plano quadrática 7. Liste todos os elementos de simetria que podem ser encontrados em uma folha de papel (a) em formato de triângulo equilátero. (b) em formato quadrado com uma face azul e outra vermelha. 8. Liste todos os elementos de simetria que podem ser encontrados em (a) CH3Cl, (b) trans[Co(en)2Cl2]+, (c) [Ni(CN)5]3- (geometria de pirâmide de base quadrada 9. Quais das seguintes moléculas e íons tem (i) centro de inversão; (ii) eixo de rotação imprória Sn a) CO2 b) C2H2 c) BF3 d) SO423+ d) [Co(CN)6] e) BrF4- (plano quadrático) f) [Co(en)2Cl2] g) [CuCl5]3- bipirâmide trigonal 10. Escreva a fórmula estrutural de cada isômero possível e liste todos os elementos de simetria que podem ser encontrados em (a)[RuCl2(NH3)4] , (b) [CoCl3(OH2)]-, (c) [CoCl2(en)(NH3)2]+ 11. Prediga todos os isômeros possíveis para o complexo [Co(NH3)2Cl2(py)2]+ onde py = piridina. Quais apresentam fórmulas enantioméricas? 12. Determine o grupo de ponto dos seguintes complexos: (a) cis-[Ru(NH3)4Cl2] octaedro (e) trans-[Ru(NH3)4Cl2] octaedro (b) cis-[Ru(NH3)4Cl2] quadrático plano (f) trans-[Ru(NH3)4Cl2] quadrático plano (c) [Co(Cl)3(OH2)]- tetraedro (g) [Cr(ox)3]3- octaedro (d) fac-[Co(NO2)3trien] octaedro (h) [Pt(Cl)4]2- CQ133 – Química Inorgânica Fundamental Curso: Licenciatura em Química – CQ133 a Prof Giovana Gioppo Nunes 1 Semestre de 2015 3a Lista de Exercícios: Compostos de coordenação 1. Determine a configuração eletrônica (na forma t2gmegn ou emt2n), calcule a EECC (em múltiplos de Δo, o caráter diamagnético ou paramagnético, calcule o momento magnético efetivo dos para cada um dos seguintes complexos: a) [Co(NH3)6]3+; b) [Fe(CN)6]3-; c) [Cr(NH3)6]3+; d) [W(CO)6)]. 2. Compare as energias de estabilização de campo cristalino (EECC) para complexos octaédricos bivalentes d0 até d10, para situações de campo forte ou fraco. 3. 1. Determine se os seguintes complexos tem um centro quiral: (a) [Fe(en)3]2+ ; (b) trans-[Co(en)Br2]; (c) fac-[Co(en)(H20)Cl3]; (d) quadrado planar Pt(NH3)(H20)(Cl)(N02) 4. O complexo [Mn(H2O)6]2+ possui cinco elétrons desemparelhados, enquanto [Mn(CN)6]4- possui apenas um. Usando o modelo do campo cristalino, represente a configuração eletrônica de cada íon. Usando o modelo do campo cristalino, represente a configuração eletrônica de cada íon. O que você pode concluir sobre o efeito dos ligantes diferentes sobre o Δo? 5. Explique o que é o efeito quelato e quais são os fatores que interferem na estabilidade dos compostos de coordenação contendo quelantes? 6. Como varia o parâmetro de desdobramento de campo cristalino (Dq) (a) ao longo de um período, (b) em função do estado de oxidação de um metal e (c) de um período para o outro? 7. Para o complexo [Cr(CN)6]4-, medidas espectroscópicas mostram que o é 380 kJ mol-1. A energia de pareamento, P, para o Cr2+ é 245 kJ mol-1. Calcule a energia de estabilização do campo cristalino (EECC) para um complexo de [Cr(CN)6]4- de spin alto e de spin baixo e diga qual das duas configurações eletrônicas deveria ser adotada. 8. O complexo [CoF6]3- é paramagnético (spin alto), ao passo que o complexo [Co(H2O)6]3+ é diamagnético. Com base na série espectroquímica, o que se pode concluir a respeito do caráter magnético dos complexos [Co(NO2)6]3-, [Co(CN)6]3- e [Co(NH3)6]3+. 9. Na corrente sanguínea existem traços de íons metálicos complexados por aminoácidos ou por pequenos peptídeos. O ânion do aminoácido glicina H2NCH2COO- simbolizado por gly, é um ligante bidentado que pode se ligar por um dos oxigênios (-O-) do grupo acetila ou pelo nitrogênio. Quantos isômeros são possíveis para (a) [Zn(gly)2] tetraaédrico, (b) [Co(gly)3] octaédrico. Utilize a notação (ON) para simplificar suas representações. 10. Mostre, por meio de um diagrama, as variações nas energias dos orbitais d produzidas por um campo octaédrico, tetraédrico e quadrado planar. 11. Como varia o parâmetro de desdobramento de campo cristalino (Dq) (a) ao longo de um período, (b) em função do estado de oxidação de um metal e (c) de um período para o outro? 12. Quais as geometrias possíveis de serem adotadas por complexos de níquel(II) com número de coordenação 4? Utilizando os conceitos da TCC mostre por meio de diagramas a ocupação dos elétrons d do níquel(II) em cada caso? 13. O complexo [CoF6]3- é paramagnético (spin alto), ao passo que o complexo [Co(H2O)6]3+ é diamagnético. Com base na série espectroquímica, o que se pode concluir a respeito do caráter magnético dos complexos [Co(NO2)6]3-, [Co(CN)6]3- e [Co(NH3)6]3+. 14. O que é distorção tetragonal e efeito Janh Teller. 15. Diga se há distorção de Jahn Teller no complexo [Cr(OH2)6]2+? Desenhe o diagrama de energia que descreve a estrutura eletrônica dos orbitais d neste complexo? 16. Soluções dos complexos [Co(NH3)6]2+, [Co(H2O)6]2+ (ambos octaédricos) e [CoCl4]2- (tetraédrico) são coloridas. Uma é rosa, outra amarela e a terceira é azul. Com o auxílio da série espectroquímica e dos valores de Δo e Δtd, faça a atribuição das cores de cada íon complexo. 17. O íon complexo trans-[Co(NH3)4Cl2]+ absorve a luz na região vermelha do espectro (a) absorção mais intensa é a 680 nm). (a) Que cor terá o complexo? (b) Justifique sua resposta. (c) Desenhe a estrutura do complexo e escreva o seu nome. 18. Um complexo de metal de transição absorve luz de 425 nm. Qual é sua cor? (vermelho, amarelo, verde ou azul). 19. Qual entre os seguintes complexos do Ti3+, tem a absorção no menor comprimento de onda do espectro visível: (a) [Ti(OH2)6]3+, (b) [Ti(en)3]3+, (c) [Ti(Cl)6]320. Dois complexos (a) [CoF6]3- e (b) [Co(en)3]3+, um é amarelo e o outro é azul. Identifique o complexo com a cor e explique sua escolha. 21. Sugira a razão pela qual os íons Zn2+(aq) são incolores? Você espera que complexos contendo este metal sejam paramagnéticos? 22. Quais dos seguintes complexos deverão apresentar cor? Justifique sua resposta utilizando a TCC: (a) [Fe(SO4)(H2O)4], (b) [Ti(Cl)4] e (c) [V(OH2)6]2+ CQ133 – Química Inorgânica Fundamental a Curso: Licenciatura em Química – CQ133 Prof Giovana Gioppo Nunes 1 Semestre de 2015 4a Lista de Exercícios: Compostos de coordenação 1. [Cr(NH3)6]Cl2 possui um momento magnético efetivo de, µeff = 4,85 µB. Preveja se o complexo é de spin alto ou baixo. 2. Que mudança no campo magnético pode ser esperada quando ligantes NO2- em um complexo octaédrico do tipo FeL6 são substituídos por Cl-. Calcule o momento magnético efetivo dos dois complexos. 3. Compare as propriedades magnéticas de [Ni(en)3]2+ com [Ni(H2O)6]2+. 4. Os complexos de níquel(II) tetracoordenados exibem geometrias tanto tetraédricas quanto quadrado planar. Os complexos tetraédricos como [Ni(Cl4)]2-, são paramagnéticos; os complexos quadrado planar [Ni(CN)4]2-, são diamagnéticos. Desenhe os diagramas de energia que descrevem a estrutura eletrônica destes complexos. 5. Discuta as estruturas prováveis, incluindo diagramas de campo cristalino, dos complexos [NiCl4]2paramagnético e [PtCl4]2- diamagnético? A seguir calcule o momento magnético efetivo de cada complexo. 6. Interprete os valores de energia reticular (em kJ mol-1) dos seguintes óxidos; CaO (3460); TiO (3878); VO (3913); MnO(3810); FeO 3921; CoO(3988); NiO(4071). 7. Discuta a estrutura provável dos espinélios MnCr2O4, NiAl2O4, MgFe2O4, Fe3O4. 8. Quais dos seguintes íons octaédricos, de campo fraco, serão afetados pela distorção de Jahn-Teller? Ti3+, V2+, Mn3+, Fe2+, Ni2+, Cr3+, Cu2+ e Zn2+? 9. O complexo de [Cr(OH2)6]2+ possui um momento magnético efetivo = xxx µB enquanto que o complexo [Cr(OH2)6]3+ possui um momento magnético efetivo = xxx µB. Discuta as estruturas prováveis. 10. O que são bandas de transfer~encia de carga e como elas podem ser diferenciadas de uma transição de campo ligante (d-d). 11. Explique porque a cor púrpura do íon permanganato não pode ser atribuída a uma transição de camplo ligante (d-d). 12. Um complexo aproximadamente octaédrico de cobalto(III) com amônia e cloreto apresenta duas bandas com máx = 2 x 104 mol-1 L-1 cm-1. Explique o porquê das diferenças nos valores de máx. 13. O que são complexos de valência mista. Procure um exemplo na literatura e discuta-o. 14. As reações de formações sucessivas de complexos de níquel com amônia [Ni(OH2)5(NH3)]2+ a [Ni(NH3)6]2+ possuem os seguintes valores de constantes de equilíbrios: log K1 = 2,72; log de K2 = 2,17; log de K3 = 1,66; log de K4 = 1,12; log de K5 = 0,67; log de K6 = 0,03. (a) Escreva as equações químicas representando as reações correspondentes a cada constante Kn. (b) Calcule os valores de K1 a K6. (c) Escreva as equações químicas representando as reações correspondentes a cada constante de equilíbrio global n. (d) Explique porque ocorre uma variação nos valores das constantes de equilíbrio na seguinte ordem: K1 > K2 > K3 > K4 > K5 > K6? 15. Descreva a classificação de ácidos e bases feita por Lewis. O que as eletronegatividades sugerem sobre a natureza da ligação química entre: (a) Um ácido duro e uma base dura (b) Um ácido macio e uma base macia 16. Identifique os ácidos e as bases de Lewis nas seguintes reações: (a) AsF5 + F- → AsF6- (b) [Cu(OH2)6]2+ + 6 NH3 → [Cu(NH3)6]2+ + 6 H2O 17. Em cada um dos seguintes compostos, classifique o íon metálico e os ligantes como duro, macio ou intermediário: (a) [HgCl2]; (b) [Hg(CH3)2]; (c) (NH4)2[Pd(-SCN)4]; 18. Nas reações abaixo prediga se os reagentes ou os produtos serão favorecidos (justifique sua resposta). Escreva as expressões de equilíbrio químico e prediga se a constante de equilíbrio será maior ou menor do que 1. (a) AsS5 + 5 HgO → As2O5 + 5 HgS (b) 3 FeO + Fe2S3 → Fe2O3 + 3 FeS 19. Cite pelo menos dois exemplos (diferentes dos apresentados em aula) de: (a) reações de deslocamento; (b) reações de adição; (c) Reações de metátese. 20. Identifique quais dos minerais são comumente obtidos: (a) (PtAs2 ou PtSiO4) (b) (ThS2 ou ThO2) 21. Estudantes em um laboratório de química inorgânica descobriram alguns elementos novos, com os seguintes símbolos e propriedades. mn Símbolo Fl Mq Mr Az Za Mm Eletronegatividade 2,22 1,33 2,08 2,60 3,33 1,91 Íon formado Fl2Mq3+ Mr+ Az2Za2Mm2+ Raio iônico (pm) 188 62 125 155 117 103
Baixar