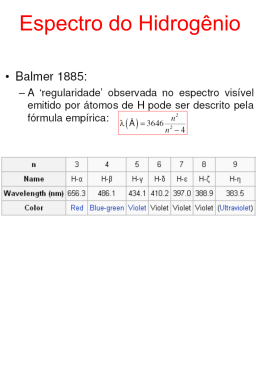
Física 12º ano A trilogia de Bohr: 100 anos do modelo atómico núcleo - eletrão Trabalho realizado por: Igor Balan 12Ct2 João Sabarigo 12ºCt2 Maria Mexia 12ºCt2 Marina Correia 12ºCt2 NIELS BOHR • 1885 – Nasceu a 7 de outubro, em Copenhaga; • 1908 – Condecorado pela Academia de Ciências - Investigação teórica e experimental sobre a tensão da superfície provocada pela oscilação de jatos fluidos; • 1913 – “Philosophical Magazine” – Trilogia De Bohr; • 1914 a 1916 – Professor de Física Teórica – na Universidade de Victoria, em Manchester; NIELS BOHR • 1920 – Diretor do Instituto de Física Teórica • 1922 – Prémio Nobel da Física investigações sobre a estrutura atómica à luz da Mecânica Quântica • 1950 – “Carta Aberta” às Nações Unidas • 1957 – Prémio Átomos Para a Paz - luta em defesa da preservação da paz • 1962 – Faleceu a 19 de novembro, em Copenhaga Período Histórico em que se insere 1897 1900 h 1905 1911 1913 Bases do seu trabalho Bases do seu trabalho Modelo de Rutherford Constante de Planck h Modelo de Rutherford Modelo de Rutherford Ernest Rutherford (1871-1937) Experiência de Rutherford Electrões Núcleo Partículas Alfa Conclusões de Rutherford Existência de uma parte maciça carregada positivamente, o núcleo, rodeado pelos electrões, ligados pelas forças atractivas; neutrão protão Conclusões de Rutherford Dimensões lineares do núcleo muito pequenas em comparação com as dimensões lineares do átomo total; < Conclusões de Rutherford Hipótese de o núcleo conter a parte essencial da massa do átomo; ≈ m m Bohr e o modelo de Rutherford “Deve atribuir-se um grande interesse a este modelo atómico;” “a hipótese da existência de núcleos, como os considerados, parece ser necessária para dar conta dos resultados das experiências sobre os ângulos de dispersão muito grandes dos raios alfa.” Problemas não resolvidos pelo modelo de Rutherford Utilização do modelo de Rutherford para a explicação de propriedades da matéria Dificuldades derivadas da aparente instabilidade dos átomos Problemas não resolvidos pelo modelo de Rutherford O electrão perderia energia e acabaria por cair no núcleo. Radiação electromagnética Radiação electromagnética Constante de Planck h "Para os crentes Deus está no princípio das coisas. Para os cientistas no final de toda a reflexão. " Constante de Planck James Clerk Maxwell (1831-1879) E ∝ |amplitude|² E = hν frequência Constante de Planck h Constante de Planck = Max Karl Ernst Ludwig Planck h 2π Trabalho de Bohr “O oposto de uma verdade é mentira, mas o oposto de uma verdade profunda pode muito bem ser outra verdade profunda.” Raio das órbitas Momento linear Vector posição Momento angular Raio das órbitas L=n = n = h 2π Raio das órbitas Constante de Planck reduzida Nº natural Nº atómico -10mdo a0 = 0,53 x 10Carga a eletrão Massa do eletrão Energia das órbitas • 1 eV = 1,602 177 33 (49) x 10-19 J; • Energias negativas devido ao facto de o eletrão estar num estado de ligação com o protão. Modelo Atómico de Bohr • O eletrão gira à volta do núcleo em órbitas circulares. • O raio das órbitas não é aleatório, isto é, não pode tomar um valor qualquer mas sim um valor múltiplo do quadrado de um número inteiro n, ou seja, é quantificado; a energia do eletrão não pode ter um valor qualquer e também é quantificada; Modelo Atómico de Bohr • Enquanto o eletrão percorre determinada órbita, não absorve nem emite energia; Modelo Atómico de Bohr • Quando o átomo absorve energia (há excitação) o eletrão passa para um estado estacionário de energia superior; • Quando o átomo emite energia (há desexcitação) o eletrão passa para um nível de energia inferior. Trilogia de Niels Bohr • A trilogia foi publicada em Philosophical Magazine; • Este trabalho foi o marco da “antiga” teoria quântica; • O modelo de Bohr foi bem sucedido no ponto de vista empírico. Trilogia de Niels Bohr • “Sobre a constituição de átomos e moléculas” está dividida em três partes. • Parte I – “Ligação de eletrões por núcleos positivos”- explica-nos o átomo de Bohr. • Parte II – “Sistemas que contêm um só núcleo”- explora átomos polieletrónicos e antecipa o conceito de carga atómica efetiva. • Parte III – “Sistemas que contêm vários núcleos”- apresenta a molécula de H2 que por analogia ao átomo de Bohr deve ser denominada de molécula de Bohr. Contribuições de Bohr na evolução do modelo atómico • Consegue explicar o espectro descontínuo do átomo de hidrogénio e de “partículas hidrogenóides”(catiões mono eletrónicos), através da quantização de energia do eletrão no átomo. Limitações do modelo atómico de Bohr • Admite que os eletrões descrevem órbitas, contudo é impossível determinar, simultaneamente e com exatidão a posição e o momento linear de um eletrão; Limitações do modelo atómico de Bohr • Não consegue explicar os resultados obtidos para átomos polieletrónicos, nem o desdobramento das riscas espectrais do espetro de emissão, na presença de um campo magnético. Repercussões à teoria de Bohr • Rutherford comentou que Bohr não conseguia explicar como é que os eletrões sabiam a que frequências deviam vibrar para passarem de um estado estacionário para outro. “There appears to me one grave difficulty in your hypothesis, which I have no doubt you fully realize, namely how does an electron decide what frequency it is going to vibrate at when it passes from one stationary state to the other? It seems to me that you have to assume that the electron knows beforehand where it is going to stop.”E.RUTHERFORD Repercussões à teoria de Bohr • A 12 de Setembro de 1913, Bohr fala pela primeira vez do seu trabalho. Depois dessa conferência surgiram opiniões bastante diferentes. Repercussões à teoria de Bohr • Por um lado os estudantes da Universidade de Goettingen estavam extremamente interessados na sua pesquisa e pediram mais cópias do seu trabalho. Repercussões à teoria de Bohr • Por outro lado, uma parte dos cientistas não se atrevem sequer a acreditar que Bohr poderia estar certo, eles acharam a teoria de Bohr muito atrevida e imaginária. “Do not dare to believe that they can be objectively right; they find the assumptions too bold and fantastic.”D.HIBERT Repercussões à teoria de Bohr • A geração mais antiga de físicos não acompanhou os ideais de Bohr. Muitos não se pronunciaram, ou pronunciaram com pouco interesse, como foi o caso de Lord Rayleigh, que depois de analisar o trabalho de Bohr afirmou que este não lhe servia para nada, não o desvalorizando, pois este provavelmente iria ter um fim. “I have looked at it, but I saw it was no use to me. I do not say that discoveries may not be made in that sort of way. I think it is very likely they may be. But it does not suit me.” L.RAYLEIGH Repercussões à teoria de Bohr • J.J.Thomson apenas se pronunciou em 1936, dizendo que a teoria apenas contribuía para explicar fenómenos da espectroscopia. “They have in some departments of spectroscopy changed chaos into order, and ... were, I think, the most valuable contributions which quantum theory has ever made to physical science.” J.J.THOMSON Repercussões à teoria de Bohr • O professor Emil Warbug, que fazia parte da Sociedade de Física de Berlim comentou que a teoria de Bohr com a constante de Planck eram a chave para a compreensão do átomo. “There Bohr has had a stroke of genius , Planck's h proves to be the key for understanding the atom.” E.WARBUG Repercussões à teoria de Bohr • Einstein, quando abordado acerca da teoria de Bohr fez um balanço positivo. “This is an enormous achievement. The theory of Bohr must then be right” A.EINSTEIN Repercussões à teoria de Bohr • Mosely acreditava que mesmo se o trabalho de Bohr estivesse errado, este teve um grande efeito na descoberta do átomo. “Your theory is having a splendid effect on Physics, and I believe when we really know what an atom is, as we must within a few years, your theory even if wrong in detail will deserve much of the credit.” H. MOSELEY Repercussões à teoria de Bohr • Para Bohr, resposta ao seu trabalho foi positiva mas este tinha consciência que o seu trabalho não conseguia explicar tudo e iria ser algo provisório. “I think he always had the idea that it was makeshift and something provisional.”A.LANDÉ Conclusão O modelo atómico de Bohr foi uma etapa importante para que a Ciência tivesse um rumo a novos estudos, em busca da explicação mais coerente para o entendimento do átomo. No entanto não tem um uso especifico para o nosso dia a dia, foi apenas um modelo transitório, para que se pudesse evoluir para um novo modelo atómico, nomeadamente, o modelo da nuvem eletrónica. Agradecimentos Bibliografia Bohr, Niels Sobre a Constituição de Átomos e Moléculas, Textos Fundamentais da Física Moderna - II Volume – Portugal Fundação Calouste Gulbenkian – 2001; Pais, Abraham Niels Bohr’s times, in Physics, Philosophy and Polity, Oxford University Press – 1991.
Baixar