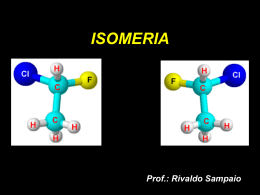
ISOMERIA Isomeria é o fenômeno em que compostos diferentes têm a mesma fórmula molecular e fórmulas estruturais diferentes. ( ISO: igual e MEROS: partes ) Os compostos (modelos ao lado) possuem fórmulas estruturais diferentes mas a mesma fórmula molecular, portanto, são isômeros. ISOMERIA (COMPOSTOS DIFERENTES, MAS COM MESMA FÓRMULA MOLECULAR) PLANA DE CADEIA DE POSIÇÃO DE FUNÇÃO ESPACIAL METAMERIA GEOMÉTRICA ÓPTICA ISOMERIA PLANA ou CONSTITUCIONAL É aquela que ocorre quando a diferença entre os isômeros pode ser explicada observando-se apenas as fórmulas estruturais planas. ISOMERIA PLANA DE CADEIA DE POSIÇÃO DE FUNÇÃO METAMERIA DE CADEIA : Também chamada isomeria de núcleo, é aquela em que os isômeros pertencem à mesma função mas têm cadeias com classificação diferentes. DE POSIÇÃO : É aquela em que os isômeros pertencem à mesma função, têm o mesmo tipo de cadeia carbônica, mas diferem quanto à posição de ligantes (grupos funcionais ou ramificações) ou de insaturações. DE FUNÇÃO : Também chamada isomeria funcional, é aquela que ocorre quando os isômeros pertencem a funções químicas diferentes. Outros exemplos... Existe um caso particular de isomeria de função em que os dois isômeros coexistem em equilíbrio dinâmico. É chamada particularmente de TAUTOMERIA. TAUTOMERIA : Os casos mais comuns de tautomeria ocorrem entre: 1. Aldeído e Enol; 2. Cetona e Enol; 3. Amida e Iminoálcool. Exemplo de tautomeria envolvendo aldeído e enol. Exemplo de tautomeria envolvendo cetona e enol. Obs.: Nos casos de tautomeria aldo-enólica e ceto-enólica é necessário que haja pelo menos um átomo de hidrogênio ligado ao carbono vizinho à carbonila. Exemplo de tautomeria envolvendo amida e iminoálcool. Obs.: a solução contendo os tautômeros é denominada mistura alelótropa. METAMERIA ou COMPENSAÇÃO : São isômeros de mesma função com cadeias carbônicas diferentes mas com a mesma classificação. e ISOMERIA ESPACIAL (estereoisomeria) É aquela que só pode ser explicada por meio de estruturas (fórmulas) espaciais. ISOMERIA ESPACIAL GEOMÉTRICA ÓPTICA ISOMERIA GEOMÉTRICA : Ocorre quando não existe livre rotação entre dois átomos de carbono: Condições necessárias: Nomenclatura cis/trans: somente para compostos dissubstituídos Isômero cis : átomos de hidrogênio de um mesmo lado. Isômero trans : átomos de hidrogênio em lados opostos. Isômeros geométricos são estereoisômeros que não são imagens especulares entre si e, portanto, podem ser denominados diastereoisômeros ou diastereômeros. Propriedades físicas e químicas dos isômeros geométricos: Isômero cis: • maior temperatura de ebulição (molécula polar); • menor ponto de fusão (menor empacotamento molecular). Isômero trans: • menor temperatura de ebulição (molécula apolar); • maior ponto de fusão (maior empacotamento molecular). Ácido maleico: (isômero cis) Maior solubilidade em água (molécula polar); Menor ponto de fusão (as ligações de hidrogênio intramoleculares diminuem o número de ligações de hidrogênio intermoleculares). Ácido fumárico: (isômero trans) Menor solubilidade em água (molécula apolar); Maior ponto de fusão (maior número de ligações de hidrogênio intermoleculares). Margarinas: hidrogenação parcial de óleos poli-insaturados; maior consistência sólida (cadeias mais lineares facilitam o empacotamento); formação da “gordura” trans (aterosclerose). Nomenclatura E/Z: (pode ser utilizada para quaisquer isômeros geométricos) Atribui-se prioridade aos ligantes dos carbonos da dupla ou do anel: a prioridade é dada ao ligante de maior número atômico. Para átomos iguais o desempate de prioridade é feito comparando-se as prioridades dos elementos ligados a cada um deles. ISOMERIA ÓPTICA : A Isomeria Óptica estuda as relações entre os compostos que possuem configuração espacial assimétrica, ou seja, as moléculas que não possuem um plano de simetria ou que possam ser divididas em duas metades rigorosamente iguais (moléculas quirais). Do grego CHEIR, que significa mão. CONDIÇÕES PARA A ATIVIDADE ÓPTICA: Assimetria Cristalina – Quando os cristais do composto estudado são assimétricos entre si. Assimetria molecular – Quando a estrutura da molécula estudada não possui plano de simetria, ou seja, a molécula não pode ser dividida em duas metades iguais. Carbono quiral na molécula – carbono sp3 que possui os 4 ligantes diferentes entre si. Uma molécula quiral não é idêntica à sua imagem especular. Perceba que a tentativa de sobrepor as moléculas de ácido lático, a fim de obter compostos iguais é frustrada. Aqui, como nas mãos, há assimetria ou “quiralidade”. CLASSES DE ISÔMEROS ÓPTICOS Enantiômeros : estereoisômeros que são imagens especulares um do outro e que não se superpõem; Diastereômeros : estereoisômeros que não são imagens especulares um do outro e que não se superpõem. Isso que dizer que existem dois tipos de ácido lático? Sim. São os denominados enantiômeros. Eles podem apresentar, além de proriedades organolépticas, comportamentos químicos e fisiológicos diferentes. EXEMPLOS : Existe um tipo de ácido lático que é produzido no leite e outro, nos músculos, quando temos câimbras. Os enantiômeros do composto abaixo possuem cheiros diferentes : ISOMERIA ÓPTICA No medicamento talidomida um dos isômeros foi bastante utilizado no combate a enjôos na gravidez e o outro, possui efeito teratogênico (pode causar deformações no feto – focomelia). LSD Um dos isômeros causa alucinações e o outro não produz nenhum efeito. ASPARTAME Um dos isômeros tem sabor doce e o outro, amargo. INTERAÇÃO DE ENANTIÔMEROS COM A LUZ POLARIZADA Esquema de um polarímetro. A luz, ao passar pela amostra, é desviada para direita ou para a esquerda. INTERAÇÃO DE ENANTIÔMEROS COM A LUZ POLARIZADA ISÔMERO DEXTRÓGIRO (d ou +) ISÔMERO LEVÓGIRO (l ou -) A mistura equimolar de um par de enantiômeros (50% dextrógiro + 50% levógiro) é denominada de mistura racêmica ou racemato. Uma mistura racêmica é opticamente inativa por compensação externa. ISOMERIA ÓPTICA COM 2 CARBONOS QUIRAIS DIFERENTES: Suponhamos que um seja responsável por um desvio α e o outro por um desvio β e convencionemos, por exemplo: A B C D CÁLCULO DO NÚMERO DE ISÔMEROS ÓPTICOS E RACÊMICOS : n = Número de carbonos assimétricos diferentes; 2n = Número de isômeros opticamente ativos(IOA); 2n-1 = Número de racêmicos (IOI) e número de pares de enantiômeros; SUBSTÂNCIAS COM CARBONOS ASSIMÉTRICOS COM LIGANTES IGUAIS : O composto irá apresentar um estereoisômero inativo denominado de meso (inativo por compensação interna); O isômero meso é um caso particular no qual a molécula possui carbonos assimétricos e plano de simetria (aquiral). Como só temos um par de enantiômeros só é possível a existência de uma mistura racêmica. O isômero meso só existe em moléculas que possuem números pares de carbonos quirais. ASSIMETRIA MOLECULAR EM COMPOSTOS CÍCLICOS : * Levar em conta os ligantes fora do anel e considerar como ligantes as sequências nos sentidos horários e anti-horário no anel. * Qual o número de carbonos quirais em cada composto abaixo? 2 Isômeros opticamente ativos: 2n = 2 = 4 Isômeros opticamente inativos: As fórmulas estruturais dos isômeros ficam: QUANDO DOIS CARBONOS DO ANEL POSSUEM OS LIGANTES IGUAIS ENTRE SI, POSSUI ASSIMETRIA MOLECULAR SOMENTE A FORMA TRANS : ISOMERIA ÓPTICA SEM CARBONO ASSIMÉTRICO (ASSIMETRIA MOLECULAR) O aleno (C3H4) é o mais simples dos alcadienos. Alguns derivados do aleno apresentam isomeria óptica por não apresentarem plano de simetria molecular. Isso ocorre quando a seguinte condição é obedecida: Os planos das ligações pi são perpendiculares entre si.
Download