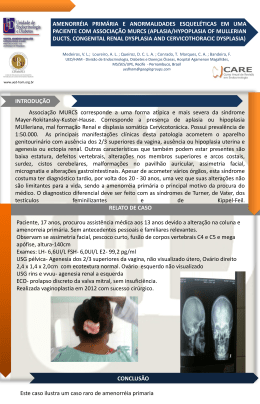
Universidade Federal do Estado do Rio de Janeiro – UNIRIO Escola de Medicina e Cirurgia – EMC Disciplina de Genética II Doença Policística Renal Filipe Teixeira Duarte (20071130122) Introdução • A doença policística renal está entre os distúrbios hereditários potencialmente fatais mais comuns do mundo • A doença renal policística autossômica dominante (DRPAD) é normalmente identificada em adultos – mais comum • A doença renal policística autossômica recessiva (DRPAR) surge já na infância Doença Autossômica Dominante Epidemiologia • Dentre as doenças policísticas, é a mais comum • Prevalência • 1:400 – 1:1000 • 600.000 pessoas nos Estados Unidos • Taxas de prevalência proporcionais em todos os grupos étnicos • 4% dos casos de doença renal terminal (DRT) nos EUA Etiologia • Dois genes são conhecidos • PKD-1 • Braço curto do cromossomo 16 • Codifica policistina-1: possui região extracelular longa e cauda intracelular curta; parece funcionar como receptor, apesar do ligante não ter sido identificado • PKD-2 • Braço longo do cromossomo 4 • Codifica policistina-2: possui um porção extracelular, um fração transmembrana e uma subunidade que funciona como um canal ao Ca+2, participando da regulação de sua concentração intracelular Etiologia • Policistina 1 e 2 estão localizadas ao longo dos segmentos do néfron - na superfície luminar das células tubulares dos cílios primários, na superfície basal dos complexos de aderência e superfície lateral das junções aderentes • Também expressas no epitélio de outros órgãos, tecido conjuntivo, músculo liso, esquelético e cardíaco - miócitos e miofibroblastos valvulares • As duas proteínas formam um complexo que pode desempenhar um papel na detecção de fluxo do fluido no túbulo renal - flexão dos cílios e ativação do ‘sensor de fluxo policistina’ - influxo de Ca+2 na célula • Além disso regulam a transcrição genética, apoptose, diferenciação e as interações entre as células adultas e a matriz extracelular Patogenia • Mutações em PKD-1 e 2 inativação dos alelos e perda da produção de policistina; por um mecanismo conforme a ‘lei dos dois eventos’ • Alteração da homeostase de Ca+2 que pode ser associada com várias alterações celulares – proliferação e apoptose desreguladas, alteração de polaridade e exacerbação das propriedades secretoras • Foram identificadas inúmeras mutações do tipo missense nos alelos • Estudos evidenciam que a proteína é fragmentada em várias partes associação do fenótipo com a região do gene que sofreu mutação, com perda específica de um produto da clivagem da policistina Clínica • Penetrância – praticamente todos os afetados desenvolvem múltiplos cistos renais bilaterais • Variabilidade na severidade das manifestações renais e extra-renais 1) Manifestações renais • Desenvolvimentos dos cistos e aumento dos rins *contribuição da vasopressina anormalidades funcionais no órgão • Distorção da arquitetura, interferência no processo de contracorrente, depleção dos níveis de amônia na medula Clínica • Hipertensão – ↓ fluxo sanguíneo e ↑ resistência vascular renal – Aumenta risco de proteinúria, hematúria, declínio na função renal, doenças cardiovasculares (já presentes na doença) e complicações na gestação • Dor renal • Desconforto pelo aumento e distorção renal pelo cisto; também por hemorragia do cisto, litíase, infecção dos cistos e, raramente, tumor • Nefrolitíase (20%) • Maioria por ác. úrico e oxalato de cálcio • Devido à ↓ da secreção de amônia, baixo pH urinário e baixa concentração de citrato Clínica • Infecção urinária e infecção do cisto • Principalmente por E. coli • Aparecimento de febre e dor é sugestivo • Carcinoma de células renais • Não é mais frequente na doença do que no resto da população • Porém quando presente aparece mais cedo, com sintomas constitucionais mais evidentes e maior proporção de câncer sarcomatóide, bilateralidade e metástase • Suspeita – massa sólida na US, calcificações espiculadas na TC • Falência renal • Em 50% ocorre por volta de 60 anos • Por compressão do parênquima, esclerose vascular, inflamação intersticial e fibrose, além de apoptose tubular • Preditores: tamanho do rim, volume dos cistos, fluxo sanguíneo renal Clínica 2) Manifestações extra-renais • Doença hepática policística • Raro nas crianças, mais comum em mulheres do que homens (possível papel do estrogênio) – 58% a 96%, de acordo com idade • Usualmente assintomáticos sem causar falência hepática • Efeito de massa – compressão da v. cava, vv. Hepáticas e trato biliar • Complicações – hemorragia, infecção e ruptura do cisto • TC é útil no diagnóstico • Pâncreas – cistos (8%), com possível pancreatite, tumor intraductal papilar mucinoso • Cistos na vesícula seminal (40%), membrana aracnóide Clínica • Manifestações cardiovasculares • Alterações do tecido conjuntivo, perda da organização mioelástica da parede do vasos e da constituição normal das válvulas • Aneurismas intracranianos e de outras artérias, dilatação da raiz da aorta, dissecção da aorta torácica e vasos cervicais e cefálicos, aumento da espessura das carótidas • Prolapso de válvula mitral, insuficiência aórtica • Hipertrofia do ventrículo esquerdo com disfunção diastólica • Efusão pericárdica • Hérnia de parede abdominal Clínica • Rim policístico Clínica • Cálculo Renal Clínica • Aneurismas Correlação genótipo-fenótipo • Mutações em PKD-1 estão associadas a doença mais precoce, e doença renal terminal de surgimento 20 anos mais cedo do que em PKD-2 • Mutações em PKD-2 – progressão é mais rápida nas mulheres do que nos homens • Outros fatores envolvidos na progressão da doença – dislipidemia, dieta rica em proteínas, traço falciforme, controle da hipertensão • Manifestações extra-renais presentes na mutação em ambos os genes • A posição da mutação no gene parece estar envolvida na gravidade da doença • Homozigose no feto – incompatível com a vida Diagnóstico Diferencial • Doença policística renal autossômica recessiva • Esclerose tuberosa • S. Von Hippel-Lindau • S. oral-facial-digital tipo 1 • Diabetes mellitus tipo 5 • Doença renal glomeruloesclrerótica • Doença hepática policística autossômica dominante Diagnóstico • Basicamente clínico • Critérios clínicos baseados na ultra-sonografia – para indivíduos com 50% de risco para DRPAD: • Ao menos 2 cistos uni ou bilaterais em menores de 30 anos; • 2 cistos em cada rim – 30 aos 59 anos • 4 cistos em cada rim – maiores de 60 anos *Sensibilidade próxima de 100% nos indivíduos com 30 anos ou mais, ou mais jovens com mutação em PKD-1 Ou • Rins ecogênicos aumentados sem cisto macroscopicamente evidente na criança com 50% de risco pra DRPAD • Testes genéticos - Solicitados quando exames de imagem são inconclusivos ou quando há necessidade de diagnóstico definitivo em adulto jovem Diagnóstico • Estratégia de diagnóstico • Métodos de imagem como ultra-sonografia, TC e RM devem ser considerados primeiro • Teste genético para análise das seqüências são úteis quando o diagnóstico clínico é inconclusivo ou quando diagnóstico definitivo é necessário no adulto jovem • Quando a mutação PKD-1 e 2 são negativas, pode-se investigar deleção ou duplicação no gene PKD-2 • O diagnóstico pré-sintomático pode ser feito quando se conhece a mutação específica em determinada família Manejo • Estabelecer quadro do paciente diagnosticado • Ultra-sonografia renal, ou TC para menores de 30 anos com mutação em PKD-2 • TC de abdome com e sem contraste – extensão da doença renal e hepática • Monitoramente da pressão arterial em 24 horas • Verificar lipidograma • Análise de urina – proteinúria, hematúria, etc • Ecocardiograma • AngioTC – investigação de aneurismas Manejo • Tratamento da hipertensão – inibidores de ECA e antagonistas dos receptores de angiotensina II • Dor renal - Não-opióides > antidepressivos tricíclicos > bloqueio do nervo com anestésico - Se não for suficiente – aspiração dos cistos guiada por US ou uso de agentes esclerosantes, ou manuseio cirúrgico • Se houver hemorragia do cisto e hematúria maciça – descanso, analgésicos e hidratação adequada • Nefrolitíase - Diagnóstico - US - Ingesta de líquido, citrato de potássio; alcalinização da urina e alopurinol se o cálculo for de ác. úrico - Litotripsia, nefrolitotomia percutânea Manejo • Infecção do cisto - Antibioticoterapia (SMT-TMP e fluoroquinolonas) - Se ineficaz, drenagem cirúrgica do cisto • Monitoramento de carcinoma de células renais – se alto grau de suspeição • Doença renal terminal - Prevenção por controle de hipertensão, hiperlipidemia, dieta pobre em proteínas, controle da acidose e hiperpotassemia - Diálise peritoneal ou hemodiálise - Transplante de rim • Doença hepática – maioria assintomáticos Manejo • Aneurismas • Ruptura – intervenção cirúrgica • Assintomáticos • < 5.0mm – seguidos anualmente • 6.0 – 9.0mm – controverso • > 10.0mm – Intervenção cirúrgica • Dissecção da aorta – intervenção cirúrgica • Administração de agentes nefrotóxicos por longa data • Evitar • Cafeína – aumento do cistos • Uso de estrogênio – fígado policístico • Fumo Aconselhamento genético - Doença é de herança autossômica dominante • Pais do indivíduo afetado - A maioria tem um dos pais com DRPAD - A incidência de mutações de novo está em torno de 10% • Irmãos do indivíduo - Se um dos pais do indivíduo estão afetados, os irmãos tem risco de 50% de herdar um alelo mutado - Quando os testes de imagem e/ou genéticos não identificam a doença nos pais, a mutação do indivíduo é considerada de novo, e o risco para os irmãos é muito baixo • Prole do indivíduo - Os filhos do indivíduo com a doença tem 50% de chance de herdar a mutação - Lembrar: fenômeno dos dois ventos – necessitam de mutação somática para desenvolver as alterações Aconselhamento genético • Teste pré-natal - Teste genético: para grávidas com gestação de alto risco, a análise do DNA pode ser feita por células obtidas na amniocentese ou do vilo coriônico • Em geral, o teste não é feito antes do paciente atingir os 18 anos, uma vez que a doença não afeta drasticamente o desenvolvimento do indivíduo e possui tratamento disponível Doença autossômica recessiva Genética • Mutações no gene PKHD1 – doença hepática e renal policística tipo 1 • Localizado no braço curto do cromossomo 6 • Codifica a fibrocistina • Encontrada nos ductos coletores corticais e medulares e no segmento ascendente da alça de Henle, epitélio dos ductos biliares e hepáticos • Parece funcionar como receptor - envolvida nas interações intercelulares e com a matriz • Várias mutações identificadas, particulares em cada família • RN que sobrevivem geralmente tem no mínimo uma mutação do tipo missense • Mutações encontradas em 30% das crianças com fiborse hepática congênita (S. de Caroli) sem comprometimento renal evidente Clínica • Apresentação muito variável • Até 50% dos RN morrem por hipoplasia pulmonar em virtude de oligoidrâmnio secundário à doença renal intra-uterina grave • 80% dos bebês que sobrevivem ao período neonatal conseguem viver por mais de dez anos; contudo 33% desenvolvem doença renal terminal • Os rins aumentados podem ser palpados logo após o nascimento como massas abdominais bilaterais • Deterioração da função tubular – acidose metabólica e redução da concentração urinária • Hipertensão nos primeiros anos de vida • Deterioração da função renal entre infância e primeiros anos de vida adulta • Sobreviventes a longo prazo – hipertensão portal, varizes esofágicas e hiperesplenismo secundário à fibrose periportal Diagnóstico • US – rins ecogênicos e volumosos • Casos graves – diagnóstico in utero depois da 24ª semana de gestação • Se os pais não tem cistos – indício de doença recessiva • Grande número de mutações diferentes e as grandes dimensões desse gene complicam o diagnóstico molecular • Diagnóstico pré-natal – análise das ligações gênicas em famílias que tem um filho com doença renal policística autossômica recessiva Manejo • Não há tratamento específico • Avanços na ventilação mecânica, suporte neonatal, controle de pressão arterial, diálise e transplante – sobrevivência em condições satisfatórias • Fibrose hepática – pode necessitar transplante de fígado Aconselhamento genético • Pais do indivíduo com DRPAR • São obrigatoriamente heterozigotos, e são assintomáticos • Importante ultra-sonografia nos pais para confirmar • Irmãos do indivíduo • 25% de chance de herdar dois alelos mutados – DRPAR • 50% de herdar apenas um alelo – sem doença • 25% de chance de não herdar nenhum alelo • Os irmãos não afetados tem 2/3 de chances de serem portadores do gene • Prole do indivíduo • Os filhos do indivíduo com DRPAR são necessariamente portadores do alelo • O risco para os filhos depende do parceiro (se é heterozigoto ou não possui nenhum alelo mutado) Referências Bibliográficas • http://www.lume.ufrgs.br/bitstream/handle/10183/4933/000462008.pd f?sequence=1 • http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=pkdad • http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=pkd-ar • http://www.pro-renal.org.br/renal_035.php • http://www.medicinageriatrica.com.br/wpcontent/uploads/2009/02/rim-policistico.jpg • http://1.bp.blogspot.com/_pMxMXFn7L-4/SRRPHoODfI/AAAAAAAADos/ta6a_LjPrI8/s400/Image3.jpg • http://www.clinicacocuzza.com.br/Ultrassom/ultrassom_rins_policistico s_02_g.jpg • http://www.clinicacocuzza.com.br/Ultrassom/ultrassom_calculo_renal_ 04_g.jpg • I. Fauci, Anthony S. et al. Harrison Medicina Interna. McGraw-Hill Interamericana do Brasil, 2008
Download